修回日期: 2019-06-11
接受日期: 2019-07-15
在线出版日期: 2019-07-28
晚期胃癌(gastric cancer, GC)患者通常接受化疗作为主要治疗方法. 然而, 化疗的有效性受到GC细胞耐药性的限制. 本研究旨在探讨microRNA-221(miR-221)在顺铂(cisplatin, DDP)耐药GC细胞中的生物学作用和潜在机制, 以期为临床治疗提供参考.
研究下调MiR-221对GC DDP耐药细胞增殖及DDP敏感性的影响及相关机制.
采用AGS和MGC-803细胞构建出DDP耐药AGS/DDP和MGC-803/DDP细胞. RT-qPCR检测GC及癌旁组织、DDP化疗敏感组织、DDP化疗耐药组织、GC细胞和GC DDP耐药细胞的miR-221表达水平; 用LV-miR-221-shRNA慢病毒转染AGS/DDP和MGC-803/DDP细胞后, MTT检测细胞增殖以及对DDP的化学敏感性; Annexin V-FITC/PI染色检测细胞凋亡; 进行生物信息学分析以寻找miR-221的潜在靶基因, 应用RT-qPCR和Western blotting检测细胞中CCND1的mRNA和蛋白表达.
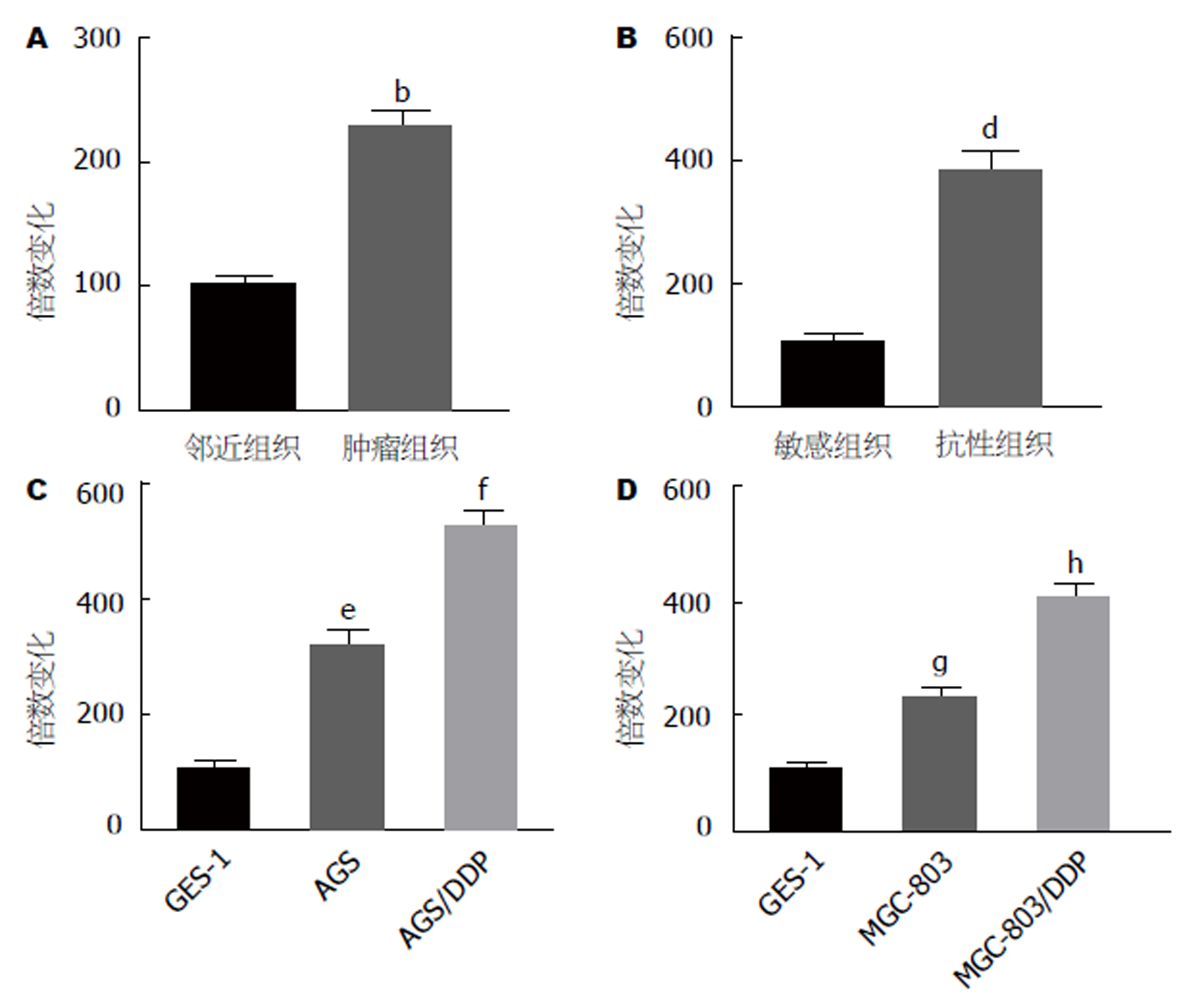
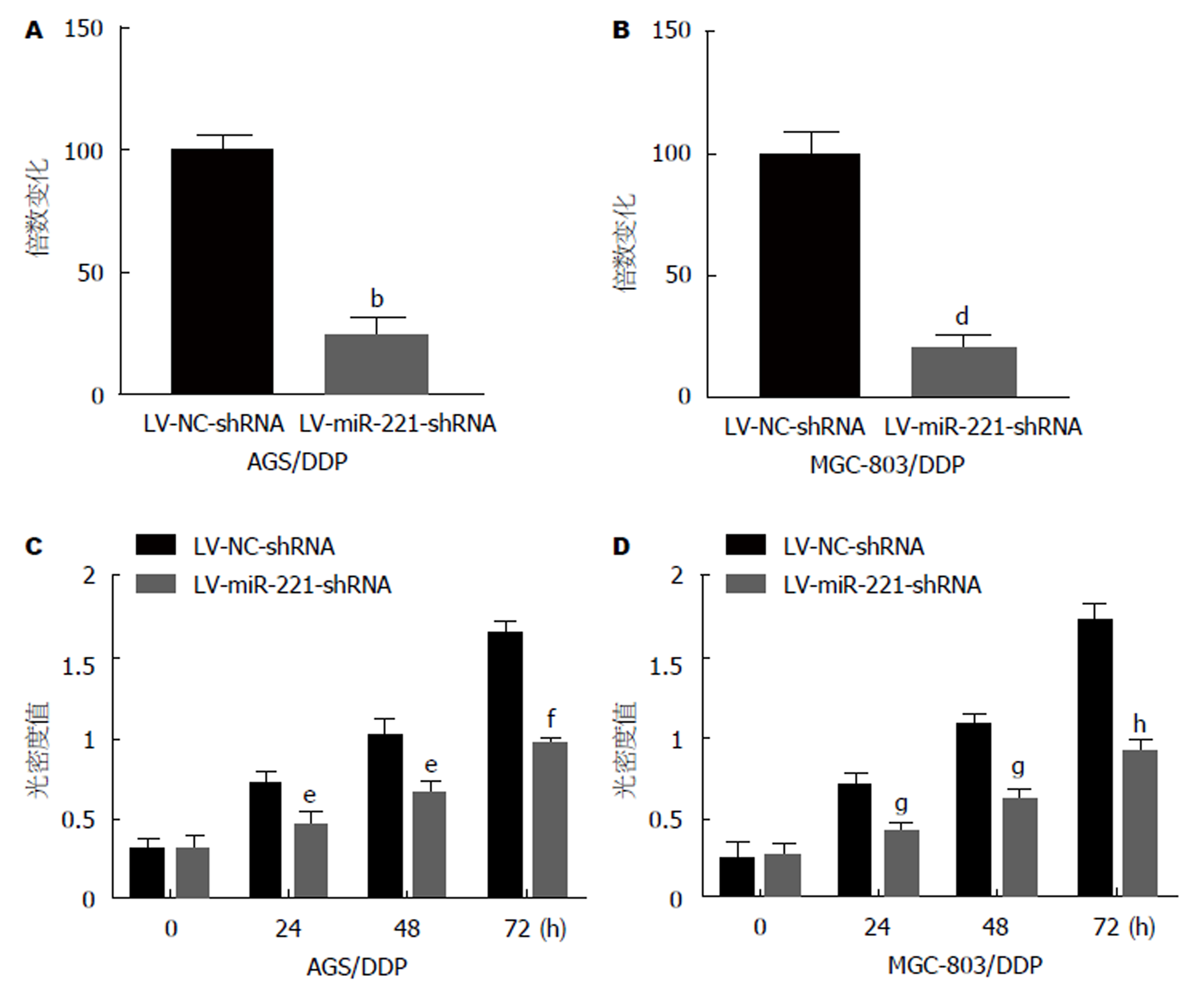
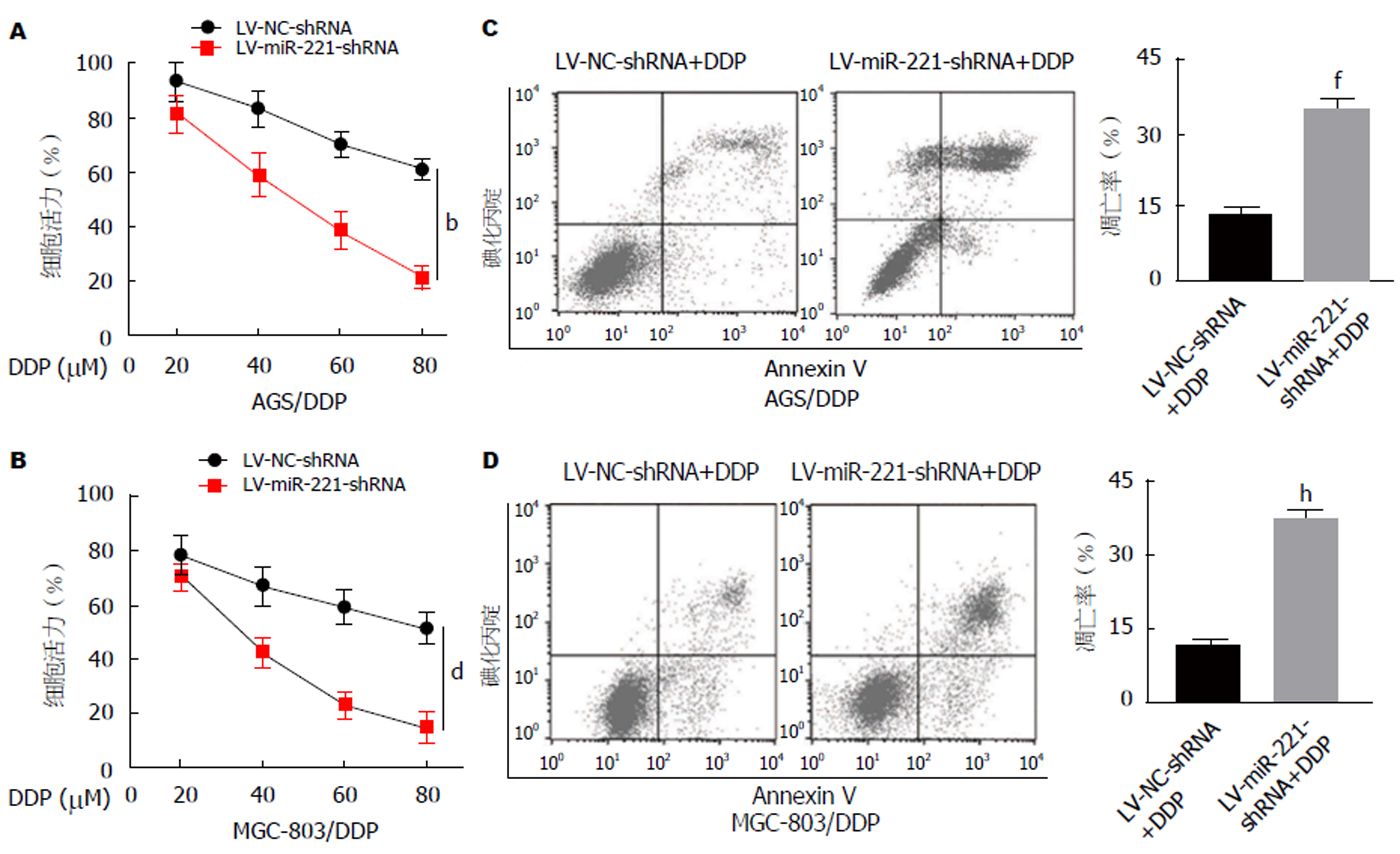
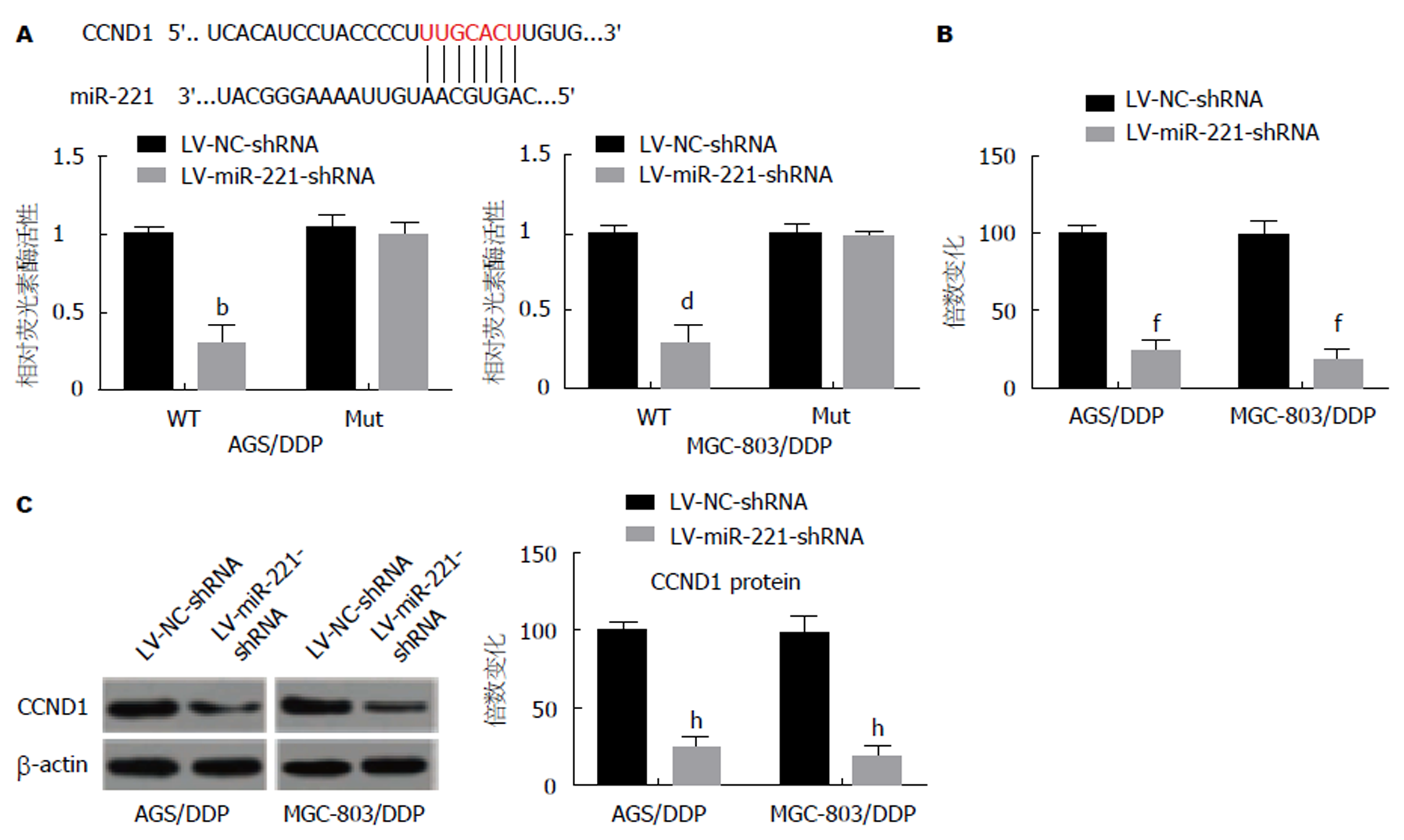
在GC组织和GC细胞细中miR-221明显上调, 且DDP耐药组织和DDP耐药细胞中miR-221表达更高. 下调miR-221抑制了AGS/DDP和MGC-803/DDP细胞增殖, 促进了细胞凋亡和细胞对DDP的化学敏感性; CCND1是miR-221的直接靶基因, 转染LV-miR-221-shRNA抑制CCND1 mRNA和蛋白表达水平.
下调miR-221可以抑制GC DDP耐药细胞增殖, 促进其对DDP的化学敏感性, 这一作用可能通过抑制靶基因CCND1表达来实现的.
核心提要: microRNA-221(miR-221)在胃癌(gastric cancer, GC)耐药组织和GC顺铂(cisplatin, DDP)耐药细胞中显著高表达. 下调miR-221表达抑制GC耐药细胞增殖并促进其对DDP的化学敏感性. 本研究发现, CCND1为GC中miR-221的直接靶基因, 下调miR-221通过抑制CCND1发挥逆转GC DDP耐药的作用, 为抗GC DDP化疗耐药的研究提供了参考.
引文著录: 徐丽娜, 金莉娜. 下调MiR-221对胃癌顺铂耐药细胞增殖及顺铂敏感性的影响及其相关机制. 世界华人消化杂志 2019; 27(14): 857-863
Revised: June 11, 2019
Accepted: July 15, 2019
Published online: July 28, 2019
Patients with advanced gastric cancer (GC) usually undergo chemotherapy as the primary treatment. However, the effectiveness of chemotherapy is often limited by the development of drug resistance in GC cells. This study aimed to investigate the expression pattern, biological role, and potential mechanism of microRNA-221 (miR-221) in cisplatin (DDP)-resistant GC cells, in order to provide a reference for clinical treatment of this malignancy.
To investigate the effect of down-regulation of miR-221 on cell proliferation and DDP sensitivity in DDP-resistant GC cells and to explore the underlying mechanism.
AGS and MGC-803 cells were screened for DDP-resistant cells (AGS/DDP and MGC-803/DDP). The expression levels of miR-221 in GC tissues, matched tumor adjacent tissues, DDP-sensitive tissues, DDP-resistant tissues, GC cells, and DDP-resistant GC cells were detected by RT-PCR. After AGS/DDP and MGC-803/DDP cells were transfected with LV-miR-221-shRNA, cell proliferation and DDP sensitivity in those cells were measured by MTT assay, cell apoptosis was detected by Annexin V-FITC/PI staining, and the mRNA and protein expression of CCND1 was detected by RT-qPCR and Western blot, respectively. The potential target genes of miR-221 were predicted by bioinformatics analysis.
The expression of miR-221 was up-regulated in GC tissues and gastric cells, especially in DDP-resistant tissues and DDP-resistant GC cells. Down-regulation of miR-221 inhibited the proliferation of AGS/DDP and MGC-803/DDP cells, but increased their apoptosis and chemosensitivity to DDP. CCND1 was found to be a direct target gene of miR-221. Transfection with LV-miR-221-shRNA inhibited the mRNA and protein expression of CCND1.
Down-regulation of miR-221 can inhibit cell proliferation and promote chemosensitivity to DDP in DDP-resistant GC cells, which may be achieved by inhibiting the expression of its target gene CCND1.
- Citation: Xu LN, Jin LN. Effect of down-regulation of miR-221 on cell proliferation and cisplatin sensitivity in cisplatin-resistant gastric cancer cells and underlying mechanism. Shijie Huaren Xiaohua Zazhi 2019; 27(14): 857-863
- URL: https://www.wjgnet.com/1009-3079/full/v27/i14/857.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i14.857
胃癌(gastric cancer, GC)是世界上发病率第四高、死亡率第三高的常见癌症, 每年导致大量人死亡(占总数的9.5%)[1]. 由于缺乏有效的早期诊断技术, 大多数GC患者被诊断出已是晚期[2]. 化疗是晚期GC最常见的主要治疗方法. 然而, 成功化疗的主要障碍是多药耐药(multi-drug resistance, MDR), 这是由于接触单一化疗药物后对多种化疗药物的耐药性的发展[3]. 越来越多的证据表明, 细胞介导的MDR引起许多变化, 包括药物摄取和代谢、DNA合成和修复、细胞存活和凋亡, 以及其他细胞功能[4,5]. 尽管目前学者对MDR发展的机制进行了广泛的研究, 但仍需要形成克服MDR的有效策略.
关于microRNA(miRNA)的研究有助于提高我们对化疗耐药性的理解. miRNA是一大类短的非编码单链RNA分子, 可以发挥重要的调节作用. 异常的miRNA表达已在包括GC在内的几乎所有类型的人类恶性肿瘤中广泛报道[6-8]. 因此, 靶向miRNA可能是治疗GC化学耐药性的新治疗策略. 在本研究中, 我们研究了microRNA-221(miR-221)在顺铂(cisplatin, DDP)耐药性中的作用, 以期为GC细胞化疗敏感性提供参考.
1.1.1 GC及癌旁组织收集: 收集台州医院2016/2018年经胃镜活检的20对GC及癌旁组织, 20例化疗敏感组织与20例化疗耐药组织. 患者本人签署知情同意书, 且本研究通过台州恩泽医疗中心(集团)台州医院伦理委员会同意. 其中获取GC及癌旁组织的患者, 均首次发现, 未进行过抗癌等治疗; 获取的化疗敏感组织与化疗耐药组织患者, 均为患者进行DDP治疗方案的患者, 其中组织经病理科检验为化疗敏感组织与化疗耐药组织.
1.1.2 细胞培养和耐药株的筛选: (1)细胞获得与培养: GC细胞系, 包括AGS和MGC-803, 获自中国科学院生物化学与细胞生物学研究所(上海, 中国). 人胃上皮细胞系GES-1购自美国ATCC. 所有这些细胞系均在补充有10%胎牛血清(FBS), 100 U/mL青霉素和100 mg/ml链霉素的DMEM培养基中生长(Gibco, 美国). 所有细胞系在含有5%CO2的细胞培养箱中于37 ℃培养. (2)筛选DPP耐药株: 采用反复刺激并逐渐增加DDP(Sigma, 美国)浓度刺激细胞的方法, 细胞贴壁后长至80%, DDP浓度为0.1 μg/mL DDP刺激48 h, 将细胞传代, 待细胞贴壁长至80%, 再用0.2 μg/mL DDP刺激48 h, 依次类推至DDP浓度达到1 μg/mL环境中稳定生长. 收集细胞用于后续实验.
1.2.1 细胞转染: 上海吉玛公司设计合成的miR-221的shRNA序列(miR-221-shRNA: 5'-GGCATGAACCTGGCATACAAT-3')和乱码的对照序列(NC-shRNA: 5'-TTCTCCGAACGTGTCACGT-3'), 并克隆至慢病毒载体上. 然后将事先筛选的AGS/DDP和MGC-803/DDP耐药株培养传代生长至约50%-60%融合后, 分别转染30 MOI的LV-miR-221-shRNA或LV-NC-shRNA, 并继续培养细胞48 h.
1.2.2 RT-qPCR实验: 根据制造商的说明, 使用TRIzol®Plus RNA纯化试剂盒(Invitrogen, 美国)从组织样本或细胞中分离总RNA. 为了检测miR-221表达, 使用TaqMan MicroRNA逆转录试剂盒(Applied Biosystems, 美国)进行逆转录以合成互补DNA(cDNA). 为了分析miR-221和CCND1 mRNA表达, 分别使用PrimeScript RT试剂盒(Takara Bio, 日本)和SYBR Premix Ex Taq TM试剂盒 (Takara Bio, 日本)进行RT-qPCR. U6和GAPDH分别用作miR-221和CCND1 mRNA的内源对照. 数据通过2-△△Ct方法计算.
1.2.3 MTT法测定细胞增殖: 收集转染的细胞, 并以每孔3×103个细胞的密度接种到96孔板中. 细胞培养24、48或72 h后, 根据制造商的说明书进行MTT测定, 将20 μL MTT溶液(5 mg/mL, Sigma, 美国)加入每个样品孔中, 温育4 h后, 将培养基替换为150 μL的DMSO并涡旋10 min. 然后, 使用自动多孔分光光度计(Bio-Rad Laboratories, 美国) 在490 nm的波长下检测吸光度. 每个实验一式三孔进行, 并重复三次.
1.2.4 MTT法测定体外化学敏感性: 收集转染的细胞, 将细胞以每孔3×103个细胞的密度接种到96孔板中. 细胞贴壁后, 用0、20、40、60和80 μmol/L的DDP(Sigma, 美国)处理细胞. 在DDP施用48 h后, 使用MTT法测定进行体外化学敏感性, 并绘制剂量-反应曲线. 每个实验一式三孔进行, 并重复三次.
1.2.5 流式细胞术分析: 流式细胞术分析用于评估细胞凋亡. 将细胞以每孔8×105个细胞的密度接种在6孔板中. 转染48 h后, 用浓度为60 μmol/L的DDP处理细胞. 在37 ℃, 含5%CO2中培养48 h后, 胰蛋白酶消化收集细胞并用PBS洗涤. 根据制造商的说明书, 用Annexin V-FITC细胞凋亡检测试剂盒(Invitrogen, 美国)测定细胞凋亡. 然后, 将细胞重悬于300 μL的结合缓冲液中, 然后在室温下在黑暗中用5 μL Annexin V和5 μL PI染色15 min. 使用流式细胞仪(Beckman Coulter, 美国)定量检测细胞凋亡. 每个测试进行重复三次.
1.2.6 双荧光素酶报告分析: 将含有miR-221的预测结合序列的野生型(WT) CCND1 3'-UTR和缺少miR-221结合序列的突变型(MUT)CCND1 3'-UTR的载体质粒使用LipofectamineTM2000辅助转染至细胞, 然后分别转染LV-miR-221-shRNA或LV-NC-shRNA. 在转染48 h后, 使用双荧光素酶报道分析系统(Promega Corporation, 美国)检测荧光素酶活性. Renilla荧光素酶活性用作内部参考.
1.2.7 Western Blotting分析: 使用裂解缓冲液(碧云天生物公司, 江苏)从细胞中提取总蛋白. 使用白质测定试剂盒(碧云天生物公司, 江苏)检测总蛋白质的浓度后, 通过10%SDS-PAGE分离相同量的蛋白质, 并转移到PVDF膜(Millipore, 美国)上. 用含有吐温20的Tris缓冲液(TBST)中的5%脱脂乳封闭1 h后, 将膜在4 ℃下与抗CCND1的一抗(1:1000稀释; Santa Cruz, 美国)和β-actin(1:5000稀释; 碧云天生物公司, 江苏)孵育过夜. 用TBST洗涤三次后, 将膜与山羊抗小鼠辣根过氧化物酶偶联的二抗(1:5000稀释; 碧云天生物公司, 江苏)在室温下孵育2 h. 使用ECL化学发光法(Pierce Biotechnology,美国)使蛋白质条带可视化. QuantityOne® 4.62软件(Bio-Rad, 美国)用于分析谱带强度.
统计学处理 计量资料的数值采用mean±SD的形式表示, 采用SPSS 20.0进行统计分析. 两组比较采用两独立样本t检验; 多组组间比较采用单因素方差分析后LSD检验; 当P<0.05时认为差异具有统计学意义.
与癌旁组织相比, miR-221在GC组织中高表达(图1A, P<0.01). 与DDPGC化疗敏感组织相比, miR-221在DDPGC化疗耐药组织高表达(图1B, P<0.01). 与GES-1细胞相比, GC细胞(AGS和MGC-803)中miR-221高表达, 而耐药株(AGS/DDP和MGC-803/DDP)中miR-221表达更高(图1C和D).
采用LV-miR-221-shRNA或LV-NC-shRNA慢病毒转染AGS/DDP和MGC-803/DDP细胞, 使用RT-qPCR评估转染效率. 结果显示, 与LV-NC-shRNA转染组相比, LV-miR-221-shRNA转染的AGS/DDP和MGC-803/DDP细胞中miR-221的表达显著下调(P<0.01)(图2A和2B). 随后, 采用MTT检测转染24、48、72 h后细胞增殖的情况. 如图2C和2D所示, 与LV-NC-shRNA转染组相比, miR-221下调在转染24、48、72 h后均显著降低了AGS/DDP和MGC-803/DDP细胞的增殖(P<0.05, P<0.05, P<0.01).
转染LV-miR-221-shRNA后, 采用MTT检测GCDDP耐药细胞对DDP的化学敏感性的变化. 结果显示, 转染LV-miR-221-shRNA的AGS/DDP和MGC-803/DDP细胞对DDP表现出增加敏感性(P<0.01)(图3A和B). 为探索下调miR-221对GC细胞化疗敏感性影响的机制, 本研究进行了流式细胞术检测DDP诱导的GCDDP耐药细胞凋亡的情况. 如图3C和3D所示, miR-221的下调增加了DDP诱导的AGS/DDP和MGC-803/DDP细胞凋亡(P<0.01).
采用生物信息学分析以寻找miR-221的潜在靶标并探索可能导致miR-221在GC细胞中起作用的机制. 结果发现CCND1(图4A)可能是miR-221的潜在靶标. 为进一步确认, 应用RT-qPCR和Western印迹分析检测转染miR-221模拟物或miR-NC的AGS/DDP和MGC-803/DDP细胞中CCND1的mRNA和蛋白表达. 结果显示, 转染LV-miR-221-shRNA降低了AGS/DDP和MGC-803/DDP细胞中CCND1的mRNA水平(P<0.01) (图4B)和蛋白水平(P<0.01)(图4C).
大量研究表明, miRNA参与多种类型人类癌症对化疗的敏感性或耐药性[9,10]. 因此, 全面了解化疗耐药相关miRNA在GC中的表达模式和生物学作用可能有助于开发新的治疗策略以提高GC的疗效.
在分子生物学中, miR-221是一种致癌microRNA[11]. 它可以通过靶向CD117, 促进细胞迁移和增殖[12]. 在肝癌中, miR-221诱导肿瘤血管生成[13]. 然而, miR-221在GC中的表达模式、生物学功能和生物学机制仍不清楚. 在这项研究中, 我们证实miR-221表达在GC组织和GC细胞中显著上调, 尤其是耐药组织和DDP耐药GC细胞. 进一步研究发现, 下调miR-221能抑制AGS/DDP和MGC-803/DDP细胞的增殖并增加它们对DDP的化学敏感性. 而miRNA通过以碱基配对方式与其靶基因的3'-非翻译区(3'-UTR)直接相互作用参与基因调控, 从而导致mRNA的重新调节或抑制翻译[14]. 因此, 我们通过生物信息学对miR-221靶基因进行了预测, 发现CCND1为GC细胞中miR-221的直接靶标. 位于染色体11q13的CCND1是在甲状腺癌[15]、乳腺癌[16]和肺癌[17]等多种肿瘤细胞中过表达的癌基因. 在GC中, CCND1表达并与GC分化强弱相关[18]. 且以往的研究表明CCND1在多种肿瘤中发挥抑癌及增加化疗敏感性的作用[19,20]. 本研究发现下调miR-221靶向抑制CCND1表达在GC细胞生长和化学抗性中发挥肿瘤抑制作用, 这意味着miR-221可能被作为一种治疗靶点进行研究, 以快速阻断这种恶性肿瘤患者的肿瘤生长和化疗耐药.
总之, miR-221在GC DDP耐药组织和GC DDP耐药细胞中显著高表达. 下调miR-221表达抑制GC耐药细胞增殖并促进其对DDP的化学敏感性. 并且本研究发现, CCND1为GC中miR-221的直接靶基因, 下调miR-221可能通过抑制CCND1发挥逆转GC DDP耐药的作用. 本研究为抗GC DDP化疗耐药的研究提供了参考.
胃癌(gastric cancer, GC)是常见的消化系统恶性肿瘤. 化疗作为主要治疗方法, 但其有效性往往受到GC细胞耐药性发展的限制.
本研究旨在探讨microRNA-221(miR-221)在GC中的表达模式, 生物学作用和潜在机制, 以期为临床治疗提供参考.
研究的目标是探索下调MiR-221对GC顺铂(cisplatin, DDP)耐药细胞增殖及DDP敏感性的影响, 并探索其中的相关机制.
采用AGS和MGC-803细胞构建出DDP耐药AGS/DDP和MGC-803/DDP细胞. 使用RT-qPCR、慢病毒转染、MTT、Annexin V-FITC/PI染色等方法, 检测了GC及癌旁组织、化疗敏感组织、化疗耐药组织、GC细胞和GC DDP耐药细胞的miR-221表达水平; 检测细胞增殖以及对DDP的化学敏感性; 检测细胞凋亡并生物信息学分析以寻找miR-221的潜在靶基因.
GC组织和GC细胞细中miR-221明显上调, 且耐药组织和DDP耐药细胞中miR-221表达更高. 下调miR-221抑制了AGS/DDP和MGC-803/DDP细胞增殖, 促进了细胞凋亡和细胞对DDP的化学敏感性; 我们报道了CCND1是miR-221的直接靶基因.
下调miR-221可以抑制GC DDP耐药细胞增殖, 促进其对DDP的化学敏感性, 这一作用可能通过抑制靶基因CCND1表达来实现的.
该研究提供了对作为GC细胞化学抗性基础的分子机制的重要见解. 这项研究的结果可能有助于开发一种新的GC治疗策略. 但是作为未来的临床治疗GC推广, 仍然需要深入的研究.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
编辑:崔丽君 电编:刘继红
| 1. | Ferlay J, Colombet M, Soerjomataram I, Mathers C, Parkin DM, Piñeros M, Znaor A, Bray F. Estimating the global cancer incidence and mortality in 2018: GLOBOCAN sources and methods. Int J Cancer. 2019;144:1941-1953. [PubMed] [DOI] |
| 2. | An Y, Zhang Z, Shang Y, Jiang X, Dong J, Yu P, Nie Y, Zhao Q. miR-23b-3p regulates the chemoresistance of gastric cancer cells by targeting ATG12 and HMGB2. Cell Death Dis. 2015;6:e1766. [PubMed] [DOI] |
| 3. | Szakacs G, Paterson JK, Ludwig JA, Booth-Genthe C, Gottesman MM. Targeting multidrug resistance in cancer. Nat Rev Drug Discov. 2006;5:219-234. [PubMed] [DOI] |
| 4. | Rabik CA, Dolan ME. Molecular mechanisms of resistance and toxicity associated with platinating agents. Cancer Treat Rev. 2007;33:9-23. [PubMed] [DOI] |
| 5. | Johnstone RW, Ruefli AA, Lowe SW. Apoptosis: a link between cancer genetics and chemotherapy. Cell. 2002;108:153-164. [PubMed] [DOI] |
| 6. | Tao Y, Yang S, Wu Y, Fang X, Wang Y, Song Y, Han T. MicroRNA-216a inhibits the metastasis of gastric cancer cells by targeting JAK2/STAT3-mediated EMT process. Oncotarget. 2017;8:88870-88881. [PubMed] [DOI] |
| 7. | Yoshino H, Yonezawa T, Yonemori M, Miyamoto K, Sakaguchi T, Sugita S, Osako Y, Tatarano S, Nakagawa M, Enokida H. Downregulation of microRNA-1274a induces cell apoptosis through regulation of BMPR1B in clear cell renal cell carcinoma. Oncol Rep. 2018;39:173-181. [PubMed] [DOI] |
| 8. | Yang X, Yang L, Ma Y, Zhao X, Wang H. MicroRNA-205 Mediates Proteinase-Activated Receptor 2 (PAR2) -Promoted Cancer Cell Migration. Cancer Invest. 2017;35:601-609. [PubMed] [DOI] |
| 9. | Wang P, Li Z, Liu H, Zhou D, Fu A, Zhang E. MicroRNA-126 increases chemosensitivity in drug-resistant gastric cancer cells by targeting EZH2. Biochem Biophys Res Commun. 2016;479:91-96. [PubMed] [DOI] |
| 10. | Xu W, Jiang H, Zhang F, Gao J, Hou J. MicroRNA-330 inhibited cell proliferation and enhanced chemosensitivity to 5-fluorouracil in colorectal cancer by directly targeting thymidylate synthase. Oncol Lett. 2017;13:3387-3394. [PubMed] [DOI] |
| 11. | Cha YJ, Lee JH, Han HH, Kim BG, Kang S, Choi YD, Cho NH. MicroRNA alteration and putative target genes in high-grade prostatic intraepithelial neoplasia and prostate cancer: STAT3 and ZEB1 are upregulated during prostate carcinogenesis. Prostate. 2016;76:937-947. [PubMed] [DOI] |
| 12. | Urbich C, Kuehbacher A, Dimmeler S. Role of microRNAs in vascular diseases, inflammation, and angiogenesis. Cardiovasc Res. 2008;79:581-588. [PubMed] [DOI] |
| 13. | Santhekadur PK, Das SK, Gredler R, Chen D, Srivastava J, Robertson C, Baldwin AS, Fisher PB, Sarkar D. Multifunction protein staphylococcal nuclease domain containing 1 (SND1) promotes tumor angiogenesis in human hepatocellular carcinoma through novel pathway that involves nuclear factor κand miR-221. J Biol Chem. 2012;287:13952-13958. [PubMed] [DOI] |
| 14. | Cortes-Sempere M, Ibañez de Caceres I. microRNAs as novel epigenetic biomarkers for human cancer. Clin Transl Oncol. 2011;13:357-362. [PubMed] [DOI] |
| 15. | Brzezianska E, Cyniak-Magierska A, Sporny S, Pastuszak-Lewandoska D, Lewinski A. Assessment of cyclin D1 gene expression as a prognostic factor in benign and malignant thyroid lesions. Neuro Endocrinol Lett. 2007;28:341-350. [PubMed] |
| 16. | Li X, Huo X, Li W, Yang Q, Wang Y, Kang X. Genetic association between cyclin D1 polymorphism and breast cancer susceptibility. Tumour Biol. 2014;35:11959-11965. [PubMed] [DOI] |
| 17. | Betticher DC, Heighway J, Hasleton PS, Altermatt HJ, Ryder WD, Cerny T, Thatcher N. Prognostic significance of CCND1 (cyclin D1) overexpression in primary resected non-small-cell lung cancer. Br J Cancer. 1996;73:294-300. [PubMed] [DOI] |
| 18. | Shan YS, Hsu HP, Lai MD, Hung YH, Wang CY, Yen MC, Chen YL. Cyclin D1 overexpression correlates with poor tumor differentiation and prognosis in gastric cancer. Oncol Lett. 2017;14:4517-4526. [PubMed] [DOI] |
| 19. | Yuan C, Zhu X, Han Y, Song C, Liu C, Lu S, Zhang M, Yu F, Peng Z, Zhou C. Elevated HOXA1 expression correlates with accelerated tumor cell proliferation and poor prognosis in gastric cancer partly via cyclin D1. J Exp Clin Cancer Res. 2016;35:15. [PubMed] [DOI] |
| 20. | Wang L, Zhang Y, Zhao L, Liu S, Yu S, Ma Y, Sun G. MicroRNA-193b inhibits the proliferation, migration and invasion of gastric cancer cells via targeting cyclin D1. Acta Histochem. 2016;118:323-330. [PubMed] [DOI] |