修回日期: 2018-09-12
接受日期: 2018-09-26
在线出版日期: 2018-10-28
研究miR-128-3p与肝癌(hepatocellular carcinoma, HCC)细胞对奥沙利铂敏感性的影响, 并探讨其作用机制.
采用qRT-PCR法检测人正常肝细胞HL-7702、HCC细胞BEL-7402和Hep-3B中miR-128-3p、Lin28B的表达; 将对数生长期的HCC细胞BEL-7402、Hep-3B随机分成miR-128-3p mimics组(转染miR-128-3P mimics )、miR-NC组(未转染细胞)、Lin28B-3ʹUTR WT组(载体psiCHECK2-Lin28B-3ʹUTR WT和miR-128-3p共转染)、Lin28B-3ʹUTR MUT组(载体psiCHECK2-Lin28B-3ʹUTR MUT和miR-NC共转染)和miR-128-3p+Lin28B组(miR-128-3p和Lin28B共转染)、si-Lin28B组(转染si-Lin28B)和si-NC组(转染沉默对照), 均以脂质体转染. 采用MTT法检测各组细胞的存活率和活力; Western Blot检测各组细胞的蛋白表达.
与人正常肝细胞相比, HCC细胞BEL-7402和Hep-3B中miR-128-3p的表达较显著降低(P<0.01), Lin28B的表达较显著升高(P<0.01), 且过表达miR-128-3p、沉默Lin28B均可抑制HCC细胞增殖, 促进凋亡, 增加HCC细胞对奥沙利铂的敏感性. Lin28B为miR-128-3p的靶标, 且回补Lin28B可逆转miR-128-3p增加HCC细胞对奥沙利铂敏感性的作用.
miR-128-3p可增加HCC细胞对奥沙利铂的敏感性, 其作用机制可能与靶向Lin28B有关, 提示miR-128-3p可作为抗奥沙利铂耐药性的潜在靶点.
核心提要: miR-128-3p联合奥沙利铂可抑制肝癌(hepato-cellular carcinoma, HCC)细胞的增殖, 促进凋亡, 增加对奥沙利铂的敏感性, 其机制可能是通过靶向作用于Lin28B. miR-128-3p有望成为治疗耐药HCC细胞的新靶点.
引文著录: 夏如冰, 王红英, 戴丹, 董陶明, 汪和平, 邹思璐, 张健. miR-128-3p靶向Lin28B增加肝癌细胞对奥沙利铂的敏感性. 世界华人消化杂志 2018; 26(30): 1748-1757
Revised: September 12, 2018
Accepted: September 26, 2018
Published online: October 28, 2018
To investigate the effect of miR-128-3p on the sensitivity of hepatocellular carcinoma (HCC) cells to oxaliplatin, and explore the underlying mechanism.
qRT-PCR was used to detect the expression of miR-128-3p and Lin28B in human liver cells (HL-7702) and human HCC cells (BEL-7402 and Hep-3B). BEL-7402 and Hep-3B cells as well as oxaliplatin resistant BEL-7402 and Hep-3B cells in logarithmic growth phase were randomly divided into a miR-128-3p mimic group (transfected with miR-128-3p mimics), a miR-NC group (untransfected cells), a Lin28B-3ʹ UTR WT group (psiCHECK2-Lin28B-3ʹUTR WT and miR-128-3p co-transfection), a Lin28B-3ʹ-UTR MUT (psiCHECK2-Lin28B-3ʹ UTR MUT and miR-NC co-transfection), a miR-128-3p + Lin28B group (miR-128-3p and Lin28B co-transfection), a si-Lin28B group (transfected with si-Lin28B) and a si-NC (transfected with silencing control). All cells were transfected via liposomes. The survival rate and viability of each group were detected by MTT assay, and the protein expression was detected by Western blot.
Compared with human hepatocytes, the expression of miR-128-3p in HCC cells (BEL-7402 and Hep-3B) was significantly decreased, and the expression of Lin28B was significantly increased. Overexpression of miR-128-3p or silencing Lin28B increased the sensitivity of HCC cells to oxaliplatin. Lin28B is a target of miR-128-3p, and overexpression of Lin28B could reverse the effect of miR-128-3p in increasing the sensitivity of HCC cells to oxaliplatin.
MiR-128-3p can increase the sensitivity of HCC cells to oxaliplatin possibly via a mechanism related to targeting Lin28B, suggesting that miR-128-3p could be used as a potential target for treatment of oxaliplatin resistance.
- Citation: Xia RB, Wang HY, Dai D, Dong TM, Wang HP, Zou SL, Zhang J. MiR-128-3p increases sensitivity of hepatoma cells to oxaliplatin by targeting Lin28B. Shijie Huaren Xiaohua Zazhi 2018; 26(30): 1748-1757
- URL: https://www.wjgnet.com/1009-3079/full/v26/i30/1748.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i30.1748
肝癌(hepatocellular carcinoma, HCC)是我国最常见的恶性肿瘤之一, 其发病率在恶性肿瘤中位居第五, 致死率位居第三, 且其复发率极高[1]. 目前临床上常用手术、化疗、放疗的方式治疗患者, 虽在一定程度上延长HCC患者的生存期, 但也存在缺乏特效药和耐药的问题.
奥沙利铂是治疗原发性HCC的一种化学治疗药物, 在术后辅助化疗的预后得到临床医生的普遍认可, 但其耐药性仍是影响化疗的主要因素[2]. 有报道称可通过miRNAs调节抑癌基因/促癌基因的表达增加HCC细胞对药物的敏感性[3,4]. miRNA是一种小的非编码RNA, 长度约为20-25个核苷酸, 近年来发现其在表观调控领域具有重大作用. miRNAs可结合到靶基因的3'非编码区域, 以完全互补或不完全互补的方式降解靶基因或抑制靶基因翻译, 以至靶基因沉默[5]. miR-128-3p对HCC细胞的功能也已有报道, 其在HCC组织中低表达, 调节PIK3R1表达, 诱导G1期细胞阻滞和迁移, 从而抑制HCC细胞增殖[6,7], 也可通过靶向CYP2C9 mRNA抑制肿瘤发生[8]. 但miR-128-3p对耐奥沙利铂的HCC细胞的作用及机制仍不甚清楚.
Lin28B在原发性人类肿瘤及肿瘤细胞中均高表达, 促进肿瘤的自我更新和增殖, 以利于肿瘤的形成、生长[9]. 据相关报道, 66%的肿瘤中存在较高水平的Lin28B, 如其在膀胱癌、胃癌、结肠癌、乳腺癌、肺癌和HCC中均高表达[10-16]. Lin28B可作为miR-125b的靶基因调控HCC细胞的增殖和侵袭[10]. 但miR-128-3p和Lin28B在HCC细胞中的关系仍尚未阐明.
本研究将通过检测miR-128-3p和Lin28B在HCC细胞中的表达, 观察过表达miR-128-3p和沉默LIN28B对耐奥沙利铂的HCC细胞的存活率、活力和凋亡率的影响, 阐明miR-128-3p增加HCC细胞对奥沙利铂耐药性的机制, 为临床的靶向治疗提供理论依据.
人正常肝细胞株HL-7702、HCC细胞株BEL-7402和Hep-3B均购于中国科学院细胞库; si-Lin28B、miR-128-3p、miR-NC和si-NC均购于广州锐博生物公司; BCA蛋白定量试剂盒、脂质体LipofectamineTM2000、逆转录试剂盒购于大连Takara公司; PVDF膜购于德国罗氏诊断有限公司; SDS-PAGE 试剂盒、ECL发光液和RIPA蛋白裂解液均购于碧云天生物技术公司; 双荧光素酶报告基因检测试剂盒购于美国Promega公司; Transwell小室购于美国Coming公司; 凝胶成像分析仪购于柯达公司; 半干转膜仪购于美国BIO-RAD公司; 流式细胞仪购于美国 FALS CALIBAR BD公司; ABI 7500型实时荧光定量PCR系统购于美国ABI公司; 紫外分光光度计购于美国Thermo公司; 细胞培养箱购于美国Forma Scientific公司; PCR 仪购于美国BIO-RAD公司.
1.2.1 细胞培养: 人正常肝细胞株HL-7702、HCC细胞株BEL-7402和Hep-3B均用含10%胎牛血清的RPMI1640培养基培养, 将细胞置于37 ℃, 5%CO2培养箱中培养. 细胞融合度达到80%时, 用胰蛋白酶消化, 适当比例进行传代. 将对数生长期的HCC细胞株BEL-7402和Hep-3B分别0.5 μg/mL、1.0 μg/mL、1.5 μg/mL和2.0 μg/mL的奥沙利铂连续给药培养, 培养条件与未给药培养条件一样.
1.2.2 细胞转染: 将对数生长期的BEL-7402和Hep-3B细胞及2.0 µg/mL的奥沙利铂处理的BEL-7402和Hep-3B细胞, 分别随机分成miR-128-3p组(转染miR-128-3p mimics)、miR-NC组(未转染细胞)、Lin28B-3ʹUTR WT(载体psiCHECK2-Lin28B-3ʹUTR WT和miR-128-3p共转染)、Lin28B-3ʹUTR MUT(载体psiCHECK2-Lin28B-3ʹUTR MUT和miR-NC共转染)和miR-128-3p+Lin28B组(miR-128-3p和Lin28B共转染), si-Lin28B组(转染si-Lin28B)和si-NC组(转染沉默对照)均按照LipofectamineTM2000试剂说明书进行脂质体转染, 用qRT-PCR检测转染效果. 转染成功后, 用MTT法检测各组细胞的生存率和活力, Western blot检测各组细胞的蛋白表达, 流式细胞术检测各组细胞的凋亡率, 双荧光素酶报告基因检测实验检测各组细胞的活性.
1.2.3 Quantitative Real-time RT-PCR: 取适量对数生长期1.2.2各组细胞, 用Trizol液裂解细胞后, 按照RNA抽提试剂盒技术手册操作提取RNA,定量后, 立即用逆转录试剂盒按照说明书操作合成cDNA. 按照qRT-PCR试剂盒说明书操作进行miR-128-3p和Lin28B的检测. 用2-△△Ct计算miR-128-3p和Lin28B的相对表达水平, 每个样品重复检测3次.
1.2.4 MTT实验: 取适量对数生长期1.0 μg/mL的奥沙利铂处理的各组细胞, 培养至第24 h、48 h和72 h时各加入20 μL 5 g/L的MTT溶液, 继续培养4 h, 取出后吸去上清, 每孔加入150 μLDMSO, 在酶标仪上震荡, 使结晶充分溶解, 在490 nm波长下检测细胞吸光度(A); 另将细胞用0.5 μg/mL、1.0 μg/mL、1.5 μg/mL和2.0 μg/mL的奥沙利铂处理后用同样的方法测定490 nm波长下检测细胞吸光度(A). 每组设5个重复孔, 实验重复3次.
1.2.5 Western blot实验: 取适量1.0 μg/mL的奥沙利铂处理的各组细胞, RIPA裂解后, 提取总蛋白, BCA法蛋白定量后变性, 然后进行SDS蛋白电泳, 之后进行PVDV转膜, 脱脂奶粉封闭2 h, 然后用Ⅰ抗, 4 ℃孵育过夜. 第二天, 洗膜后用辣根过氧化物酶标记的Ⅱ抗37 ℃孵育2 h. 结束后加入显影混合液, 显影曝光. 以GADPH为内参, 以目的条带灰度值与GADPH灰度值的比值表示目的蛋白的表达情况.
1.2.6 双荧光素酶报告基因检测实验: 取适量对数生长期的1.2.2各组细胞, Trizol细胞裂解液裂解, 取5 μL细胞裂解液与萤火虫荧光素酶缓冲液和5 μL底物, 混匀测荧光强度. 然后加入海肾荧光素酶缓冲液和5 μL腔肠素底物, 混匀, 再次测得海肾荧光素酶活性. psiCHECK2载体以萤火虫荧光素酶活性为内参, psiCHECK2-Lin28B-3ʹUTR WT和psiCHECK2-Lin28B-3ʹUTR MUT的表达为对照, 观察miR-128-3p对LIN28B表达的影响.
1.2.7 Annexin V-FITC/PI双染色法检测细胞凋亡: 取适量1.0 μg/mL的奥沙利铂处理的各组细胞, 用预冷的PBS洗涤2次. 用结合缓冲液 500 μL悬浮细胞, 分别加入5 μL Annexin V-/FITC和5 μL 20 mg/mL的PI, 混匀, 室温避光静置15 min. 每个样品重复3次. 细胞凋亡率采用流式细胞仪分析测定. 细胞的总凋亡率(%)为早期凋亡率(Annexin V+/PI-)与晚期凋亡率(Annexin V+/PI+)的和.
统计学处理 实验数据采用SPSS 13.0软件进行分析. 计量资料用mean±SD表示, 多组间数据比较采用单因素方差分析, 两组间数据比较采用t检验, 以P<0.05表示差异有统计学意义.
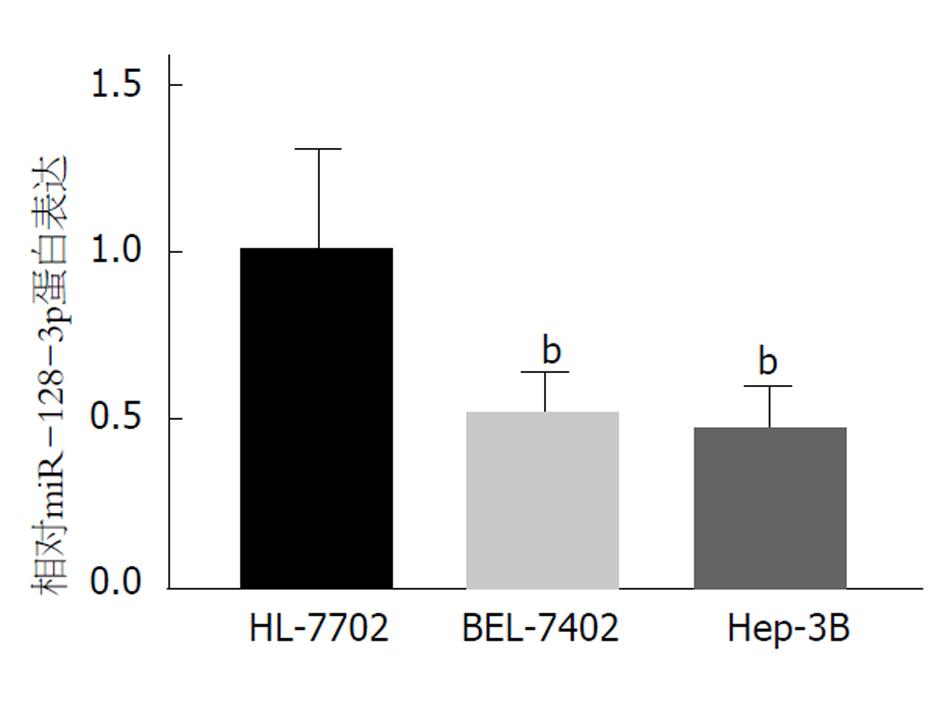
运用qRT-PCR检测正常肝细胞株HL-7702、HCC细胞株BEL-7402和Hep-3B中miR-128-3p的表达, 结果如图1所示, HCC细胞株BEL-7402和Hep-3B中miR-128-3p的表达较于正常肝细胞株HL-7702显著降低, 差异具有统计学意义(P<0.01).
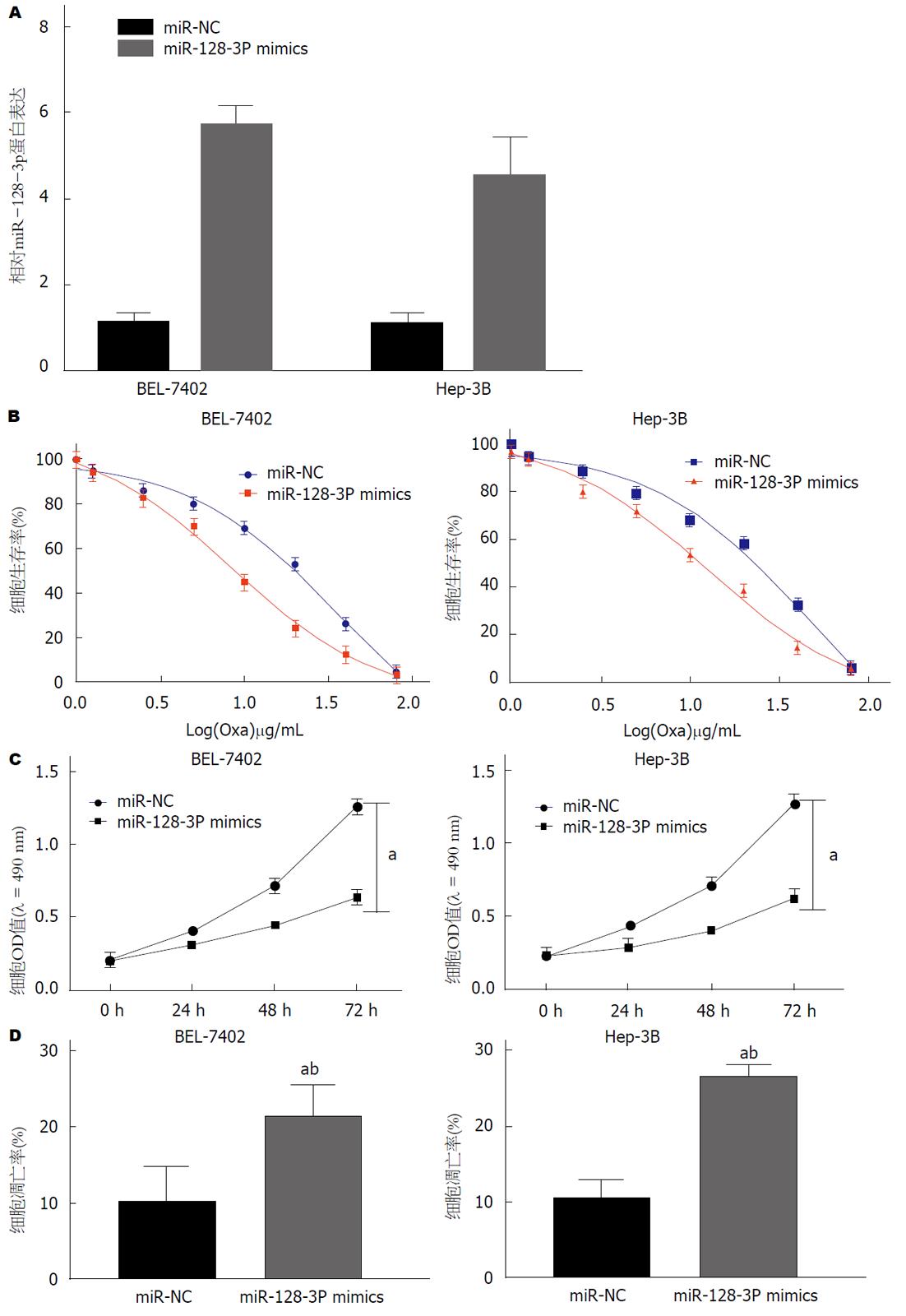
如图2A所示, HCC细胞株BEL-7402和Hep-3B中miR-128-3p的表达,与miR-NC组相比, miR-128-3p mimics组miR-128-3p的表达均显著升高. MTT法检测不同浓度奥沙利铂处理下HCC细胞的存活率, 结果如图2B所示, miR-128-3p mimics组细胞存活率于miR-NC组均降低, 且最佳浓度为1.0 μg/mL. 检测1.0 μg/mL奥沙利铂处理的BEL-7402和Hep-3B细胞活力, 结果如图2C所示, miR-128-3p mimics组细胞活力于miR-NC组均显著降低; 流式细胞术检测1.0 μg/mL奥沙利铂处理的HCC细胞凋亡率, 结果如图2D所示, miR-128-3p mimics组细胞凋亡率于miR-NC组均显著升高, 差异均具有统计学意义(P<0.01, P<0.05). 可见, 过表达miR-128-3p抑制奥沙利铂处理的HCC细胞增殖并促进其凋亡, 以增加其对奥沙利铂的敏感性.
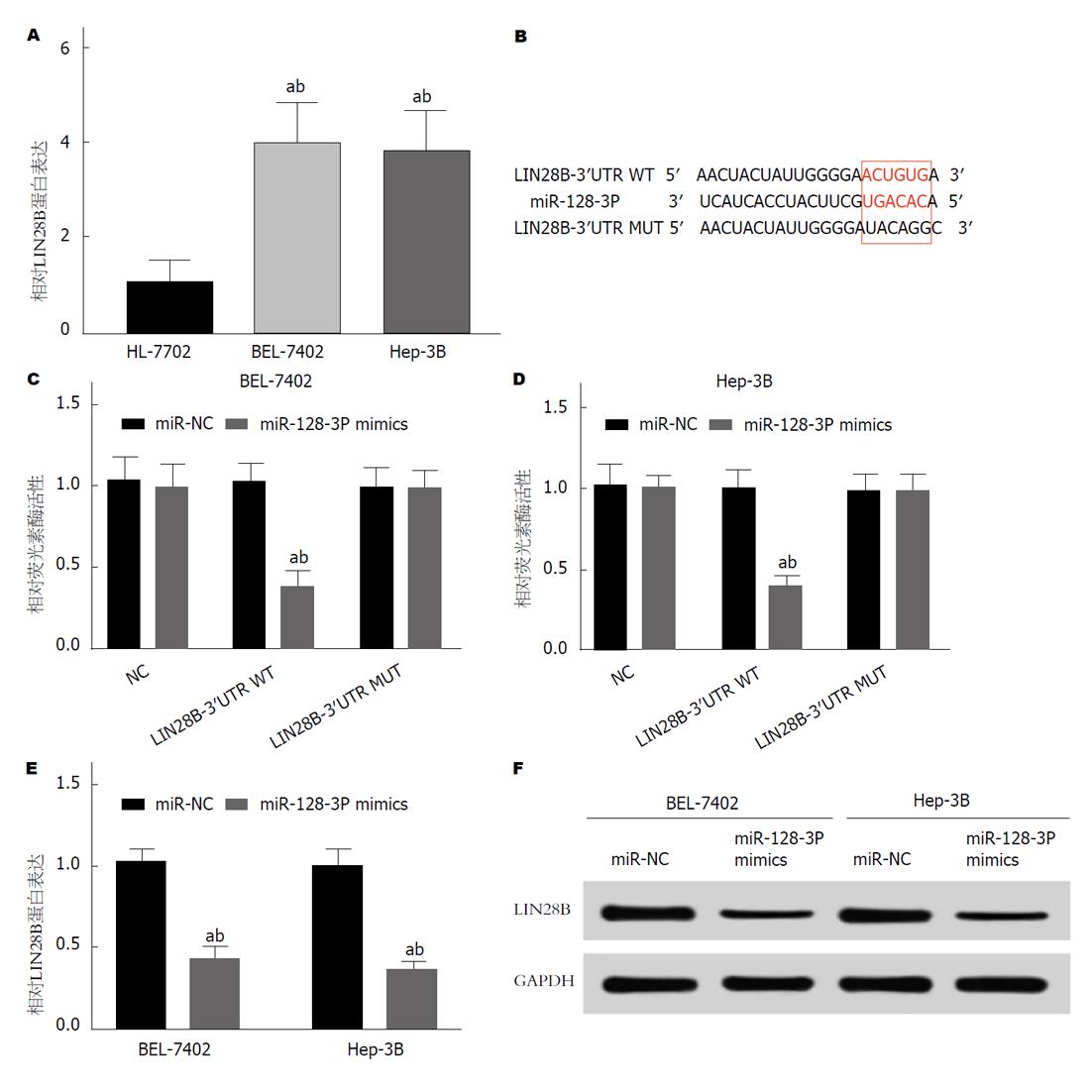
如图3A所示, 与正常肝细胞株HL-7702相比, HCC细胞株BEL-7402和Hep-3B中Lin28B的表达较显著升高. 通过TargetScan预测miR-128-3p与Lin28B的结合位点, 结果如图3B所示, miR-128-3p与Lin28B 3ʹUTR存在结合位点. 双荧光素酶活性检测实验, 结果如图3C、D所示, 与NC组相比, miR-128-3p组均较显著抑制Lin28B-3ʹUTR WT的荧光素酶活性, 均不影响Lin28B-3ʹUTR MUT的荧光素酶活性. qRT-PCR检测BEL-7402和Hep-3B细胞中Lin28B的表达, 结果如图3E所示, miR-128-3p组Lin28B的表达较显著低于miR-NC组, 提示miR-128-3p抑制Lin28B的表达. 用western blot检测蛋白表达, 结果如图3F所示, miR-128-3p组Lin28B的蛋白表达低于miR-NC组, 差异均具有统计学意义(P<0.01). 可见, 高表达因子Lin28B为miR-128-3p的靶基因.
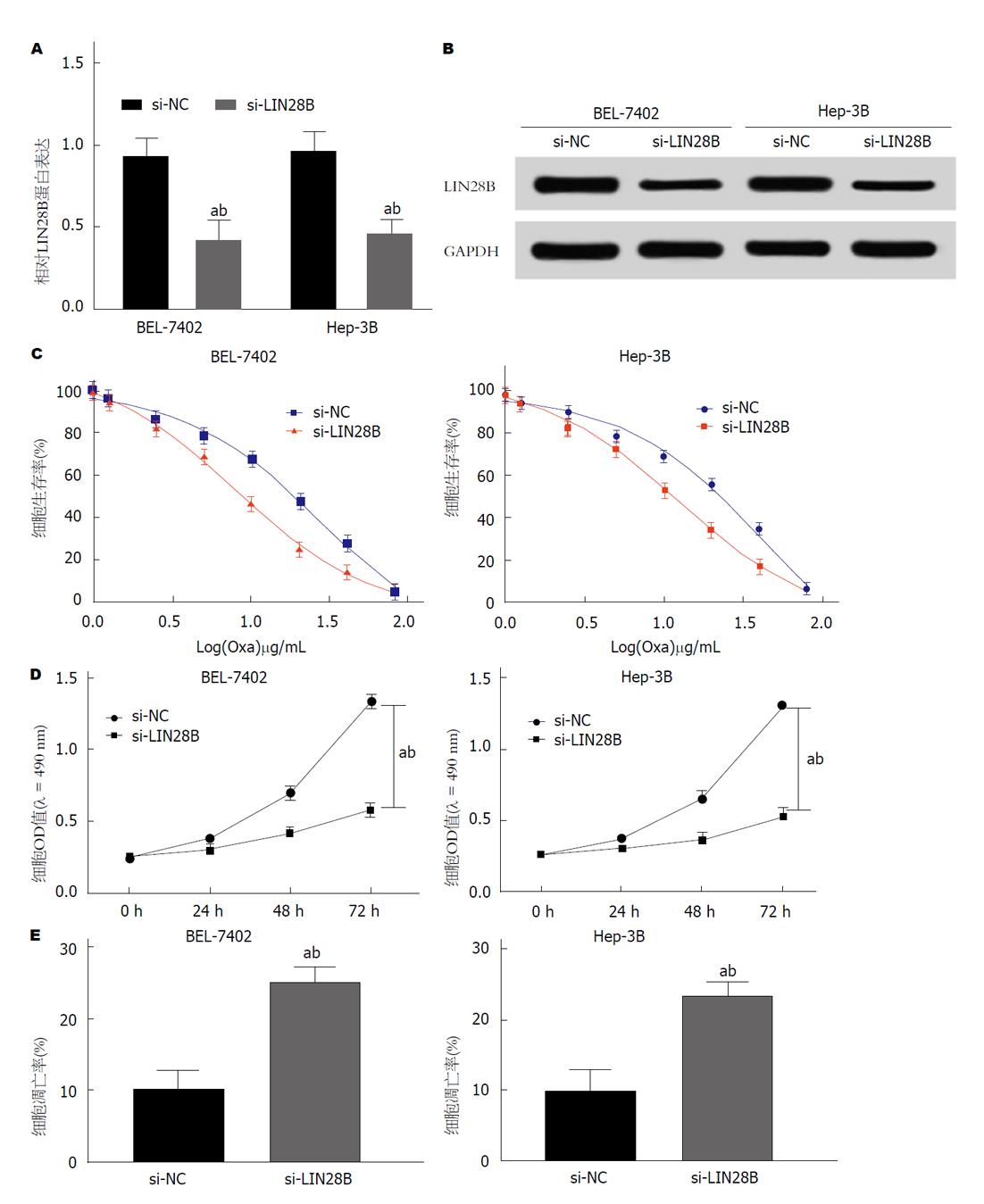
运用Western Blot检测HCC细胞株BEL-7402和Hep-3B中Lin28B的蛋白表达, 结果如图4A所示, si-Lin28B组细胞Lin28B蛋白表达于si-NC组显著低. 如图4B所示, 检测不同浓度奥沙利铂处理的HCC细胞存活率, si-Lin28B组细胞存活率于si-NC组降低, 且最佳浓度为1.0 μg/mL; 如图4C所示, 1.0 μg/mL奥沙利铂处理的HCC细胞OD值于si-NC组均显著降低. 流式细胞术检测1.0 μg/mL奥沙利铂处理的BEL-7402和Hep-3B细胞的凋亡率, 结果如图4D所示, si-Lin28B组细胞的凋亡率于si-NC组均显著升高, 差异均具有统计学意义(P<0.01). 可见, 沉默LIN28B可抑制奥沙利铂处理的HCC细胞增殖并促进凋亡, 即可增加HCC细胞对奥沙利铂的敏感性.
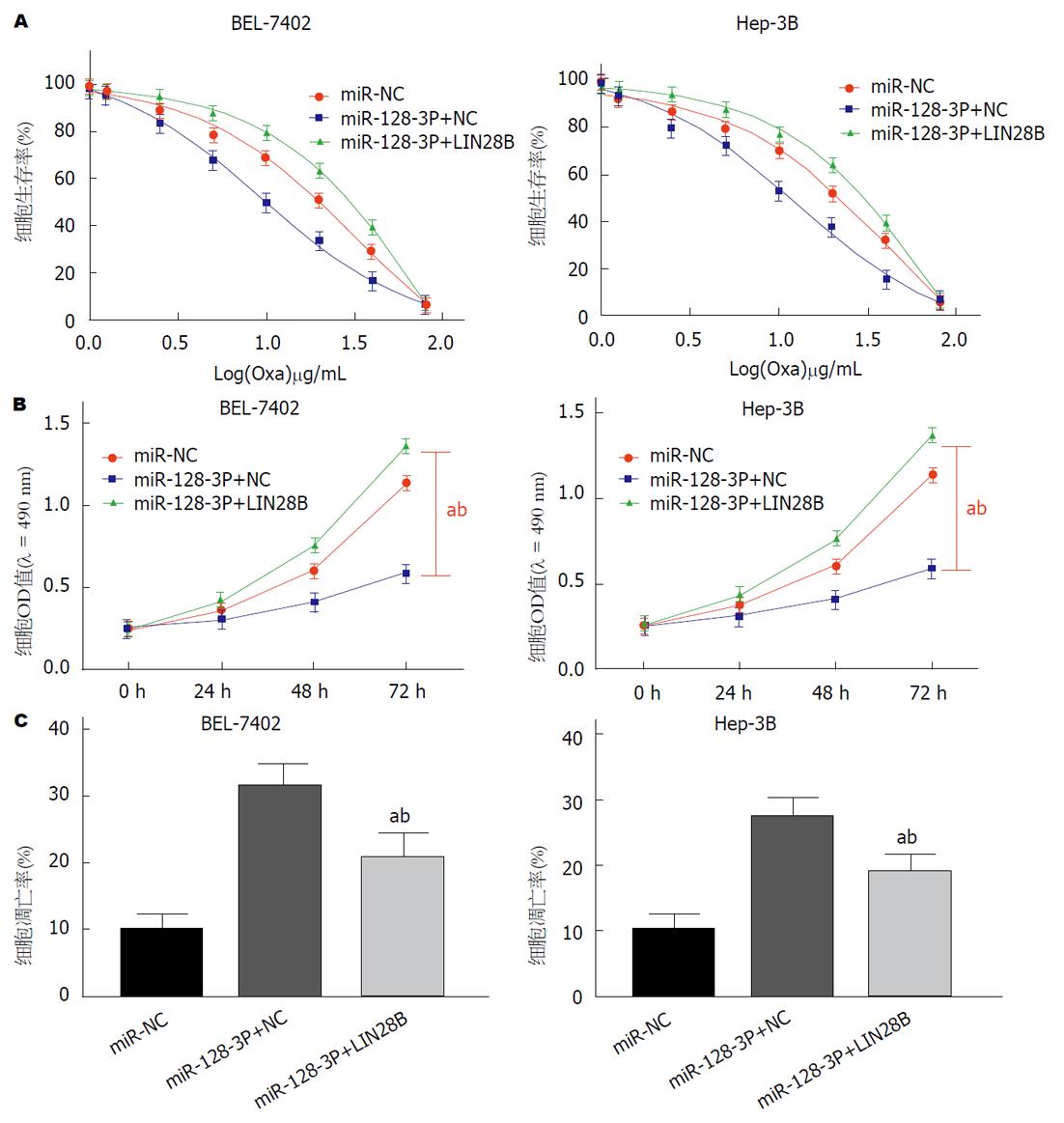
如图5A所示, 不同浓度奥沙利铂处理的HCC细胞株BEL-7402和Hep-3B的活力, miR-128-3p+Lin28B组细胞生存率均明显高于miR-128-3p+NC组, 且最佳浓度为1.0 μg/mL. 如图5B所示, 1.0 μg/mL奥沙利铂处理的HCC细胞株BEL-7402和Hep-3B的OD值, 在第24小时、48小时、72小时, miR-128-3p+Lin28B组细胞OD值显著高于miR-128-3p+NC组. 流式细胞术检测1.0 μg/mL奥沙利铂处理的HCC细胞凋亡率, 结果如图5C所示, miR-128-3p+Lin28B组细胞凋亡率均较显著低于miR-128-3p+NC组, 差异均具有统计学意义(P<0.01). 可见, Lin28B逆转了miR-128-3p增加HCC细胞对奥沙利铂敏感性的作用.
奥沙利铂为第三代铂类化合物, 化学名为左旋反式二氨基环己烷草酸铂, 分子式为C8H14N2O4Pt, 其药理学特性与其它铂类相似均为以DNA为靶点, 铂原子与DNA链形成交联, 以阻断其复制和转录[17]. 奥沙利铂治疗多种消化道肿瘤的预后已得到证实[18]. 陈超庭等[19]对奥沙利铂在HCC中的预后也给予肯定. 但奥沙利铂与其他化疗药物一样, 也会产生耐药性. 郑美玲等[20]报道, 尽管奥沙利铂可显著的延长HCC晚期患者的生存期, 但其临床疗效十分有限, 治疗失败与HCC患者产生耐药性密切相关.
有研究通过比较不同肿瘤耐药细胞株与其相应敏感细胞株中miRNA分子的表达, 证实miRNA的表达确实存在显著的差异[21]. Kovalchuk等[22]2008年已证实miR-451通过靶向多药耐药相关基因mdrl参与乳腺癌细胞对阿奇霉素的耐药. 最近杨涛等[23]通过建立耐奥沙利铂的HCC细胞系BEL-7402和Hep-3B, 利用miRNA芯片和qRT-PCR筛选出miR-93, 进一步运用MTT实验、双荧光素酶报告基因载体实验和Western Blot实验, 验证miR-93通过靶向抑癌基因PTEN增加HCC细胞对奥沙利铂的耐药性. 本研究通过MTT法检测miR-128-3p对不同浓度奥沙利铂处理的HCC细胞生存率和流式细胞术检测HCC细胞的凋亡率, 分析得到miR-128-3p可增加HCC细胞对奥沙利铂的敏感性.
Lin28B是哺乳动物Lin28的同源基因, 其通过结合let-7家族的前体RNA的终末环, 抑制let-7的成熟, 而发生调控肿瘤细胞的作用[24]. 李建华等[18]通过检测HCC组织和癌旁正常组织中miR-125b和Lin28B的表达, 运用双荧光素酶实验分析293U细胞中miR-125b和Lin28B之间的靶向关系, 又用MTT法和Transwell法验证miR-125b靶向Lin28B对HCC细胞HepG2增殖和侵袭的抑制作用, 得出miR-125b在HCC发生和发展过程中的抑制作用可能与靶向Lin28B有关. 本研究通过TargetScan预测miR-128-3p和Lin28B之间存在结合位点, 运用双荧光素酶基因报告实验验证这一预测. 又对Lin28B进行沉默和过表达, 分别用MTT法和流式细胞术检测其对不同浓度奥沙利铂处理的HCC细胞的活力和凋亡发现, miR-128-3P可靶向Lin28B增加奥沙利铂对HCC细胞的敏感性.
总之, miR-128-3p可增加HCC细胞对奥沙利铂的敏感性, 可能与其靶向Lin28B有关, 这些发现将为临床靶向治疗HCC提供新的研究方向.
近期miRNA通过靶向下游因子, 增强奥沙利铂对肝癌(hepatocellular carcinoma, HCC)细胞的耐药性, 增强对多药耐的乳腺癌的药物耐药性. 但miR-128-3p增加HCC细胞耐药性的作用机制国内外尚未有人研究.
本研究旨在研究miR-128-3p联合奥沙利铂对HCC细胞增殖、凋亡的影响, 并探讨其分子作用机制, 以期望为解决HCC治疗过程中的耐药问题提供线索.
探讨miR-128-3p联合奥沙利铂抑制HCC细胞增殖, 促进凋亡的作用, 及其机制, 以期为HCC的治疗提供新方向.
将用2.0 µg/mL的奥沙利铂处理的BEL-7402和Hep-3B细胞, 分别随机分成miR-128-3p组、Lin28B-3ʹUTR WT、Lin28B-3ʹUTR MUT、miR-128-3p+Lin28B组、si-Lin28B组, 用MTT法、流式细胞术分析HCC细胞对奥沙利铂的敏感性, Western blot检测HCC细胞中Lin28B蛋白表达, 双荧光素酶报告基因检测实验验证miR-128-3p与Lin28B的靶向关系.
本研究成功构建过表达miR-128-3p和沉默Lin28B的奥沙利铂处理HCC细胞发现, HCC细胞增殖能力减弱, 凋亡能力增强, 同时, miR-128-3p靶向调控Lin28B, 且回复Lin28B又能反向调控miR-128-3p.
miR-128-3p可增加HCC细胞对奥沙利铂的敏感性, 其可能与靶向Lin28B有关, 提示miR-128-3p可作为HCC细胞增加奥沙利铂敏感性的潜在靶点.
本研究仅在体外研究miR-128-3p增加HCC细胞对奥沙利铂的敏感性, 后期还需增加miR-128-3p与奥沙利铂对HCC细胞的增殖、凋亡的对比实验, 以更清晰的展示miR-128-3p对HCC细胞的治疗价值, 也为miR-128-3p的靶向治疗提供更充分的理论依据.
学科分类: 胃肠病学和肝病学
手稿来源地: 江西省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
编辑: 崔丽君 电编:张砚梁
| 2. | Jiang J, Zheng X, Xu X, Zhou Q, Yan H, Zhang X, Lu B, Wu C, Ju J. Prognostic significance of miR-181b and miR-21 in gastric cancer patients treated with S-1/Oxaliplatin or Doxifluridine/Oxaliplatin. PLoS One. 2011;6:e23271. [PubMed] [DOI] |
| 3. | Kurokawa K, Tanahashi T, Iima T, Yamamoto Y, Akaike Y, Nishida K, Masuda K, Kuwano Y, Murakami Y, Fukushima M. Role of miR-19b and its target mRNAs in 5-fluorouracil resistance in colon cancer cells. J Gastroenterol. 2012;47:883-895. [PubMed] [DOI] |
| 6. | Huang CY, Huang XP, Zhu JY, Chen ZG, Li XJ, Zhang XH, Huang S, He JB, Lian F, Zhao YN. miR-128-3p suppresses hepatocellular carcinoma proliferation by regulating PIK3R1 and is correlated with the prognosis of HCC patients. Oncol Rep. 2015;33:2889-2898. [PubMed] [DOI] |
| 7. | Liang L, Wong CM, Ying Q, Fan DN, Huang S, Ding J, Yao J, Yan M, Li J, Yao M. MicroRNA-125b suppressesed human liver cancer cell proliferation and metastasis by directly targeting oncogene LIN28B2. Hepatology. 2010;52:1731-1740. [PubMed] [DOI] |
| 8. | Yu D, Green B, Marrone A, Guo Y, Kadlubar S, Lin D, Fuscoe J, Pogribny I, Ning B. Suppression of CYP2C9 by microRNA hsa-miR-128-3p in human liver cells and association with hepatocellular carcinoma. Sci Rep. 2015;5:8534. [PubMed] [DOI] |
| 10. | Panella M, Mosca N, Di Palo A, Potenza N, Russo A. Mutual suppression of miR-125a and Lin28b in human hepatocellular carcinoma cells. Biochem Biophys Res Commun. 2018;500:824-827. [PubMed] [DOI] |
| 11. | Viswanathan SR, Powers JT, Einhorn W, Hoshida Y, Ng TL, Toffanin S, O'Sullivan M, Lu J, Phillips LA, Lockhart VL. Lin28 promotes transformation and is associated with advanced human malignancies. Nat Genet. 2009;41:843-848. [PubMed] [DOI] |
| 12. | Ma L, Zhao Q, Chen W, Zhang Y. Oncogene Lin28B increases chemosensitivity of colon cancer cells in a let-7-independent manner. Oncol Lett. 2018;15:6975-6981. [PubMed] [DOI] |
| 14. | Wang X, Hu H, Liu H. RNA binding protein Lin28B confers gastric cancer cells stemness via directly binding to NRP-1. Biomed Pharmacother. 2018;104:383-389. [PubMed] [DOI] |
| 15. | Ren J, Fu J, Ma T, Yan B, Gao R, An Z, Wang D. LncRNA H19-elevated LIN28B promotes lung cancer progression through sequestering miR-196b. Cell Cycle. 2018;17:1372-1380. [PubMed] [DOI] |
| 16. | Zhang X, Liang W, Liu J, Zang X, Gu J, Pan L, Shi H, Fu M, Huang Z, Zhang Y. Long non-coding RNA UFC1 promotes gastric cancer progression by regulating miR-498/Lin28b. J Exp Clin Cancer Res. 2018;37:134. [PubMed] [DOI] |
| 19. | 陈 超庭, 沈 永奇, 黄 汉生, 斯 韬, 王 志祥, 谢 华东, 孔 祥应, 林 海永. 奥沙利铂单药治疗Child-Pugh B级中晚期肝癌的临床研究. 中国热带医学. 2018;18:489-492; 499. [DOI] |
| 22. | Kovalchuk O, Filkowski J, Meservy J, Ilnytskyy Y, Tryndyak VP, Chekhun VF, Pogribny IP. Involvement of microRNA-451 in resistance of the MCF-7 breast cancer cells to chemotherapeutic drug doxorubicin. Mol Cancer Ther. 2008;7:2152-2159. [PubMed] [DOI] |
| 23. | 杨 涛, 郑 志敏, 张 献波, 李 振符, 张 国栓. miR-93通过靶定PTEN基因增加肝癌细胞对奥沙利铂的耐药性. 中国生物化学与分子生物学报. 2012;28:926-934. [DOI] |