修回日期: 2018-07-03
接受日期: 2018-07-15
在线出版日期: 2018-08-18
探讨Jagged2在结肠癌中的表达及其临床意义.
应用免疫组化、实时定量PCR及蛋白质印迹等方法检测Jagged2在42例结肠癌及癌旁组织中的表达, 并结合免疫组化结果及结肠癌患者的临床病理资料进行统计学分析.
结肠癌及癌旁组织中均检测到Jagged2 mRNA和蛋白质的表达. Jagged2在结肠癌中的表达水平明显高于其对应的癌旁组织(P<0.05); 免疫组化染色结果显示, Jagged2在结肠癌组织中的阳性比例显著高于癌旁组织(85.7% vs 33.3%, χ2 = 23.92, P<0.01), 且Jagged2的表达与肿瘤分化程度、Dukes分期、淋巴结转移及浸润深度密切相关(P<0.05).
Jagged2在结肠癌肿瘤组织中表达上调, 可能与结肠癌的发生发展和浸润转移等恶性生物学行为相关.
核心提要: 结肠癌是消化系统最常见的恶性肿瘤之一, 严重威胁着国人的身体健康, 进一步加强对结肠癌恶性生物学特性的研究, 分析Jagged2在结肠癌组织中表达与其肿瘤进展及浸润转移情况的相关性, 从而指导判断结肠癌患者生存预后, 有着极其重要的临床意义.
引文著录: 陈华涛, 瞿紫微, 肖新波, 赵春翔. Jagged2在结肠癌中的表达及临床意义. 世界华人消化杂志 2018; 26(23): 1396-1401
Revised: July 3, 2018
Accepted: July 15, 2018
Published online: August 18, 2018
To detect the expression of Jagged 2 in human colon carcinoma and to analyze its clinical significance.
The expression of Jagged 2 mRNA and protein in 42 cases of human colon carcinoma and adjacent non-tumorous tissues was detected by real-time quantitative PCR, immunohistochemistry, and Western blot. The relationship between Jagged 2 expression and clinicopathologic characteristics of colon carcinoma was then analyzed.
Jagged 2 mRNA and protein can be detected in colon carcinoma tissues and adjacent non-tumorous tissues. The expression of Jagged 2 mRNA and protein in colon carcinoma was significantly higher than that in matched adjacent non-tumorous tissues (P < 0.05). Immunohistochemical staining demonstrated that the percentage of Jagged 2 positive cells in colon carcinoma was significantly higher than that in matched adjacent non-tumorous tissues (85.7% vs 33.3%, χ2 = 23.92, P < 0.01), and the expression of Jagged 2 had a significant correlation with histopathological grade, Duke's stage, depth of invasion, and lymph node metastasis (P < 0.05).
The expression of Jagged 2 is up-regulated in colon carcinoma, suggesting that Jagged 2 may be involved in the carcinogenesis, invasion, and metastasis of colon cancer.
- Citation: Chen HT, Qu ZW, Xiao XB, Zhao CX. Clinical significance of expression of Jagged 2 in colon cancer. Shijie Huaren Xiaohua Zazhi 2018; 26(23): 1396-1401
- URL: https://www.wjgnet.com/1009-3079/full/v26/i23/1396.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i23.1396
结肠癌是消化系统最常见的恶性肿瘤之一,其发病率在我国呈上升趋势, 严重威胁着国人的身体健康[1]. 尽管目前临床手术方式和各种综合治疗方法不断改进, 然而部分肿瘤细胞对化疗药物极其耐药, 且早期易发生侵袭转移, 导致局部复发或/和远处转移, 成为患者难以治愈而最终死亡的关键原因[2]. 因此, 进一步加强对结肠癌恶性生物学特性的研究, 寻找新的诊疗靶点仍是当前研究的重点.
Notch信号通路是一条高度保守并能决定细胞命运的关键通路. 在哺乳动物中, Notch通路通过其受体与配体间相互作用参与了胚胎发育、细胞增殖、分化与凋亡等多种生物学过程的调控[3]. 近年来研究发现Notch信号通路在人类肿瘤中存在异常活化, 且其异常激活与肿瘤的发生和发展密切相关, 已成为当今肿瘤学研究的热点[4,5]. Jagged2是Notch通路的配体之一, 研究表明其在肺癌、乳腺癌、肝癌、胰腺癌等多种人类恶性肿瘤中发挥了重要作用[6-9]. 然而目前关于Jagged2在结肠癌中的研究较少, 其在结肠癌中的表达情况和意义尚不明确. 本研究通过检测结肠癌及癌旁组织中Jagged2的表达, 并分析其与结肠癌临床病理特征之间的关系, 旨在初步探讨Jagged2在结肠癌中的表达特点及其临床意义.
收集2014-06/2015-06武汉市第一医院诊断为结肠癌并行手术切除的组织标本共42例, 所有标本均经病理确诊为腺癌. 其中男性30例, 女性12例, 年龄28-76岁, 中位年龄58.5岁.肿瘤位于近段结肠26例, 远端结肠16例. 病理分期按Duke分期A期12例、B期7例、C期20例、D期3例. 按分化程度分为高分化10例, 中分化18例, 低分化14例. 经病理证实有淋巴结转移22例, 无淋巴结转移20例. 浸润深度未侵及浆膜者13例, 侵及浆膜者29例. 癌旁组织来源于同期肿瘤切除距肿瘤边缘5 cm以外肠管黏膜. 所有病例均无其他严重内科疾病或伴发其他恶性肿瘤, 术前均未行放疗或化疗.标本在术后立即置于液氮罐中低温保存. 12例组织标本行PCR和蛋白质印迹检测, 42例标本行石蜡包埋. TRIzol购于Invitrogen公司(美国); 逆转录试剂盒(FSQ-101), 荧光定量PCR试剂盒(QPK-201)均购于TOYOBO公司(日本); Jagged2及GAPDH引物序列由上海生工生物工程有限公司合成. 兔抗人Jagged2多克隆抗体购于Abcam公司(英国); 鼠抗人GAPDH单克隆抗体购于Proteintech公司(美国); 免疫组化SABC试剂盒购自北京中杉金桥生物技术有限公司, 其余试剂均为国产分析纯试剂.
1.2.1 RNA提取和cDNA合成: 取组织约50 mg, 按TRIzol说明书提取总RNA. 紫外分光光度计(Eppendorf-BioPhotometer, 德国)检测并计算RNA的纯度和浓度.以1 μg RNA为模板, 按cDNA第一链合成逆转录试剂盒说明书合成cDNA, 产物保存于-80 ℃冰箱.
1.2.2 实时定量PCR检测mRNA的表达: ABI7500荧光定量PCR仪上进行检测, 反应如下: 95 ℃ 3 min, 95 ℃ 15 s, 65 ℃ 1 min, 65 ℃读取数据; 40次循环. Jagged2引物序列上游为5'-AGGTGGAGACGGTTGTTACG-3', 下游为5'-TTGCACTGGTAGAGCACGTC-3'. GAPDH引物序列上游为5'-GGGTGTGAACCATGAGAAGT-3', 下游为5'-GGCATGGACTGTGGTCATGA-3'. 以上过程设置3个复孔. 荧光信号达到设定阈值所经历的循环数即CT值, 样本目的基因循环阈值与内参基因循环阈值的差异为ΔCT, 实验样本与对照样本(正常肠管黏膜组织)ΔCT的差异为ΔΔCT. 以2-ΔΔCT计算基因的相对表达量.
1.2.3 蛋白质印迹检测目的蛋白的表达: 提取组织蛋白并经BCA法检测其浓度. 以20 μg蛋白/泳道上样并进行电泳, 转膜, 5%脱脂奶粉室温封闭1 h, 然后加入GAPDH一抗(1:5000)和Jagged2一抗(1:500)于4 ℃孵育过夜,TBST洗膜后二抗(1:2000)室温孵育2 h, 之后用化学发光(ECL)试剂(美国Pierce公司)于凝胶成像仪中曝光. 结果用ImageJ进行分析, 计算目的蛋白与GAPDH的光密度比值.
1.2.4 免疫组织化学法检测蛋白表达: 标本常规石蜡包埋、4 μm厚度切片. Jagged2一抗浓度为1:100. 按SABC试剂说明书进行. 用PBS代替一抗作阴性对照, 已知阳性的结肠癌切片作阳性对照. 两位高年资病理科医师在双盲条件下进行分析, 判定标准参照文献[8]. Jagged2主要为胞浆着色. 每张切片随机观察5个高倍视野(400倍)读取阳性细胞数, 并计算阳性细胞百分率. 根据阳性细胞染色程度及阳性细胞百分数评分之和的均值综合判断: 不着色为0分, 浅棕黄色为1分, 棕黄色为2分, 黄褐色为3分. 阳性细胞数<5%为0分, 5%-25%为1分, 26%-50%为2分, 51%-75%为3分, >75%为4分. 结果判定: 总分<2判定为阴性, 总分≥2判定为阳性.
统计学处理 所有数据采用SPSS17.0软件进行分析.两个样本均数间比较用Student's t检验. Jagged2阳性表达率和临床病理资料之间的相关性分析采用χ2检验. P<0.05表示差异有统计学意义.
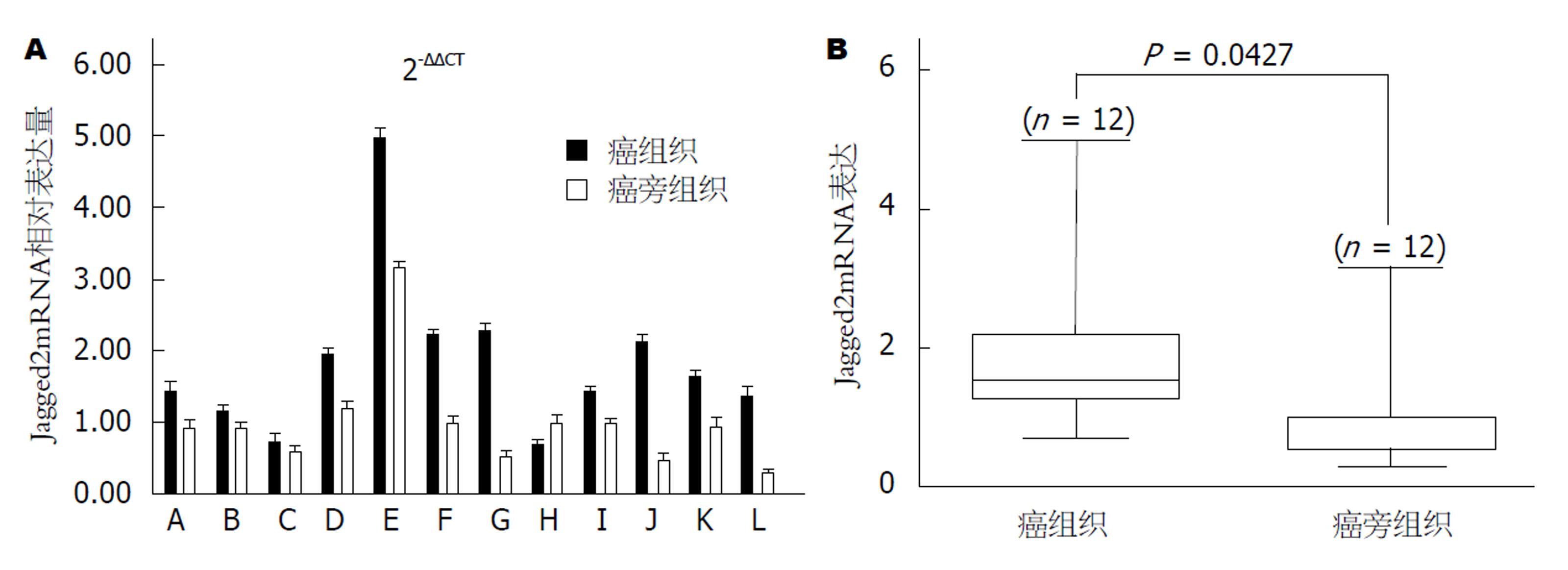
实时荧光定量PCR结果显示, Jagged2mRNA在癌旁组织及结肠癌肿瘤组织中均有表达, 但12对中有11对(91.7%)癌组织的Jagged2mRNA表达水平高于对应的癌旁组织(图1A), 二者表达水平有统计学意义(P<0.05, 图1B).
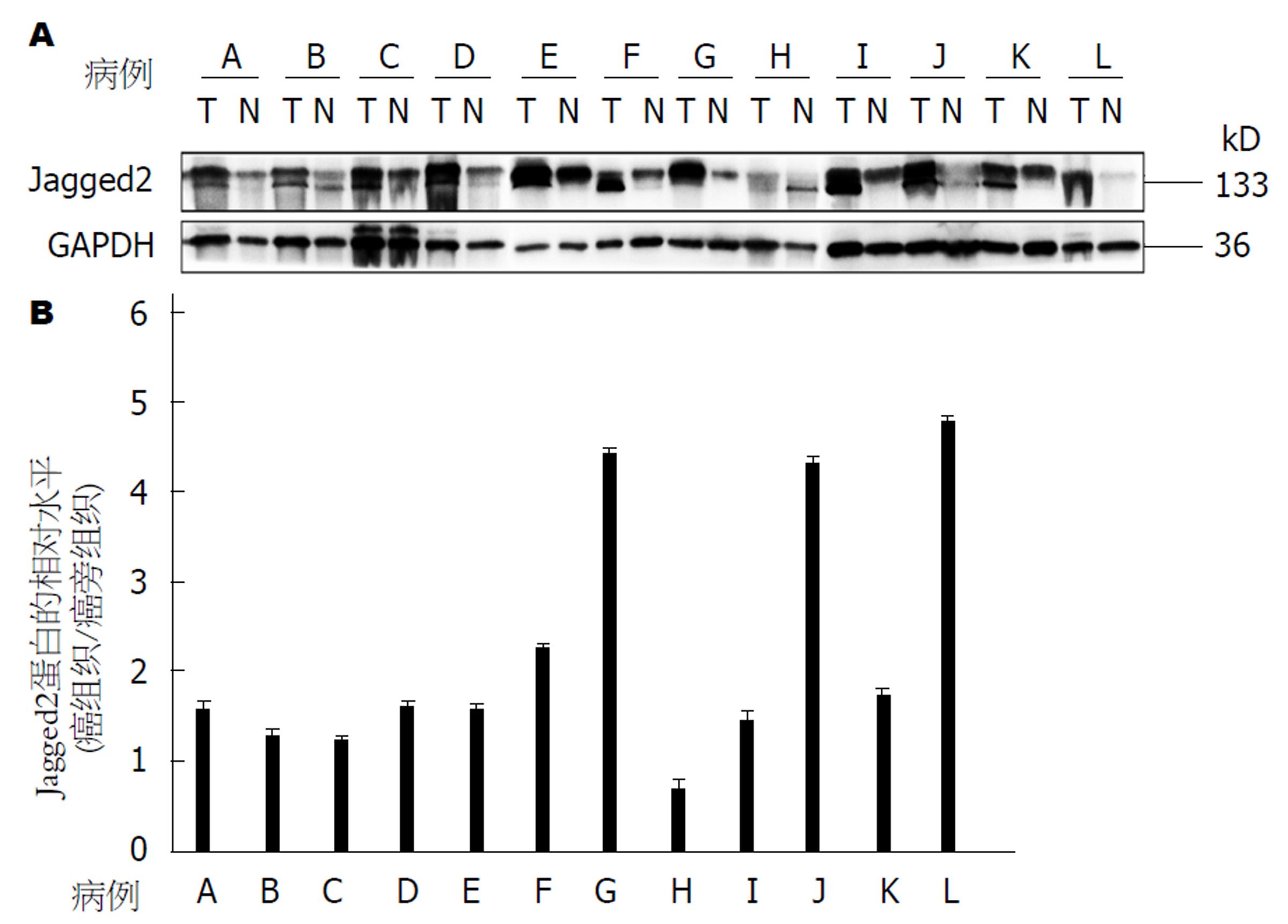
在12对结肠癌组织中有11对(91.7%)癌组织的Jagged2蛋白表达量高于对应的癌旁组织, 差异有统计学意义(P<0.05, 图2).
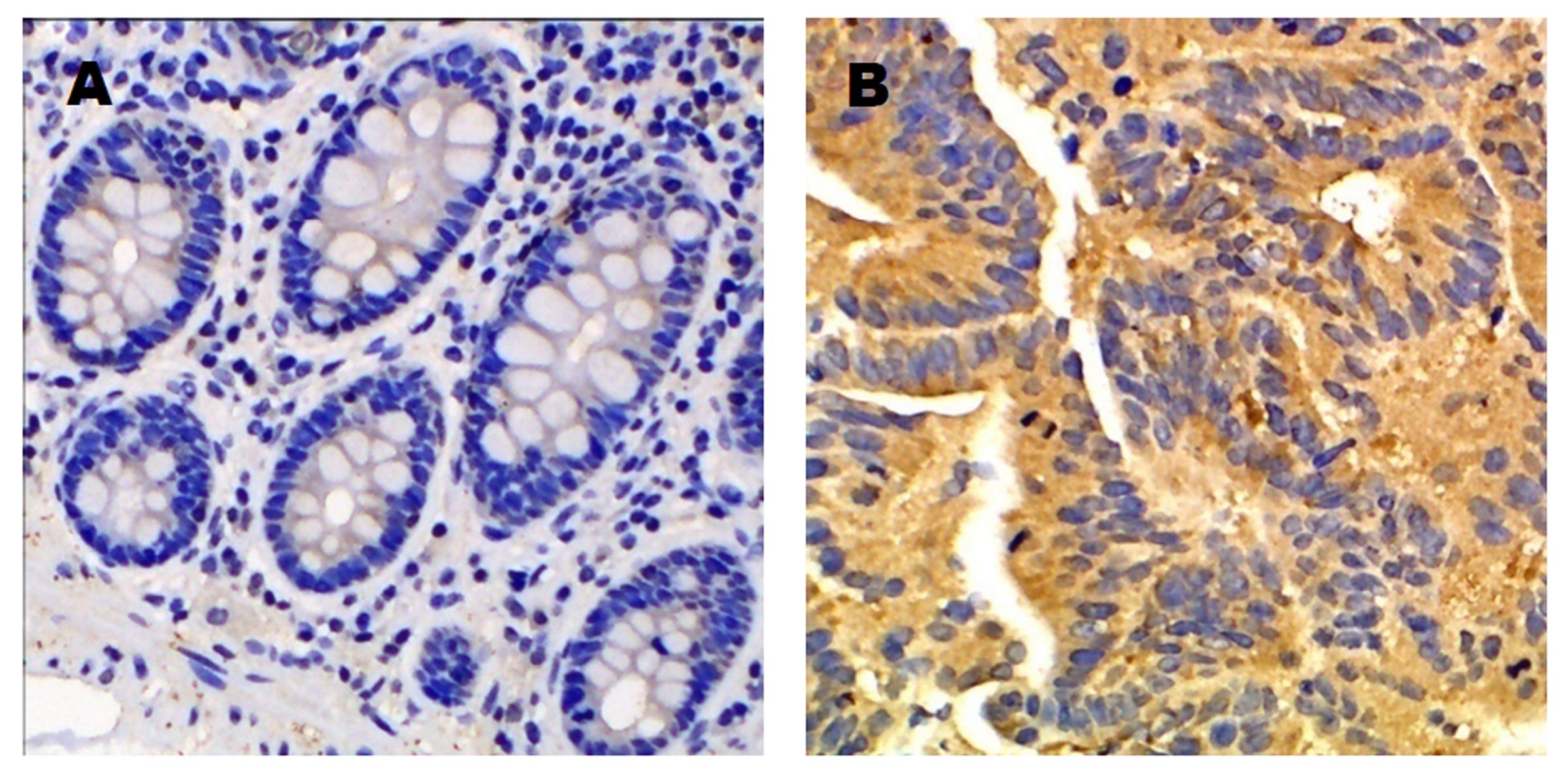
Jagged2在所有癌组织及大部分癌旁组织中均有表达, 其主要定位于胞浆(图3). 42例结肠癌组织中Jagged2阳性表达率为85.7%(36/42), 而对应的癌旁组织中Jagged2阳性表达率为33.3%(14/42),差异有统计学意义(χ2 = 23.92, P<0.01).
统计学结果显示, Jagged2蛋白的表达与患者的年龄、性别、肿瘤部位、肿瘤大小无关; 而与肿瘤的分化程度、Dukes分期、浸润深度及淋巴结转移情况有关(P<0.05, 表1).
| 临床资料 | n | Jagged2蛋白表达 | χ2值 | P值 | |
| 阳性 (n = 36) | 阴性 (n = 6) | ||||
| 年龄 (岁) | 0.00 | 0.93 | |||
| ≤55 | 25 | 21 | 4 | ||
| >55 | 17 | 15 | 2 | ||
| 性别 | 0.04 | 0.78 | |||
| 男性 | 30 | 25 | 5 | ||
| 女性 | 12 | 11 | 1 | ||
| 肿瘤部位 | 0.04 | 0.97 | |||
| 近段结肠 | 26 | 22 | 4 | ||
| 远段结肠 | 16 | 14 | 2 | ||
| 肿瘤大小 (cm) | 0.22 | 0.65 | |||
| <5 | 28 | 23 | 5 | ||
| ≥5 | 14 | 13 | 1 | ||
| 分化程度 | 4.60 | 0.03 | |||
| 高分化 | 10 | 6 | 4 | ||
| 中-低分化 | 32 | 30 | 2 | ||
| Dukes分期 | 6.09 | 0.01 | |||
| A+B | 19 | 13 | 6 | ||
| C+D | 23 | 23 | 0 | ||
| 浸润深度 | 6.35 | 0.01 | |||
| 未及浆膜 | 13 | 8 | 5 | ||
| 浆膜以外 | 29 | 28 | 1 | ||
| 淋巴结转移 | 5.44 | 0.02 | |||
| 无 | 20 | 14 | 6 | ||
| 有 | 22 | 22 | 0 | ||
当前研究认为结肠癌的发生发展是一个多基因改变和多因素参与的复杂过程, 其中异常信号转导在此过程中占主要地位[10,11]. 因此, 进一步阐明结肠癌细胞中关键信号分子的作用, 并寻找新的治疗干预靶点成为提高结肠癌治疗效果的关键.
Notch通路是由受体、配体以及下游的效应蛋白构成的连锁信号通路, 目前已经发现多种Notch通路蛋白在人类肿瘤中呈高表达, 且其表达程度与肿瘤侵袭转移、耐药及患者预后密切相关[4]. 此外, Notch通路还被认为参与了肿瘤干细胞恶性生物学特性的维持, 其蛋白异常活化是细胞恶性转化、浸润的重要环节[12,13]. 而在结肠癌中, Zhang等[14]报道Notch受体蛋白Notch1在结肠癌组织中的表达明显高于正常结肠黏膜组织, 且其表达与Dukes分期及淋巴结转移呈正相关. Sonoshita等[15]发现抑癌基因Aes能通过抑制Notch通路阻止结肠癌细胞侵袭转移. Meng等[16]利用γ-分泌酶抑制剂阻断Notch信号通路后能显著增加结肠癌细胞对化疗药物的敏感性. 由此可见Notch信号通路在结肠癌恶性生物学进程中发挥着极为重要的作用.
Jagged2是Notch通路配体蛋白的主要成员之一, 研究表明Jagged2在胚胎发育、细胞分化及成熟等过程中扮演着重要角色[17-19], 然而关于其在肿瘤中的作用目前仅有少量文献报道. Zhang等[8]报道Jagged2在肝癌中的表达水平较对应的癌旁组织升高, 且与肿瘤的分期和肝内转移呈正相关. Yang等[6]利用小鼠体内模型研究发现Jagged2能调节细胞的上皮间质转换过程, 进而促进肺癌细胞侵袭转移. 而Xing等[7]报道在缺氧条件下, Jagged2能促进乳腺癌细胞转移并维持其干细胞的自我更新特性. 值得注意的是, 最新研究发现Jagged2在90%以上的胰腺癌细胞中高表达, 下调Jagged2表达能显著抑制胰腺癌细胞的侵袭转移, 而这种效应并不依赖于Notch下游通路的激活, 提示Jagged2在肿瘤中可能通过非经典Notch通路发挥作用[9,20].
目前关于Jagged2在结肠癌中的研究报道并不多见. 我们的研究显示, Jagged2mRNA和蛋白在结肠癌组织及对应的癌旁组织中的表达差异具有统计学意义, 在结肠癌中Jagged2表达上调. 同时我们还发现, Jagged2蛋白的表达与结肠癌的分化程度、Dukes分期、浸润深度及淋巴结转移情况呈正相关, 提示Jagged2可能在结肠癌的进展及浸润转移过程中起着重要作用, 这与前述研究结果相类似.
总之, 本研究通过检测发现Jagged2在结肠癌组织中表达上调, 且与其肿瘤进展及浸润转移情况相关, 而肿瘤的浸润转移是影响结肠癌患者生存预后的重要因素. 因此, Jagged2有潜力成为结肠癌的一个预后判断指标, 指导患者的生存预后. 但目前Jagged2在肿瘤中所扮演的角色及调控机制尚未完全阐明, 而其在结肠癌中的功能机制尚需进一步研究.
Notch1信号通路的激活与肿瘤的发生和发展有关, Jagged2蛋白作为Notch2的主要配体, 其与肿瘤的关系有待验证, 尤其是在结肠癌当中, Jagged2在结肠癌患者中的表达和临床特征的关系需要深入研究.
研究Jagged2在蛋白和mRNA水平在结肠癌患者肿瘤组织中和癌旁当中表达的差异. 进一步研究其与患者临床资料的关系, 分析Jagged2蛋白在结肠癌进展中的作用.
明确Jagged2蛋白与结肠癌患者的关系, 为结肠癌患者预后以及治疗策略提供新的靶点做铺垫.
采用Q-PCR, Western以及特发性血色素沉着, 研究目的分子的表达. 检验分析采用配对t检验和χ2检验.
Jagged在蛋白水平和mRNA水平在结肠癌组织中的表达都高于相应的癌旁组织, 此外Jagged蛋白的表达水平与肿瘤的分化, 浸润程度, 淋巴结的转移和患者临床分期有关. 提示Jagged蛋白在结肠癌的发展当中起到了重要的作用.
本研究发现Jagged2蛋白和mRNA在结肠癌癌组织中表达相对较高, 并且与患者的肿瘤分化程度、浸润程度、淋巴结的转移、患者临床分期密切相关. 说明Jagged 2与结肠癌的发展有关. 作为Notch2的主要配体之一, Jagged2很有可能是通过与Notch2相互作用从而激活Notch信号通路, 参与对结肠癌生长侵袭和转移的调控.
Jagged2蛋白与结肠癌的进展有关, Jagged2蛋白与患者的预后有待接下来的研究, 此外Notch通路的激活与肿瘤的发生和发展关系密切, 阻断Jagged2蛋白与Notch2的相互作用有望成为肿瘤治疗的靶点之一.
学科分类: 胃肠病学和肝病学
手稿来源地: 湖北省
同行评议报告分类
A级 (优秀): A
B级 (非常好): 0
C级 (良好): 0
D级 (一般): C
E级 (差): 0
编辑:崔丽君 电编:张砚梁
| 2. | Hegde SR, Sun W, Lynch JP. Systemic and targeted therapy for advanced colon cancer. Expert Rev Gastroenterol Hepatol. 2008;2:135-149. [PubMed] [DOI] |
| 3. | Lai EC. Notch signaling: control of cell communication and cell fate. Development. 2004;131:965-973. [PubMed] [DOI] |
| 4. | Roy M, Pear WS, Aster JC. The multifaceted role of Notch in cancer. Curr Opin Genet Dev. 2007;17:52-59. [PubMed] [DOI] |
| 5. | Takebe N, Nguyen D, Yang SX. Targeting notch signaling pathway in cancer: clinical development advances and challenges. Pharmacol Ther. 2014;141:140-149. [PubMed] [DOI] |
| 6. | Yang Y, Ahn YH, Gibbons DL, Zang Y, Lin W, Thilaganathan N, Alvarez CA, Moreira DC, Creighton CJ, Gregory PA. The Notch ligand Jagged2 promotes lung adenocarcinoma metastasis through a miR-200-dependent pathway in mice. J Clin Invest. 2011;121:1373-1385. [PubMed] [DOI] |
| 7. | Xing F, Okuda H, Watabe M, Kobayashi A, Pai SK, Liu W, Pandey PR, Fukuda K, Hirota S, Sugai T. Hypoxia-induced Jagged2 promotes breast cancer metastasis and self-renewal of cancer stem-like cells. Oncogene. 2011;30:4075-4086. [PubMed] [DOI] |
| 8. | Zhang J, Tu K, Yang W, Li C, Yao Y, Zheng X, Liu Q. Evaluation of Jagged2 and Gli1 expression and their correlation with prognosis in human hepatocellular carcinoma. Mol Med Rep. 2014;10:749-754. [PubMed] [DOI] |
| 9. | Mullendore ME, Koorstra JB, Li YM, Offerhaus GJ, Fan X, Henderson CM, Matsui W, Eberhart CG, Maitra A, Feldmann G. Ligand-dependent Notch signaling is involved in tumor initiation and tumor maintenance in pancreatic cancer. Clin Cancer Res. 2009;15:2291-2301. [PubMed] [DOI] |
| 10. | Tsunoda T, Nakamura T, Ishimoto K, Yamaue H, Tanimura H, Saijo N, Nishio K. Upregulated expression of angiogenesis genes and down regulation of cell cycle genes in human colorectal cancer tissue determined by cDNA macroarray. Anticancer Res. 2001;21:137-143. [PubMed] |
| 11. | Slattery ML, Herrick JS, Lundgreen A, Fitzpatrick FA, Curtin K, Wolff RK. Genetic variation in a metabolic signaling pathway and colon and rectal cancer risk: mTOR, PTEN, STK11, RPKAA1, PRKAG2, TSC1, TSC2, PI3K and Akt1. Carcinogenesis. 2010;31:1604-1611. [PubMed] [DOI] |
| 12. | Pannuti A, Foreman K, Rizzo P, Osipo C, Golde T, Osborne B, Miele L. Targeting Notch to target cancer stem cells. Clin Cancer Res. 2010;16:3141-3152. [PubMed] [DOI] |
| 13. | Hovinga KE, Shimizu F, Wang R, Panagiotakos G, Van Der Heijden M, Moayedpardazi H, Correia AS, Soulet D, Major T, Menon J. Inhibition of notch signaling in glioblastoma targets cancer stem cells via an endothelial cell intermediate. Stem Cells. 2010;28:1019-1029. [PubMed] [DOI] |
| 14. | Zhang Y, Li B, Ji ZZ, Zheng PS. Notch1 regulates the growth of human colon cancers. Cancer. 2010;116:5207-5218. [PubMed] [DOI] |
| 15. | Sonoshita M, Aoki M, Fuwa H, Aoki K, Hosogi H, Sakai Y, Hashida H, Takabayashi A, Sasaki M, Robine S. Suppression of colon cancer metastasis by Aes through inhibition of Notch signaling. Cancer Cell. 2011;19:125-137. [PubMed] [DOI] |
| 16. | Meng RD, Shelton CC, Li YM, Qin LX, Notterman D, Paty PB, Schwartz GK. gamma-Secretase inhibitors abrogate oxaliplatin-induced activation of the Notch-1 signaling pathway in colon cancer cells resulting in enhanced chemosensitivity. Cancer Res. 2009;69:573-582. [PubMed] [DOI] |
| 17. | Jiang R, Lan Y, Chapman HD, Shawber C, Norton CR, Serreze DV, Weinmaster G, Gridley T. Defects in limb, craniofacial, and thymic development in Jagged2 mutant mice. Genes Dev. 1998;12:1046-1057. [PubMed] |
| 18. | Cereseto A, Tsai S. Jagged2 induces cell cycling in confluent fibroblasts susceptible to density-dependent inhibition of cell division. J Cell Physiol. 2000;185:425-431. [PubMed] [DOI] |
| 19. | DeHart SL, Heikens MJ, Tsai S. Jagged2 promotes the development of natural killer cells and the establishment of functional natural killer cell lines. Blood. 2005;105:3521-3527. [PubMed] [DOI] |
| 20. | Hu Y, Su H, Li X, Guo G, Cheng L, Qin R, Qing G, Liu H. The NOTCH ligand JAGGED2 promotes pancreatic cancer metastasis independent of NOTCH signaling activation. Mol Cancer Ther. 2015;14:289-297. [PubMed] [DOI] |