修回日期: 2018-03-28
接受日期: 2018-04-04
在线出版日期: 2018-04-18
探讨RNA干扰半乳糖凝集素-3(galectin-3, Gal-3)表达对胰腺癌细胞增殖和凋亡的影响及其机制.
将培养的Panc-1细胞随机分为对照组(未处理)、NC组(转染control-siRNA)和Gal-3干扰组(转染Gal-3-siRNA), 以小干扰RNA(Small interfering RNA, siRNA)技术干扰Panc-1细胞中Gal-3表达后, RT-PCR和Western blot检测干扰效果, CCK-8法检测细胞增殖, 流式细胞仪检测细胞凋亡, Western blot检测细胞中ki67、细胞周期蛋白D1(CyclinD1)、活化的含半胱氨酸的天冬氨酸蛋白水解酶 3(Cleaved caspase-3)抗体和β-连环蛋白(β-catenin)蛋白表达.
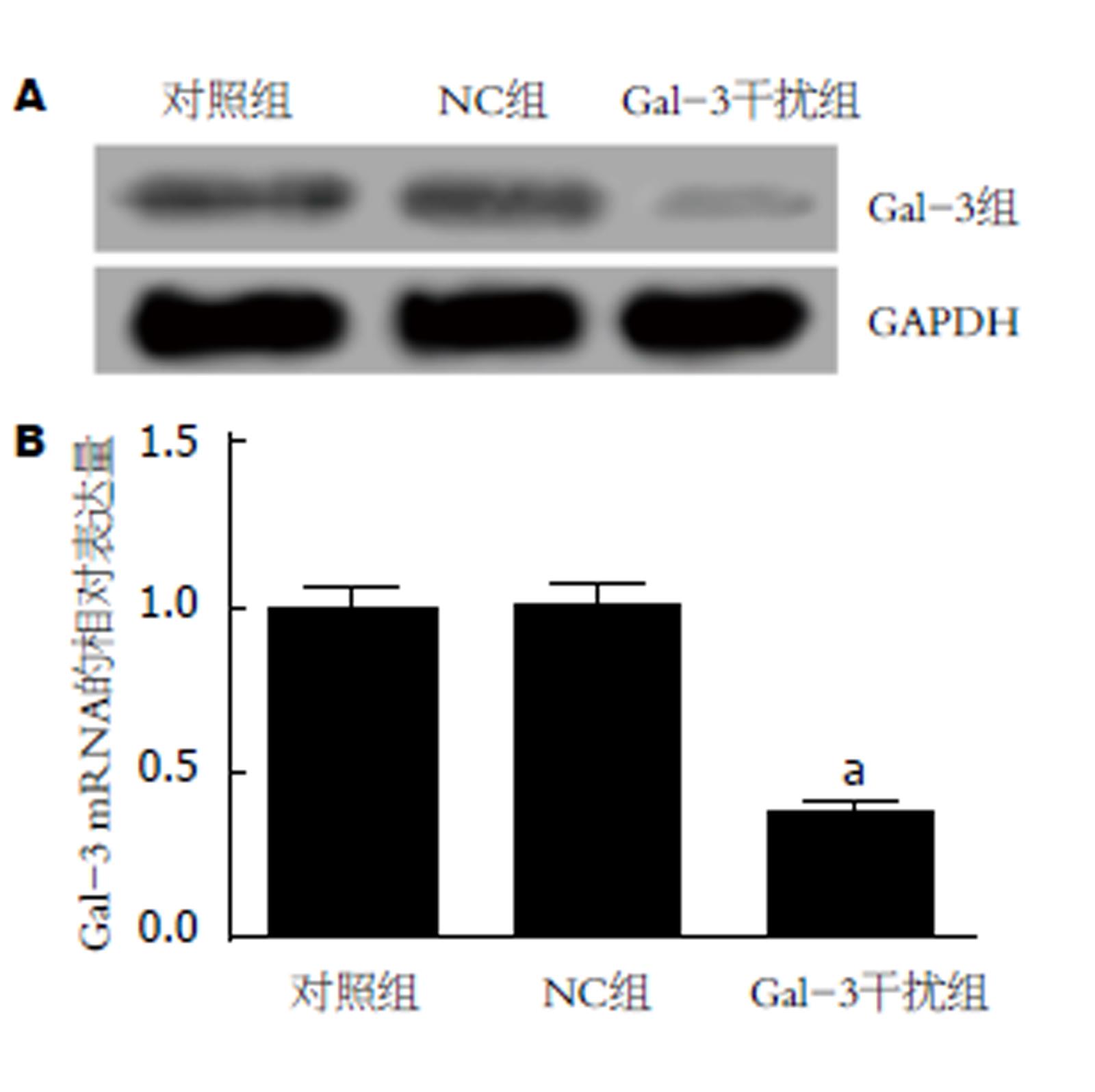
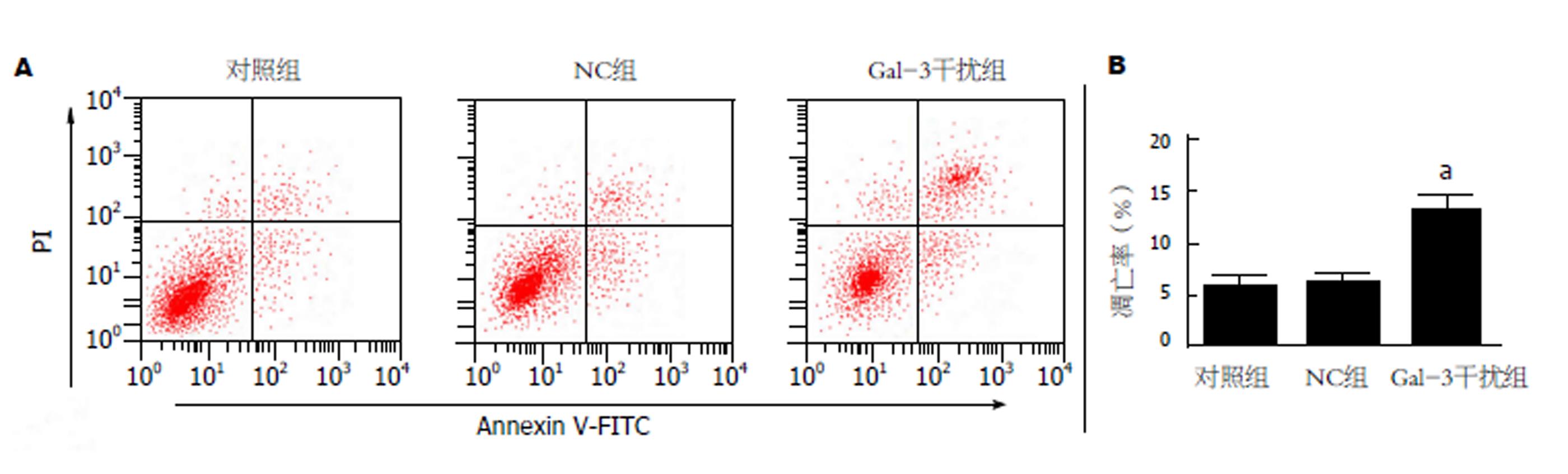
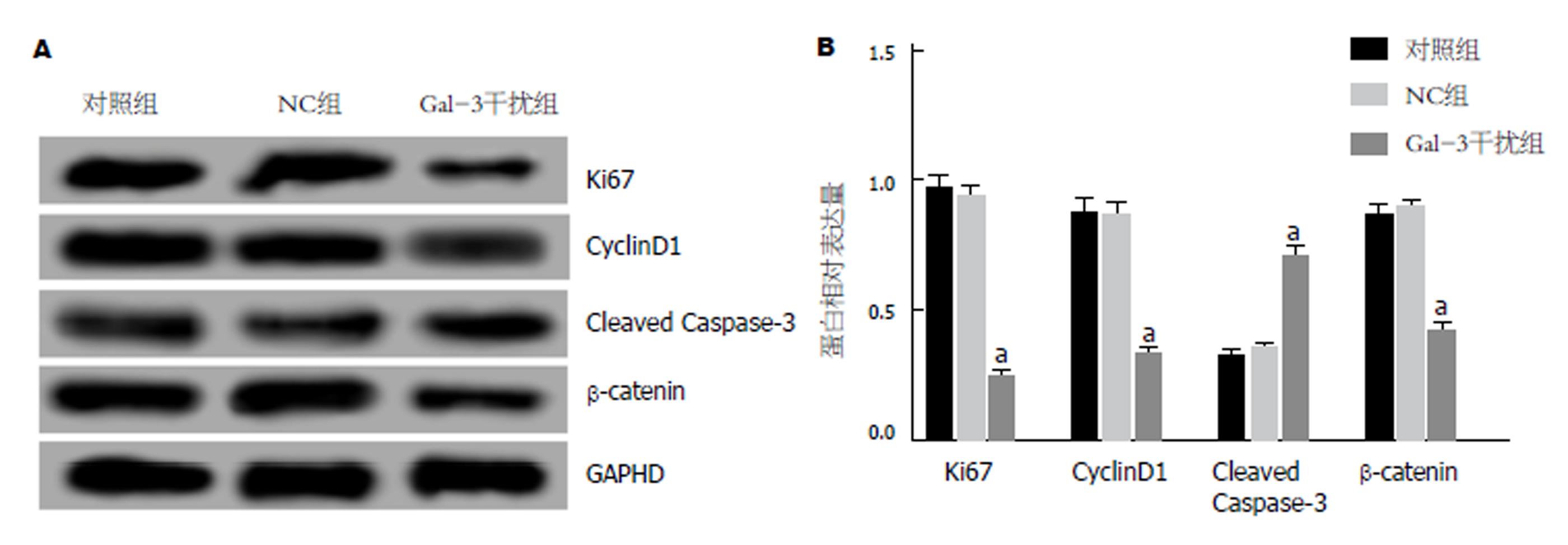
与对照组相比, NC组中Gal-3 mRNA(0.99±0.08 vs 1.01±0.06)和蛋白(0.36±0.03 vs 0.34±0.05)的表达差异不显著(P>0.05), 而Gal-3干扰组中Gal-3 mRNA(0.38±0.02 vs 1.01±0.06)和蛋白(0.10±0.01 vs 0.34±0.05)的表达均显著降低(P<0.05); Gal-3干扰组细胞增殖能力减弱(24 h: 0.55±0.03 vs 0.71±0.05; 48 h: 0.76±0.05 vs 0.97±0.06; 72 h: 1.08±0.06 vs 1.32±0.09), G0/G1期细胞百分比升高(79.48±1.32 vs 71.52±1.15 ), S期(14.26±1.08 vs 18.24±1.06)和G2/M期(6.21±0.78 vs 10.19±1.52)降低, 凋亡能力增强(13.26±2.28 vs 5.82±0.35), 与对照组相比, 差异均有统计学意义(P<0.05); 与对照组相比, Gal-3干扰组中ki67(0.24±0.02 vs 0.96±0.07)、CyclinD1(0.26±0.03 vs 0.88±0.09)和β-catenin(0.42±0.05 vs 0.87±0.05)蛋白的表达水平均明显降低, 而Cleaved Caspase-3(0.70±0.06 vs 0.32±0.03)蛋白表达水平明显升高, 差异有统计学意义(P<0.05); NC组与对照组间各指标差异均无统计学意义(P>0.05).
RNA干扰Panc-1细胞中Gal-3表达, 可抑制细胞增殖并促进细胞凋亡, 其机制可能与抑制Wnt/β-catenin信号通路有关.
核心提要: 半乳糖凝集素-3(galectin-3, Gal-3)表达可促进胰腺癌Panc-1细胞增殖, 小干扰RNA(small interfering RNA, siRNA)技术干扰其表达可抑制Panc-1细胞增殖, 诱导细胞凋亡, 并阻滞细胞于G0/G1期. Gal-3有望成为治疗胰腺癌的新靶点.
引文著录: 刘治智, 方从诚, 黄美君. RNA干扰Gal-3表达抑制胰腺癌细胞增殖并促进其凋亡. 世界华人消化杂志 2018; 26(11): 648-654
Revised: March 28, 2018
Accepted: April 4, 2018
Published online: April 18, 2018
To investigate the effect of RNA interference-mediated knockdown of galectin-3 (Gal-3) on the proliferation and apoptosis of pancreatic cancer cells and the possible mechanism involved.
Cultured Panc-1 cells were randomly divided into a control group (untreated), an NC group (transfected with control siRNA) and a Gal-3 interference group (transfected with Gal-3-siRNA). After using small interfering RNA (siRNA) technology to interfere with the expression of Gal-3 in Panc-1 cells, Gal-3 expression was detected by RT-PCR and Western blot, cell proliferation was measured by CCK-8 assay, and cell apoptosis was tested by flow cytometry. The expression of Ki67, cleaved caspase-3, and β-catenin proteins was examined by Western blot.
Compared with the control group, there was no significant difference in the expression of Gal-3 mRNA (0.99 ± 0.08 vs 1.01 ± 0.06) or protein (0.36 ± 0.03 vs 0.34 ± 0.05) in the NC group (P > 0.05), while the expression of Gal-3 mRNA (0.38 ± 0.02 vs 1.01 ± 0.06) and protein (0.10 ± 0.01 vs 0.34 ± 0.05) in the Gal-3 interference group was significantly decreased (P < 0.05). Compared with the control group, RNA interference-mediated knockdown of Gal-3 significantly decreased cell proliferation (24 h: 0.55 ± 0.03 vs 0.71 ± 0.05; 48 h: 0.76 ± 0.05 vs 0.97 ± 0.06; 72 h: 1.08 ± 0.06 vs 1.32 ± 0.09), increased the percentage of cells in G0/G1 stage (79.48 ± 1.32 vs 71.52 ± 1.15), reduced the percentage of cells in S (14.26 ± 1.08 vs 18.24 ± 1.06 ) and G2/M stages (6.21 ± 0.78 vs 10.19 ± 1.52), increased apoptosis (13.26 ± 2.28 vs 5.82 ± 0.35), downregulated the expression of Ki67 (0.24 ± 0.02 vs 0.96 ± 0.07), cyclin D1 (0.26 ± 0.03 vs 0.88 ± 0.09), and β-catenin (0.42 ± 0.05 vs 0.87 ± 0.05), and upregulated the expression of cleaved caspase-3 (0.70 ± 0.06 vs 0.32 ± 0.03) (P < 0.05 for all). There was no significant difference in the above indexes between the NC group and control group (P > 0.05).
RNA interference-mediated Gal-3 knockdown can inhibit proliferation and promote apoptosis of pancreatic cancer cells via mechanisms that may be related to the inhibition of the Wnt/ beta-catenin signaling pathway.
- Citation: Liu ZZ, Fang CC, Huang MJ. RNA interference-mediated Gal-3 knockdown inhibits proliferation and promotes apoptosis of pancreatic cancer cells. Shijie Huaren Xiaohua Zazhi 2018; 26(11): 648-654
- URL: https://www.wjgnet.com/1009-3079/full/v26/i11/648.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i11.648
近十几年来我国胰腺癌的发病率和死亡率在逐渐升高[1,2]. 2015年数据显示, 胰腺癌的发病人数和死亡人数分别达到9.01万和7.94万, 分别占恶性肿瘤的第9位和第6位[3]. 随着医疗水平的发展, 胰腺癌的治疗已由传统的手术治疗发展为手术、放疗和化疗等相结合的综合治疗, 但由于胰腺癌发病隐匿、诊断困难和易复发等特点使得其治疗和预后效果并不理想[4,5]. 近年来, 靶向药物的研究和应用受到广大关注, 寻找精准的药物靶点一直是胰腺癌治疗研究的重要课题[6-8]. 半乳糖凝集素3(galectin-3, Gal-3)是半乳凝素(galectin, Gal)家族中的重要一员, 其在多种肿瘤组织如前列腺癌和子宫内膜癌中异常表达, 与参与肿瘤的发生发展过程[9-12], 是糖生物学领域中研究较多抗癌药物靶点. 有研究指出, Gal-3在胰腺癌组织中高表达, 与胰腺癌病理分期和淋巴结转移关系密切, 但其促细胞生长的作用机制尚不明确[13]. 因此, 本研究通过小干扰RNA(Small interfering RNA, siRNA)技术干扰Panc-1细胞中Gal-3表达后, 观察其对细胞增殖凋亡的影响, 并探讨其可能的作用机制, 以期为以Gal-3为靶点的胰腺癌治疗提供新的参考依据.
1.1.1 细胞及其培养: 人胰腺癌Panc-1细胞购于中国科学院细胞库, 采用含有10%胎牛血清和青链霉双抗的DMEM培养基, 于湿度饱和、温度37℃和CO2体积分数5%的孵箱中常规培养. 收集生长状况良好的对数增殖期细胞进行后续实验.
1.1.2 试剂和仪器: 二喹啉甲酸(BCA)试剂盒、十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)、聚偏二氟乙烯(PVDF)、增强化学发光试剂(ECL)、细胞周期试剂盒和RIPA 裂解均购于上海碧云天公司. CCK-8溶液购于上海玉博公司, 膜联蛋白V-FITC(Annexin V-FITC)/碘化丙锭(PI)试剂盒和流式细胞仪均购于美国BD公司, 反转录试剂盒、RNA提取试剂盒及PCR扩增试剂盒购于上海拜力公司, β肌动蛋白(β-actin)抗体、HRP标记山羊抗兔/鼠IgG、Gal-3抗体、细胞周期蛋白D1(CyclinD1)抗体、β-连环蛋白(β-catenin)和活化的含半胱氨酸的天冬氨酸蛋白水解酶3(Cleaved caspase-3)抗体和ki67抗体购于美国Santa Cruz公司. MEM培养基、青链霉素、胰蛋白酶和LipofectamineTM2000购于美国Invitrogen公司. 胎牛血清购于杭州四季青公司, PCR扩增仪、电泳仪和凝胶图像分析系统均购自美国Bio-Rad公司, 酶标仪购于上海旦鼎公司, CO2细胞培养箱购于上海印溪公司, 引物由上海吉玛公司合成.
1.2.1 胰腺癌Panc-1细胞处理: 取6孔细胞板, 将对数生长期的Panc-1细胞按照3.5×105个/孔的密度接种. 置于孵箱中常规条件下培养至细胞汇合度为85%左右时, 以脂质体进行转染. 实验分组: 对照组、NC组和Gal-3干扰组. 参照脂质体LipofectamineTM2000配制siRNA/脂质体复合物并将control-siRNA和Gal-3-siRNA转染至NC组和Gal-3干扰组细胞中, 对照组细胞不做处理. 置于孵箱中培养5 h后, 更换培养基(含10%胎牛血清). 再置于孵箱中培养48 h后, 检测各组Panc-1细胞的Gal-3mRNA和蛋白的表达情况, 具体实验步骤参照1.4和1.5.
1.2.2 胰腺癌Panc-1细胞中Gal-3 mRNA表达检测: RT-PCR检测Gal-3mRNA的表达. 以RNA提取试剂盒提取Panc-1细胞的总RNA, 并测定其浓度. 再以逆转录试剂盒合成模板链cDNA. 将含有25 μL反应体系的EP管上样至Bio-Rad PCR仪中进行扩增. 每组实验设3个重复. 扩增条件: 94℃ 30 s预变性(1个循环), 94℃ 5 s变性(40个循环), 60℃ 30 s退火(40个循环), 72℃ 60 s延伸(40个循环); 反应体系: 2 μL模板cDNA, 各0.5 μL上下游引物, 12.5 μL 1×SYBR Premix Ex Taq和9.5 μL ddH2O. 其中, Gal-3引物: 正向为5'-TATTCCGTGTTAGTCACCGG-3', 反向为5'-TGCAACCTTGAAGTGGTCAG-3'; 内参GAPDH引物: 正向为5'-AACTAAAACCTCC-CTAGAGC-3', 反向为5'-TGTGGTCATGAGTCCTTCCA-3'. 采用2-△△CT法对数据进行计数, 以得到H6C7细胞和Panc-1细胞中Gal-3 mRNA的相对表达量.
1.2.3 胰腺癌Panc-1细胞中Gal-3蛋白表达检测: Western blot检测Gal-3蛋白的表达. 取对数生长期的Panc-1细胞, 加RIPA裂解液提取总蛋白, 并定量其浓度. 经沸水浴变性后, 以每孔50 μg上样至SDS-PAGE电泳. 经转PVDF膜后, 以TBST封闭液(含5%脱脂牛奶)常温反应2 h. 加特异性Gal-3抗体(1: 800稀释)和GAPDH抗体(1:1000稀释), 于4℃下反应24 h. 以TBST洗涤(洗涤3×10 min/次)后, 在37℃下以HRP标记二抗(1:2000稀释)反应2 h. TBST洗膜后, 采用ECL显影, 并以凝胶图像处理系统扫描图片, GAPDH为内参, ImageJ软件分析Gal-3蛋白表达. 其中, 每组实验重复3次.
1.2.4 胰腺癌Panc-1细胞增殖能力的检测: CCK-8法检测Panc-1细胞的增殖情况. 收集1.1中对数生长期的Panc-1细胞, 调整细胞浓度为5.5×104个/mL, 以每孔150 μL种植到96孔板上, 在孵箱中培养至细胞融合度为80%左右时, 将Panc-1细胞参照1.3中的方法进行分组和转染. 其中, 每组设定4个平行孔, 实验重复3次. 将转染5 h后的对照组、NC组和Gal-3干扰组细胞, 按照时间点24、48和72 h培养. 培养至所需时间时, 取出培养板, 吸取上清后, 加入100 μL DMEM培养基和10 μL CCK-8溶液, 置于常温下反应1 h后, 以酶标仪读取各组Panc-1细胞在490 nm处的吸光度值(OD值).
1.2.5 胰腺癌Panc-1细胞克隆形成能力的检测: 取直径为90 mm的培养皿, 经转染48 h后的Panc-1细胞以每皿800个细胞进行接种, 并设置3个重复, 置于细胞培养箱内常规培养14 d后, 弃培养基, 加入浓度为4%的甲醛, 固定12 min后, 加入吉姆萨染色10 min, 洗涤晾干后, 以显微镜观察Panc-1细胞的克隆形成能力, 以细胞克隆形成率 = (细胞克隆数平均值/铺板细胞数)×100%来表示.
1.2.6 胰腺癌Panc-1细胞周期分布和凋亡能力的检测: 流式细胞仪检测Panc-1细胞周期和凋亡率. 转染后48 h, 收集对照组、NC组和Gal-3干扰组细胞, 分别按照细胞周期试剂盒及凋亡检测试剂盒说明书操作步骤检测各组Panc-1细胞的周期分布及凋亡率.
1.2.7 Panc-1细胞中ki67、CyclinD1、Cleaved Caspase-3和β-catenin蛋白检测: Western blot检测ki67、CyclinD1、Cleaved Caspase-3和β-catenin蛋白表达. 转染后48 h, 收集对照组、NC组和Gal-3干扰组细胞, 提取总蛋白. 再经SDS-PAGE电泳、转PVDF膜和TBST封闭液处理后, 加入ki67抗体(1:500稀释)、CyclinD1抗体(1:800稀释)、Cleaved caspase-3抗体(1:1000稀释)和β-catenin抗体(1:800稀释), 4℃孵育过夜后, 加入2000倍稀释的二抗, 充分反应后, 以ECL显影, 扫描并分析Panc-1细胞中ki67、CyclinD1、Cleaved Caspase-3和β-catenin蛋白的表达. 详细步骤见1.5.
统计学处理 以mean±SD表示实验所得数据, SPSS20.0软件进行多组间单因素方差分析和两组间独立样本t检验, P<0.05表示差异有统计学意义
RT-PCR和Western blot检测转染后48 h各组Panc-1细胞中Gal-3 mRNA和蛋白的表达情况, 结果见图1. NC组中Gal-3 mRNA和蛋白与对照组比较, 差异无统计学意义(P>0.05), 而Gal-3干扰组中Gal-3 mRNA和蛋白表达水平显著低于对照组, 差异有统计学意义(P<0.05).
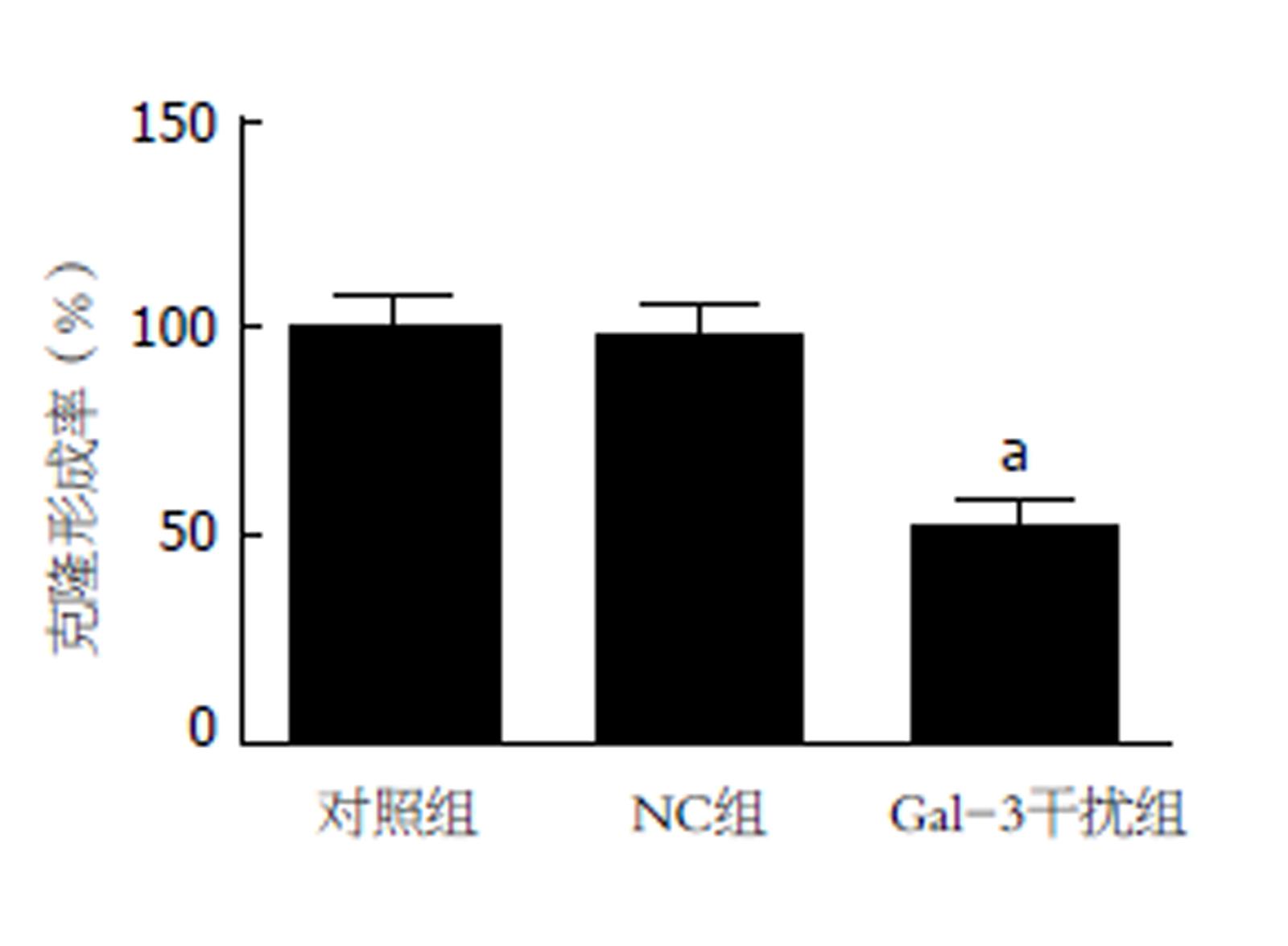
CCK-8法检测各组Panc-1细胞在转染不同时间后的OD值, 结果见表1. 在相同作用时间下, NC组Panc-1细胞的OD值较对照组无显著性变化(P>0.05), 但Gal-3干扰组细胞的OD值较对照组显著降低(P<0.05). 进一步采用克隆形成实验验证RNA干扰Gal-3表达抑制Panc-1细胞增殖能力. 图2显示, 与对照组相比, NC组细胞的克隆形成率虽无显示改变, 但Gal-3干扰组细胞的克隆形成率明显下降(P<0.05).
表2结果显示, 与对照组比较, Gal-3干扰组中G0/G1期细胞百分比升高, S期和G2/M期下降, 差异均有统计学意义(P<0.05); NC组和对照组相比, 细胞周期分布无明显变化, 各时相细胞百分比差异无统计学意义(P>0.05).
图3结果显示, NC组细胞凋亡能力较对照组差异不显著(P>0.05), 而Gal-3干扰组细胞的凋亡能力与对照组相比显著增强(P<0.05).
Western blot检测各组细胞中ki67、CyclinD1、Cleaved Caspase-3和β-catenin蛋白表达情况, 结果见图4. 在Gal-3干扰组细胞中, ki67、CyclinD1和β-catenin蛋白的表达水平明显降低, 而Cleaved Caspase-3蛋白表达水平明显升高, 与对照组比较, 差异均显著(P<0.05). 但在NC组细胞中, 4种蛋白的表达水平与对照组相比无显著性变化(P>0.05). 干扰Panc-1细胞中Gal-3表达, 可下调ki67、CyclinD1和β-catenin及上调Cleaved Caspase-3蛋白表达.
Gal-3是一个由串联重复序列结构域、N端结构域和糖识别结构域组成的嵌合型动物凝集素, 主要存在于细胞质中, 通过特性识别β-半乳糖苷, 在胞外肿瘤细胞侵袭和转移, 以及胞内细胞生长、细胞周期调控和凋亡等方面发挥着重要作用, 与肿瘤的发展发展密切相关[14,15]. 高表达Gal-3与宫颈癌、非小细胞肺癌和骨肉瘤等肿瘤的临床分期、淋巴结转移和预后有关[16-18]. 在甲状腺癌中, Gal-3可能通过作用于Bax参与癌细胞的抗凋亡作用[19]; 胃癌SGC-7901细胞中, siRNA干扰Gal-3表达后, 细胞增殖减弱、凋亡增强, 同时对化疗药物奥沙利铂的敏感性增强[20]. Gal-3在胰腺癌组织和细胞中有表达, 而在正常胰腺组织、周围成纤维细胞和基质中无表达, 提示其可能在胰腺癌的发生发展中发挥着重要作用, 但其作用机制尚不完全清晰[21]. 本研究通过RNA干扰技术下调胰腺癌Panc-1细胞中Gal-3表达, 采用常规生物学手段检测细胞的增殖、周期分布和凋亡情况. 结果发现, 与对照组相比, 在转染Gal-3-siRNA的Panc-1细胞中, 细胞的增殖能力减弱. 这一结果与早期周国雄等[22]发现Gal-3单抗能够抑制胰腺癌SW1990细胞增殖的结果相吻合. 同时, 本研究还发现, 干扰Gal-3表达后, Panc-1细胞被阻滞于G0/G1期, 细胞的凋亡能力增强. 提示, 高表达Gal-3在胰腺癌的发生发展过程中可能发挥着重要的促癌作用.
肿瘤被形象地称为细胞周期性疾病, 细胞增殖和凋亡过程失衡是其形成的内在机制, 而该过程是受到多种基因和信号通路调控. Ki67是公认的增殖相关蛋白, CyclinD1是促进细胞从G1期进入S期的特异性周期蛋白, 均在细胞的增殖过程中具有重要作用; 细胞凋亡是一种不同与以程序性死亡清除感染的细胞焦亡过程, Caspase-3是重要的细胞凋亡执行蛋白, 而不参与细胞焦亡过程; 三者均在胰腺癌的发生发展中发挥着重要作用[23-25]. 本研究以Western blot检测Panc-1细胞中Ki67、CyclinD1和Cleaved Caspase-3蛋白的表达情况, 以评价Gal-3基因调控胰腺癌发生发展的分子机制. 结果发现, 在Gal-3干扰组中, ki67和CyclinD1蛋白的表达水平明显降低, 而Cleaved Caspase-3蛋白表达水平明显升高. 提示, 胰腺癌中Gal-3可能通过上调ki67、CyclinD1及下调Cleaved Caspase-3表达发挥了促进细胞增殖和抑制细胞凋亡的作用. Wnt/β-catenin信号通路是经典的Wnt信号通路, 在细胞增殖凋亡过程中发挥着重要作用. 吴梦瑶等[26]和Arend等[27]研究指出, Wnt/β-catenin信号通路的异常激活, 与胰腺癌细胞的增殖和凋亡过程关系密切. 在肺癌、舌鳞癌和宫颈癌中Gal-3可通过调控Wnt/β-catenin信号通路转导核心β-catenin的表达发挥抑制肿瘤的作用[28-30]. 本研究进一步检测Panc-1细胞中β-catenin表达发现, Gal-3干扰组中β-catenin蛋白表达水平明显降低. 提示, Gal-3可能通过激活Wnt/β-catenin信号通路促进胰腺癌的发生发展.
总之, RNA干扰胰腺癌Panc-1细胞中Gal-3表达, 可抑制细胞增殖并促进细胞凋亡, 其机制可能与抑制Wnt/β-catenin信号通路有关. 这一结果丰富了胰腺癌的发生机制, 也为以Gal-3为靶点的胰腺癌的治疗提供了一定的参考依据.
近年来研究发现半乳糖凝集素3(galectin-3, Gal-3)在胃癌、前列腺癌和子宫内膜癌等多种肿瘤中异常表达, 与肿瘤细胞的增殖、侵袭和凋亡等生理过程关系密切. 但有关Gal-3对胰腺癌生物学功能的研究在国内外未见报道.
本研究旨在研究RNA干扰Gal-3表达对胰腺癌细胞增殖和凋亡的影响, 并探讨其可能的分子机制, 以期为胰腺癌的发生发展机制和治疗提供新的线索.
探讨RNA干扰Gal-3表达对胰腺癌细胞增殖和凋亡的影响及其机制, 以期为胰腺癌的治疗提供新靶点.
将培养的Panc-1细胞随机分为对照组(未处理)、NC组(转染control-siRNA)和Gal-3干扰组(转染Gal-3-siRNA), 以siRNA干扰Panc-1细胞中Gal-3表达后, RT-PCR和Western blot检测干扰效果, CCK-8法检测细胞增殖, 流式细胞仪检测细胞凋亡, Western blot检测细胞中ki67、CyclinD1、Cleaved caspase-3和β-catenin蛋白表达.
本研究成功干扰胰腺癌细胞中Gal-3的表达后发现, 胰腺癌细胞增殖能力减弱, 凋亡能力增强, 同时细胞在G0/G1期发生阻滞, ki67、CyclinD1和β-catenin蛋白的表达水平降低, Cleaved Caspase-3蛋白表达水平升高.
RNA干扰Panc-1细胞中Gal-3表达, 可抑制细胞增殖并促进细胞凋亡, 其机制可能与抑制Wnt/β-catenin信号通路有关. 该研究结果丰富了胰腺癌的发生发展机制, 也为以Gal-3为靶点的胰腺癌的治疗提供了一定的参考依据.
本研究仅从体外细胞水平上探讨了Gal-3在胰腺癌中的作用, 后期实验还需要从体内动物实验中加以验证, 采用构建胰腺癌大鼠模型的方式, 体内干预或剔除Gal-3后, 观察其对胰腺癌大鼠生长的影响, 为Gal-3有望成为治疗胰腺癌的新靶点提供更为充分的理论依据.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B, B, B
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
编辑:马亚娟 电编:张砚梁
| 1. | Kamisawa T, Wood LD, Itoi T, Takaori K. Pancreatic cancer. Lancet. 2016;388:73-85. [PubMed] [DOI] |
| 2. | 马 少军, 屈 振亮, 孔 棣, 曹 洪波. 胰腺癌流行病学及诊断研究进展. 中国中西医结合外科杂志. 2015;1:87-92. [DOI] |
| 3. | Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, Jemal A, Yu XQ, He J. Cancer statistics in China, 2015. CA Cancer J Clin. 2016;66:115-132. [PubMed] [DOI] |
| 5. | Armstrong EA, Beal EW, Chakedis J, Paredes AZ, Moris D, Pawlik TM, Schmidt CR, Dillhoff ME. Exosomes in Pancreatic Cancer: from Early Detection to Treatment. J Gastrointest Surg. 2018;22:737-750. [PubMed] [DOI] |
| 7. | 迪力夏提·吐尼牙孜, 丁伟, 依马木买买提江·阿布拉, 易超, 苏雅婷, 李海军. SMO基因siRNA慢病毒表达载体的构建及其对胰腺癌细胞SMO基因表达的影响. 世界华人消化杂志. 2016;19:2974-2981. [DOI] |
| 8. | Wang LH, Huang J, Wu CR, Huang LY, Cui J, Xing ZZ, Zhao CY. Downregulation of miR29b targets DNMT3b to suppress cellular apoptosis and enhance proliferation in pancreatic cancer. Mol Med Rep. 2018;17:2113-2120. [PubMed] [DOI] |
| 9. | Leal MF, Calcagno DQ, Chung J, de Freitas VM, Demachki S, Assumpção PP, Chammas R, Burbano RR, Smith MC. Deregulated expression of annexin-A2 and galectin-3 is associated with metastasis in gastric cancer patients. Clin Exp Med. 2015;15:415-420. [PubMed] [DOI] |
| 10. | Dondoo TO, Fukumori T, Daizumoto K, Fukawa T, Kohzuki M, Kowada M, Kusuhara Y, Mori H, Nakatsuji H, Takahashi M. Galectin-3 Is Implicated in Tumor Progression and Resistance to Anti-androgen Drug Through Regulation of Androgen Receptor Signaling in Prostate Cancer. Anticancer Res. 2017;37:125-134. [PubMed] [DOI] |
| 11. | Lambropoulou M, Deftereou TE, Kynigopoulos S, Patsias A, Anagnostopoulos C, Alexiadis G, Kotini A, Tsaroucha A, Nikolaidou C, Kiziridou A. Co-expression of galectin-3 and CRIP-1 in endometrial cancer: prognostic value and patient survival. Med Oncol. 2016;33:8. [PubMed] [DOI] |
| 12. | Song L, Tang JW, Owusu L, Sun MZ, Wu J, Zhang J. Galectin-3 in cancer. Clin Chim Acta. 2014;431:185-191. [PubMed] [DOI] |
| 13. | Xie L, Ni WK, Chen XD, Xiao MB, Chen BY, He S, Lu CH, Li XY, Jiang F, Ni RZ. The expressions and clinical significances of tissue and serum galectin-3 in pancreatic carcinoma. J Cancer Res Clin Oncol. 2012;138:1035-1043. [PubMed] [DOI] |
| 14. | Punt S, Thijssen VL, Vrolijk J, de Kroon CD, Gorter A, Jordanova ES. Galectin-1, -3 and -9 Expression and Clinical Significance in Squamous Cervical Cancer. PLoS One. 2015;10:e0129119. [PubMed] [DOI] |
| 15. | Ajani JA, Estrella JS, Chen Q, Correa AM, Ma L, Scott AW, Jin J, Liu B, Xie M, Sudo K. Galectin-3 expression is prognostic in diffuse type gastric adenocarcinoma, confers aggressive phenotype, and can be targeted by YAP1/BET inhibitors. Br J Cancer. 2018;118:52-61. [PubMed] [DOI] |
| 16. | Diao B, Liu Y, Xu GZ, Zhang Y, Xie J, Gong J. The role of galectin-3 in the tumorigenesis and progression of pituitary tumors. Oncol Lett. 2018;15:4919-4925. [PubMed] [DOI] |
| 18. | Zhou X, Jing J, Peng J, Mao W, Zheng Y, Wang D, Wang X, Liu Z, Zhang X. Expression and clinical significance of galectin-3 in osteosarcoma. Gene. 2014;546:403-407. [PubMed] [DOI] |
| 19. | Harazono Y, Kho DH, Balan V, Nakajima K, Zhang T, Hogan V, Raz A. Galectin-3 leads to attenuation of apoptosis through Bax heterodimerization in human thyroid carcinoma cells. Oncotarget. 2014;5:9992-10001. [PubMed] [DOI] |
| 20. | 陈 微微, 陈 卫昌, 岑 建农, 严 苏. siRNA干扰galectin-3表达对人胃癌细胞株SGC-7901增殖、凋亡和化疗敏感性的影响. 胃肠病学. 2014;5:261-265. [DOI] |
| 22. | 周 国雄, 张 淼, 丁 晓凌, 张 海峰, 曹 维, 瞿 利帅, 蒯 小玲, 张 弘, 徐 正府. 半乳凝素3在胰腺癌细胞中的表达及对胰腺癌SW1990细胞增殖和侵袭的影响. 中华胰腺病杂志. 2012;5:320-322. [DOI] |
| 23. | Hao L. Electrochemical Analysis of Ki67 Protein As Pancreatic Cancer Biomarker Based on Graphene-Polydopamine Nanocomposite. Int J Electrochem Sci. 2017;4:3040-3049. [DOI] |
| 24. | Zhang Y, Su Y, Zhao Y, Lv G, Luo Y. MicroRNA720 inhibits pancreatic cancer cell proliferation and invasion by directly targeting cyclin D1. Mol Med Rep. 2017;16:9256-9262. [PubMed] [DOI] |
| 27. | Arend RC, Londoño-Joshi AI, Straughn JM Jr, Buchsbaum DJ. The Wnt/β-catenin pathway in ovarian cancer: a review. Gynecol Oncol. 2013;131:772-779. [PubMed] [DOI] |
| 28. | Chung LY, Tang SJ, Wu YC, Sun GH, Liu HY, Sun KH. Galectin-3 augments tumor initiating property and tumorigenicity of lung cancer through interaction with β-catenin. Oncotarget. 2015;6:4936-4952. [PubMed] [DOI] |
| 29. | Zhang D, Chen ZG, Liu SH, Dong ZQ, Dalin M, Bao SS, Hu YW, Wei FC. Galectin-3 gene silencing inhibits migration and invasion of human tongue cancer cells in vitro via downregulating β-catenin. Acta Pharmacol Sin. 2013;34:176-184. [PubMed] [DOI] |