修回日期: 2017-09-15
接受日期: 2017-09-24
在线出版日期: 2017-12-08
谷丙转氨酶(alanine transaminase, ALT)目前仍是评价肝细胞损伤的最灵敏标志物, 但许多非病理因素如不同性别、年龄、妊娠、生活条件、运动、昼夜节律变化、饮食、饮酒、吸烟甚至采血方式、标本采集、传送与保存等, 亦直接或间接影响血清ALT等肝酶活性的检测值. 临床上应该重视ALT正常值的界定以及某些非病理因素对其检测结果的影响.
核心提要: 日常生活中影响谷丙转氨酶测值的因素众多, 临床解读其测值时需详细了解检测者的相关生活状况, 注意排除常见的非病理情况对测值的干扰.
引文著录: 程书权. 重视非病理因素对ALT测值的影响. 世界华人消化杂志 2017; 25(34): 3005-3020
Revised: September 15, 2017
Accepted: September 24, 2017
Published online: December 8, 2017
Alanine transaminase (ALT) is still the most sensitive marker for evaluating the damage of liver cells. ALT measurements may be affected by common non-pathological factors such as gender, age, pregnancy, different physiological conditions, circadian rhythm, diet, drinking, smoking, strenuous exercise, metabolic factors, drugs, blood collection methods, and specimen collection, transmission, and preservation. It is important to emphasize the definition of limits of normal ALT and the influence of the above-mentioned non-pathological factors on its test results.
- Citation: Cheng SQ. Influence of non-pathological factors on ALT measurements. Shijie Huaren Xiaohua Zazhi 2017; 25(34): 3005-3020
- URL: https://www.wjgnet.com/1009-3079/full/v25/i34/3005.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i34.3005
肝功能检查是临床各科和健康体检中最为普遍而常用的血液生化学检查项目之一, 尤其其中的谷丙转氨酶(alanine transaminase, ALT)和谷草转氨酶(aspartate transaminase, AST)等酶学水平的测定, 由于其灵敏度高、价廉易得、重复性好而备受医患双方的共同青睐. 目前其活性测值不仅用于筛查与评价肝脏疾病, 还被作为监测总体健康状况的客观指标之一[1]. 异常的ALT等肝功能测值, 常引起无症状患者或体检者的极大焦虑与担忧. 即便是这些指标的轻微超标, 亦可能导致被检测者就医兴趣与频度的大幅度增加和进一步追加补做各种深层次检查的几率, 以确定自己是否患有某种潜在的肝脏疾病[2], 使体检者的就医负担(包括时间、经济、心身等)大为增加. ALT的使用频率一般在普通门诊为20%-40%, 内科住院患者为50%-80%, 手术患者则达90%以上, 而在体检菜单中则几乎100%会出现. 业已发现, ALT等转氨酶升高至少有上百种常见原因, 其中最常见的除各型病毒性肝炎、服用药物、酒精过量、各种感染、某些系统性疾病如胆道疾病、心肾等重要脏器疾病外[1-3], 近年发现某些代谢紊乱, 如体质量指数(body mass index, BMI)超标、脂类和糖代谢异常、胰岛素抵抗以及肥胖、高脂血症、糖尿病(diabetes mellitus, DM)等亦可出现轻至中度的ALT升高[1]. 许多非病理因素如不同性别、年龄、妊娠、生活条件、运动、昼夜节律变化、饮食、饮酒、吸烟甚至采血方式、标本采集、传送与保存等[2], 亦直接或间接影响血清ALT等肝酶活性的检测值. 目前, ALT检测不仅广泛用于鉴别具有明显临床症状的肝病的发生、发展和预后, 还为潜隐性肝病的筛查、健康体检以及整体健康状况的评估提供参考[1,3]. 因此, 恰当评价ALT的测值, 认识与了解某些非病理因素对其准确性的影响十分必要. 本文拟就近年国内外有关ALT正常值的界定以及某些非病理因素对其检测结果的影响情况加以总结.
转氨酶或称氨基移换酶, 是细胞内一组催化氨基(-NH4+)在氨基酸与α-酮酸间相互转移的酶类, 能够将氨基从一个氨基酸供体分子转移至另一个受体分子, 参与生物有机体内的多种非必需氨基酸的代谢与合成, ALT和AST是其中最重要的两种. 二者主要分布于肝细胞内, 仅有一小部分存在于肌肉细胞中. ALT作为一种非特异性细胞内功能酶, 在机体组织细胞内广泛存, 以肝细胞含量最多, 其次为心肌、脑和肾脏组织, 脂肪组织、肠道、前列腺亦有少量[1]. 在肝细胞中, ALT主要存在于细胞质, 少量存在于线粒体内, 其活性较血清高100倍[1]. AST广泛存在多种器官中, 按含量多少顺序分布于心、肝、骨骼肌和肾等, 肝中70%存在于肝细胞线粒体中. 由于肝内ALT和AST浓度活性分别为血清的3000和7000倍, 在肝细胞膜通透性增加时, 即使无明显的肝细胞坏死, 细胞内的转氨酶也会因巨大的浓度梯度而渗溢入血液中, 呈现不同程度的测值异常, 因此血清转氨酶水平被临床作为反映肝细胞损害的敏感指标[1]. 转氨酶在健康人体血清内含量较低, 当肝细胞受到损伤时方释放入血液, 显示测值的升高, 成为肝脏可能存在某一疾病的信号. 其中ALT最为敏感, 1%肝细胞的坏死, 足以使血清中酶活性测值增高1倍. 大多数情况下, ALT和AST升高程度与肝细胞受损程度相一致, 但测值高于正常水平并不一定等同于肝脏存在疾病[2]. 即使确有肝脏疾病的存在, 其测值与肝病的急缓、轻重程度并非总是呈现良好的线性关系[1]. 如5%-10%的慢性乙型肝炎(chronic hepatitis B, CHB)、15%的慢性丙型肝炎(chronic hepatitis C, CHC)和非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)患者ALT水平可能保持在正常值范围; 而甲型肝炎病毒感染造成的急性肝损害, 血清ALT和AST水平可于短期内急剧升高达数百倍, 但大多可完全康复, 几无慢性迁延不愈的情况存在. 相反, 通常CHC患者虽然肝细胞出现了持续性的炎症损伤, 有的甚至渐进为肝硬化、已经出现了腹水或癌变, 但ALT和AST水平可能仅仅只是稍微升高或不显示升高. 由于取样界定正常值范围的误差和局限性, 少数健康人(约2.5%)会有ALT的轻度增高. 其他多种疾病, 如心肌梗死[4]、肝脏外因性钝性损伤[5]等亦会导致肝酶水平的测值异常.
欲判断ALT水平高低及其临床意义, 首先需要了解ALT正常值的界定. 迄今国内外多数医院长期沿用的ALT正常参考范围为5-40 IU/L[6,7]. 这一标准制订于20世纪80年代, 囿于当时的医学认知水平, 对CHC和非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)等还未被发现或充分了解, 因此在设定ALT正常上限的参考人群中可能包含有少部分CHC和NAFLD患者, 并非真正意义上的"健康人群". 由于在不同取样群体、医院、试剂、参考标准、生化检测仪器与方法等进行检测所获数据有很大的差异, 故所谓的"正常值"仅仅是一个相对的概念. 按照当前ALT<40 IU/L为正常的标准, 多项研究[8,9]显示ALT正常的乙型肝炎e抗原(hepatitis B e antigen, HBeAg)阳性和阴性的CHB患者中有30%-50%存在明显肝脏坏死炎症和纤维化等肝脏组织学异常; Mofrad等[10]发现ALT正常的NAFLD患者中, 35.3%存在有明显肝纤维化、早期肝硬化等组织学异常; 另据Fracanzani等[11]报告, ALT正常的NAFLD患者中, 有59%的病例存在NASH. 从死亡风险看也有同样的结果, Kim等[12]发现, ALT处于正常范围内的患者的慢性肝病死亡风险也随ALT水平不同而有差异: 与<20 IU/L的男性相比, ALT水平为30-39 IU/L者的死亡风险显著增加. 2016年韩国的一项研究[13]还显示, ALT水平与死亡风险呈正相关, 即使ALT仅有1-2倍轻度升高, 其心血管疾病(cardiovascular disease, CVD)死亡风险、肝脏相关死亡风险及全因死亡率都有不同程度的升高. 以上资料说明恰当判断与解读ALT的测值水平对被检查者健康状况和疾病与生存有着十分重要的意义, 而按照<40 IU/L的标准有可能漏检少部分有风险的潜在患病人群. 2006年, 美国Keeffe等[14]8名资深专家拟定的《美国慢性乙型肝炎病毒感染处理流程》中, 建议将ALT正常值上限下调为男性30 IU/L, 女性19 IU/L. 此后国外专家反复推荐这一观点, 甚至是更低的正常值范围, 并被不少研究者与医院所接受[6]. 对于这一问题国内外至今一直有不同的声音发出. 按照我国2015年更新的《CHB防治指南》推荐, CHB患者抗病毒治疗人群需同时满足以下条件: 乙型肝炎病毒(hepatitis B virus, HBV) DNA≥105 拷贝/mL(HBeAg阳性)或104 拷贝/mL(HBeAg阴性), ALT持续升高≥2×正常值上限(upper limit of normal, ULN). 依Keeffe等的上述新"标准"而论, 国内临床医师会不可避免的产生困惑, 即CHB患者如果ALT水平恰好处于男≥60 IU/L和女≥38 IU/L, 是否需要给予规范的核苷(酸)类似物抗病毒治疗? 陈成伟等[6]国内知名肝病和检验专家亦非常关注. 在2016-12-11的上海肝病论坛上, 来自国内多家的医院肝病和检验方面的专家学者就此问题的正反观点还进行了精彩的辩论与点评.
目前的主要观点如下: (1)下调ALT正常值: 多项研究显示, 下调ALT正常值, 可以提高病毒性肝炎等慢性肝脏疾病诊断的敏感性. 如Choi等[15]发现, 下调ALT正常值标准至男34 IU/L、女25 IU/L, 可使诊断常见慢性肝脏疾病的敏感性从18%提高至33%, 利于早期发现肝脏疾病患者. 在代谢综合征方面也有相关研究, Yadav等[16]发现, 与当前界定的ALT正常值水平相比, 当ALT正常值下调为男性≤31 IU/L、女性≤23 IU/L后, 试验组的代谢综合征发生率有明显差异(P<0.01). 研究[17]还显示, 降低ALT正常值, 可提高对病毒性肝炎显著肝脏病理改变的检出率. 另外的一些研究[6]亦发现, 与ALT正常范围低值组相比, 处于正常范围高值组的患者中显著肝脏病理改变的发生率高, 与低值组之间存在有显著差别; 下调ALT正常值上限到25 IU/L后, 肝纤维化的发现率可从5%增加到25%, 存在肝脏炎症情况的发现率从20%增加到41%; 降低上限值可以除外显著肝脏病理改变的病例, 阴性预测值优于传统的上限值; 下调ALT正常上限值有利于对慢性肝病预后的评估等等; (2)ALT正常值下调依据不充分, 应维持原状: 前述Keeffe等的研究是基于韩国医疗保险公司的数据, 其观察对象为政府和私立学校雇员及家属(男性94533人、女性47522人), 采用1990年和1992年的单次健康检查结果和1992年的自我调查表, 分析1993年以后人群死于肝病的情况. 结果表明, 与最低水平(<20 IU/L)相比, 男性AST和ALT水平分别为20-29 IU/L和30-39 IU/L时, 因肝病死亡风险显著增加. 故而在男性判断肝病死亡风险的AST和ALT临床值分别为31 IU/L和30 IU/L. 但该研究存在很多局限: (1)研究入组前未作严格的健康(未排除CVD风险)或肝病筛查(肝硬化、酒精性肝病、NASH和可能潜在的遗传和代谢性肝病等), 仅做了一次基线ALT和AST检查, 部分还是来自于自我调查; (2)ALT和AST检测方法未标准化, 20世纪90年代初自动生化分析仪未普及, 各实验室标准有很大差异; (3)研究对象未作区分, 如慢性HBV和丙型肝炎病毒(hepatitis C virus, HCV)携带者、慢性肝炎组和肝硬化组的肝病死亡相对危险有本质的差异等. 因此这一研究结果受到诸多质疑. 而且下调ALT正常值上限可能带来的以下后果时下亦难以被人们广泛接受: (a)可能高估肝脏实际存在的炎症程度, 造成临床生化检测指标和肝脏病理结果之间的更大脱节, 很多治疗对象因此被人为扩大, 如年轻非激活状态的HBV携带者和免疫耐受期乙型肝炎表面抗原(hepatitis B surface antigen, HBsAg)阳性者; (b)由此带来的过度治疗势必加速诱导HBV核苷类耐药株和多重耐药株的出现, 增加未来的治疗难度; (c)增加社会恐慌和患者心理负担, 并可能因之造成很大的社会压力; (d)给临床医师制定治疗决策带来新的困惑; (e)医保费用将因此激增[18], 患者和社会的经济负担将因此增加, 如每增加1000万例非活动状态的HBV携带者为CHB, 以每年每人1万元的治疗费用计算, 总体医疗费用会增加1000亿人民币, 这显然有悖于中国国情, 更有可能在很大程度上潜在的对国家医疗体制的改革造成不利影响和制约. 因此, 反对降低正常值亦非无据; (3)不同视角看待ALT的正常值得出不同结论: 原ALT正常值上限40 IU/L是在20世纪70年代由临床肝脏病医师、临床检验人员和卫生统计专家共同合作, 根据传统的手工赖氏法测定所得, 该数值为当时参考人群测定值的第99百分位值. 目前ALT均已改为自动生化分析仪检测. 为校正手工法与自动生化仪的差异, 复旦大学附属中山医院和上海市临检中心组织了32家医院检验科先后进行了9次实验[6], 每次实验前将校正品中含有的根据国际临床化学联合会(International Federation of Clinical Chemistry, IFCC)推荐方法要求测得的ALT值传递到1份新鲜人混合血清, 以此校准各参加医院检验科的ALT检测系统, 并在检测结果基本一致后分别进行了7598例和21970例年龄为17-78岁的表面健康人员ALT测定值调查. 结果表明, 校准前各参加医院检验科之间的ALT检测值变异系数(coefficient of variation, CV)为17.1%-20.5%. 校准后各医院之间检测值具有良好的一致性, CV降至1.42%-5.97%. 2次ALT参考范围调查中男性和女性的第95百分位值分别为58 IU/L和45 IU/L, 约相当于30或23赖氏法单位; 第97.5百分位分别为67 IU/L和55 IU/L, 约相当于35或29赖氏法单位, 第99百分位值分别为75 IU/L和67 IU/L, 约相当于39或35赖氏法单位. 据此, 建议参考范围上限值改为60-65 IU/L, 但这一"正常值"意见目前未被重视和推荐. 尽管如此, 从中也可以看到不同设计和研究方法会得出不同的结果.
当前对ALT正常值上限的新定义: 当前对健康参考人群的新定义为Parti标准[19], 即罹患肝病风险低的人群, HBsAg、抗-HCV、抗-人类免疫缺陷病毒(human immunodeficiency virus, HIV)及梅毒抗体均(-), 无代谢综合征等高危因素, BMI<25 kg/m2, 甘油三酯(triglyceride, TG), 总胆固醇(total cholesterol, TC)和空腹血糖正常, 不饮酒或乙醇摄入量<60 g/d、无合并用药. 这一严格的标准出台后为多项研究所采纳. 目前研究的总趋势是应该降低ALT正常值上限, 但是降低的幅度和范围尚无一致意见, 建议男性的正常值上限波动值为21-35 IU/L, 女性17-26 IU/L[17,19,20], 但研究样本在2054-13637例, 尚缺乏足够大的样本数据库. 有鉴于此, 目前ALT正常值上限的界定尚未能完全统一, 我国人群的ALT正常值范围仍需更多的临床研究, 需要更多的检验和临床医师共同探索, 在国家主管机构发布新的修订标准之前, 临床仍沿用目前标准, 以免引起混乱. 国外报道的上限参考范围也各有不同, 如Schumann等[21]认为第97.5百分位点男性为45 IU/L, 女性为34 IU/L, Bock等[22]对438180例受试者的调查结果提出ALT的上限值分别为69 IU/L(男)和39 IU/L(女), 以色列的调查则显示, 男性和女性ALT正常值上限分别为44.9 IU/L和31.8 IU/L. IFCC认为, 献血员筛查ALT决定水平可取正常值参考范围的2倍, 即男、女性分别为132 IU/L和86 IU/L.
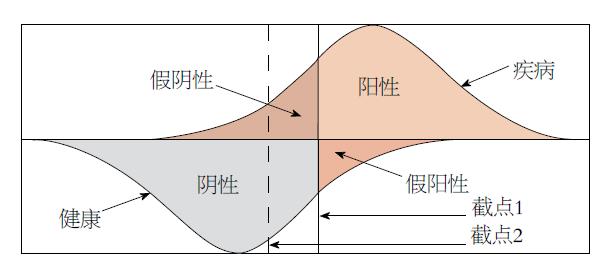
总之, 一个广被接受的ALT正常值的修定或改变, 如何选取恰如其分的截点, 最大限度地减少假阳性和假阴性的情况出现, 准确甄别出健康人和肝脏患者(下图), 需要未来通过更为科学严密的大数据程序设计、涵盖我国不同地区民族人群足够量大的样本、更加严谨的实验和精确的统计方法来实施完成. 在目前情况下不主张把ALT正常值上限下调, 更不希望这种下调倾向是出于专业和学术以外的其他利益背景(图1).
3.1.1 性别与年龄因素: 目前认为, 不同的年龄和性别对ALT水平影响明显. 为了解性别因素对ALT的影响, Mera等[23]对3618例未经选择的健康受试者检测ALT、AST、碱性磷酸酶(alkaline phosphatase, AKP)和总胆红素(total bilirubin, TBil)水平. 结果显示, ALT和AST浓度女性比男性显著为低, 在不同的年龄群体二者水平亦存在性别差异, AST/ALT比值女性高于男性. 建议通过ALT、AST结果评估患者的肝脏疾病状态时, 应考虑性别因素. Danielsson等[24]通过6269例健康人群进行测量, 探讨性别、年龄及生活方式对血清肝酶的影响, 发现年龄对男性ALT有显著影响(P<0.001), γ-谷氨酰转肽酶(gamma-glutamyltransferase, GGT)亦同时超标, 而女性则无. 可能与男性饮酒者较多有关. 高BMI与年龄之间也存在显著的交互作用(P<0.005). 相比之下, 女性表现出与BMI、酒精有显著的交互作用(GGT: P<0.05), 吸烟(GGT: P<0.001)和咖啡消费(GGT: P<0.001)亦然. 目前公认男性血清ALT水平普遍高于女性, 但随着年龄的增加, 血清ALT水平呈下降趋势, 而女性随着年龄的增加, 血清ALT水平呈波浪状变化. 健康人群中不同性别、相同年龄组血清ALT水平存在差异. 在相同条件下男性ALT增高大于女性, 可能与男性生活相对不规律, 如饮酒者相对较多有关[25]. 但一项来自伦敦[1]生活条件完全一致的家庭成年人, 已排除各种肝炎和饮酒、服用药物等情况的无偿献血者中的观察发现, 男性ALT水平依然高于女性, 且差异明显. 认为可能与两性之间的性激素水平差异有关, 并非饮酒这则单一因素. 李春芸等[26]按性别分组对ALT测定结果进行正态性检验发现, 两组测值呈偏态分布, 以Wilcoxon秩和检验, 男性ALT活性略高于女性, 组间差异具有统计学意义(P<0.05), 如男性的血清ALT活性参考上限(95%可信区间)确定为42 IU/L, 女性则为30 IU/L. 目前认为, 血浆ALT和AST水平主要受遗传因素的影响, 而GGT则受环境因素(如饮酒)的影响更为明显.
Ruhl等[27]曾经报道, ALT活性随年龄增长而降低. Elinav等[28]通过对以色列207例无肝脏疾病的成人受试者, 按照不同年龄分组, 进一步横向评价年龄和ALT活性之间的关系发现, ALT活性随年龄增长呈现线性下降. 40岁之前ALT水平为19 IU/L±13 IU/L, 40-55岁为25 IU/L±19 IU/L, 56-72岁为22 IU/L±10 IU/L, 73-83岁为17 IU/L±9 IU/L, 83-100岁为13 IU/L±5 IU/L. 形成一个倒U字曲线, 正常ALT水平在40-55岁达高峰, 此后开始递减. 同时发现, 性别也与ALT水平相关, 男性平均水平为22 IU/L±15 IU/L, 女性为17 IU/L±11 IU/L. 对年龄、性别、肾小球滤过率(glomerular filtration rate, GFR)、BMI等因素纳入多元回归分析, 显示年龄、性别与ALT活性水平相关, 而AST水平无此关联. 认为评价ALT与肝脏疾病关系时应考虑此种年龄关系. 但对此亦有不同意见, 如Helmersson-Karlqvist等[29]观察了一组531例80岁无CVD的男女性老年人群, 其中男性265例, 女性266例. 包括ALT、AST、TBil、GGT、AKP、乳酸脱氢酶(lactic dehydrogenase, LDH)、白蛋白、淀粉酶、血脂、电解质、肌酐(creatinine, Cr)、GFR、C-反应蛋白、胱抑素-C、血红蛋白、血小板、白细胞计数等34项常用的实验室指标, 结果发现, 老年组除Cr和尿素参考上限明显增加, 铁和白蛋白的下限降低外, ALT等其他指标与年龄20-50岁组具有很好的一致性.
年龄对ALT水平的影响不仅是数量的差别, 重要的还在于对许多疾病病因和死亡率的预测价值[1]. 儿童的ALT水平普遍低于成年人, Lai等[30]甚至认为儿童的ALT正常值可界定至8 IU/L. Kliethermes等[31]建议对儿童ALT上限建议为男28 IU/L、女21 IU/L, 可很好甄别儿童肥胖这一NAFLD对儿童健康的影响因素. 囿于不断增长的年龄和身体对测值的影响, 定义儿童ALT测值的正常值参考区间(reference intervals, RIS)颇为困难. 韩国Cho等[32]于2010-2012年对2474例2-16岁儿童观察ALT等13项血清生化指标, 均采用日立7600分析仪测量. 结果发现除钙离子和白蛋白外, 大多分析指标均需通过性别、年龄来划分RIS. 其中AKP、Cr和TBil区间受年龄因素影响最大, ALT在性别、年龄方面均有影响, 而血清总蛋白、无机磷、TC、尿素氮、尿酸、葡萄糖等指标主要受性别影响. 此外, 不同的民族和家庭生活行为差异也可影响ALT的变化. 如Elizondo-Montemayor等[33]报告, 一组在墨西哥儿童中开展的ALT和代谢综合征的关系研究发现, 西班牙裔儿童ALT水平较其他种族儿童更容易受到NAFLD的影响使测值偏高.
3.1.2 妊娠与遗传因素: 妊娠作为女性重要而特殊的生理历程, ALT的检测与评价不可或缺. 由于妊娠期间胎盘能分泌某些酶类, 如ALT、AKP、LDH等, 使之在血清中活性增高, 尤以妊娠后期更为明显[8,34], 多数呈短期波动性轻微异常, 30%以上可自然恢复于妊娠过程中或生育之后, 但不同研究者报道的结果有较大差异. 据一项观察155例排除常见感染与系统疾病等情况的女性妊娠期ALT水平升高者[1], 并与221例ALT水平正常的对照组比较, 分析其原因和妊娠结局. 结果发现两组在基线特征上无差异, 29%的ALT异常发生在妊娠10-20 wk, 39.4%发生在30-40 wk, 常见的原因为妊娠剧吐和先兆子痫. 多为1 ULN之内的轻度升高. Bacq等[35]进一步研究认为, 有症状的妊娠呕吐患者血清ALT水平可达103.5 IU/L, 但先兆子痫者仅为115 IU/L, 溶血性血小板减少症患者为149 IU/L. 三者于产后3 d内ALT可迅速下降, 幅度超过50%, 表明此种升高为良性经过, 对妊娠过程及生育无重大影响. Wong等[36]甚至认为ALT水平的这种无症状升高在通常妊娠期间尤其妊娠早、中期十分常见, 其一项103例孕妇和103例健康对照女性的前瞻性观察, 于健康孕妇分孕初、孕中和孕末3个月采血送检肝功能, 结果发现, 孕妇和非孕妇AST、TBA水平无差异. 孕中期ALT活性略高于对照组, 但均未超出正常范围. DM患者妊娠期ALT水平不受血糖干扰[37].
另外, 血清ALT和AST水平还可能受遗传因素的影响, 据Whitfield等[38]对206例成人双胞胎的调查发现, 在雌雄异卵双生的双胞胎中, 男性ALT水平略高于女性, 认为可能与男性中相对于女性, 酒精摄入人群普遍较多饮酒量有一个显著梯度差异有关, 但两性GGT水平无统计学差异却又高于同龄同性别的非双胞胎者. 已知人类对酒精的嗜好是高度遗传的, 这一性别差异似乎可作为遗传对ALT活性影响的佐证. Bathum等[39]在丹麦双胞胎中进行的一项调查显示, 2749例年龄在73-102岁的老年人群中, 经丹麦双胞胎登记确认中心确定. 290对同性双胞胎共580例血液样本被收集, 在6 mo内分析ALT、GGT、TBil、白蛋白等指标. 记录饮酒量和BMI. 建立结构方程分析遗传率, 发现男、女性别的遗传力相等, 在控制酒精消费和BMI后对ALT测值无影响.
3.1.3 昼夜节律: 昼夜节律对ALT检测水平的影响亦较多被临床关注, 一般认为其测值在24 h之内可呈现10%-30%左右的生理波动, 下午高于清晨[40], 但研究数据较少. 据Córdoba等[41]的一项在慢性肝病ALT活动的研究, 包括12例有各种病因的肝硬化患者接受了24 h的动态观察, 每小时的血液抽样发现白天ALT等肝酶活性测值高于晚上, 下午高于上午, ALT的最低值(谷值)出现在凌晨4点, 而峰值为下午4点. Ruhl等[42]于1999-2008年对9361例青少年和22970例成年参加美国国家健康和营养调查者进行研究, 其中4474例青少年、11235例成年被随机分配到早晨抽血, 另4887例青少年和11735例成人下午/晚上抽血. 对ALT测值进行分析, 青年男女和成年男女阈值分别定义为≤31 IU/L、≤24 IU/L、≤43 IU/L和≤30 IU/L. 结果无肝病者的4组ALT测值相似, 在女性平均ALT值在统计学中下午组略高于上午组(19.6 IU/L vs 19.1 IU/L). 在患有慢性肝炎的成年女性亚组中, 下午ALT测值有较高的异常, 明显高于上午的测值. 调整肝损伤风险因素后, 早、晚两个不同时间段检测的平均ALT测值几乎无差异. 认为在美国人群中, ALT活动的昼夜变化无临床意义. 为探讨昼夜轮班工作对ALT的影响, Lin等[43]通过分析1196名男性半导体制造公司工人持续昼夜轮班工作超过5年者的肝功能情况, 分为持续白班、白、夜班交替和持续夜班3组. 通过多变量逻辑回归分析, 并控制年龄、职业因素、教育水平、生活方式因素、代谢综合征、病毒感染和脂肪肝等混杂变量后, 与持续白天工作比较, 5年期间54%的昼夜轮班工作者ALT水平升高, 明显多于持续白班和夜班者, 持续夜班者ALT变化水平亦明显高于持续白班者. Nakamura等[44]亦有类似研究结论.
3.2.1 饮食与营养因素: 饮食作为人类生存与生活的主体要件之一, 三餐不可一日或缺. 中国人的早餐食谱远较西方复杂, 且因南、北地域和不同民族与生活习俗的不同差异颇大. 早餐种类及所含的碳水化合物、蛋白质、脂肪、矿物质等亦因之而有很大不同. 临床发现, 不同食物或食谱对人体诸多生化指标的检验测有重要影响, 这种波动还和餐后采血时间间隔而异. 曾有研究发现, 标准餐后, 血中三酰甘油将上升50%, ALT活力增加20%, TBil、无机磷、血糖水平增加15%, ALT及血钾水平上升15%, 总蛋白、白蛋白、尿素、尿酸等增加5%. 因此, 医学教科书规定检测肝、肾功能, 血糖, 血脂等指标均要求采集空腹血(采血前禁食12 h). 但在当今人类生活日趋追求时间成本和个性与多元化的时代, 一味强求空腹采血检测ALT等简单酶学指标, 许多地处偏远山区和患有DM等特殊状况的人群势必延长候诊时间, 为疾病诊疗时限带来极大不便. 鉴于国人的晨间早餐相对于中、晚餐内容和结构均较为简单, 程书权等[45]曾通过以模拟北方人早餐模式的标准餐与自由进食者进行分组比较, 发现进餐前后仅对血糖、白蛋白、血脂、电解质等指标有较大影响, 对ALT波及甚小或几无影响. 因此建议对ALT、AST等酶学指标检测可不受是否进食的限制随机抽血化验. 当然, 若禁食时间过长或处于过度饥饿状态, 体内趋于分解代谢的时间过久, 势必亦引起蛋白、脂肪、糖、尿素等测定结果偏低; 而进食过多或暴饮暴食后采血亦会对检测结果的准确性带来弊端. 大量服用补品、营养品亦会加重肝脏负担, 使ALT测值增高, 需化验者宜于停用2 wk后采血. 为了解肝酶标志物和饮食习惯的内在关系, Iwata等[46]报告了1809例19-59岁男性参与的研究. 结果显示, ALT、AST、GGT三种酶学水平除与年龄和BMI呈正相关外, 午餐饮酒、过多进食方便面(≥3次/wk), 均会导致ALT升高. 由于方便面是饱和脂肪酸平均含量较高的谷物食品, 改善这种习惯后ALT水平可恢复常态. 习惯性乙醇摄入与肝细胞损伤显著相关, 但每日饮酒量与ALT的升高阈值因人而异.
另外, 进食速度对ALT测值的影响近来亦受到关注. 据日本Mochizuki等[47]的一项旨在探讨ALT水平和生活方式的相关性研究, 包括900例40-64岁健康女性的横断面数据, 通过自我报告的进食速度与肝损伤之间的关联分析表明, 进食速度很快者较细嚼慢咽者ALT水平为高. 调整年龄、饮酒、能量摄入、吸烟和体育活动等因素后依然相关. 认为ALT水平与吃饭速度过快有内在关联, 这可能与能量摄入过多、过快使肝脏负担加重有关[48], 中年以上健康女性进食过快者更宜注意. 暴饮暴食和神经性贪食症及神经性厌食症等进食行为异常者亦会影响ALT的水平, 导致酶活性的异常升高. Rosen等[49]对181例严重神经性厌食症患者的肝功能评估, 多数表现为AST、ALT的轻度升高, 但BMI较低(11.9 kg/m2±1.8 kg/m2), 较正常的体质量(56.5%±7.7%)比例低者和伴有较低的前白蛋白水平者, 可呈现较显著的肝酶升高. 此类患者易于发生低血糖、低血磷等, 临床宜加注意[50].
当今, 营养过度或肥胖正在逐渐成为新的社会问题, 尤其处于亚临床状态的潜在代谢综合征的广泛存在, 尚未引起人们的注意. 嗜食肥甘厚腻而运动过少, 大量脂肪成分蓄积体内尤其肝脏, 引起高脂血症和脂肪肝甚至出现代谢综合征及NAFLD, 势必导致ALT等血清生化指标的测值升高[51]. 据Tynjälä等[52]在伊朗通过横断面调查, 对1172例6-18岁的正常体重和超重青少年学生进行ALT水平研究, 评估ALT水平与代谢疾病危险因素的关系, 按照男30 IU/L、女19 IU/L以下为正常(其中56.2%为女性). 结果显示, 超重或肥胖学生ALT明显升高. 进一步的逻辑回归分析表明, ALT与TG、TC和舒张压水平有线性关系, 年龄和BMI调整后, 这些影响仍然存在. 认为腰围和BMI增加提示代谢综合征的存在, 此类儿童ALT水平往往异于平常. Lee等[53]报道, 韩国1105例经活检证实肝细胞功能正常、准备做移植肝捐赠的标准健康者, 男643例, 女462例, 年龄25-30岁, 平均BMI男性22.3 kg/m2, 女性21.4 kg/m2. 做ALT健康上限估算, 得出的阈值为男35 IU/L, 女26 IU/L. 分析测值发现年龄和BMI均与男、女两性的ALT水平独立相关, 男性还和血清TC浓度、女性和血糖水平相关. 选择其中的665例调整至BMI<23 kg/m2, 健康的ALT值分别为33 IU/L和25 IU/L; 若男性BMI为16.7 kg/m2则ALT的健康水平为19.5 IU/L, 女性BMI为12.8 kg/m2则ALT为14.9 IU/L. 认为肝活检证实的健康ALT上限明显低于以前公认的阈值, 随着年龄、BMI、血脂、血糖等代谢参数的增加显著影响ALT水平的相应递增. Chen等[54]2012-2013年在中国东北农村进行的一项多中心横断面研究, 共纳入11573名健康成人数据, 上限ALT和AST水平均定义为<40 IU/L. 结果共有7.4%和3.5%的参与者ALT和AST水平升高, 其中男性37.3%, 女性45.8%, 调整潜在的混杂因素后, ALT水平升高主要与代谢综合征相关, 尤其无症状的亚临床型患者, 除ALT等酶学指标升高外常无自觉主诉. 与肥胖的日益流行类似, NAFLD近年在健康人群的全球发病率高达10%-24%, 已成为迄今做健康体检者原因不明的轻度ALT升高的常见病因之一[1,54], 由于多数患者无明显不适表现, 仅仅为酶活性的改变而在常规健康检查时被偶然确诊. 虽然ALT升高的程度与NAFLD的组织学严重程度无明显相关性, 但NAFLD导致的肥胖、DM和CVD等通常与过早死亡有关. 据Unalp-Arida等[55]近年对美国14527例无病毒性肝炎、酒精性肝病及其他明确肝病的貌似健康成年人23年相关的死亡数据进行分析, 观察肝酶活性及肝脏超声, 判定是否有脂肪肝. 结果显示, 患有NAFLD者全因累积死亡率为36.2%, 其中CVD 16.3%、恶性肿瘤10.8%、DM 5.4%、肝病1.1%. 认为前三者伴NAFLD和ALT升高者会增加相关死亡率. 有学者甚至将ALT、AST及AST/ALT比值的常规健康检查作为预测CVD死亡标记的简单而重要的指标之一[13,56]. 这些研究结果表明, 升高的AST/ALT比值可能更多地体现系统紊乱不单纯局限于肝损伤[57], 亦与冠状动脉钙化的发生风险相关[58]. Kotronen等[59]还发现, 与同样肥胖的非DM患者相比, 无DM的脂肪肝患者和脂肪肝合并DM患者ALT均升高. 目前ALT和AST水平检测已被推荐为发现与筛查代谢综合征的早期生化学标志物[60], 甚至超重或轻微-中度体质量增加即引起ALT的测值升高[61,62]. 据Robinson等[63]报告, 体质量因素是影响血清ALT等酶学水平的重要因素之一, 在一项约21000例男性参加的常规健康检查研究中, 排除相关的行为因素如饮酒、吸烟、运动水平和肥胖后, BMI超标者ALT、AST、GGT三种酶的平均水平均显着增加, 尤肥胖者ALT的影响特别明显, BMI≥31 kg/m2者ALT值较BMI≤25 kg/m2者高8倍以上, 即使排除共同存在的酒精混杂等因素的影响之后差异依然明显.
值得注意的是, 相对于营养过剩, 营养不良者亦增加ALT等肝酶升高几率. Singla等[64]通过175例肺结核患者前瞻性评估抗结核治疗引起肝毒性的风险因素发现, 基线营养状态不良, 尤其血清白蛋白水平<35 g/L者, 易于罹发肝功能异常, 导致ALT水平的升高, 可成为独立的肝毒性的危险因素存在. 认为营养不良是抗痨过程中发生ALT升高的独立预测指标, 临床可据此筛选肝毒性的高危人群并提前加以干预. Wright等[65]还发现, 肌营养不良症患者ALT水平可出现升高, 在儿童的健康体检中, 异常ALT、AST的偶然发现, 可能是发现肌肉疾病的一个早期诊断线索.
某些食物或果蔬如紫甘薯、蓝莓、黑莓、紫甘蓝、紫色茄子、紫苏、黑(红)米、黑枸杞、黑加仑、桑葚、蓝靛果、红枸杞、蔓越莓、红树莓、紫皮葡萄、紫色火龙果、血橙、红球甘蓝、樱桃、红橙、草莓、山楂皮、牵牛花等深色果蔬或食品添加剂富含花青素, 具有抗氧化消除体内有害自由基的功效, 并能改善视力、增强免疫力、预防肿瘤及辐射等, 广受人们青睐. 如蓝莓等紫色果蔬在欧洲被誉为"口服的皮肤化妆品", 不但能防止皮肤皱纹的提早生成, 更能补充营养. 有研究[66]发现, 喜好或长期大量进食此类含丰富花青素的食品者, 血清ALT水平低于常人, 可能与肝脏的抗氧化与解毒功能增强有关, 体检时宜注意了解此类饮食习惯, 以免引起不必要的恐慌. 另外, Carrieri等[67]使用纵向数据通过HIV-HCV双重感染者队列研究发现, 咖啡和巧克力等富含多酚的食物摄入对肝酶水平亦有一定影响. 990例患者饮用咖啡每天≥3杯或每日摄入巧克力, 40%的患者肝酶水平降低, ALT等肝功能异常的出现几率较无上述嗜好者明显为低. 认为咖啡和巧克力的适当摄入或补充具有护肝作用, 尤其对肝损伤患者有益. 咖啡消费对健康人群ALT等肝酶的裨益亦为日本研究者[68]证实.
中、西方许多人均喜好应用所谓"膳食补充剂", 即在日常膳食如饮品、粥、蔬菜、肉类中加入具有一定药物性能的中草药成分, 药膳、药酒、补酒、补品等亦在此列. 近年发现, 长期应用此类添加剂制作的饮食, 是许多原因不明性ALT升高甚至肝损害的重要诱因[69]. 囿于中草药植物的广泛性和临床对不同组方与炮制条件、采挖季节、入药部位、熬制时间与配比的未知性存在的巨大差异, 目前尚乏妥善技术加以甄别. 西方对此已经有专门的诊断和管理机构及相应指南, 我国目前尚未引起足够重视.
3.2.2 饮酒对检测结果的影响: 酒精摄入后由门静脉进入肝脏, 90%经过肝脏内的葡萄糖6-磷酸酶脱氢、脱羟等一系列酶促反应, 变成水、CO2和热量供人体利用[1]. 此过程短期少量时仅一过性加重肝脏的代谢负担, 长期、大量的酒精摄入势必使肝细胞的正常酶系统受到干扰破坏, 甚至直接损害肝细胞, 引起炎症和变性坏死, 从而导致体内多种指标产生不同程度的影响. 饮酒后2-4 h, 由于肝内糖异生受抑制, 致血糖下降, 长期饮酒者由于酒精对肝脏造成的长期不良刺激和毒理作用, 血中ALT、AST将升高[1]. Joanna等[24]通过6269例年龄25-74岁的健康个体进行横断面调查, 探讨影响性别、年龄和生活方式因素(酒精、超重、咖啡和吸烟)对血清ALT的影响发现, 酗酒在普通人群的出现频率日趋增多, 半数以上体检者超重, 对健康造成的不良影响隐袭而持续, 正在成为新的社会问题. 其ALT和GGT水平与饮酒(P<0.001)和BMI(P<0.001)密切相关. 男性、中年以上、吸烟、BMI偏高、长期饮酒, 尤其50 g/d以上的高度白酒者ALT异常率明显增多, 而女性仅与BMI、吸烟、和咖啡消费相关. 脂肪在肝组织中的积累在早期可能仅仅为血清肝酶学指标的轻度升高, 但由于饮酒或多余的体质量诱发的一系列CVD和脑血管疾病的严重事件已引起临床的广泛注意[70]. Liu等[1]认为, 酒精摄入尤其过量摄入为普通健康人群中ALT升高的重要原因之一. 在意大利接受健康体检的人群中, 45.6%的ALT改变是因为酒精摄入过多(≥50 g/d), 而在美国国家人口调查中, 过量饮酒(>1次/d)亦为导致ALT升高的重要原因, 频度仅次于HCV感染. 其引起ALT活性改变与饮酒持续的时间和每次的饮用数量有一定相关性, 但存在着种族差异. 英国一项基于来自世界各地不同地区的酒精滥用者的研究中, 来自南亚的成年人更容易受到与酒精有关的肝脏损害, ALT水平高于欧洲的酒精滥用群体. 短期和少量酒精摄入并不立即引起显著的ALT升高. 偶尔的少量饮酒对ALT活性的影响有别于酗酒, 尤其在正常体重人群中, 由于其对改善胰岛素敏感性的潜在影响, 适量饮酒不会导致显著的ALT升高. Stranges等[71]的研究亦发现, 每日饮酒者ALT、GGT等酶学指标改变超过间断饮酒者, 长期戒酒者、新近戒酒者的酶平均水平均明显低于继续饮酒者. 女性在周末饮酒GGT等酶水平亦明显升高. 空腹饮酒没有食物缓冲者较进食后饮用同等数量的酒精饮料者升高明显, 饮用低度酒较高度者明显, 同等条件下女性较男性、中国人较白种人饮酒后ALT波动为小, 可能与国人大多在饮酒过程中有食物或菜肴的佐餐有关. 为探讨饮酒后肝功能的动态变化情况, 评价酒精对人体的损害程度, Yue等[72]曾经对15例健康志愿者进行研究, 统一一次性摄入80 g酒精饮料后, 间隔0.5 h分别采集血液样本, 检测肝酶水平. 发现饮酒后受试者很快出现各种症状, 血酒精浓度在酒后1 h达高峰, 24 h内正常化. 当静脉酒精浓度从0 g/L提高到1.2 g/L, GGT、AKP水平逐渐升高, 酒精浓度达到0.4 g/L时, ALT、AST开始升高, 但ALT升高水平和速度比AST明显为快, 24 h后随着血酒精浓度的恢复而趋于正常. 酒的饮用种类亦对ALT水平有一定影响, 据Pinzani等[73]通过对一组健康百岁老人的红酒摄入对肝功能影响的观察发现, 长期温和(<500 mL/d)饮用红酒者, ALT和AST相对于少量饮酒和不饮酒者仅轻度升高(高6.2-8.2 IU/L), 但这种差异无统计学意义. TBil、GGT、AKP、胆碱酯酶(cholinesterase, ChE)水平均在正常范围内, 认为饮用红酒对百岁老人血清肝酶的水平没有负面影响. 由于长期饮酒者潜在的酒精性肝病引起肝线粒体损伤和吡哆醇缺乏, AST水平升高幅度多于ALT, 计算血清AST/ALT比值常>2, GGT和AKP水平亦明显升高, 临床依此三点来区别非酒精性肝病和病毒性肝炎[74].
3.2.3 吸烟对检测结果的影响: 业已发现, 烟草中含有的多种有毒物质可损害肝脏功能, 抑制肝细胞再生和修复, 从而会加速肝纤维化、肝硬化乃至肝癌的发生, 早期可能仅表现为转氨酶等肝功能测值的轻微升高[75]. 研究[75,76]发现, 吸烟超过20支/d, 甚至每年超过20包, 尼古丁的酶的诱导作用即能够引起ALT水平的上升. 据Breitling等[77]在德国对22014名建筑工人做常规职业健康检查研究发现, 长期吸烟者ALT、AST、GGT三个肝酶标记均升高, 并且与饮酒之间呈现有害的相互作用. Park等[78]统计2007-2012年韩国27534例年龄≥20岁参加全国健康与营养调查的不同性别人群, 发现在吸烟者中ALT水平普遍高于不吸烟者. Zubairy等[79]甚至发现, 在形成吸烟习惯的ALT、AST升高烟民中, 口腔癌患病率亦明显增高. 吸烟者多数饮酒[75,76], 据一项来自伦敦的共46775人参加的健康筛查研究[76]显示, 吸烟与酒精消费呈显著正相关. 同时吸烟和饮酒者ALT、AST、GGT活性高于单独吸烟或饮酒者, 尤其吸烟超过20支/d, 饮酒酒精量>25 g/d者. 认为酒精和烟草对ALT等肝酶活性有联合作用, 在评估健康体检者个体的肝酶活性的临床价值时, 应考虑吸烟和饮酒习惯. 日本Mochizuki等[48]还发现, 能量摄入过多和吸烟者的ALT升高有关, 吸烟与饮酒或BMI的交互作用在ALT、GGT等血清酶学改变方面的作用正日益受到更多关注[78].
3.2.4 运动对检测结果的影响: 已经发现, 体力运动、过量活动和疲劳时可能短暂升高ALT、AST. 运动后一方面体内中间代谢产物增多, 肝脏解毒等负担加剧, 衰老肝细胞破坏与更新加快, ALT释放入血增多; 另一方面出汗增多、血液浓缩, 血浆总蛋白、TC、高密度脂蛋白胆固醇(high density lipoprotein cholesterol, HDL-C)、ALT、AST、红细胞数、血红蛋白等测值相对增加, 白细胞、中性粒细胞数量增高, 淋巴细胞、嗜酸性粒细胞减少[80]. 但ALT等酶学指标的改变幅度与运动量的关联研究尚少. 据Koury等[81]选取的87例男性、年龄20岁±2岁的陆军学员, 了解有氧条件对预防短期军事训练引起的肝脏和肌肉损伤的效果研究, 进行30公里行军训练, 比较训练开始前、12 h和48 h后血清ALT、AST、肌酸磷酸激酶(creatine phosphokinase, CK)三种酶水平的变化. 结果所有酶的平均血清浓度在行军后12、48 h的升高幅度分别为59%、336%、675%和256%、418%、878%. 且训练时的最大耗氧量与三种酶学的血清水平呈负相关. 表明强烈的军事训练可导致肝脏和肌肉损伤, 有氧调理可作为这些损伤的保护因素. 但亦有不同看法, 如Villegas等[82]通过3978例中国城市男性40-74岁人群的上海男性健康人群基础队列研究发现, 受试者中11.1%血清ALT升高, BMI和腰臀比(waist-to-hip ratio, WHR)与ALT和AST升高呈正相关, 与代谢综合征的患病率和Ⅱ型DM密切相关. 但发现体力活动反可降低ALT和AST水平, 可能因此组人群体力活动幅度较小, 过程较缓有关. 极大的体力消耗诱发ALT的短时可逆升高亦为泰国的研究所证实, 在一项针对泰国拳手的研究中, 20名25岁泰国青少年拳击运动员, 比赛后ALT水平均高出基线值. 此外观察到9名参加长途马拉松比赛运动员ALT水平的升高, 在跑步的第4天与基线值相比ALT测值增加了4倍. 一般将物理运动后的ALT升高归因于肌肉损伤, 但相反的资料也证实适度的体力活动有助ALT水平的正常化. 另外, Yoo等[83]通过韩国国家健康和营养检查数据进行研究, 共有13431名受试者参与, 发现肌肉减少症者的ALT升高率显著高于正常ALT组(男性: 26.5%:16.9%; 女性: 38.3%:22.1%). 男性者在调整潜在的混杂因素包括年龄、BMI、空腹血糖水平、饮食和锻炼习惯后差异依然明显. 认为肌肉减少症是男性转氨酶升高的一个危险因素. 但亦有不同看法[27].
3.2.5 职业: 为了解ALT在不同专业领域运动员之间的水平差异, Banfi等[84]比较了从事7个不同体育学科的116名男性职业运动员的ALT水平, 包括游泳、公路自行车、公路长跑的铁人三项运动员和橄榄球、足球、帆船、自行车、篮球、高山滑雪等运动者, 于训练开始前和比赛期间抽血送检. 100例普通健康的不爱运动的相似年龄组男性作为对照. 结果显示, 所有运动员的AST、ALT的平均浓度为24.4 IU/L±10.5 IU/L和23.6 IU/L±6.5 IU/L. 与久坐不动者无统计学差异. 但BMI和ALT之间存在正相关, BMI和AST之间有较弱的负相关. 另外, 从事不同职业的工人ALT水平亦存在差异, 如Arndt等[85]发现, 建筑工人肝酶活性较其他工种者RIS为高. 国内研究者[86]亦注意到, 不同职业之间ALT的正常值水平差异有统计学意义, 其中干部、军人、医务人员的ALT、AST水平变化差异度相对较低, 工人、学生、专业技术人员则相对较高. Rojas-García等[87]调查发现, 农药零售商平均ALT、GGT水平高与其他职业的从业人员包括药品零售商. 可能与长期接触或呼吸气体中残余农药对身体积淀的慢性伤害有关.
3.2.6 其他因素: (1)季节因素: Miyake等[88]为确定季节性变化对肝功能检测结果的影响, 自门诊患者的数据库中提取7年资料进行统计, 共有1270000例年龄20-79岁患者的测试结果纳入研究, 观察不同季节ALT、AST、GGT、AKP、ChE和TBil变化情况. 时间序列数据分为趋势和季节性组件, 利用余弦函数模型计算每月对每个变量的变化和周期性和波动幅度. 结果发现冬季血清生化测值呈上升趋势, 在男性和女性中, AST、ALT的增幅均分别达6%, AKP、ChE、GGT在两性中冬季亦高于夏季, 而TBil测值在夏天男性有3.6%、女性有5.0%的升高几率, 总蛋白、白蛋白含量无显著变化. 建议对这些有季节性变化的指标应建立相应RIS, 尤其ALT、AST两项酶学指标; (2)生化参数之间的相互干扰: Zelber-Sagi等[89]观察到血清尿酸水平与ALT升高独立相关, 判读时宜加注意; (3)地域因素: 为定义ALT的RIS, Ceriotti等[90]观察在意大利和在中国三个中心的新鲜血液标本, 一个中心还测量了来自北欧国家的国际项目和从土耳其中心的冷冻标本. 共765例(女411例, 男354例)18-85岁健康者参与研究, 结果ALT的地区间差异无统计学意义, 但性别差异显著. AST结果四个地区(米兰、北京、土耳其和北欧)有微小差异, 但无临床价值. 因此认为制定全球适用的共同RIS似乎是可能的; (4)地方性: Shashi等[91]观察到印度高海拔的旁遮普地区健康人群血清ALT水平普遍增高, 最后确定为当地居民饮用水中的氟化物的浓度过高(达5.9-24.5 mg/L), 与长期氟暴露导致慢性氟中毒有关; (5)罹患处于亚健康状态的隐性疾病: Doi等[92]通过对日本1804例40-79岁非DM患者的健康人群进行9年前瞻性随访显示, 随访期间135例受试者发生DM. 在两性中, 年龄增长与GGT、ALT水平升高被确定为患DM的风险因素. 认为血清GGT、ALT浓度在中年以上的普通健康人群中, 是DM的较强预测因子, 可独立于已知的危险因素如空腹胰岛素、BMI、WHR、超敏C反应蛋白和饮酒等而存在. Karim等[93]亦发现, 隐性地中海贫血者, ALT测值可明显升高, 同时化验血常规可发现贫血状况, 认为体检ALT利于隐性地中海贫血的早期确诊; (6) 原因不明性单项ALT升高: Björnsson等[94]在160000例成年健康居民的一项前瞻性研究发现, 6%的病例ALT水平呈现病因不明性升高, 均为一过性良性轻中度上升, 观察12 mo未发现肝炎或其他病变; (7)其他: 亦有个别研究认为海拔、气候等[95]因素对ALT测值的影响, 值得临床进一步关注.
药物对肝功能的影响临床报道较多, 非疾病状态下日常生活无意或不慎接触某些药物引起的ALT改变近年亦日趋受到临床关注. 如Harrill等[96]发现肝素可引起ALT和AST的良性升高, 但临床无显著肝损伤的表现, 其机制未明. 通过对408例健康男性随机接受皮下注射普通肝素150 IU/kg, 每12 h 1次观察4-5 d, >90%的受试者观察到血清ALT或AST无症状性升高. 长期乙酰氨基酚的摄入者, ALT水平的升高为亚临床肝病出现的最早期改变, 因此国外已将ALT等肝酶指标上升作为止痛剂或嗜好品性肝病的重要风险评估指标[97]. 接受美沙酮者[98]和免疫性血小板减少性紫癜治疗药埃曲波帕胺亦受到警示[99]. 尤为值得注意的是中草药、中成药及其辅助添加剂对肝功能测值的影响, 已经渗透到人们日常生活的方方面面[100,101]. 因此, 2016年新版美国胃肠病学院指南强调, 对原因不明ALT异常者应注意查找处方和非处方药品的应用历史, 尤其一些华人居住地区者受传统生活习惯的影响, 会常规应用中草药或一些未知的草本植物加工、发酵、熏制肉类, 豆制品等等食物而不自知, 需要熟悉与依据不同种族、民族的习俗仔细问诊[2].
目前国内外通用的真空采血方法具有缩短采血时间、提高检验效率、减少患者痛苦和使护士在操作过程中减少与血样的过多接触, 保证采血的安全、避免交叉感染等优点[102]. 但是, 由于护士等采血人员并非直接参与检验设备的操作者, 对检验要求把控并无了解, 因此有时采集的血液标本质量不符合检验要求, 送检后势必会影响检验结果的准确性. 如新鲜标本经过短暂运送或短期存放后, ALT活性可能会有部分丧失[27]; Kocijancic等[103]对真空采血管和血液化学分析的收集管评估后亦发现存在影响ALT测值稳定性的因素; 标本溶血对检验结果的影响已人所共知[104-106]; 如果体检者有高血红蛋白或异种血红蛋白存在(如血红蛋白高于3.4 g/L), 即可使ALT、AST、LDH等指标测值被错误高估[107]. 甚至于静脉采血时患者由于恐惧或痛苦而紧握拳头, 由于肌肉收缩或溶血, 可引起ALT、CK等测值的2.0%-2.3%增加, 而血红蛋白可能有28.2%的显著增加, 故静脉穿刺成功后采集血样时切记叮嘱患者放松拳头, 手掌保持于舒展状态[108]. 另外需要注意的是, 卧位采血与坐、立位采血的结果亦有区别, 过久坐、立后, 静脉渗透压增加, 一部分水分从心血管系统转移到间质组织之中, 血液相对浓缩, ALT测值可因此偏高.
目前我国采用的是IFCC 1985-06通过并向全球推荐的ALT测定方法. 测定方法的选择和评价是另一类极其复杂的问题, 测值亦受诸多环节因素的影响. 其中起主要作用的还是仪器和试剂性能, 应用自动分析仪最好选用原装配套试剂. 虽然各试剂公司生产的ALT试剂盒者均列出各自详尽的操作说明与正常值参考范围, 但每个实验都应自行测定所用仪器和试验及面对地区人群的个性化参考范围. 因检测操作方法的不规范, 在动物和人类的血清实验中有人证实ALT的活性存在10%-20%的平均差异[109]. 为确定生化测值在不同国家和地区间的区域差异, 以确定国际通用的参考区间, IFCC曾在东京、首尔、吉隆坡、香港、台北和上海六地启动了一项亚洲项目[110], 对415名相同性别、年龄比例的健康人群血清样本, 统一分析设备试剂, 测量ALT、AST、GGT、血脂等7种化学分析物. 结果显示, 上海、台北、汉城的ALT和GGT测值较其他三地为高, 上海GGT和TG较高、东京HDL-C较其他五地为高. 认为检验的环境因素似对ALT等生化测量分析物有较大影响. Green等[111]为观察不同检验单位ALT测试对检验结果的影响, 将同一血清样本分两批发送到两个独立的临床实验室进行检验, 每个实验室使用不同的仪器和试剂, 统一采用标准化的参考范围后比对所得结果, ALT在A实验室测得的平均值为33.6 IU/L, B实验室为47.92 IU/ L, 按照性别区分则男性在A实验室为63 IU/L, 女性54 IU/L, 两性在B实验室均为31 IU/L. 认为不同检验条件对ALT测值有较大影响.
肝细胞中富含的ALT和AST等酶系统, 每于受到生物性或非生物性因素影响而出现炎症反应时, 可很快引起血清ALT和AST测值的显著升高, 因此其检测一直被认为是反映肝细胞损害的标准试验. 由于ALT变化灵敏, 仅有极少数肝细胞受到波及即可引起血清中的明显升高, 但其特异性较差, 常常ALT水平早已明显异常, 临床却迟迟难以做出病因诊断. 此时恰当、中肯地评价ALT改变包含的确切临床意义变得十分重要. 除众所周知的教科书与文献报道的引发ALT等肝功能指标异常的常见病理情况外, 临床还有诸多非病理因素影响着ALT测值的判读. 其中许多因素是人们较为生疏或远未引起重视的, 其中一些误区平时稍加戒备即可完全避免. 本文回顾的多种非病理因素对ALT测值影响的观察研究, 希冀对临床工作者判别解读常见肝功能指标时有所裨益与汲取. 值得注意的是, ALT在机体细胞内的活动是一个复杂、迅疾而持续的动态过程, 测值所得的数据仅仅反映静脉采血时的某一瞬时状况, 非能涵盖人体病理生理的全貌. 其昼、夜时段, 运动与否等不同情况下取血测值亦非静止不变. 其次, 人类的衰老、任何疾病的发生发展与显化均为一渐进过程. 本文所言非病理状态亦仅相对而论, 其间尚有一大片居中的未知"灰色地带", 由于人体对早期疾病信号的感受和对痛苦阈限的差异, 许多处于早期的隐性疾病状态或亚临床、亚健康情况者并无相应躯体症状, 因缺乏先进手段加以甄别, 往往被误判为健康. 如许多隐性DM、潜隐性高血压病、肥胖早期等处于渐变或渐进过程中者, 一时难以应用健康或亚健康、非健康等恰当名词表述, 因此不易完全区分. 当今虽然随着医疗技术的不断进步, 相继深化了对许多疾病的认识, 也使得一些比亚临床状态更早者的风险被发现并得以妥善处理, 但欲窥其全貌依然前路漫漫. 包括过量的体力活动、嗜好烟酒、咖啡等嗜好品应用期间, ALT水平的动态改变, 亦难以病理与非病理情况加以评判, 除非超过正常值上限过多, 否则对测值临床宜灵活把握、慎重评价. 有前述特殊生活状态者可嘱其安静休息1-2 wk后再抽血复查, 对休息后ALT可自然恢复到正常水平的轻度异常(<2 ULN)体检结果, 不可轻易下"肝炎"或"肝病"之诊断. 关于"正常"ALT患者疾病进展的研究数据并不一致. 由于CHB、CHC等肝病患者可能存在较长的生化缓解期, ALT水平可以波动, 所以, 一般要求超过6 mo, 连续3次检测ALT, 均处于正常范围内, 才能定义为"正常". ALT等酶学测值虽然被视为目前最常应用的反映肝损伤的指标, 但在各种类型肝损伤的鉴别方面并无特异性, 如不能区别药物性肝病抑或病毒性肝炎和其他形式的肝损伤, 且与肝病的进展情况不完全一致. 因此, 迄今临床依然迫切需要更加灵敏、特异和稳定的肝损伤生物学指标.
为指导与规范临床医师在日常工作中恰当评估异常的肝脏功能检测结果, 2016-12, 美国胃肠病学院(American College of Gastroenterology, ACG)发布了新的肝脏生化学异常评估指南. 其中谷丙转氨酶(alanine transaminase, ALT)检测被列为首条, 其次包括谷草转氨酶(asparine transaminase, AST)、碱性磷酸酶、γ-谷氨酰转肽酶和胆红素. ACG提出的19条推荐意见中, 第一条强烈推荐启动异常肝脏生化学评估之前, 应重复实验室检测或进行澄清测试以确认肝脏生化学确实存在异常. 提示对ALT测值的正确评判与恰当运用十分重要.
2006年以Keeffe等为首的8位美国学者曾发表《美国慢性乙型肝炎处理流程》, 该流程依据韩国参加医疗保险和健康体检的人群基线ALT、AST水平与其后发生的与肝病致死率的相关性队列研究资料, 建议将目前通用的ALT正常值(<40 IU/L)向下调整为男性上限30 IU/L, 女性19 IU/L. 此后, 这一观点被国外学者反复推荐, 甚至有人主张将ALT的水平降的更低. 而我国2015版《慢性乙型肝炎防治指南》中推荐慢性乙型肝炎(chronic hepatitis B, CHB)抗病毒治疗的适应人群为ALT持续升高≥2正常值上限. 两相对比, 引起临床医师对CHB抗病毒治疗适应证的把控出现困惑与混乱: 依据Keeffe推荐的标准, CHB患者乙型肝炎病毒(hepatitis B virus, HBV)载量(HBV DNA)超标者, 是否男ALT>60 IU/L、女>38 IU/L就应该抗HBV治疗? 此后关于ALT正常值之争持续不断.
ALT的检测由于灵敏度高, 价廉易得, 重复性好而在临床各科和健康体检时被广为应用, 但其特异性差、影响因素众多亦为不争的事实. 国内外临床研究一致发现, ALT水平本身迄今已远非仅仅反映肝脏炎症病变, 其水平异常与许多重要的肝外疾病的发生、发展及预后的评估有关; ALT水平的变化还受许多非病理因素如性别、年龄、生活饮食习惯、嗜好、运动、检测技术等情况的影响, 大大增加了评价难度, 临床对此充分了解与注意是十分必要的.
ALT等肝功能指标的检测目前在临床和健康体检中心已经得到广泛普及, 但其测值所反映的真实病理情况的评估除专科医师外, 尚未引起基层医务人员的广泛注意. 尤其Keeffe等出台了新的正常值判断标准之后, 对处于测值在临界状态者的临床意义评价在不同国家和地域之间引起了一定混乱. 鉴于国内大多非专科的基层医师对ALT测值的非病理情况尚缺乏全面了解与足够重视, 本文结合国内外最新研究与应用方面的文献就ALT正常值的设定与现代争议和能够影响ALT检测结果的非病理因素从生理、生活、季节、地域、药物、标本采集过程、检验设备与检查操作等诸多过程或环节入手进行了系统梳理.
本文结合国内外最新研究文献, 对可能影响ALT等肝功能检测正常值的常见非病理因素进行了总结.
不同性别、年龄、妊娠、遗传、昼夜节律变化、营养、饮食与食物、饮酒、吸烟、运动、职业等诸多因素可能对ALT的测值产生影响, 临床医师判读肝功能化验单时宜首先甄别与排除上述非病理情况.
本文综述了非病理因素对血清ALT的影响, 国内外的文献综述详细而且全面, 有一定新颖性, 是作者花费了较多时间写出来的, 既有专业性又具有科普作品的价值.
向晓星, 主任医师, 苏北人民医院消化科, 扬州大学临床医学院消化内科(肝胆胰); 姚登福, 教授, 南通大学附属医院临床医学
手稿来源: 邀请约稿
学科分类: 胃肠病学和肝病学
手稿来源地: 广西壮族自治区
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C
D级 (一般): D
E级 (差): 0
编辑:马亚娟 电编:杜冉冉
| 1. | Liu Z, Que S, Xu J, Peng T. Alanine aminotransferase-old biomarker and new concept: a review. Int J Med Sci. 2014;11:925-935. [PubMed] [DOI] |
| 2. | Kwo PY, Cohen SM, Lim JK. ACG Clinical Guideline: Evaluation of Abnormal Liver Chemistries. Am J Gastroenterol. 2017;112:18-35. [PubMed] [DOI] |
| 3. | Kunutsor SK, Apekey TA, Khan H. Liver enzymes and risk of cardiovascular disease in the general population: a meta-analysis of prospective cohort studies. Atherosclerosis. 2014;236:7-17. [PubMed] [DOI] |
| 4. | Lazzeri C, Valente S, Boddi M, Mecarocci V, Chiostri M, Gensini GF. Clinical and prognostic significance of increased liver enzymes in ST-elevation myocardial infarction. Int J Cardiol. 2014;177:543-544. [PubMed] [DOI] |
| 5. | Koyama T, Hamada H, Nishida M, Naess PA, Gaarder C, Sakamoto T. Defining the optimal cut-off values for liver enzymes in diagnosing blunt liver injury. BMC Res Notes. 2016;9:41. [PubMed] [DOI] |
| 6. | 陈 成伟, 潘 柏申, 程 明亮. ALT正常值应下调吗? 第十次全国感染病学术会议暨第二届全国感染科医师大会. 2008;13-15. |
| 7. | Barbosa-Júnior FV, Sanchez-Lermen Rde L, Vieira Kde A, Oliveira RV, Souto FJ. Detection of hepatitis B activity in HBeAg-negative carriers with normal aminotransferase levels in central Brazil. Ann Hepatol. 2015;14:470-476. [PubMed] |
| 8. | Charatcharoenwitthaya P, Phisalprapa P, Pausawasdi N, Rungkaew P, Kajornvuthidej S, Bandidniyamanon W, Chotiyaputta W, Chainuvati S, Tanwandee T. Alanine aminotransferase course, serum hepatitis B virus DNA, and liver stiffness measurement for therapeutic decisions in hepatitis B e antigen-negative chronic hepatitis B. Hepatol Res. 2016;46:1347-1357. [PubMed] [DOI] |
| 9. | Wang H, Ru GQ, Yan R, Zhou Y, Wang MS, Cheng MJ. Histologic Disease in Chinese Chronic Hepatitis B Patients With Low Viral Loads and Persistently Normal Alanine Aminotransferase Levels. J Clin Gastroenterol. 2016;50:790-796. [PubMed] [DOI] |
| 10. | Mofrad P, Contos MJ, Haque M, Sargeant C, Fisher RA, Luketic VA, Sterling RK, Shiffman ML, Stravitz RT, Sanyal AJ. Clinical and histologic spectrum of nonalcoholic fatty liver disease associated with normal ALT values. Hepatology. 2003;37:1286-1292. [PubMed] [DOI] |
| 11. | Fracanzani AL, Burdick L, Raselli S, Pedotti P, Grigore L, Santorelli G, Valenti L, Maraschi A, Catapano A, Fargion S. Carotid artery intima-media thickness in nonalcoholic fatty liver disease. Am J Med. 2008;121:72-78. [PubMed] [DOI] |
| 12. | Kim HC, Nam CM, Jee SH, Han KH, Oh DK, Suh I. Normal serum aminotransferase concentration and risk of mortality from liver diseases: prospective cohort study. BMJ. 2004;328:983. [PubMed] [DOI] |
| 13. | Lee H, Shin DW, Lee TH, Yang HK, Ahn E, Yoon JM, Lee HK, Suh B, Son KY, Kim JS. Association Between Change in Serum Aminotransferase and Mortality: A Nationwide Cohort Study in Korea. Medicine (Baltimore). 2016;95:e3158. [PubMed] [DOI] |
| 14. | Keeffe EB, Dieterich DT, Han SH, Jacobson IM, Martin P, Schiff ER, Tobias H, Wright TL. A treatment algorithm for the management of chronic hepatitis B virus infection in the United States: an update. Clin Gastroenterol Hepatol. 2006;4:936-962. [PubMed] [DOI] |
| 15. | Choi MS, Sinn DH, Kim SA, Lee YS, Choi W, Paik SW. The clinical and laboratory characteristics of patients with chronic hepatitis B using current or past antiviral therapy in Korea: a multi-center, nation-wide, cross-sectional epidemiologic study. Gut Liver. 2012;6:241-248. [PubMed] [DOI] |
| 16. | Yadav D, Choi E, Ahn SV, Baik SK, Cho YZ, Koh SB, Huh JH, Chang Y, Sung KC, Kim JY. Incremental Predictive Value of Serum AST-to-ALT Ratio for Incident Metabolic Syndrome: The ARIRANG Study. PLoS One. 2016;11:e0161304. [PubMed] [DOI] |
| 17. | Zheng MH, Shi KQ, Fan YC, Liu WY, Lin XF, Li LF, Chen YP. Upper limits of normal for serum alanine aminotransferase levels in Chinese Han population. PLoS One. 2012;7:e43736. [PubMed] [DOI] |
| 18. | Tapper EB, Saini SD, Sengupta N. Extensive testing or focused testing of patients with elevated liver enzymes. J Hepatol. 2017;66:313-319. [PubMed] [DOI] |
| 19. | Park SH, Heo NY, Kim CH, Suk KT, Kim DJ, Lee HY. Upper reference limits for aminotransferase activities and the prevalence of elevated aminotransferase activities in a Korean population. J Clin Gastroenterol. 2013;47:76-82. [PubMed] [DOI] |
| 20. | Kowdley KV. Advances in the diagnosis and treatment of nonalcoholic steatohepatitis. Gastroenterol Hepatol (N Y). 2014;10:184-186. [PubMed] |
| 21. | Schumann G, Klauke R. New IFCC reference procedures for the determination of catalytic activity concentrations of five enzymes in serum: preliminary upper reference limits obtained in hospitalized subjects. Clin Chim Acta. 2003;327:69-79. [PubMed] [DOI] |
| 22. | Bock BJ, Dolan CT, Miller GC, Fitter WF, Hartsell BD, Crowson AN, Sheehan WW, Williams JD. The data warehouse as a foundation for population-based reference intervals. Am J Clin Pathol. 2003;120:662-670. [PubMed] [DOI] |
| 23. | Mera JR, Dickson B, Feldman M. Influence of gender on the ratio of serum aspartate aminotransferase (AST) to alanine aminotransferase (ALT) in patients with and without hyperbilirubinemia. Dig Dis Sci. 2008;53:799-802. [PubMed] [DOI] |
| 24. | Danielsson J, Kangastupa P, Laatikainen T, Aalto M, Niemelä O. Impacts of common factors of life style on serum liver enzymes. World J Gastroenterol. 2014;20:11743-11752. [PubMed] [DOI] |
| 25. | Sull JW, Yun JE, Lee SY, Ohrr H, Jee SH, Guallar E, Samet JM. Body mass index and serum aminotransferase levels in Korean men and women. J Clin Gastroenterol. 2009;43:869-875. [PubMed] [DOI] |
| 27. | Ruhl CE, Everhart JE. The association of low serum alanine aminotransferase activity with mortality in the US population. Am J Epidemiol. 2013;178:1702-1711. [PubMed] [DOI] |
| 28. | Elinav E, Ben-Dov IZ, Ackerman E, Kiderman A, Glikberg F, Shapira Y, Ackerman Z. Correlation between serum alanine aminotransferase activity and age: an inverted U curve pattern. Am J Gastroenterol. 2005;100:2201-2204. [PubMed] [DOI] |
| 29. | Helmersson-Karlqvist J, Ridefelt P, Lind L, Larsson A. Reference values for 34 frequently used laboratory tests in 80-year-old men and women. Maturitas. 2016;92:97-101. [PubMed] [DOI] |
| 30. | Lai DS, Chen SC, Chang YH, Chen CY, Lin JB, Lin YJ, Yang SF, Yang CC, Chen WK, Lin DB. Pediatric reference intervals for several biochemical analytes in school children in Central Taiwan. J Formos Med Assoc. 2009;108:957-963. [PubMed] [DOI] |
| 31. | Kliethermes S, Ma M, Purtell C, Balasubramanian N, Gonzalez B, Layden TJ, Cotler SJ. An assessment of racial differences in the upper limits of normal ALT levels in children and the effect of obesity on elevated values. Pediatr Obes. 2017;12:363-372. [PubMed] [DOI] |
| 32. | Cho SM, Lee SG, Kim HS, Kim JH. Establishing pediatric reference intervals for 13 biochemical analytes derived from normal subjects in a pediatric endocrinology clinic in Korea. Clin Biochem. 2014;47:268-271. [PubMed] [DOI] |
| 33. | Elizondo-Montemayor L, Ugalde-Casas PA, Lam-Franco L, Bustamante-Careaga H, Serrano-González M, Gutiérrez NG, Martínez U. Association of ALT and the metabolic syndrome among Mexican children. Obes Res Clin Pract. 2014;8:e79-e87. [PubMed] [DOI] |
| 34. | Holstege A. Elevated liver enzymes. Dtsch Med Wochenschr. 2016;141:1640-1646. [PubMed] [DOI] |
| 35. | Bacq Y, Zarka O, Bréchot JF, Mariotte N, Vol S, Tichet J, Weill J. Liver function tests in normal pregnancy: a prospective study of 103 pregnant women and 103 matched controls. Hepatology. 1996;23:1030-1034. [PubMed] [DOI] |
| 36. | Wong HY, Tan JY, Lim CC. Abnormal liver function tests in the symptomatic pregnant patient: the local experience in Singapore. Ann Acad Med Singapore. 2004;33:204-208. [PubMed] |
| 37. | Khan R, Khan Z, Javed K, Ali K. Effect of gestational diabetes on blood sugar, liver and renal function tests. J Ayub Med Coll Abbottabad. 2012;24:95-98. [PubMed] |
| 38. | Whitfield JB, Martin NG. Individual differences in plasma ALT, AST and GGT: contributions of genetic and environmental factors, including alcohol consumption. Enzyme. 1985;33:61-69. [PubMed] [DOI] |
| 39. | Bathum L, Petersen HC, Rosholm JU, Hyltoft Petersen P, Vaupel J, Christensen K. Evidence for a substantial genetic influence on biochemical liver function tests: results from a population-based Danish twin study. Clin Chem. 2001;47:81-87. [PubMed] |
| 41. | Córdoba J, O'Riordan K, Dupuis J, Borensztajin J, Blei AT. Diurnal variation of serum alanine transaminase activity in chronic liver disease. Hepatology. 1998;28:1724-1725. [PubMed] [DOI] |
| 42. | Ruhl CE, Everhart JE. Diurnal variation in serum alanine aminotransferase activity in the US population. J Clin Gastroenterol. 2013;47:165-173. [PubMed] [DOI] |
| 43. | Lin YC, Hsieh IC, Chen PC. Long-term day-and-night rotating shift work poses a barrier to the normalization of alanine transaminase. Chronobiol Int. 2014;31:487-495. [PubMed] [DOI] |
| 44. | Nakamura K, Motohashi Y, Kikuchi S, Tanaka M, Nakano S. Liver transferase activity in healthy Japanese employees aged 18-39 years. Ind Health. 1998;36:218-222. [PubMed] [DOI] |
| 46. | Iwata T, Arai K, Saito N, Murata K. The association between dietary lifestyles and hepatocellular injury in Japanese workers. Tohoku J Exp Med. 2013;231:257-263. [PubMed] [DOI] |
| 47. | Mochizuki K, Hariya N, Miyauchi R, Misaki Y, Ichikawa Y, Goda T. Self-reported faster eating associated with higher ALT activity in middle-aged, apparently healthy Japanese women. Nutrition. 2014;30:69-74. [PubMed] [DOI] |
| 48. | Mochizuki K, Miyauchi R, Hariya N, Misaki Y, Kasezawa N, Tohyama K, Goda T. Self-reported rate of eating is associated with higher circulating ALT activity in middle-aged apparently healthy Japanese men. Eur J Nutr. 2013;52:985-990. [PubMed] [DOI] |
| 49. | Rosen E, Sabel AL, Brinton JT, Catanach B, Gaudiani JL, Mehler PS. Liver dysfunction in patients with severe anorexia nervosa. Int J Eat Disord. 2016;49:151-158. [PubMed] [DOI] |
| 50. | Lelli L, Castellini G, Gabbani T, Godini L, Rotella F, Ricca V. Associations between liver enzymes, psychopathological and clinical features in eating disorders. Eur Eat Disord Rev. 2014;22:443-447. [PubMed] [DOI] |
| 51. | Fontana L, Zhao E, Amir M, Dong H, Tanaka K, Czaja MJ. Aging promotes the development of diet-induced murine steatohepatitis but not steatosis. Hepatology. 2013;57:995-1004. [PubMed] [DOI] |
| 52. | Tynjälä J, Kangastupa P, Laatikainen T, Aalto M, Niemelä O. Effect of age and gender on the relationship between alcohol consumption and serum GGT: time to recalibrate goals for normal ranges. Alcohol Alcohol. 2012;47:558-562. [PubMed] [DOI] |
| 53. | Lee JK, Shim JH, Lee HC, Lee SH, Kim KM, Lim YS, Chung YH, Lee YS, Suh DJ. Estimation of the healthy upper limits for serum alanine aminotransferase in Asian populations with normal liver histology. Hepatology. 2010;51:1577-1583. [PubMed] [DOI] |
| 54. | Chen S, Guo X, Yu S, Zhou Y, Li Z, Sun Y. Metabolic Syndrome and Serum Liver Enzymes in the General Chinese Population. Int J Environ Res Public Health. 2016;13:223. [PubMed] [DOI] |
| 55. | Unalp-Arida A, Ruhl CE. Noninvasive fatty liver markers predict liver disease mortality in the U.S. population. Hepatology. 2016;63:1170-1183. [PubMed] [DOI] |
| 56. | Yokoyama M, Watanabe T, Otaki Y, Takahashi H, Arimoto T, Shishido T, Miyamoto T, Konta T, Shibata Y, Daimon M. Association of the Aspartate Aminotransferase to Alanine Aminotransferase Ratio with BNP Level and Cardiovascular Mortality in the General Population: The Yamagata Study 10-Year Follow-Up. Dis Markers. 2016;2016:4857917. [PubMed] |
| 57. | Zoppini G, Cacciatori V, Negri C, Stoico V, Lippi G, Targher G, Bonora E. The aspartate aminotransferase-to-alanine aminotransferase ratio predicts all-cause and cardiovascular mortality in patients with type 2 diabetes. Medicine (Baltimore). 2016;95:e4821. [PubMed] [DOI] |
| 58. | Jung DH, Lee YJ, Ahn HY, Shim JY, Lee HR. Relationship of hepatic steatosis and alanine aminotransferase with coronary calcification. Clin Chem Lab Med. 2010;48:1829-1834. [PubMed] [DOI] |
| 59. | Kotronen A, Juurinen L, Hakkarainen A, Westerbacka J, Cornér A, Bergholm R, Yki-Järvinen H. Liver fat is increased in type 2 diabetic patients and underestimated by serum alanine aminotransferase compared with equally obese nondiabetic subjects. Diabetes Care. 2008;31:165-169. [PubMed] [DOI] |
| 60. | Chen QC, Xiao J, Zhang PP, Chen LL, Chen XX, Wang SM. Longitudinal Changes in Liver Aminotransferases Predict Metabolic Syndrome in Chinese Patients with Nonviral Hepatitis. Biomed Environ Sci. 2016;29:254-266. [PubMed] [DOI] |
| 61. | Niemelä O, Alatalo P. Biomarkers of alcohol consumption and related liver disease. Scand J Clin Lab Invest. 2010;70:305-312. [PubMed] [DOI] |
| 62. | Lee DH, Ha MH, Christiani DC. Body weight, alcohol consumption and liver enzyme activity--a 4-year follow-up study. Int J Epidemiol. 2001;30:766-770. [PubMed] [DOI] |
| 63. | Robinson D, Whitehead TP. Effect of body mass and other factors on serum liver enzyme levels in men attending for well population screening. Ann Clin Biochem. 1989;26:393-400. [PubMed] [DOI] |
| 64. | Singla R, Sharma SK, Mohan A, Makharia G, Sreenivas V, Jha B, Kumar S, Sarda P, Singh S. Evaluation of risk factors for antituberculosis treatment induced hepatotoxicity. Indian J Med Res. 2010;132:81-86. [PubMed] |
| 65. | Wright MA, Yang ML, Parsons JA, Westfall JM, Yee AS. Consider muscle disease in children with elevated transaminase. J Am Board Fam Med. 2012;25:536-540. [PubMed] [DOI] |
| 66. | Suda I, Ishikawa F, Hatakeyama M, Miyawaki M, Kudo T, Hirano K, Ito A, Yamakawa O, Horiuchi S. Intake of purple sweet potato beverage affects on serum hepatic biomarker levels of healthy adult men with borderline hepatitis. Eur J Clin Nutr. 2008;62:60-67. [PubMed] [DOI] |
| 67. | Carrieri MP, Lions C, Sogni P, Winnock M, Roux P, Mora M, Bonnard P, Salmon D, Dabis F, Spire B; ANRS CO13 HEPAVIH Study Group. Association between elevated coffee consumption and daily chocolate intake with normal liver enzymes in HIV-HCV infected individuals: results from the ANRS CO13 HEPAVIH cohort study. J Hepatol. 2014;60:46-53. [PubMed] [DOI] |
| 68. | Jordan SA, McWilliam P, O'Briain DS, Humphries P. Dinucleotide repeat polymorphism at the D14S42 locus. Nucleic Acids Res. 1991;19:1171. [PubMed] [DOI] |
| 69. | Chalasani NP, Hayashi PH, Bonkovsky HL, Navarro VJ, Lee WM, Fontana RJ; Practice Parameters Committee of the American College of Gastroenterology. ACG Clinical Guideline: the diagnosis and management of idiosyncratic drug-induced liver injury. Am J Gastroenterol. 2014;109:950-966; quiz 967. [PubMed] [DOI] |
| 70. | Weikert C, Drogan D, di Giuseppe R, Fritsche A, Buijsse B, Nöthlings U, Willich SN, Berger K, Boeing H. Liver enzymes and stroke risk in middle-aged German adults. Atherosclerosis. 2013;228:508-514. [PubMed] [DOI] |
| 71. | Stranges S, Freudenheim JL, Muti P, Farinaro E, Russell M, Nochajski TH, Trevisan M. Differential effects of alcohol drinking pattern on liver enzymes in men and women. Alcohol Clin Exp Res. 2004;28:949-956. [PubMed] [DOI] |
| 72. | Yue M, Ni Q, Yu CH, Ren KM, Chen WX, Li YM. Transient elevation of hepatic enzymes in volunteers after intake of alcohol. Hepatobiliary Pancreat Dis Int. 2006;5:52-55. [PubMed] |
| 73. | Pinzani P, Petruzzi E, Orlando C, Malentacchi F, Petruzzi I, Pazzagli M, Masotti G. Healthy centenarian subjects: the effect of red wine consumption on liver function tests. J Endocrinol Invest. 2005;28:120-122. [PubMed] |
| 74. | Torkadi PP, Apte IC, Bhute AK. Biochemical Evaluation of Patients of Alcoholic Liver Disease and Non-alcoholic Liver Disease. Indian J Clin Biochem. 2014;29:79-83. [PubMed] [DOI] |
| 75. | Park EY, Lim MK, Oh JK, Cho H, Bae MJ, Yun EH, Kim DI, Shin HR. Independent and supra-additive effects of alcohol consumption, cigarette smoking, and metabolic syndrome on the elevation of serum liver enzyme levels. PLoS One. 2013;8:e63439. [PubMed] [DOI] |
| 76. | Whitehead TP, Robinson D, Allaway SL. The effects of cigarette smoking and alcohol consumption on serum liver enzyme activities: a dose-related study in men. Ann Clin Biochem. 1996;33:530-535. [PubMed] [DOI] |
| 77. | Breitling LP, Arndt V, Drath C, Brenner H. Liver enzymes: interaction analysis of smoking with alcohol consumption or BMI, comparing AST and ALT to γ-GT. PLoS One. 2011;6:e27951. [PubMed] [DOI] |
| 78. | Park S, Ahn J, Lee BK. Self-rated Subjective Health Status Is Strongly Associated with Sociodemographic Factors, Lifestyle, Nutrient Intakes, and Biochemical Indices, but Not Smoking Status: KNHANES 2007-2012. J Korean Med Sci. 2015;30:1279-1287. [PubMed] [DOI] |
| 79. | Zubairy YF, Patil VW, Benjamin T, Jangam D, Bijle MN, Patil S. Effect of methylxanthines (coffee/tea consumers) on oral precancer and oral cancer patients with smoking and smokeless tobacco habits. J Contemp Dent Pract. 2012;13:745-758. [PubMed] [DOI] |
| 80. | 丛 玉隆. 检验与临床诊断、质量管理和常规检验手册. 北京: 人民军医出版社 2006; 76-77. |
| 81. | Koury JC, Daleprane JB, Pitaluga-Filho MV, de Oliveira CF, Gonçalves MC, Passos MC. Aerobic Conditioning Might Protect Against Liver and Muscle Injury Caused by Short-Term Military Training. J Strength Cond Res. 2016;30:454-460. [PubMed] [DOI] |
| 82. | Villegas R, Xiang YB, Elasy T, Cai Q, Xu W, Li H, Fazio S, Linton MF, Raiford D, Zheng W. Liver enzymes, type 2 diabetes, and metabolic syndrome in middle-aged, urban Chinese men. Metab Syndr Relat Disord. 2011;9:305-311. [PubMed] [DOI] |
| 83. | Yoo KD, Jun DW, Lee KN, Lee HL, Lee OY, Yoon BC, Choi HS. Sarcopenia is a risk factor for elevated aminotransferase in men independently of body mass index, dietary habits, and physical activity. Dig Liver Dis. 2015;47:303-308. [PubMed] [DOI] |
| 84. | Banfi G, Morelli P. Relation between body mass index and serum aminotransferases concentrations in professional athletes. J Sports Med Phys Fitness. 2008;48:197-200. [PubMed] |
| 85. | Arndt V, Brenner H, Rothenbacher D, Zschenderlein B, Fraisse E, Fliedner TM. Elevated liver enzyme activity in construction workers: prevalence and impact on early retirement and all-cause mortality. Int Arch Occup Environ Health. 1998;71:405-412. [PubMed] [DOI] |
| 87. | Rojas-García AE, Medina-Díaz IM, Robledo-Marenco Mde L, Barrón-Vivanco BS, Girón-Pérez MI, Velázquez-Fernández JB, González-Arias CA, Albores-Medina A, Quintanilla-Vega B, Ostrosky-Wegman P. Hematological, biochemical effects, and self-reported symptoms in pesticide retailers. J Occup Environ Med. 2011;53:517-521. [PubMed] [DOI] |
| 88. | Miyake K, Miyake N, Kondo S, Tabe Y, Ohsaka A, Miida T. Seasonal variation in liver function tests: a time-series analysis of outpatient data. Ann Clin Biochem. 2009;46:377-384. [PubMed] [DOI] |
| 89. | Zelber-Sagi S, Ben-Assuli O, Rabinowich L, Goldstein A, Magid A, Shalev V, Shibolet O, Chodick G. The association between the serum levels of uric acid and alanine aminotransferase in a population-based cohort. Liver Int. 2015;35:2408-2415. [PubMed] [DOI] |
| 90. | Ceriotti F, Henny J, Queraltó J, Ziyu S, Özarda Y, Chen B, Boyd JC, Panteghini M; IFCC Committee on Reference Intervals and Decision Limits (C-RIDL); Committee on Reference Systems for Enzymes (C-RSE). Common reference intervals for aspartate aminotransferase (AST), alanine aminotransferase (ALT) and γ-glutamyl transferase (GGT) in serum: results from an IFCC multicenter study. Clin Chem Lab Med. 2010;48:1593-1601. [PubMed] [DOI] |
| 91. | Shashi A, Bhardwaj M. Study on blood biochemical diagnostic indices for hepatic function biomarkers in endemic skeletal fluorosis. Biol Trace Elem Res. 2011;143:803-814. [PubMed] [DOI] |
| 92. | Doi Y, Kubo M, Yonemoto K, Ninomiya T, Iwase M, Tanizaki Y, Shikata K, Iida M, Kiyohara Y. Liver enzymes as a predictor for incident diabetes in a Japanese population: the Hisayama study. Obesity (Silver Spring). 2007;15:1841-1850. [PubMed] [DOI] |
| 93. | Karim MF, Ismail M, Hasan AM, Shekhar HU. Hematological and biochemical status of Beta-thalassemia major patients in Bangladesh: A comparative analysis. Int J Hematol Oncol Stem Cell Res. 2016;10:7-12. [PubMed] |
| 94. | Björnsson HK, Olafsson S, Bergmann OM, Björnsson ES. A prospective study on the causes of notably raised alanine aminotransferase (ALT). Scand J Gastroenterol. 2016;51:594-600. [PubMed] [DOI] |
| 95. | Guo S, Jin D, Wang H, Zhang C. Reference intervals of several renal and hepatic function parameters for apparently healthy adults from Eastern China. J Clin Lab Anal. 2015;29:235-241. [PubMed] [DOI] |
| 96. | Harrill AH, Roach J, Fier I, Eaddy JS, Kurtz CL, Antoine DJ, Spencer DM, Kishimoto TK, Pisetsky DS, Park BK. The effects of heparins on the liver: application of mechanistic serum biomarkers in a randomized study in healthy volunteers. Clin Pharmacol Ther. 2012;92:214-220. [PubMed] [DOI] |
| 97. | Curtis RM, Sivilotti ML. A descriptive analysis of aspartate and alanine aminotransferase rise and fall following acetaminophen overdose. Clin Toxicol (Phila). 2015;53:849-855. [PubMed] [DOI] |
| 98. | Eslami-Shahrbabaki M, Haghdoost AA, Mashaiekhi A, Khalili N, Amini-Ranjbar Z, Ghayomi A. Effects of methadone on liver enzymes in patients undergoing methadone maintenance treatment. Addict Health. 2012;4:111-116. [PubMed] |
| 99. | Gounden V, Zhao Z. Eltrombopag interference in routine chemistry testing. Ann Clin Biochem. 2016;53:611-614. [PubMed] [DOI] |
| 100. | Lee AR, Yim JM, Kim WI. Influence of prescribed herbal and Western medicine on patients with abnormal liver function tests: a retrospective quasi-experimental study. J Pharmacopuncture. 2012;15:34-39. [PubMed] [DOI] |
| 101. | Dasgupta A, Bernard DW. Herbal remedies: effects on clinical laboratory tests. Arch Pathol Lab Med. 2006;130:521-528. [PubMed] |
| 103. | Kocijancic M, Cargonja J, Delic-Knezevic A. Evaluation of the BD Vacutainer(®) RST blood collection tube for routine chemistry analytes: clinical significance of differences and stability study. Biochem Med (Zagreb). 2014;24:368-375. [PubMed] [DOI] |
| 104. | Lippi G, Salvagno GL, Montagnana M, Brocco G, Guidi GC. Influence of hemolysis on routine clinical chemistry testing. Clin Chem Lab Med. 2006;44:311-316. [PubMed] [DOI] |
| 105. | Monneret D, Mestari F, Atlan G, Corlouer C, Ramani Z, Jaffre J, Dever S, Fressart V, Alkouri R, Lamari F. Hemolysis indexes for biochemical tests and immunoassays on Roche analyzers: determination of allowable interference limits according to different calculation methods. Scand J Clin Lab Invest. 2015;75:162-169. [PubMed] [DOI] |
| 106. | Koseoglu M, Hur A, Atay A, Cuhadar S. Effects of hemolysis interferences on routine biochemistry parameters. Biochem Med (Zagreb). 2011;21:79-85. [PubMed] [DOI] |
| 107. | Guder WG. Haemolysis as an influence and interference factor in clinical chemistry. J Clin Chem Clin Biochem. 1986;24:125-126. [PubMed] |
| 108. | Lima-Oliveira G, Guidi GC, Salvagno GL, Brocco G, Danese E, Lippi G. Estimation of the imprecision on clinical chemistry testing due to fist clenching and maintenance during venipuncture. Clin Biochem. 2016;49:1364-1367. [PubMed] [DOI] |
| 109. | Tarrant J, Meyer D, Katavolos P. Use of optimized aminotransferase methods in regulated preclinical studies. Vet Clin Pathol. 2013;42:535-538. [PubMed] [DOI] |
| 110. | Ichihara K, Itoh Y, Min WK, Yap SF, Lam CW, Kong XT, Chou CT, Nakamura H; Committee on Plasma Proteins, International Federation of Clinical Chemistry and Laboratory Medicine. Diagnostic and epidemiological implications of regional differences in serum concentrations of proteins observed in six Asian cities. Clin Chem Lab Med. 2004;42:800-809. [PubMed] [DOI] |
| 111. | Green JL, Campagna E, Bogdan GM, Dart RC, Heard K. Effects of clinical laboratory choice on study outcome: an interlaboratory evaluation of aminotransferase levels. Pharmacotherapy. 2008;28:453-457. [PubMed] [DOI] |