修回日期: 2017-10-18
接受日期: 2017-11-04
在线出版日期: 2017-11-18
肿瘤微环境为肿瘤提供了特有的营养代谢环境, 使得肿瘤细胞生物学行为受到自身遗传学及其周边微环境的双重调控. 胃肠胰神经内分泌肿瘤(gastroenteropancreatic neuroendocrine neoplasms, GEP-NENs)是起源于消化系统神经内分泌细胞的异质性肿瘤, 它以分泌生物活性物质为特点. GEP-NENs早期症状不典型, 确诊时常已发生转移, 对其肿瘤微环境的研究有助于我们进一步认识GEP-NENs的发生发展机制, 并能为临床诊断、治疗GEP-NENs提供新的依据. 本篇文章综述了肿瘤微环境中不同细胞成分、细胞外基质重塑蛋白、可溶性生长因子以及嗜铬粒蛋白在GEP-NENs进展中的作用.
核心提要: 肿瘤微环境成分对胃肠胰神经内分泌肿瘤的发生发展具有重要作用: 成纤维细胞促进肿瘤组织纤维化、内皮细胞构建肿瘤微血管网络、免疫炎症细胞促使肿瘤细胞免疫逃逸、蛋白酶类重塑细胞外基质、生长因子介导肿瘤与微环境信号传导, 从而共同营造利于肿瘤生存转移的优势环境.
引文著录: 魏亚玲, 柏建安, 何娜, 汤琪云. 胃肠胰神经内分泌肿瘤的肿瘤微环境. 世界华人消化杂志 2017; 25(32): 2896-2905
Revised: October 18, 2017
Accepted: November 4, 2017
Published online: November 18, 2017
Tumor microenvironment provides a unique environment for tumor development, where the biology behavior of tumor cells is regulated not only by their genetics but also by the surrounding environment. Gastroenteropancreatic neuroendocrine neoplasms (GEP-NENs) originating from the neuroendocrine cells of the gastroenteropancreatic system are characterized by a propensity to secrete a variety of peptide hormones and biogenic amines. The symptoms of GEP-NENs at early stages are often atypical, thus delaying the diagnosis. A further understanding of the pathobiology of GEP-NENs on the basis of studies on GEP-NENs tumor microenvironment can provide new evidence for clinical diagnosis and treatment. This review aims to introduce different cell types, several proteins involved in extracellular matrix remodeling, some growth factors, and chromogranin A (CgA) in the tumor microenvironment of GEP-NENs, in order to highlight their indispensable roles in GEP-NENs progression.
- Citation: Wei YL, Bai JA, He N, Tang QY. Tumor microenvironment of gastroenteropancreatic neuroendocrine neoplasms. Shijie Huaren Xiaohua Zazhi 2017; 25(32): 2896-2905
- URL: https://www.wjgnet.com/1009-3079/full/v25/i32/2896.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i32.2896
肿瘤微环境的概念最早来源于Stephen Paget的"种子与土壤"假说. 该理论探究肿瘤发病机制时, 不仅着重于肿瘤细胞这一"种子", 还将目光投向了提供其营养的"土壤"[1]. 肿瘤微环境理论认为, 肿瘤生物学行为不仅受到肿瘤细胞自身遗传学的影响, 还接受周围环境对其生存、增殖和转移的影响[2]. 肿瘤微环境是一个动态网络, 其间包含有肿瘤细胞、基质组织、不可溶性细胞外基质以及基质中的可溶性分子. 其中, 基质组织是支持性的结缔组织, 由多种细胞组成, 包括成纤维细胞、血管内皮细胞和浸润性免疫细胞等[2].
神经内分泌肿瘤(neuroendocrine neoplasms, NENs)是分布于人体弥散神经内分泌系统的异质性肿瘤, 约55%-70%发生于消化系统如胃肠道和胰腺, 该肿瘤以分泌多种肽类激素和生物活性胺类物质为特点[3]. 近年来, 随着医疗诊断技术的提高以及人们对于自身健康关注的增加, 胃肠胰神经内分泌肿瘤(gastroenteropancreatic neuroendocrine neoplasms, GEP-NENs)发病率迅速上升, 其在消化道肿瘤发病率中仅次于结肠癌, 居于第2位[4]. NENs的生长依赖于高度富集生长因子的肿瘤微环境, 特别是GEP-NENs[5]. GEP-NENs通过过表达各类促血管生成因子而促进肿瘤微环境中密集血管网络的构建, 借此为肿瘤细胞的远处转移提供营养与通道. 由此可见, 肿瘤微环境是GEP-NENs生长及转移的重要调控因素. 此外, 肿瘤微环境还影响抗肿瘤药物的有效性以及肿瘤耐药性的产生. 因此, 深入探究肿瘤微环境影响GEP-NENs进展的分子机制, 早期识别肿瘤微环境中相关组分的改变可为GEP-NENs诊治提供新思路. 本文将对GEP-NENs肿瘤微环境的研究进展进行综述.
肿瘤微环境的基质细胞大部分为肿瘤相关成纤维细胞(cancer-associated fibroblasts, CAFs), 其很有可能是早期肿瘤招募至肿瘤局部最早的基质细胞, 它通过分泌生长因子、趋化因子与基质中的其他细胞如肿瘤细胞、上皮细胞、内皮细胞和炎症细胞相互作用[6]. 比如, CAFs产生的肝细胞生长因子、表皮生长因子(epidermal growth factor, EGF)、转化生长因子(transforming growth factor, TGF-β)能促进肿瘤细胞增殖, 而这些生长因子又可以由肿瘤细胞产生而影响CAFs的生长[7]. 研究[8]表明, 小肠神经内分泌肿瘤(small intestine neuroendocrine tumors, SI-NETs)的生长与腹腔特定的微环境密切相关, 而SI-NETs肿瘤细胞可以通过分泌促纤维化和血管新生因子来维持这种有利其增殖的微环境. SI-NETs患者常表现为癌周组织、邻近肠系膜、腹膜、甚至心脏和肺部的纤维化, 而CAFs活化能在NENs相关纤维化和转移中发挥重要作用[9]. 研究人员在SI-NETs肿瘤微环境共培养模型(KRJ-1: HEK293细胞)中发现, SI-NETs细胞系KRJ-1细胞所分泌的5-羟色胺(5-hydroxytryptamine, 5-HT)是激活CAFs并诱导纤维化的重要因子. KRJ-1细胞分泌的5-HT通过作用于邻近CAFs表面的5-HT2A/C受体而促进CAFs增殖并高分泌TGF-β1、结缔组织生长因子(connective tissue growth factor, CTGF)和成纤维生长因子(fibroblast growth factor, FGF)[8]. TGF-β1和CTGF是典型的促纤维化生长因子, 血清中两者的水平升高与SI-NETs患者癌周组织纤维化明显相关. 而FGF是已知的血管内皮细胞刺激因子, 能促进血管新生. 此外, KRJ-1细胞自分泌的5-HT也能作用于自身细胞表面的5-HT2B受体, 从而促进KRJ-1细胞高分泌TGF-β1、CTGF和FGF.5-HT还能通过激活KRJ-1细胞内RAS/RAF/ERK信号通路促进SI-NETs肿瘤细胞自身的增殖[8].
肿瘤微环境中高水平的细胞因子和趋化因子可以招募并激活多种免疫炎症细胞, 包括巨噬细胞、树突细胞、淋巴细胞、中性粒细胞、嗜酸性粒细胞和肥大细胞等. 这些免疫炎症细胞中有些发挥抗肿瘤作用, 而有些则促进肿瘤进展[10]. 肿瘤抑制性炎症细胞和肿瘤促进性炎症细胞之间的平衡对于肿瘤发展具有重要调控作用. 巨噬细胞是微环境中浸润比例最高的免疫炎症细胞, 因此, 其在肿瘤相关炎症过程中发挥最主要的作用. 此外, T淋巴细胞也是肿瘤微环境中最常见的免疫炎症细胞[11]. 免疫炎症细胞可以分泌多种信号分子如EGF、血管内皮生长因子(vascular endothelial growth factor, VEGF)等促进肿瘤发展[12]. 此外, 肿瘤局部的浸润性免疫细胞可以分泌基质金属蛋白酶(matrix metalloproteinases, MMPs)降解肿瘤细胞外基质, 从而为肿瘤转移和血管新生创造有利的周边微环境[13]. 在胰岛素瘤转基因小鼠模型中, 研究人员就发现固有免疫细胞能向肿瘤微环境提供MMPs和其他的基质降解酶而促进肿瘤血管形成并加速肿瘤进展[14]. 肿瘤相关免疫炎症细胞一方面能直接促进肿瘤部位血管新生而增加肿瘤细胞的营养输送, 另一方面其可以协助肿瘤细胞逃避免疫监视与免疫攻击而增加肿瘤细胞存活. 下面就主要肿瘤促进性炎症细胞探讨如下.
1.2.1 T淋巴细胞: 肿瘤患者的Th1型免疫常受抑制, 故而Th1型免疫活化的细胞毒性T细胞(cytotoxic T lymphocytes, CTLs)作为有效的抗肿瘤免疫效应细胞已成为当今肿瘤免疫治疗的热点. 调节性T细胞(regulatory T cells, Tregs)是一类调节体内自身免疫反应的T细胞亚群, 早期亦称为抑制性T细胞. Tregs可以促进人体自身抗原产生外周耐受, 从而阻碍有效的免疫治疗[15]. 肿瘤局部浸润性Tregs能抑制效应T细胞的抗肿瘤作用, Tregs细胞数量与中肠NENs患者的肿瘤负荷明显相关[16]. 中肠NENs患者外周血中循环Tregs数量以及Tregs相关的Th1型免疫抑制细胞因子TGF-β明显增加, 而CTLs的增殖能力以及Th1型免疫促进细胞因子白介素-1β(interleukin-1β, IL-1β)、IL-12p70明显下降[16].
1.2.2 肥大细胞: 肥大细胞起源于骨髓造血干细胞, 刚进入外周血循环时处于未成熟的状态, 随后其不断成熟并进入外周组织定居. 在肿瘤组织中定居的肥大细胞一经活化就可以释放多种介质以参与肿瘤微环境重塑. 比如, 肥大细胞能产生类胰蛋白酶、糜蛋白酶而降解肿瘤细胞外基质; 可以释放组胺等血管活性因子而降低血管内皮屏障; 能释放VEGF、FGF、TGF-β等促血管因子而诱导肿瘤微血管新生; 还能向周围基质释放多种炎症免疫细胞因子和趋化因子而重塑肿瘤的免疫炎症微环境[17,18]. Soucek等[19]从胰岛素瘤转基因小鼠模型中发现, 胰岛β细胞内转录因子Myc的活化能启动肿瘤局部复杂的炎症和血管新生反应, 主要以释放大量的趋化因子和IL-1β为特点. 这些趋化因子可以快速招募外周血中肥大细胞、巨噬细胞和中性粒细胞涌入肿瘤微环境, 从而促进胰岛素瘤的血管生成并刺激肿瘤细胞增殖. 若缺乏肥大细胞的招募和局部浸润, Myc激活的胰岛β细胞呈现为一种特定的转化表型, 该类肿瘤细胞失去快速的细胞增殖能力以至于无法形成肿瘤实体. 这是因为由外周血循环招募至肿瘤局部的肥大细胞能为胰岛素瘤细胞建立和维持一个有利于肿瘤血管新生和肿瘤生长的微环境. 同时, 他们还发现采用色苷酸二钠抑制肥大细胞脱颗粒能够明显增加胰岛素瘤细胞的死亡. 此外, 酪氨酸激酶的新型抑制剂PCI-32765也能通过抑制肥大细胞脱颗粒, 而瓦解胰岛素瘤的肿瘤血管网络. 以上数据提示, 肿瘤微环境中肥大细胞浸润在维持胰腺神经内分泌肿瘤(pancreatic neuroendocrine neoplasms, pNENs)细胞生存中发挥重要作用, 而能抑制肥大细胞脱颗粒的酪氨酸激酶抑制剂也许能成为未来pNENs靶向免疫治疗的有效药物.
1.2.3 肿瘤相关巨噬细胞: 外周血循环中的单核细胞被肿瘤细胞招募之后成熟为巨噬细胞并定居于肿瘤组织. 依赖于肿瘤微环境中的不同信号分子, 巨噬细胞发生极化分型, 即经典活化的M1型巨噬细胞(type M1 macrophage, M1)和选择性活化的M2型巨噬细胞(type M2 macrophage, M2). M1所分泌的趋化因子CXCL9、CXCL10能诱导Th1淋巴细胞的浸润, 从而增强机体抗肿瘤免疫活性. 而M2通过表达趋化因子CCL17、CCL22和CCL24而招募Tregs, 从而抑制抗肿瘤适应性免疫[20]. 肿瘤相关巨噬细胞(tumor-associated macrophages, TAMs)凭借这种表型转换而最终获得免疫抑制相关的表型, 即M2型, 这对于TAMs促进肿瘤生长至关重要. TAMs的极化分型、增殖和存活依赖于肿瘤微环境当中的集落刺激因子-1(colony-stimulating factor-1, CSF-1). Pyonteck等[21]报道TAMs与pNENs的肿瘤分级和肝转移呈正相关关系. 他们还构建了CSF-1表达缺陷的Csf1op/op RT2小鼠模型, 并发现CSF-1表达缺失会导致pNENs肿瘤微环境中TAMs浸润明显减少, 从而降低了小鼠的累积肿瘤负荷, 包括瘤体内部的血管转化和肿瘤数目. Wei等[22]收集了更大规模的pNENs患者临床数据, 发现TAMs浸润与非功能性pNENs患者的术后复发率呈正相关关系. 因此, TAMs被推荐作为非功能性pNENs患者术后复发的有效预测指标, 对于临床医师指导非功能性pNENs患者随访具有一定意义.
血管内皮细胞是肿瘤微环境的主要细胞之一, 其与肿瘤微环境中其他细胞之间的相互作用贯穿于肿瘤血管新生的全过程[23,24]. 肿瘤内血管新生对于肿瘤扩张和转移至关重要, 一方面新生血管可以为肿瘤生长提供必要的营养和氧气; 另一方面, 新生血管也为肿瘤细胞的转移提供通道[25]. 血管新生是一个需要多种信号分子介导的复杂过程, 而VEGF是最重要的介导者. NENs是血管性肿瘤, 其内部的微血管密度一般比其他类型的肿瘤要高10倍, 有些情况甚至可以高达30倍[26-28]. pNENs高表达VEGF及其相应受体, 而VEGF正是其血管生成的重要驱动因子[29,30]. NENs来源的细胞系也被证明具有合成和分泌高水平VEGF的能力[31]. VEGF和血管内皮细胞表面的VEGFR的结合促进了NENs肿瘤微环境中内皮细胞增殖、新生血管形成. VEGFR抑制剂舒尼替尼可以减少内皮细胞密度和肿瘤血管的周皮细胞覆盖而延缓RIP1-Tag2转基因小鼠的pNENs肿瘤生长[32,33]. Raymond等[34]进行的一项随机对照3期临床试验表明, 舒尼替尼能使pNENs患者的无进展生存率提高两倍以上. 但是, NENs患者在接受单一抗VEGF-VEGFR靶向治疗后会产生一定的耐药性. 这是因为抗血管新生的靶向治疗会引发NENs肿瘤内部缺氧并伴随缺氧诱导因子1α的高度积累, 从而激活肿瘤局部的缺氧应激表达网络, 其中包括大量促血管生成因子的释放[35,36]. 在这一耐药性产生过程中, 除外肿瘤细胞和血管内皮细胞之外, 肿瘤微环境中其他基质细胞如成纤维细胞、巨噬细胞和炎症细胞成为了促血管生成因子的另一大来源. 此外, 血管内皮细胞还能通过VEGFR1招募血管祖细胞至NENs微环境, 以此诱导抗VEGF-VEGFR靶向治疗的获得性耐药[37]. pNENs细胞系BON细胞表达并分泌碱性成纤维生长因子(basic fibroblast growth factor, bFGF). 有效的内皮细胞有丝分裂原bFGF参与了肠道NENs的血管形成反应[38]. 体外细胞实验[31,39]表明, 生长抑素类似物具有较强的抗血管生成作用. 一方面其作用于内皮细胞表面的生长抑素受体而抑制内皮细胞增殖; 另一方面抑制肿瘤细胞合成和分泌促血管生成因子VEGF. 生长抑素类似物奥曲肽能上调小肠NENs细胞系CNDT2.5细胞内基因TNFSF15的转录与蛋白表达. TNFSF15基因编码的是血管内皮细胞生长抑制因子(vascular endothelial growth inhibitor, VEGI). VEGI能通过激活胞内核因子-κB和丝裂素活化蛋白激酶通路而诱导内皮细胞凋亡[40]. 这也许是生长抑素类似物处理可以有效抑制NENs血管生成的机制之一. 体内动物实验[41]显示, 奥曲肽能下调NENs移植瘤模型血浆中VEGF、bFGF等促血管生成因子的水平以及肿瘤内部微血管密度. 然而, 生长抑素类似物的体内抗血管生成作用到目前为止仍存在争议, 这方面的研究结果也是有限的. 研究人员认为体内NENs肿瘤微环境中存在着复杂的促血管和抗血管生成网络, 生长抑素类似物无法与微环境中强大的促血管生成因子竞争从而不能发挥有效的抗血管生成作用[39].
细胞外基质是存在于微环境中的不可溶性复杂混合物, 它由蛋白、蛋白聚糖、黏附性糖蛋白组成[42]. 正常情况下, 大多数细胞外基质成分是由成纤维细胞合成分泌的, 然而成纤维细胞在肿瘤微环境中转化为肌成纤维细胞, 转化之后的细胞事实上倾向于分泌细胞外基质降解酶. 肿瘤特殊微环境形成的首要步骤是重塑细胞外基质, 重塑过程依赖于各种蛋白酶, 最重要的是MMPs. 经蛋白酶重塑的细胞外基质促进肿瘤细胞穿越宿主组织屏障, 诱导生长因子释放, 并能增加内皮细胞迁移入基质形成新生血管的能力[43]. 许多研究表明, NENs对其细胞外基质进行了有效的重塑. 乙酰肝素酶能降解NENs的细胞外基质、帮助肿瘤细胞穿透血管内皮, 因此其被认为是NENs侵袭的标志物. 研究人员在RIP1-Tag2动物模型中发现, 乙酰肝素酶的表达水平与NENs的肿瘤分期、分级以及肿瘤的转移明显正相关[44]. MMP9参与小鼠pNENs模型的早期肿瘤形成过程. 此外, 研究人员发现, IL-1β介导了该pNENs小鼠模型的肿瘤微环境中MMP9的积累[45]. 组织蛋白酶B直接参与肿瘤微环境中多种成分的降解, 包括纤连蛋白、Ⅰ/Ⅳ型胶原蛋白、层黏连蛋白等细胞外基质蛋白以及E钙黏蛋白等细胞黏附分子. 发生MMP9活性缺失的pNENs常伴随肿瘤微环境中蛋白酶谱的改变, 主要表现为补偿性的半胱氨酸组织蛋白酶尤其是组织蛋白酶B的表达上升[45].
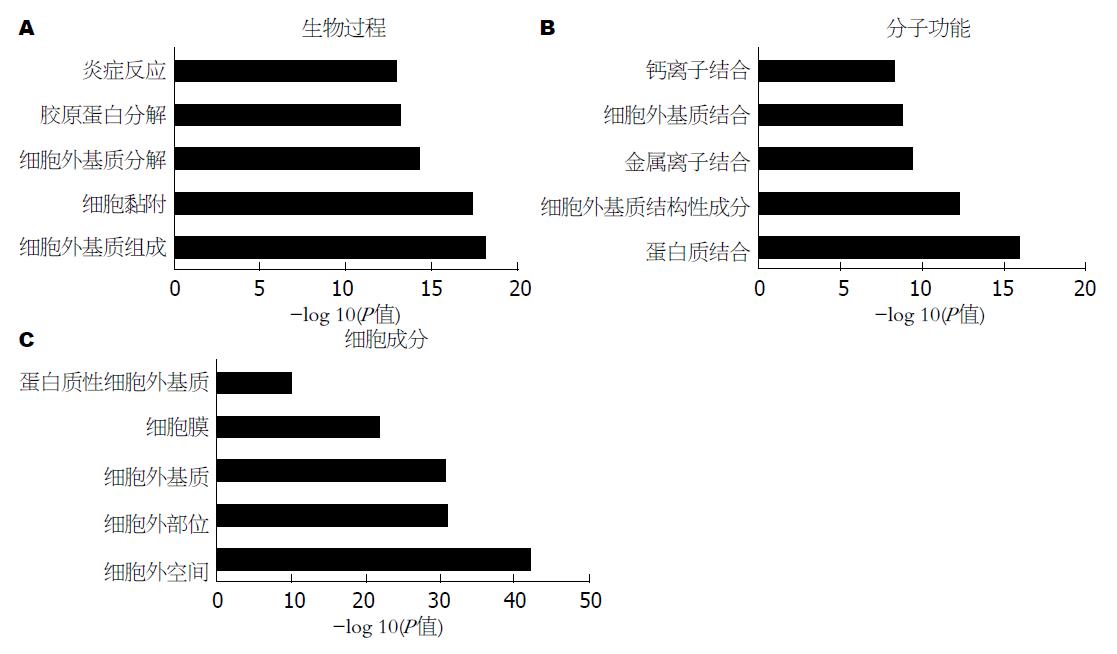
我们的前期研究也提示细胞外基质重塑可能是GEP-NENs的潜在致病机制. 我们利用3对胃NENs肿瘤组织及相应的癌旁组织进行转录组测序, 全面分析3对样本的转录组, 从中筛选出癌组织和癌旁组织的差异表达基因. 对差异基因进行基因本体论分析, 结果显示两组之间存在的差异基因主要参与细胞外基质组成、细胞外基质分解、胶原蛋白分解等生物过程; 差异基因的主要分子功能包括细胞外基质结构性成分、细胞外基质结合、胶原蛋白结合等; 而差异基因功能主要存在于细胞外区域、细胞外基质(图1)[P<0.05、错误发现率<0.05].
肿瘤微环境除了细胞成分和细胞外基质蛋白外, 还包含一些可溶性因子, 比如趋化因子、细胞因子和各类生长因子. NENs的生长依赖于高度富集的生长因子和各种下游信号通路. PI3K/AKT/mTOR信号通路在BON细胞中常被激活, mTOR抑制剂依维莫司通过抑制该条信号通路而有效抑制BON细胞增殖. 然而, 当BON细胞暴露于富血清培养基时, 依维莫司的生长抑制作用将明显减少. 这提示血清中的各类生长因子激活了BON细胞内其他替代性生长信号通路, 从而部分挽救了依维莫司所致的细胞死亡[46]. 可见, 肿瘤微环境中的各种生长因子对于GEP-NENs肿瘤细胞生存至关重要. 下面将主要生长因子介绍如下.
3.1.1 TGF-β: 3种TGF-β, 即TGF-β1、TGF-β2和TGF-β3在GEP-NENs肿瘤组织中大量表达. TGF-β的表达来源于肿瘤细胞还是肿瘤微环境中的基质细胞, 这仍需进一步的研究证实. 但是pNENs细胞系BON细胞在没有成纤维细胞存在的情况下也能表达并分泌这3种TGF-β, 并能在其培养基中检测到TGF-β的活性[9]. TGF-β能诱导GEP-NENs肿瘤微环境中细胞外基质的产生与沉积. 这是因为TGF-β能上调微环境中胶原蛋白、纤连蛋白和蛋白聚糖表达, 减少胶原酶等蛋白酶表达, 同时促进蛋白酶抑制剂如Ⅰ型纤溶酶原激活物抑制剂和组织特异性金属蛋白酶抑制剂的表达[9]. GEP-NENs肿瘤细胞所分泌的TGF-β1与自身细胞膜上TGF-βⅡ型受体结合, 通过磷酸化smad而激活细胞周期蛋白依赖性激酶抑制剂P21而致肿瘤细胞的G1期阻滞[47]. 然而, 胃和小肠NENs动物模型实验显示, TGF-β1在体内发挥着与体外细胞实验相互矛盾的生长调控作用. 在GEP-NENs动物模型中, 肿瘤细胞会逃离TGF-β的生长抑制作用, 肿瘤发展后期, TGF-β甚至促进NENs生长及转移[48,49]. TGF-β1与生长抑素(somatostatin, SST)是GEP-NENs肿瘤微环境中重要的细胞增殖及转移的调控因子. TGF-β与GEP-NENs肿瘤细胞表面的TGF-βⅡ型受体结合可以诱导SST的分泌增加以及生长抑素受体2(somatostatin receptor 2, SSTR2)表达上调, 从而激活肿瘤细胞的SST-SSTR2负性生长自分泌环路[50]. TGF-β-SST关联过程的任何中断都会导致BON细胞发生可逆的神经内分泌间质转化(neuroendocrine-mesenchymal transition, NMT). NMT表现为神经内分泌标记物如CgA、蛋白基因产物9.5表达缺失, 并伴随间充质细胞标记物如波形蛋白、Twist表达上调. NMT的产生意味着GEP-NENs肿瘤细胞的转移能力增加. 研究[50]表明, BON细胞经由富含TGF-β的胎牛血清处理后, BON细胞形态变得更圆, 细胞间边界变得模糊不清而无法辨别. 当用相应抗体中和TGF或SST之后, BON细胞间联系减少并呈现为更加伸展的形态, 同时伴随细胞膜上皮标记物E-钙黏蛋白的表达明显下降. 然而, 研究者[50]指出TGF-β通过SST-SSTR2所发挥的生长抑制作用是阶段依赖性的, 最终TGF-β会导致GEP-NENs肿瘤细胞的增殖和转移.
3.1.2 胰岛素样生长因子-Ⅰ: 大多数GEP-NENs肿瘤组织表达胰岛素样生长因子-Ⅰ(insulin-like growth factor-Ⅰ, IGF-Ⅰ)和IGF-Ⅰ受体(insulin-like growth factor-Ⅰreceptor, IGFⅠR). pNENs细胞系BON细胞也表达IGFⅠR并分泌其配体IGF-Ⅰ. 在无血清培养基中, 由BON细胞内源性分泌的IGF-Ⅰ作用于自身细胞膜表面的IGFⅠR从而刺激细胞生长. BON细胞依赖于自分泌IGF-Ⅰ环路而调控细胞的基础神经内分泌水平. 例如, 在培养基中外源性加入IGF-Ⅰ能促进BON细胞的CgA分泌. BON细胞还能分泌胰岛素样生长因子结合蛋白-2, 它能与IGF-Ⅰ结合而延长其半衰期从而促进BON细胞的IGF-Ⅰ自分泌作用[51].
3.1.3 CTGF: CTGF可以促进小肠NENs细胞系KRJ-1和胃NENs转基因小鼠模型的肿瘤细胞生长[52,53]. 临床上, 肿瘤局部和患者外周血中CTGF水平与GEP-NENs的恶性程度密切相关[5]. 此外, CTGF还是GEP-NENs相关纤维化的重要介导者[8].
GEP-NENs以分泌多种肽类激素和生物活性胺类物质为特点. pNENs细胞系BON细胞能合成和分泌多种生物活性分子入周边微环境, 包括CgA、5-HT、突触素、神经降压素和神经特异性酯酶. CgA是储存于大多数正常神经内分泌细胞和瘤性神经内分泌细胞分泌囊泡中的可溶性酸性糖蛋白. 某些NENs患者的肿瘤细胞释放异常量CgA入肿瘤微环境从而使得患者血循环中CgA高达100-500 nmol/L[54]. 循环CgA是诊断多种NENs的敏感标记物[55]. CgA及其片段可以影响肿瘤微环境的多种细胞成分, 包括成纤维细胞和内皮细胞. CgA能参与调节多种内皮细胞特征, 如血管渗透, 炎症和血管生成. 系统性给予小鼠低剂量人源性CgA或者由基因工程小鼠肿瘤自身产生的内源性CgA可以阻止肿瘤坏死因子(tumor necrosis factor, TNF)诱导的血管渗透[56]. 4-40 nmol/L的CgA足以在体外抑制TNF所致的内皮细胞通透性增加. CgA是生物活性肽血管生成抑制素I(vasostatin-I, VS-I)的前体, 研究发现VS-I可以在负瘤小鼠体内抑制由VEGF激活的一系列作用, 例如内皮细胞生长、迁移、新生血管萌芽和毛细血管样结构形成, 这提示VS-I具有抗血管生成作用[57]. CgA通过与纤溶酶原/纤溶酶系统之间的相互作用而调控肿瘤微环境当中成纤维细胞的黏附及功能. 例如, 从人嗜铬细胞瘤分离得到的CgA能抑制人和鼠成纤维细胞黏附至由胶原蛋白Ⅰ、胶原蛋白Ⅳ、纤连蛋白或小牛血清包被的培养皿. 用血纤维蛋白溶酶水解CgA之后能明显减少其在纤连蛋白依赖性成纤维细胞黏附试验中的抗黏附活性, 此现象与CgA经蛋白水解之后释放促成纤维细胞黏附片段VS-I有关[58].
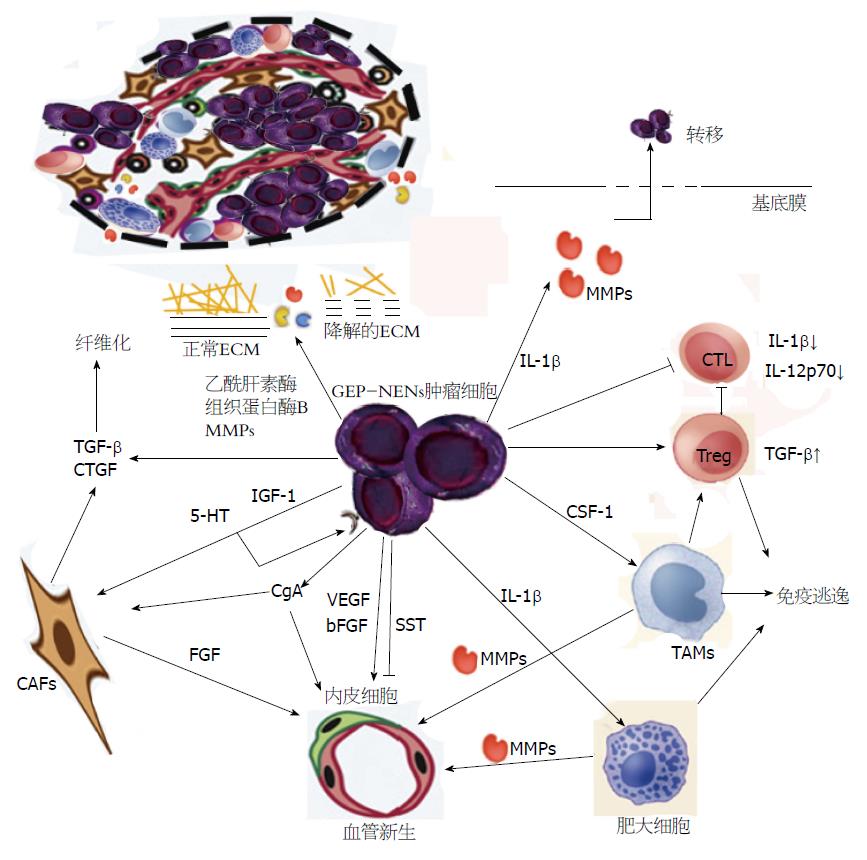
GEP-NENs肿瘤微环境当中的肿瘤细胞、基质组织和细胞外基质间存在着丰富而复杂的相互作用. 凭借于这些精密调控的相互作用, GEP-NENs肿瘤细胞获得恶性转化能力, 并且塑造了利于肿瘤生长转移的周边环境. CAFs参与GEP-NENs肿瘤组织纤维化过程; 免疫炎症细胞亚群之间的相互制衡使得GEP-NENs肿瘤细胞免受宿主的免疫攻击; 内皮细胞在各种细胞因子的作用下发生迁移并促进微环境内血管新生; GEP-NENs肿瘤细胞依赖于基质降解酶重塑细胞外基质, 借此获得生长转移的优势微环境; 基质中的可溶性生长因子与肿瘤微环境中各类细胞的表面受体结合而影响GEP-NENs肿瘤细胞生长、转移和分泌(图2). 尽管, 关于GEP-NENs肿瘤微环境的研究不少, 但是微环境当中仍有许多的细胞、细胞表面受体、可溶性分子等没有得到充分的研究, 特别是其中的相应机制不甚明确. 目前许多研究发现和验证GEP-NENs肿瘤微环境中的治疗靶点, 但肿瘤微环境复杂多变且异质性高, 它们的临床应用价值有待进一步商榷. 对于肿瘤微环境的充分理解将会引导人们将目光投放于与肿瘤密不可分的周边微环境, 这将为GEP-NENs的治疗提供新的线索和思路.
神经内分泌肿瘤是起源于人体弥散神经内分泌系统的异质性肿瘤, 多发生于消化系统, 即胃肠胰神经内分泌肿瘤(gastroenteropancreatic neuroendocrine neoplasms, GEP-NENs). GEP-NENs的发病机制仍不清楚. 肿瘤与其周围微环境之间存在紧密的相互作用. 肿瘤细胞通过细胞外信号分子影响微环境, 反过来微环境中各成分也可影响肿瘤生长和转移. 了解GEP-NENs肿瘤微环境对探究其发病机制具有重要作用.
研究发现, GEP-NENs内部微血管高度增生, 而靶向抑制血管内皮生长因子受体的酪氨酸激酶抑制剂舒尼替尼已被用于临床治疗胰腺神经内分泌肿瘤(pancreatic neuroendocrine neoplasms, pNENs). 但是抗血管新生的靶向治疗常激活肿瘤局部的缺氧应激表达网络, 包括大量促血管生成因子的释放, 从而引起耐药性.
鉴于GEP-NENs肿瘤组织高度血管化, 抑制血管新生成为GEP-NENs主要的靶向治疗方向. 新型酪氨酸激酶抑制剂能抑制GEP-NENs微环境中肥大细胞脱颗粒而瓦解微血管网络, 也许能成为新的靶向治疗药物. 肿瘤相关巨噬细胞可以预测非功能性pNENs患者术后复发, 可以指导患者随访.
本文较全面地介绍了GEP-NENs的肿瘤微环境, 包括肿瘤微环境中的主要细胞成分、细胞外基质、相关生长因子和嗜铬粒蛋白等. 并且结合前期的高通量测序结果, 阐述了细胞外基质重塑在GEP-NENs发病中的作用.
本文首次系统全面地从肿瘤微环境的角度探讨GEP-NENs的发病机制. 在基础研究、临床试验数据基础上, 详细介绍了肿瘤微环境中各成分之间的相互作用. 这对于科研人员探寻GEP-NENs的发病机制具有一定指导意义.
转录组: 某一生理条件下, 细胞内所有转录产物的集合, 包括信使RNA、非编码RNA、核糖体RNA及转运RNA. 转录组是连接基因组遗传信息与体现生物功能的蛋白质组之间的纽带. 高通量转录组测序可以了解某一物种在某一状态下特定组织或器官内存在的几乎所有转录本的序列信息, 广泛应用于基础研究、临床诊断等领域.
陈淑珍, 研究员, 中国医学科学院北京协和医学院医药生物技术研究所中国协和医科大学, 中国医学科学院医药生物技术研究所肿瘤室; 田华, 副教授, 上海交通大学医学院附属仁济医院上海市肿瘤研究所; 周福有, 教授, 主任医师, 安阳市肿瘤医院胸外科
本文对胃肠胰神经内分泌肿瘤的肿瘤微环境进行了综述, 主要介绍了微环境中的细胞成分及分泌蛋白等, 对从事该研究的科研人员具有一定的参考意义.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 江苏省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): 0
编辑:马亚娟 电编:杜冉冉
| 1. | Witz IP. The tumor microenvironment: the making of a paradigm. Cancer Microenviron. 2009;2 Suppl 1:9-17. [PubMed] [DOI] |
| 2. | Spaw M, Anant S, Thomas SM. Stromal contributions to the carcinogenic process. Mol Carcinog. 2017;56:1199-1213. [PubMed] [DOI] |
| 3. | Vinik AI, Chaya C. Clinical Presentation and Diagnosis of Neuroendocrine Tumors. Hematol Oncol Clin North Am. 2016;30:21-48. [PubMed] [DOI] |
| 4. | Yao JC, Hassan M, Phan A, Dagohoy C, Leary C, Mares JE, Abdalla EK, Fleming JB, Vauthey JN, Rashid A. One hundred years after "carcinoid": epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States. J Clin Oncol. 2008;26:3063-3072. [PubMed] [DOI] |
| 5. | Kidd M, Schimmack S, Lawrence B, Alaimo D, Modlin IM. EGFR/TGFα and TGFβ/CTGF Signaling in Neuroendocrine Neoplasia: Theoretical Therapeutic Targets. Neuroendocrinology. 2013;97:35-44. [PubMed] [DOI] |
| 6. | Shiga K, Hara M, Nagasaki T, Sato T, Takahashi H, Takeyama H. Cancer-Associated Fibroblasts: Their Characteristics and Their Roles in Tumor Growth. Cancers (Basel). 2015;7:2443-2458. [PubMed] [DOI] |
| 7. | Mukaida N, Sasaki S. Fibroblasts, an inconspicuous but essential player in colon cancer development and progression. World J Gastroenterol. 2016;22:5301-5316. [PubMed] [DOI] |
| 8. | Svejda B, Kidd M, Giovinazzo F, Eltawil K, Gustafsson BI, Pfragner R, Modlin IM. The 5-HT(2B) receptor plays a key regulatory role in both neuroendocrine tumor cell proliferation and the modulation of the fibroblast component of the neoplastic microenvironment. Cancer. 2010;116:2902-2912. [PubMed] [DOI] |
| 9. | Beauchamp RD, Coffey RJ Jr, Lyons RM, Perkett EA, Townsend CM Jr, Moses HL. Human carcinoid cell production of paracrine growth factors that can stimulate fibroblast and endothelial cell growth. Cancer Res. 1991;51:5253-5260. [PubMed] |
| 10. | Banat GA, Tretyn A, Pullamsetti SS, Wilhelm J, Weigert A, Olesch C, Ebel K, Stiewe T, Grimminger F, Seeger W. Immune and Inflammatory Cell Composition of Human Lung Cancer Stroma. PLoS One. 2015;10:e0139073. [PubMed] [DOI] |
| 11. | Wang H, Chen L. Tumor microenviroment and hepatocellular carcinoma metastasis. J Gastroenterol Hepatol. 2013;28 Suppl 1:43-48. [PubMed] [DOI] |
| 12. | DeNardo DG, Andreu P, Coussens LM. Interactions between lymphocytes and myeloid cells regulate pro- versus anti-tumor immunity. Cancer Metastasis Rev. 2010;29:309-316. [PubMed] [DOI] |
| 13. | Keskinov AA, Shurin MR. Myeloid regulatory cells in tumor spreading and metastasis. Immunobiology. 2015;220:236-242. [PubMed] [DOI] |
| 14. | Casanovas O, Hicklin DJ, Bergers G, Hanahan D. Drug resistance by evasion of antiangiogenic targeting of VEGF signaling in late-stage pancreatic islet tumors. Cancer Cell. 2005;8:299-309. [PubMed] [DOI] |
| 15. | Frydrychowicz M, Boruczkowski M, Kolecka-Bednarczyk A, Dworacki G. The dual role of Treg in cancer. Scand J Immunol. 2017; Sep 23. [Epub ahead of print]. [PubMed] [DOI] |
| 16. | Vikman S, Sommaggio R, De La Torre M, Oberg K, Essand M, Giandomenico V, Loskog A, Totterman TH. Midgut carcinoid patients display increased numbers of regulatory T cells in peripheral blood with infiltration into tumor tissue. Acta Oncol. 2009;48:391-400. [PubMed] [DOI] |
| 17. | de Souza Junior DA, Santana AC, da Silva EZ, Oliver C, Jamur MC. The Role of Mast Cell Specific Chymases and Tryptases in Tumor Angiogenesis. Biomed Res Int. 2015;2015:142359. [PubMed] [DOI] |
| 18. | Krystel-Whittemore M, Dileepan KN, Wood JG. Mast Cell: A Multi-Functional Master Cell. Front Immunol. 2016;6:620. [PubMed] [DOI] |
| 19. | Soucek L, Buggy JJ, Kortlever R, Adimoolam S, Monclús HA, Allende MT, Swigart LB, Evan GI. Modeling pharmacological inhibition of mast cell degranulation as a therapy for insulinoma. Neoplasia. 2011;13:1093-1100. [PubMed] [DOI] |
| 20. | Rhee I. Diverse macrophages polarization in tumor microenvironment. Arch Pharm Res. 2016;39:1588-1596. [PubMed] [DOI] |
| 21. | Pyonteck SM, Gadea BB, Wang HW, Gocheva V, Hunter KE, Tang LH, Joyce JA. Deficiency of the macrophage growth factor CSF-1 disrupts pancreatic neuroendocrine tumor development. Oncogene. 2012;31:1459-1467. [PubMed] [DOI] |
| 22. | Wei IH, Harmon CM, Arcerito M, Cheng DF, Minter RM, Simeone DM. Tumor-associated macrophages are a useful biomarker to predict recurrence after surgical resection of nonfunctional pancreatic neuroendocrine tumors. Ann Surg. 2014;260:1088-1094. [PubMed] [DOI] |
| 23. | Loges S, Mazzone M, Hohensinner P, Carmeliet P. Silencing or fueling metastasis with VEGF inhibitors: antiangiogenesis revisited. Cancer Cell. 2009;15:167-170. [PubMed] [DOI] |
| 24. | Maishi N, Hida K. Tumor endothelial cells accelerate tumor metastasis. Cancer Sci. 2017;108:1921-1926. [PubMed] [DOI] |
| 25. | Forster JC, Harriss-Phillips WM, Douglass MJ, Bezak E. A review of the development of tumor vasculature and its effects on the tumor microenvironment. Hypoxia (Auckl). 2017;5:21-32. [PubMed] [DOI] |
| 26. | Marion-Audibert AM, Barel C, Gouysse G, Dumortier J, Pilleul F, Pourreyron C, Hervieu V, Poncet G, Lombard-Bohas C, Chayvialle JA. Low microvessel density is an unfavorable histoprognostic factor in pancreatic endocrine tumors. Gastroenterology. 2003;125:1094-1104. [PubMed] [DOI] |
| 27. | Couvelard A, O'Toole D, Turley H, Leek R, Sauvanet A, Degott C, Ruszniewski P, Belghiti J, Harris AL, Gatter K. Microvascular density and hypoxia-inducible factor pathway in pancreatic endocrine tumours: negative correlation of microvascular density and VEGF expression with tumour progression. Br J Cancer. 2005;92:94-101. [PubMed] [DOI] |
| 28. | Takahashi Y, Akishima-Fukasawa Y, Kobayashi N, Sano T, Kosuge T, Nimura Y, Kanai Y, Hiraoka N. Prognostic value of tumor architecture, tumor-associated vascular characteristics, and expression of angiogenic molecules in pancreatic endocrine tumors. Clin Cancer Res. 2007;13:187-196. [PubMed] [DOI] |
| 29. | Inoue M, Hager JH, Ferrara N, Gerber HP, Hanahan D. VEGF-A has a critical, nonredundant role in angiogenic switching and pancreatic beta cell carcinogenesis. Cancer Cell. 2002;1:193-202. [PubMed] [DOI] |
| 30. | Capozzi M, VON Arx C, DE Divitiis C, Ottaiano A, Tatangelo F, Romano GM, Tafuto S; (On behalf of ENETS Center of Excellence Multidisciplinary Group for Neuroendocrine Tumors in Naples, Italy). Antiangiogenic Therapy in Pancreatic Neuroendocrine Tumors. Anticancer Res. 2016;36:5025-5030. [PubMed] [DOI] |
| 31. | Villaume K, Blanc M, Gouysse G, Walter T, Couderc C, Nejjari M, Vercherat C, Cordier-Bussat M, Roche C, Scoazec JY. VEGF secretion by neuroendocrine tumor cells is inhibited by octreotide and by inhibitors of the PI3K/AKT/mTOR pathway. Neuroendocrinology. 2010;91:268-278. [PubMed] [DOI] |
| 32. | Pietras K, Hanahan D. A multitargeted, metronomic, and maximum-tolerated dose "chemo-switch" regimen is antiangiogenic, producing objective responses and survival benefit in a mouse model of cancer. J Clin Oncol. 2005;23:939-952. [PubMed] [DOI] |
| 33. | Yao VJ, Sennino B, Davis RB, Christensen J, Hu-Lowe D, Roberts G, McDonald DM. 78 POSTER Combined anti-VEGFR and anti-PDGFR actions of sunitinib on blood vessels in preclinical tumor models. EJC Suppl. 2006;4:27-28. [DOI] |
| 34. | Raymond E, Dahan L, Raoul JL, Bang YJ, Borbath I, Lombard-Bohas C, Valle J, Metrakos P, Smith D, Vinik A. Sunitinib malate for the treatment of pancreatic neuroendocrine tumors. N Engl J Med. 2011;364:501-513. [PubMed] [DOI] |
| 35. | Carmeliet P. Angiogenesis in life, disease and medicine. Nature. 2005;438:932-936. [PubMed] [DOI] |
| 36. | Pàez-Ribes M, Allen E, Hudock J, Takeda T, Okuyama H, Viñals F, Inoue M, Bergers G, Hanahan D, Casanovas O. Antiangiogenic therapy elicits malignant progression of tumors to increased local invasion and distant metastasis. Cancer Cell. 2009;15:220-231. [PubMed] [DOI] |
| 37. | Oberg K, Casanovas O, Castaño JP, Chung D, Delle Fave G, Denèfle P, Harris P, Khan MS, Kulke MH, Scarpa A. Molecular pathogenesis of neuroendocrine tumors: implications for current and future therapeutic approaches. Clin Cancer Res. 2013;19:2842-2849. [PubMed] [DOI] |
| 38. | Abraham JA, Mergia A, Whang JL, Tumolo A, Friedman J, Hjerrild KA, Gospodarowicz D, Fiddes JC. Nucleotide sequence of a bovine clone encoding the angiogenic protein, basic fibroblast growth factor. Science. 1986;233:545-548. [PubMed] [DOI] |
| 39. | Walter T, Hommell-Fontaine J, Gouysse G, Pourreyron C, Nejjari M, Villaume K, Causeret S, Hervieu V, Poncet G, Roche C. Effects of somatostatin and octreotide on the interactions between neoplastic gastroenteropancreatic endocrine cells and endothelial cells: a comparison between in vitro and in vivo properties. Neuroendocrinology. 2011;94:200-208. [PubMed] [DOI] |
| 40. | Li SC, Martijn C, Cui T, Essaghir A, Luque RM, Demoulin JB, Castaño JP, Öberg K, Giandomenico V. The somatostatin analogue octreotide inhibits growth of small intestine neuroendocrine tumour cells. PLoS One. 2012;7:e48411. [PubMed] [DOI] |
| 41. | Koizumi M, Onda M, Tanaka N, Seya T, Yamada T, Takahashi Y. Antiangiogenic effect of octreotide inhibits the growth of human rectal neuroendocrine carcinoma. Digestion. 2002;65:200-206. [PubMed] [DOI] |
| 42. | Insua-Rodríguez J, Oskarsson T. The extracellular matrix in breast cancer. Adv Drug Deliv Rev. 2016;97:41-55. [PubMed] [DOI] |
| 43. | Jabłońska-Trypuć A, Matejczyk M, Rosochacki S. Matrix metalloproteinases (MMPs), the main extracellular matrix (ECM) enzymes in collagen degradation, as a target for anticancer drugs. J Enzyme Inhib Med Chem. 2016;31:177-183. [PubMed] [DOI] |
| 44. | Hunter KE, Palermo C, Kester JC, Simpson K, Li JP, Tang LH, Klimstra DS, Vlodavsky I, Joyce JA. Heparanase promotes lymphangiogenesis and tumor invasion in pancreatic neuroendocrine tumors. Oncogene. 2014;33:1799-1808. [PubMed] [DOI] |
| 45. | Shchors K, Nozawa H, Xu J, Rostker F, Swigart-Brown L, Evan G, Hanahan D. Increased invasiveness of MMP-9-deficient tumors in two mouse models of neuroendocrine tumorigenesis. Oncogene. 2013;32:502-513. [PubMed] [DOI] |
| 46. | Zitzmann K, De Toni EN, Brand S, Göke B, Meinecke J, Spöttl G, Meyer HH, Auernhammer CJ. The novel mTOR inhibitor RAD001 (everolimus) induces antiproliferative effects in human pancreatic neuroendocrine tumor cells. Neuroendocrinology. 2007;85:54-60. [PubMed] [DOI] |
| 47. | Wimmel A, Wiedenmann B, Rosewicz S. Autocrine growth inhibition by transforming growth factor beta-1 (TGFbeta-1) in human neuroendocrine tumour cells. Gut. 2003;52:1308-1316. [PubMed] [DOI] |
| 48. | Kidd M, Modlin IM, Pfragner R, Eick GN, Champaneria MC, Chan AK, Camp RL, Mane SM. Small bowel carcinoid (enterochromaffin cell) neoplasia exhibits transforming growth factor-beta1-mediated regulatory abnormalities including up-regulation of C-Myc and MTA1. Cancer. 2007;109:2420-2431. [PubMed] [DOI] |
| 49. | Zhang L, Sato E, Amagasaki K, Nakao A, Naganuma H. Participation of an abnormality in the transforming growth factor-beta signaling pathway in resistance of malignant glioma cells to growth inhibition induced by that factor. J Neurosurg. 2006;105:119-128. [PubMed] [DOI] |
| 50. | Leu FP, Nandi M, Niu C. The effect of transforming growth factor beta on human neuroendocrine tumor BON cell proliferation and differentiation is mediated through somatostatin signaling. Mol Cancer Res. 2008;6:1029-1042. [PubMed] [DOI] |
| 51. | von Wichert G, Jehle PM, Hoeflich A, Koschnick S, Dralle H, Wolf E, Wiedenmann B, Boehm BO, Adler G, Seufferlein T. Insulin-like growth factor-I is an autocrine regulator of chromogranin A secretion and growth in human neuroendocrine tumor cells. Cancer Res. 2000;60:4573-4581. [PubMed] |
| 52. | Siddique ZL, Drozdov I, Floch J, Gustafsson BI, Stunes K, Pfragner R, Kidd M, Modlin IM. KRJ-I and BON cell lines: defining an appropriate enterochromaffin cell neuroendocrine tumor model. Neuroendocrinology. 2009;89:458-470. [PubMed] [DOI] |
| 53. | Syder AJ, Karam SM, Mills JC, Ippolito JE, Ansari HR, Farook V, Gordon JI. A transgenic mouse model of metastatic carcinoma involving transdifferentiation of a gastric epithelial lineage progenitor to a neuroendocrine phenotype. Proc Natl Acad Sci USA. 2004;101:4471-4476. [PubMed] [DOI] |
| 54. | O'Connor DT, Deftos LJ. Secretion of chromogranin A by peptide-producing endocrine neoplasms. N Engl J Med. 1986;314:1145-1151. [PubMed] [DOI] |
| 55. | Tőke J, Czirják G, Tóth M, Rácz K, Patócs A. Significance of biochemical markers in the diagnosis of neuroendocrine tumours and for the follow-up of patients. Orv Hetil. 2014;155:1775-1782. [PubMed] [DOI] |
| 56. | Ferrero E, Scabini S, Magni E, Foglieni C, Belloni D, Colombo B, Curnis F, Villa A, Ferrero ME, Corti A. Chromogranin A protects vessels against tumor necrosis factor alpha-induced vascular leakage. FASEB J. 2004;18:554-556. [PubMed] [DOI] |
| 57. | Belloni D, Scabini S, Foglieni C, Veschini L, Giazzon A, Colombo B, Fulgenzi A, Helle KB, Ferrero ME, Corti A. The vasostatin-I fragment of chromogranin A inhibits VEGF-induced endothelial cell proliferation and migration. FASEB J. 2007;21:3052-3062. [PubMed] [DOI] |
| 58. | Colombo B, Longhi R, Marinzi C, Magni F, Cattaneo A, Yoo SH, Curnis F, Corti A. Cleavage of chromogranin A N-terminal domain by plasmin provides a new mechanism for regulating cell adhesion. J Biol Chem. 2002;277:45911-45919. [PubMed] [DOI] |