修回日期: 2016-07-28
接受日期: 2016-08-07
在线出版日期: 2016-09-08
探索紫草素对刀豆蛋白A(concanavalin A, Con A)诱导的急性肝损伤的保护作用及其可能机制.
通过尾静脉注射Con A建立急性肝损伤模型. 小鼠随机分为正常组、肝损伤模型组、紫草素低剂量组(12.5 mg/kg)、紫草素中剂量组(25 mg/kg)、紫草素高剂量组(50 mg/kg), 共计5个分组. 检测不同分组之间的谷丙转氨酶(alanine transaminase, ALT)、谷草转氨酶(aspartate transaminase, AST)水平; HE染色比较不同分组之间的病理改变; 一氧化氮检测试剂盒检测不同分组之间的一氧化氮水平; Western blot测定一氧化氮合酶(inducible nitric oxide synthase, iNOS)、核因子-κB(nuclear factor-κB, NF-κB)、IκBα和IκBβ的表达.
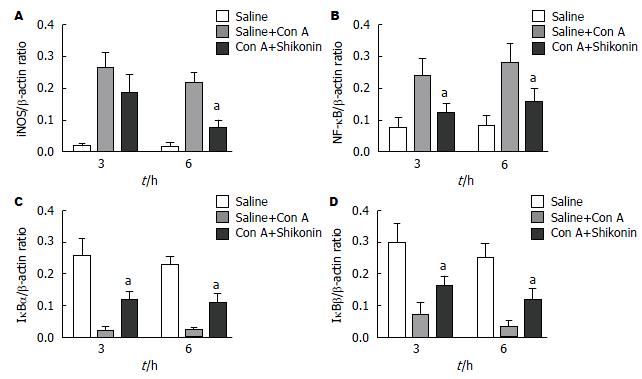
与正常组相比, 模型组中血清中的ALT和AST水平显著升高(P<0.05); 模型组肝组织坏死明显, 坏死率差异具有统计学意义; 模型组肝组织中NO的合成增多(P<0.05); 模型组肝组织中iNOS和NF-κB表达增多, IκBα和IκBβ的表达减少. 与模型组相比, 紫草素(50 mg/kg)显著降低小鼠血清中的ALT和AST水平, 并减少肝细胞坏死率; 同时减少iNOS和NF-κB表达, IκBα和IκBβ的表达则增多. 低剂量组(12.5 mg/kg)和中剂量组(25 mg/kg)与模型组比较无统计学差异.
紫草素(50 mg/kg)可以显著改善Con A诱导的急性肝损伤, 且可能是通过抑制NF-κB信号通路激活, 进而减少NO合成来实现的.
核心提要: 紫草素可能是通过抑制核因子-κB(nuclear factor-κB, NF-κB)信号通路激活, 进而减少一氧化氮合酶表达和一氧化氮合成来改善刀豆蛋白A(concanavalin A, Con A)诱导的急性肝损伤.
引文著录: 沈淼. 紫草素对刀豆蛋白A诱导的急性肝损伤的作用及初步机制. 世界华人消化杂志 2016; 24(25): 3689-3695
Revised: July 28, 2016
Accepted: August 7, 2016
Published online: September 8, 2016
To investigate the effect of shikonin on concanavalin A (Con A)-induced acute liver injury in mice and explore the underlying mechanisms.
Acute liver injury was induced by Con A in Balb/c mice through tail injection. The mice were randomly divided into five groups of fourteen mice as follows: (1) normal group; (2) Con A-induced model group; (3) low-dose (12.5 mg/kg) shikonin + Con A group; (4) medium-dose (25 mg/kg) shikonin + Con A group; (5) high-dose (50 mg/kg) shikonin + Con A group. Histological grading and the measurement of the levels of alanine transaminase (ALT), aspartate transaminase (AST), nitric oxide (NO), inducible nitric oxide synthase (iNOS), nuclear factor-κB (NF-κB), IκBα and IκBβ were performed.
Compared to the normal group, the histological grade as well as the levels of ALT, AST, NO, iNOS and NF-κB significantly increased in the model group, but the levels of IκBα and IκBβ were decreased. After shikonin (50 mg/kg) treatment, the histological grade and the levels of ALT, AST, NO, iNOS and NF-κB significantly were decreased, and the levels of IκBα and IκBβ were increased. The doses of 12.5 mg/kg and 25 mg/kg worked inefficiently.
Shikonin (50 mg/kg) protects against Con A-induced liver injury by decreasing the level of NO, which may correlate with the amelioration of NF-κB activity.
- Citation: Shen M. Effect of shikonin on concanavalin A-induced liver injury and possible mechanisms involved. Shijie Huaren Xiaohua Zazhi 2016; 24(25): 3689-3695
- URL: https://www.wjgnet.com/1009-3079/full/v24/i25/3689.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i25.3689
急性肝损伤可以由各种原因导致, 包括药物, 病毒, 酒精, 高脂饮食和射线等等. 目前来说, 肝脏疾病仍然是一个全球性的问题, 因急性肝损伤所引起的死亡率仍然较高[1,2]. 因此, 迫切需要寻求更多的药物来改善各种原因引起的肝损伤. 同时在发病机制方面, 大量研究表明, 多种炎症因子和调控通路在急性肝损伤的进展中起着重要的角色, 如白介素(interleukin, IL)-1, IL-2, IL-6, 一氧化氮合酶(inducible nitric oxide synthase, iNOS)分子和核因子-κB(nuclear factor-κB, NF-κB)信号通路等[3-7]. 紫草素, 提取于紫草, 是一种脂溶性很强的萘醌类色素, 分子式为C16H16O5, 具有多种特性, 包括抗、抗氧化、抗肿瘤、抗细菌和组织修复等[8,9]. 近几年来, 紫草素的抗炎效果在多种炎症动物模型中被证实, 同时其可能的抗炎机制也通过体外模型逐步被发现[10-13]. 这些动物模型包括有关节炎、胰腺炎、急性肺损伤和脑缺血再灌注损伤等, 比如在2009年, Dai等[14]发现紫草素可以改善自身免疫性关节炎. 内毒素所诱导的急性肺损伤可以被紫草素改善, 这一作用也在2013年被科学家证实[15]. 同样的, 也有研究指出紫草素可以通过抑制NF-κB途径来改善雨蛙素所诱导的急性胰腺炎[16]. 总而言之, 紫草素的抗炎作用被越来越多的人所熟知, 但其在急性肝损伤中的作用及相关机制尚未有报道. 本实验主要针对不同浓度紫草素对刀豆蛋白A(concanavalin A, Con A)诱导的急性肝损伤的作用及可能机制进行研究.
♂Balb/c小鼠(6-8 wk, 20-21 g)均购自上海斯莱克动物实验有限公司(上海, 中国). 自由饮食, 饲养环境温度控制在25 ℃. 12 h光照周期. 紫草素(纯度>95%)和Con A购自Sigma-Aldrich(St. Louis, MO, United States). 紫草素和Con A均被保存在4 ℃. 小鼠天冬氨酸氨基转移酶(aspartate transaminase, AST)ELISA试剂盒、小鼠谷丙转氨酶(alanine transaminase, ALT)ELISA试剂盒和一氧化氮检测试剂盒均购自上海江莱生物科技有限公司. 相关抗体包括NF-κB、IκBα、IκBβ、iNOS和β-actin均购自Cell Signaling Technology Inc.(Beverly, MA, United States).
1.2.1 动物处理: 小鼠随机分为以下5组, 每组14只. 分组如下, 第1组: 正常组(saline组); 第2组: Con A模型组; 第3组: 紫草素(12.5 mg/kg)+Con A组; 第4组: 紫草素(25 mg/kg)+Con A组; 第5组: 紫草素(50 mg/kg)+Con A组. 实验前2 wk开始将紫草素溶解在花生油中, 设定3个剂量浓度, 分别为12.5、25和50 mg/kg, 通过灌胃的方式预保护小鼠, 每天1次. 正常组和Con A模型组给予同等剂量花生油灌胃. 灌服14 d结束后1 h除正常对照组外各组小鼠均尾静脉注射Con A溶液, 剂量为20 mg/kg, 正常对照组小鼠尾静脉注射同剂量生理盐水. 小鼠分别在Con A注射后3和6 h后进行去眼球采血, 静置2 h后, 3000 r/min, 离心15 min, 取血清保存于-20 ℃冰箱中, 以备测定ALT、AST; 各组小鼠均处死并取肝左叶以液氮速冻后保存于-80 ℃冰箱中, 以备NF-κB、IκB-α、IκB-β和iNOS检测. 取肝右叶置于40 g/L多聚甲醛4 ℃下固定, 用于HE染色.
1.2.2 生化分析: 取小鼠血清, 按试剂盒说明测定血清中AST、ALT含量. NO的测定也按照试剂盒说明书进行操作, 简言之, 精确称取肝组织100 g, 提取总蛋白, 定蛋白含量后, 测定NO水平, 并以每个样品蛋白含量进行含量校正.
1.2.3 病理学检测: 小鼠肝脏组织分离得到后在40 g/L甲醛中固定24 h. 完成的组织蜡块用切片机切成5 μm厚的切片. 切片经HE染色后在光镜下观察. 其中坏死区域面积用Image-pro Plus6.0软件进行定量分析.
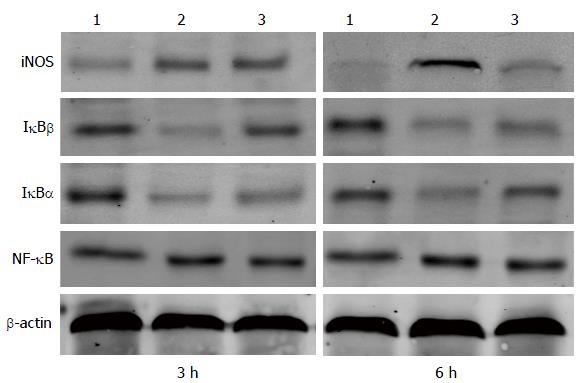
1.2.4 Western blot分析: 将储存在-80 ℃的肝组织解冻, 使用蛋白提取试剂盒获得总蛋白. 通过BCA法检测蛋白浓度, 将不同分组间等量的蛋白量加入胶孔内, 经浓缩胶和分离胶分离后, 转膜至PVDF膜上. 转膜完毕后, 非结合位点用5%牛奶进行封闭1 h, 后用相应抗体孵育过夜, 浓度分别为NF-κB(1:500), IκBα(1:500), IκBβ(1:500)和iNOS(1:500). 在第2天, 所有膜用PBST清洗3次, 每次5 min. 洗毕后, 所有膜用PBST清洗3次, 然后用对应二抗孵育1 h. 洗去二抗后, 予曝光. 用凝胶成像分析系统对NF-κB、IκBα、IκBβ和iNOS蛋白条带与相应得内参造β-actin条带进行灰度扫描, 以两者扫描强度比值作为各目标蛋白的相对表达量.
统计学处理 实验数据利用SPSS17.0软件分析. 实验结果均以mean±SD表示. 各组间比较采用方差分析, P<0.05差异有统计学意义.
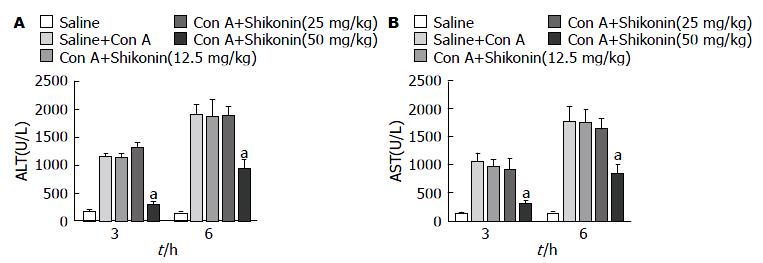
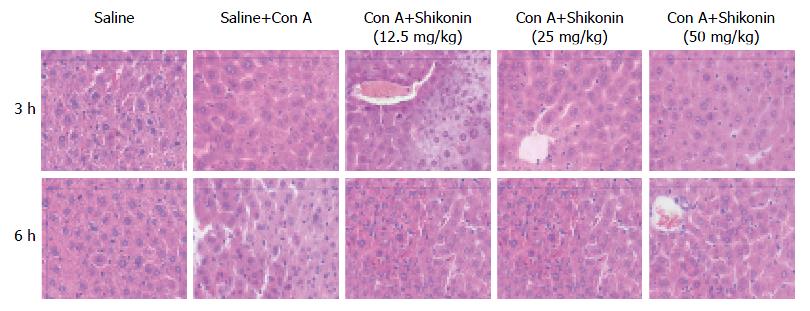
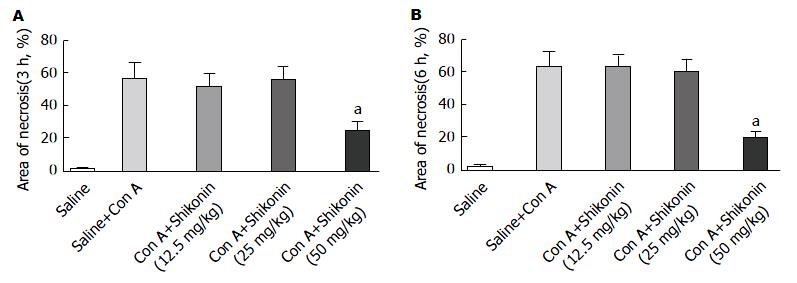
如表1, 图1所显示, 在3 h和6 h两个时间点上, 模型组的ALT和AST水平较正常组明显升高, 表明Con A诱导的急性肝损伤模型建立成功. 同时, 我们发现在紫草素(50 mg/kg)处理分组中, 两个时间点的ALT和AST水平较模型组有明显下降(P<0.05), 但在12.5 mg/kg和25 mg/kg两个分组中则不明显. 其次我们通过HE染色的方式比较不同分组的病理表现, 如图2. 我们发现在正常组中, 肝细胞以中央静脉为中心呈放射状排列, 细胞界限清晰, 细胞核明显, 结构正常. 在模型组中, 肝细胞肿胀明显并且散乱分布, 存在大量炎性细胞浸润, 小叶中可见大面积片状坏死. 而在紫草素(50 mg/kg)处理组中, 这些表现明显改善, 坏死面积较正常组显著减少, 具有统计学意义. 但在12.5 mg/kg和25 mg/kg两个分组中, 该差异无统计学意义(图3).
| 分组 | ALT | AST |
| 3 h | ||
| 正常组 | 161.33±12.33 | 120.35±11.21 |
| Con A模型组 | 1143.67±65.11 | 1040.65±125.31 |
| Con A+紫草素(12.5 mg/kg) | 1114.67±92.17 | 948.86±116.76 |
| Con A+紫草素(25 mg/kg) | 1296.25±89.63 | 902.17±210.16 |
| Con A+紫草素(50 mg/kg) | 299.54±15.63 | 299.84±19.10 |
| 6 h | ||
| 正常组 | 123.58±11.21 | 119.44±10.56 |
| Con A模型组 | 1900.33±186.31 | 1753.36±226.33 |
| Con A+紫草素(12.5 mg/kg) | 1848.13±251.41 | 1738.24±211.77 |
| Con A+紫草素(25 mg/kg) | 1870.53±200.56 | 1618.21±209.98 |
| Con A+紫草素(50 mg/kg) | 928.11±126.37 | 820.11±190.19 |
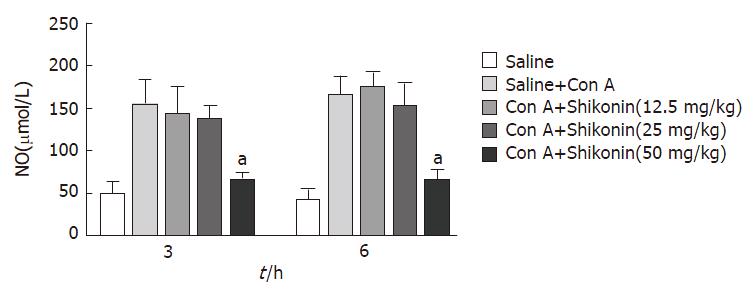
我们发现在模型组中, NO的水平较正常组明显上升, 具有统计学意义. 但在两个低剂量紫草素组中, NO水平无明显改变(图4). 同样的, 我们用Western bolt的方法检测iNOS在肝组织中的表达, 发现经紫草素(50 mg/kg)后, 肝组织中的iNOS水平被明显下调, 具有统计学差异, 两个低剂量组则不明显(图5, 6).
作为一种传统中草药紫草的提取物, 紫草素具有抗炎活性. 其抗炎活性已在多种疾病模型中得到证实[17,18], 但其在Con A诱导的急性肝损伤疾病模型中的作用尚未被报道. 本实验中, 通过检测不同分组中血清ALT和AST水平及观察病理改变, 发现紫草素(50 mg/kg)可以显著降低ALT和AST水平, 同时减少肝细胞坏死比例, 由此可见, 紫草素可以有效地改善Con A诱导的急性肝损伤.
NO是一个多功能分子, 在炎症性损伤中起着重要作用[19-22]. 正常情况下, 肝脏仅由结构型NOS即eNOS诱导产生低水平NO, 作为肝脏微循环功能调节的重要信使; 但是, 在氧化应激状态下, 诱生型NOS即iNOS激活, 持续大量的NO被合成、释放, 具有显著肝细胞毒作用, 是使肝细胞产生氧化应激的关键分子之一, 是多种类型肝损伤炎症、感染发生、发展过程的重要促进和效应因子[23-25]. 近来, Koerber等[26]通过Con A来诱导急性肝损伤, 发现敲除iNOS基因的小鼠相较于正常小鼠有显著好转. 同时, 多种药物或者复合物已被证实可以通过这条途径来改善急性肝损伤, 比如甘草苷和水飞蓟宾[27]. 可见, 通过抑制一氧化氮的合成或许是改善Con A诱导的急性肝损伤的一条重要途径. 因此, 我们设想紫草素作为一种抗炎药物, 是否可以通过抑制iNOS表达, 从而减少NO合成, 达到改善肝损伤的作用. 在本实验中, 如前文所述结果, Con A诱导的肝损伤模型中, 小鼠肝脏iNOS水平和NO合成较正常小鼠明显上升, 但经紫草素后, iNOS水平和NO合成均有所下降, 初步证实了我们的设想.
那么紫草素是如何调控iNOS的表达的呢? 大量研究表明, NF-κB信号通路在各种原因造成的肝损伤中起着重要的作用. 他通过对多种炎症因子转录的调节而参与肝损伤的发生、发展. 有学者研究证明, NF-κB活化可引起TNF-α、iNOS和内皮素的生成增加, 并认为这在Con A引发肝损伤的动态发展过程中起着重要的作用[26,28,29]. 本实验中, 我们设想紫草素是否可以抑制iNOS上游调控通路即NF-κB信号通路来调控iNOS的表达. 结果表明, NF-κB信号通路中的相关蛋白即IκBα和IκBβ经紫草素处理后, 两者的表达较模型组均有所上升, 表明其对NF-κB分子的降解作用被增强, 使NF-κB分子表达降低, 从而NF-κB信号通路被抑制.
总之, 本实验中我们证实紫草素(50 mg/kg)对Con A诱导的急性肝损伤有明显的保肝降酶作用, 且可能是通过抑制NF-κB信号通路激活, 进而降低iNOS表达, 减少NO合成来实现的.
紫草素, 提取于紫草, 是一种脂溶性很强的萘醌类色素, 具有多种特性, 包括抗、抗氧化、抗肿瘤、抗细菌和组织修复等. 近几年来, 紫草素的抗炎效果在多种炎症动物模型中被证实, 但其在急性肝损伤中的作用及相关机制尚未有报道. 本实验主要针对不同浓度紫草素对刀豆蛋白A(concanavalin A, Con A)诱导的急性肝损伤的作用及可能机制进行研究.
沈世强, 教授, 武汉大学人民医院普外科; 苏松, 副教授, 四川医科大学附属医院肝胆外科; 王晓鹏, 副主任医师, 甘肃省人民医院普外科; 张卓, 副教授, 沈阳医学院公共卫生学院营养与食品卫生学教研室
一氧化氮是急性肝损伤发生发展过程中的重要损伤因子. 一氧化氮的合成取决于一氧化氮合酶(inducible nitric oxide synthase, iNOS)的调控和表达. 同时, 在急性肝损伤的炎症反应中, 核因子-κB(nuclear factor-κB, NF-κB)通路起着重要作用, 调控多种炎症因子, 如白介素(interleukin, IL)-2, IL-6, iNOS等的表达.
有报道指出, 在Con A诱导的急性肝损伤模型中, NF-κB信号通路可以调控HMGB1的合成和释放, 进一步调控自噬的发生发展, 这一机制同样在该疾病模型中起着重要作用.
本实验首次证明紫草素可以通过抑制NF-κB信号通路激活, 使iNOS表达和NO合成减少, 从而改善Con A诱导的急性肝损伤.
本文为临床上应用紫草素治疗急性肝损伤提供了一定的实验基础, 探讨紫草素改善急性肝损伤的作用机制, 为后续研究提供了方向.
NF-κB信号通路: 在细胞因子诱导的基因表达中起关键性的调控作用, 他调控的基因编码急性期反应蛋白、细胞因子、细胞黏附因子、免疫调节分子、病毒瘤基因、生长因子、转录和生长调控因子等. 通过调控多种基因的表达, NF-κB参与免疫反应、炎症反应、细胞凋亡、肿瘤发生等多种生物进程.
本文以NF-κB信号通路中的分子表达水平为切入点, 从病理学和生化分析的角度, 研究了紫草素对Con-A诱导的小鼠急性肝损伤的保护作用. 本研究内容较为新颖, 具有较好的科研性和参考价值.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): D, D
E级 (差): 0
编辑:于明茜 电编:李瑞芳
| 1. | Bremer L, Schramm C, Tiegs G. Immunology of hepatic diseases during pregnancy. Semin Immunopathol. 2016; Jun 20. [Epub ahead of print]. [PubMed] [DOI] |
| 2. | Wang S, Pacher P, De Lisle RC, Huang H, Ding WX. A Mechanistic Review of Cell Death in Alcohol-Induced Liver Injury. Alcohol Clin Exp Res. 2016;40:1215-1223. [PubMed] [DOI] |
| 3. | Greuter T, Shah VH. Hepatic sinusoids in liver injury, inflammation, and fibrosis: new pathophysiological insights. J Gastroenterol. 2016;51:511-519. [PubMed] [DOI] |
| 4. | Bedossa P. Histological Assessment of NAFLD. Dig Dis Sci. 2016;61:1348-1355. [PubMed] [DOI] |
| 5. | Arrese M, Cabrera D, Kalergis AM, Feldstein AE. Innate Immunity and Inflammation in NAFLD/NASH. Dig Dis Sci. 2016;61:1294-1303. [PubMed] [DOI] |
| 6. | Tilg H, Moschen AR, Szabo G. Interleukin-1 and inflammasomes in ALD/AAH and NAFLD/NASH. Hepatology. 2016; Jan 16. [Epub ahead of print]. [PubMed] [DOI] |
| 7. | de Andrade KQ, Moura FA, dos Santos JM, de Araújo OR, de Farias Santos JC, Goulart MO. Oxidative Stress and Inflammation in Hepatic Diseases: Therapeutic Possibilities of N-Acetylcysteine. Int J Mol Sci. 2015;16:30269-30308. [PubMed] [DOI] |
| 8. | Chen X, Yang L, Oppenheim JJ, Howard MZ. Cellular pharmacology studies of shikonin derivatives. Phytother Res. 2002;16:199-209. [PubMed] [DOI] |
| 9. | Wang R, Yin R, Zhou W, Xu D, Li S. Shikonin and its derivatives: a patent review. Expert Opin Ther Pat. 2012;22:977-997. [PubMed] [DOI] |
| 10. | Shindo S, Hosokawa Y, Hosokawa I, Ozaki K, Matsuo T. Shikonin Inhibits Inflammatory Cytokine Production in Human Periodontal Ligament Cells. Inflammation. 2016;39:1124-1129. [PubMed] [DOI] |
| 11. | Yang KY, Chen DL. Shikonin Inhibits Inflammatory Response in Rheumatoid Arthritis Synovial Fibroblasts via lncRNA-NR024118. Evid Based Complement Alternat Med. 2015;2015:631737. [PubMed] [DOI] |
| 12. | Gan L, Wang ZH, Zhang H, Zhou R, Sun C, Liu Y, Si J, Liu YY, Wang ZG. Protective effects of shikonin on brain injury induced by carbon ion beam irradiation in mice. Biomed Environ Sci. 2015;28:148-151. [PubMed] [DOI] |
| 13. | Yang Y, Wang J, Yang Q, Wu S, Yang Z, Zhu H, Zheng M, Liu W, Wu W, He J. Shikonin inhibits the lipopolysaccharide-induced release of HMGB1 in RAW264.7 cells via IFN and NF-κB signaling pathways. Int Immunopharmacol. 2014;19:81-87. [PubMed] [DOI] |
| 14. | Dai Q, Fang J, Zhang FS. Dual role of shikonin in early and late stages of collagen type II arthritis. Mol Biol Rep. 2009;36:1597-1604. [PubMed] [DOI] |
| 15. | Bai GZ, Yu HT, Ni YF, Li XF, Zhang ZP, Su K, Lei J, Liu BY, Ke CK, Zhong DX. Shikonin attenuates lipopolysaccharide-induced acute lung injury in mice. J Surg Res. 2013;182:303-311. [PubMed] [DOI] |
| 16. | Xiong J, Ni J, Hu G, Shen J, Zhao Y, Yang L, Shen J, Yin G, Chen C, Yu G. Shikonin ameliorates cerulein-induced acute pancreatitis in mice. J Ethnopharmacol. 2013;145:573-580. [PubMed] [DOI] |
| 17. | Andújar I, Ríos JL, Giner RM, Recio MC. Pharmacological properties of shikonin - a review of literature since 2002. Planta Med. 2013;79:1685-1697. [PubMed] [DOI] |
| 18. | Ghosh N, Ghosh R, Bhat ZA, Mandal V, Bachar SC, Nima ND, Sunday OO, Mandal SC. Advances in herbal medicine for treatment of ischemic brain injury. Nat Prod Commun. 2014;9:1045-1055. [PubMed] |
| 19. | Abu-Amara M, Yang SY, Seifalian A, Davidson B, Fuller B. The nitric oxide pathway--evidence and mechanisms for protection against liver ischaemia reperfusion injury. Liver Int. 2012;32:531-543. [PubMed] [DOI] |
| 20. | Toda N, Toda H, Hatano Y. Anesthetic modulation of immune reactions mediated by nitric oxide. J Anesth. 2008;22:155-162. [PubMed] [DOI] |
| 21. | Payen D, Bernard C, Beloucif S. Nitric oxide in sepsis. Clin Chest Med. 1996;17:333-350. [PubMed] |
| 22. | Brenner C, Galluzzi L, Kepp O, Kroemer G. Decoding cell death signals in liver inflammation. J Hepatol. 2013;59:583-594. [PubMed] [DOI] |
| 23. | Iwakiri Y, Kim MY. Nitric oxide in liver diseases. Trends Pharmacol Sci. 2015;36:524-536. [PubMed] [DOI] |
| 24. | Pan MH, Chiou YS, Tsai ML, Ho CT. Anti-inflammatory activity of traditional Chinese medicinal herbs. J Tradit Complement Med. 2011;1:8-24. [PubMed] [DOI] |
| 25. | Solís Herruzo JA, García Ruiz I, Pérez Carreras M, Muñoz Yagüe MT. Non-alcoholic fatty liver disease. From insulin resistance to mitochondrial dysfunction. Rev Esp Enferm Dig. 2006;98:844-874. [PubMed] [DOI] |
| 26. | Koerber K, Sass G, Kiemer AK, Vollmar AM, Tiegs G. In vivo regulation of inducible no synthase in immune-mediated liver injury in mice. Hepatology. 2002;36:1061-1069. [PubMed] [DOI] |
| 27. | Cho BO, Ryu HW, So Y, Jin CH, Baek JY, Park KH, Byun EH, Jeong IY. Hepatoprotective effect of 2,3-dehydrosilybin on carbon tetrachloride-induced liver injury in rats. Food Chem. 2013;138:107-115. [PubMed] [DOI] |
| 28. | Ma XL, Li YH, Gao JX, Li J, Guo L, Wu CZ. Expression of inducible nitric oxide synthase in the liver is under the control of nuclear factor kappa B in concanavalin A-induced hepatitis. J Gastroenterol Hepatol. 2008;23:e231-e235. [PubMed] [DOI] |
| 29. | Taylor BS, Alarcon LH, Billiar TR. Inducible nitric oxide synthase in the liver: regulation and function. Biochemistry (Mosc). 1998;63:766-781. [PubMed] |