修回日期: 2015-08-12
接受日期: 2015-08-20
在线出版日期: 2015-10-18
目的: 观察内镜黏膜下层剥离术(endoscopic submucosal dissection, ESD)为基础的内镜下切除术在胃固有肌层肿瘤治疗中的安全性及有效性.
方法: 收集江苏省苏北人民医院2013-01/2015-01接受内镜治疗的胃固有肌层肿瘤患者资料, 总结并分析其手术并发症、临床病理及术后随访资料.
结果: 42例患者, 20例接受ESD, 15例接受内镜黏膜下肿瘤挖除(endoscopic submucosal excavation, ESE), 7例接受内镜下胃壁全层切除术(endoscopic full-thickness resection, EFR)治疗. 其中1例因较大穿孔、2例腔内外生长实施腹腔镜修补及辅助全层切除, 1例出现出血, 开腹止血修补, 成功率90.48%. 术后迟发性出血2例, 通过保守治疗恢复, 无迟发性穿孔. EFR组实施胃壁全层切除, 主动穿孔, 并在内镜下完全缝合胃壁缺损. 42例患者术后均接受6-28 mo的随访, 无局部复发及远处转移病例.
结论: 以ESD为基础的内镜切除技术治疗胃固有肌层肿瘤是一种有效的治疗手段, 部分呈腔内外生长的瘤体完整切除需要腹腔镜帮助.
核心提示: 以内镜黏膜下层剥离术(endoscopic submucosal dissection)为基石的内镜下治疗起源于固有肌层的胃肿瘤是一种有效的治疗手段, 部分呈腔内外生长的瘤体的完整切除需要腹腔镜帮助. 内镜治疗胃黏膜下肿瘤(submucosal tumor)存在创伤小, 恢复快, 不影响患者术后生活质量等优势.
引文著录: 石磊, 赵伟, 周宇, 朱海杭, 王昊, 陈平. 内镜切除技术在胃固有肌层肿瘤中的临床应用. 世界华人消化杂志 2015; 23(29): 4706-4712
Revised: August 12, 2015
Accepted: August 20, 2015
Published online: October 18, 2015
AIM: To evaluate the safety and efficacy of endoscopic submucosal dissection (ESD) for tumors originating from the gastric muscularis propria.
METHODS: Forty-two patients with tumors originating from the gastric muscularis propria who underwent endoscopic therapy between January 2013 and January 2015 were included. The complications, clinicopathological data, and postoperative follow-up data were analyzed.
RESULTS: Of the 42 patients, 20 were managed by ESD, 15 by endoscopic submucosal excavation (ESE), and 7 by endoscopic full-thickness resection (EFR). Four cases underwent surgery for unsuccessful endoscopic resection, including three cases receiving laparoscopic surgery for difficulties in en bloc removal or perforation, and 1 case receiving open surgery because of uncontrolled bleeding, and the success rate was 90.48%. Delayed hemorrhage occurred in two patients and no delayed perforation occurred. All the complications were successfully managed by endoscopic intervention and conservational therapy. Seven cases of active perforation in the EFR group were all successfully managed by endoscopy. The post-operative follow-up period ranged from 6 to 28 mo. No local recurrence or distant metastasis occurred.
CONCLUSION: ESD is an effective procedure for tumors originating from the gastric muscularis propria, and laparoseopic intervention is necessary for en bloc resection in some cases.
- Citation: Shi L, Zhao W, Zhou Y, Zhu HH, Wang H, Chen P. Therapeutic value of endoscopic submucosal dissection for gastric muscularis propria tumors. Shijie Huaren Xiaohua Zazhi 2015; 23(29): 4706-4712
- URL: https://www.wjgnet.com/1009-3079/full/v23/i29/4706.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i29.4706
消化系黏膜下肿瘤(submucosal tumor, SMT)是指一类消化道上皮以下组织起源的实体肿瘤, 常在内镜检查中发现, 其中许多病变具有恶性潜能, 尤其是固有肌层起源的SMTs[1], 常见的是胃肠道间质瘤, 即使是体积较小, 亦可能存在远处转移[2]. 以往外科手术切除是唯一的方法, 近年来随着内镜治疗技术不断发展, 对于起源固有肌层的消化系肿瘤的诊治水平有了显著提高, 出现了内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)及其衍生技术, 如内镜黏膜下挖除术(endoscopic submucosal excavation, ESE), 内镜全层切除术(endoscopic full-thickness resection, EFR)等. 本研究收集了江苏省苏北人民医院2013-01/2015-01 42例胃固有肌层肿瘤行内镜治疗的病例, 报道如下.
收集自江苏省苏北人民医院2013-01/2015-01接受内镜下治疗的42例胃固有肌层肿瘤患者. 其中男性13例, 女性29例, 年龄33-74岁, 平均年龄57.3岁. 其中肿瘤位于贲门入口6例, 胃底18例, 胃体15例, 胃窦3例. 治疗前均接受超声内镜及腹部计算机断层扫描(computed tomography, CT)检查, 20例行ESD, 15例行ESE, 7例行EFR治疗(表1). 器械包括: 日本Olympus GIF-H260单孔道胃镜, D-201-11802透明帽, KD-610 IT1刀、KD-61lL IT2刀和KD-620LR Hook刀, FD-410LR热活检钳, NM-4L-1注射针, SD-9L-1圈套器, HX-610-90金属夹; 德国ERBE ICC-200高频电切装置.
| 临床病理特征 | ESD(n = 20) | ESE(n = 15) | EFR(n = 7) |
| 年龄(岁) | 56.2 | 56.9 | 59.1 |
| 部位 | |||
| 贲门 | 5 | 1 | 0 |
| 胃底 | 8 | 3 | 7 |
| 胃体 | 7 | 8 | 0 |
| 胃窦 | 0 | 3 | 0 |
| 肿瘤直径(cm) | 1.8±1.1 | 2.1±1.2 | 1.1±0.5 |
| 中转原因 | |||
| 术中穿孔 | 1 | 0 | 0 |
| 术中大出血 | 1 | 0 | 0 |
| 瘤体呈腔内外生长 | 0 | 2 | 0 |
| 术后并发症 | |||
| 术后迟发性穿孔 | 0 | 0 | 0 |
| 术后迟发性出血 | 1 | 1 | 0 |
| 术后复发 | 0 | 0 | 0 |
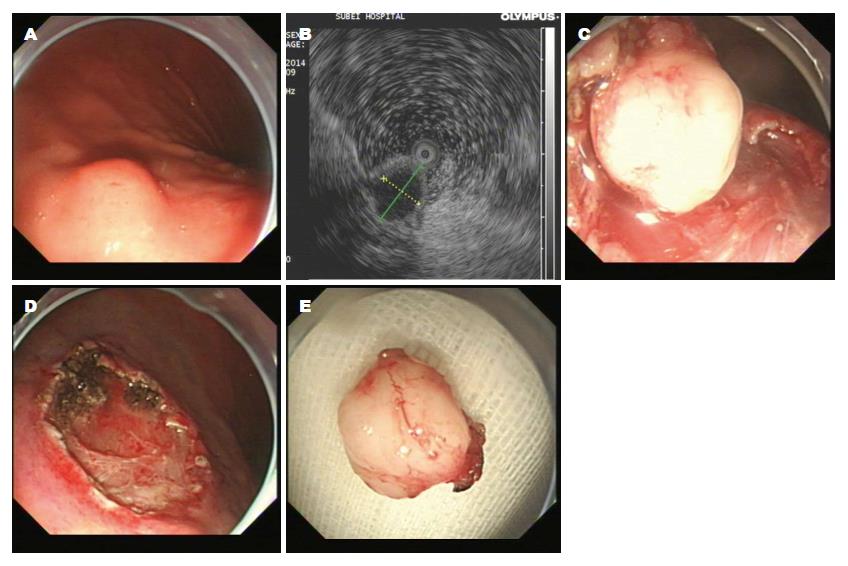
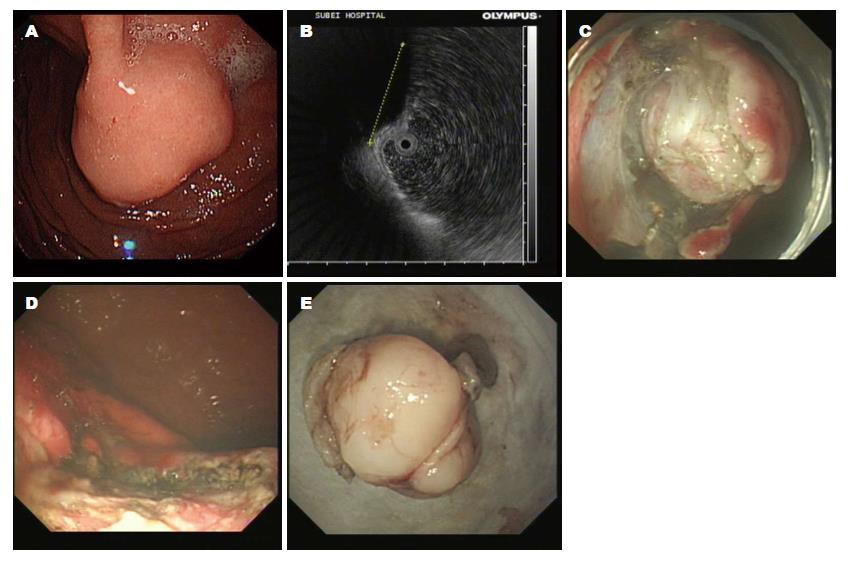
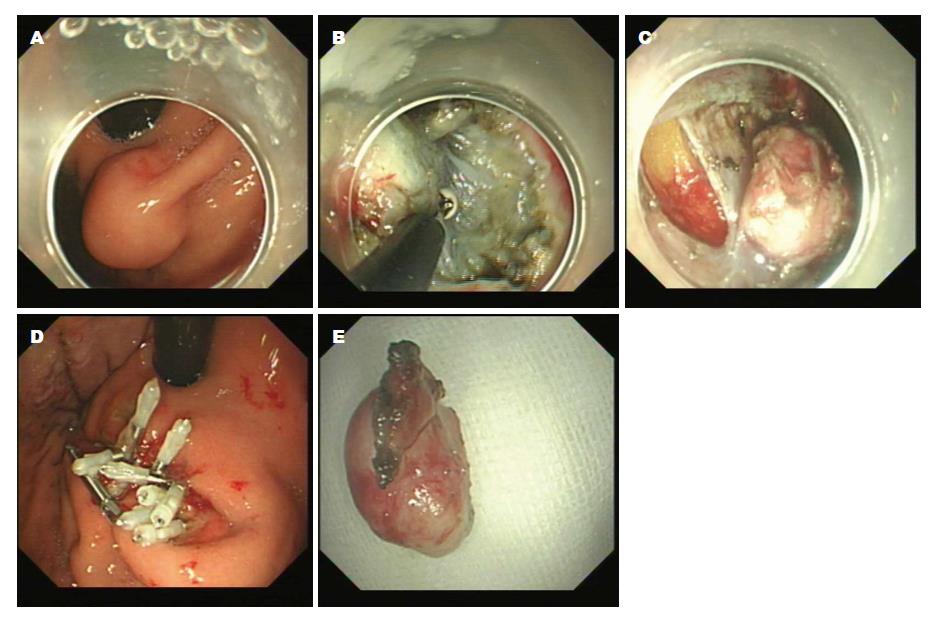
1.2.1 内镜下治疗: 按照文献[3-5]报道, 简述如下: (1)ESD: 应用针形切开刀在病灶基底边缘进行标记; 于病灶边缘标记点处进行多点黏膜下注射; 用针形切开刀切开病灶基底周围黏膜; 应用IT刀于病灶下方对黏膜下层进行剥离, 完整剥离病灶[3], 处理创面(图1); (2)ESE: 采用ESD技术预切开病变周围黏膜, 在瘤体基底部逐步剥离黏膜下层及部分固有肌层, 完整切除病变[4], 处理创面(图2); (3)EFR: 采用ESD技术沿肿瘤周围分离直至浆膜层, 直视下应用HOOK刀、IT刀或圈套器完整切除瘤体及部分浆膜, 应用金属夹封闭胃壁缺损(图3)[5].
1.2.2 术后处理: 贲门、胃底、胃体病灶切除后半卧位, 胃窦病灶治疗后仰卧位, 抑酸, 补液、止血等治疗, 24 h后流质. 术中穿孔患者置入胃肠减压管及抗炎治疗, 48 h后如无腹痛出血可少量流质.
1.2.3 随访: 所有患者出院后口服质子泵抑制剂2 mo, 停药后复查胃镜, 至术后6 mo及1年再次复查胃镜, 观察手术部位愈合情况及有无复发. 以后1-2年复查胃镜, 及影像学检查了解有无复发或转移.
统计学处理 采用SPSS13.0版软件处理, 计量资料数据以mean±SD示. 多样本均数比较采用单因素方差分析, 计数资料比较采用χ2检验. 以P<0.05为差异具有统计学意义.
本组42例患者中, ESD治疗20例, ESE治疗15例; EFR治疗7例, 其中5例出现被动穿孔, 穿孔率达11.9%, 4例内镜下成功修补, 1例因较大穿孔实施腹腔镜修补术; 2例因瘤体已突破浆膜层实施内镜辅助的腹腔镜楔形切除; 各组患者术中均出现不同程度创面出血, 其中1例出血无法控制, 开腹止血并切除病变, 余予以内镜下氩离子凝固术、热活检钳等治疗后出血控制, 内镜治疗成功率90.48%. EFR组7例均起源于固有肌层, 且与浆膜层难以分离, 术中实施内镜下胃壁全层切除, 采取主动穿孔法, 并在无腹腔镜辅助内镜下完全缝合胃壁缺损. SMT直径为0.6-3.5 cm, 平均1.8 cm±1.1 cm. ESD组平均1.8 cm±1.1 cm, ESE组平均2.1 cm±1.2 cm, EFR组平均1.1 cm±0.5 cm. 病变直径各组差异无统计学意义. 术后ESD组及ESE组各有1例患者出现迟发性出血(分别于术后第2天和第15天), 均保守治疗后出血停止. 术后无迟发性穿孔.
平滑肌瘤7例, 其中贲门入口2例、胃底1例、胃体4例; 神经鞘瘤2例, 均位于胃体; 间质瘤33例, 其中贲门入口4例、胃底17例、胃体9例, 胃窦3例, 按照美国国立卫生研究院2008年GIST危险程度分级标准, 2例属于低风险组, 31例属于极低风险组.
42例患者住院时间为3-7 d, 平均5.8 d, 术后随访6-28 mo, 平均随访时间为12.2 mo, 所有患者术后2、6及12 mo后复查胃镜, 创面愈合好, 无1例复发, 无远处转移病例.
胃SMTs患者通常无特异性临床症状, 多数在胃镜检查时发现, 病理类型以胃间质瘤多见, 少数为平滑肌瘤[6]. 国内外诊治指南指出胃来源的无症状小间质瘤(直径<2 cm), 通过超声内镜排除不良因素(边界不完整、溃疡、强回声和异质性)可以随访[7-9]. 由于黏膜下肿瘤在内镜下活检不易取得肿瘤组织, 而穿刺活检可能引起肿瘤的破溃、出血和增加肿瘤播散的危险性[10], 故不易获得明确的病理诊断, 无限期的定期随访和并不明确的诊断给部分患者造成了极大的心理负担[11], 而传统手术治疗创伤大, 存在术后黏连, 反流性食管炎等并发症, 且大多胃SMTs为良性病变, 发展缓慢. 近年来, 以ESD为基础的多种内镜下切除技术(包括ESE、EFR、STER等)已被成功用于消化系SMT的治疗[12-14], 且获得较好疗效.
ESD及其衍生技术在治疗胃SMT中虽然体现了微创手术的优势, 但出血和穿孔也是常见并发症, 也是内镜不能独立完成的主要原因. 临床文献报道[15,16]ESD穿孔的发生率达0%-8%, 高位病变及ESD操作时间较长者, 穿孔机率明显增高. 本组术中出现5例被动穿孔, 穿孔率达11.9%, 高于文献[17]的报道, 这可能与所选病变均起源于固有肌层以及术前超声内镜检查的准确率不高导致术前评估不到位有关, 并且对于有较高风险穿孔的肿瘤, 如肿瘤较大、广基或部分突出于腔外, 实施标准ESD术可能不适宜. 对于这类肿瘤, 国内报道[5]采用无腹腔镜辅助的EFR技术治疗胃固有肌层起源的SMTs, 打破传统观念, 扩大了黏膜下肿瘤ESD切除的适应证. 对于一部分突向浆膜下生长与浆膜层紧密黏连的固有肌层肿瘤, 通过EFR技术"主动"穿孔, 达到内镜下完整切除目的. 但这需要具有良好的内镜操作基础和治疗经验, 需要有娴熟的内镜下闭合穿孔技术, 一旦术中穿孔, 导致腹压增加, 膈肌上抬, 影响呼吸, 同时胃腔无法撑开, 影响操作, 导致失败, 因此对于初学阶段, 尝试我们在内镜操作前先在脐部置入腹腔镜穿刺鞘卡, 其目的有: (1)起到穿刺排气作用, 当术中出现穿孔时, 腹腔游离气体可以从穿刺鞘卡口排出, 操作者可继续胃腔持续注气, 完成操作, 而不会因腹压增大或胃腔撑不开中转开腹; (2)部分病例, 若内镜下修补困难或修补不可靠需腹腔镜修补时, 不至于因腹腔及肠腔过度积气致穿刺鞘卡置入困难; (3)内镜操作完成后, 可通过穿刺鞘卡, 腹腔留置引流管作为术后观察; (4)可探查病变生长方式, 若见瘤体呈腔外生长, 可直接采取腹腔镜下胃楔形或部分切除. 本组研究中, 11例在内镜操作前置入腹腔镜穿刺鞘卡, 1例因较大穿孔实施腹腔镜修补, 5例穿孔置入引流管, 2例术中见瘤体呈腔内外生长, 并已突破浆膜层实施内镜辅助的腹腔镜楔形切除, 3例仅作术中观察, 术后均平稳出院. 当然, 为减少并发症的发生, 提高成功率, 这要求操作者术前超声内镜、CT检查评估病情、术中出血点的随时处理、剥离过程中反复黏膜下的注射和内镜手术器械的改进, 均有助于预防"被动"穿孔的发生. 对于初学者使用腹腔镜穿刺鞘卡, 可有效降低内镜操作难度, 减少严重并发症的发生风险, 提高内镜治疗的安全性.
相对于穿孔, 出血的预防和处理尤为重要. 术中一旦发生出血, 止血过程不仅要耗费时间, 而且影响操作视野, 盲目止血易穿孔, 出血无法控制时, 往往不得不中止内镜操作[18]. 本组研究中, 1例因术中出血无法控制, 中转开腹, 2例因术中盲目止血发生穿孔予钛夹夹闭; 2例迟发性出血, 1例为胃体病变实施ESD术后第3天, 胃管里突然出现新鲜血液200 mL, 考虑与当时术中创面渗血, 经止血成功术后血痂脱落有关, 另1例为胃窦病变实施ESE术后1 wk, 出现黑便300 mL, 考虑胃窦黏膜下血运丰富, 创面未钛夹封闭有关, 2例均通过药物保守成功. 因此, 内镜手术中必须有意识地预防出血的发生: 术中反复黏膜下注射; 采取先凝后切方式; 较小黏膜下层血管, 切开刀头端直接电凝; 较粗黏膜下层血管, 热活检的合理使用[19]. 一旦发生出血, 对创面进行冲洗或透明帽下压创面, 明确出血点后进行止血; 有时也采用钛夹夹闭出血点, 但这会影响随后的操作.
总之, 该项回顾性研究显示以ESD为基石的内镜下治疗起源于固有肌层的胃肿瘤是一种有效的治疗手段. 穿孔及出血仍是内镜治疗常见并发症, 术前超声内镜的准确评估及术中的小心操作有助于并发症的减少. 对于部分呈腔内外生长的瘤体的完整切除需要腹腔镜帮助.
消化系黏膜下肿瘤(submucosal tumor, SMT)是指一类消化道上皮以下组织起源的实体肿瘤, 常见的是胃肠道间质瘤, 以往外科手术切除是唯一的方法, 近年来随着内镜治疗技术不断发展, 出现了内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)及其衍生技术内镜黏膜下挖除术(endoscopic submucosal excavation, ESE), 内镜全层切除术(endoscopic full-thickness resection, EFR)等. 本文总结了内镜切除技术在治疗胃固有肌层肿瘤中的安全性及有效性.
黄杰安, 主任医师, 广西医科大学第一附属医院
ESD及其衍生技术是微创治疗消化系病变的一类新技术, 目前已经广泛应用切除胃黏膜下肿瘤方面. 随着内镜技术的迅猛发展, 内镜下切除为胃黏膜下肿瘤的治疗提供了不同的方案. 有些专家还提出了内镜与腔镜的联合治疗.
EFR治疗胃固有肌层起源的SMTs, 打破传统观念, 扩大了黏膜下肿瘤ESD切除的适应证. 对于一部分突向浆膜下生长与浆膜层紧密黏连的固有肌层肿瘤, 通过EFR技术"主动"穿孔, 达到内镜下完整切除目的.
本文着重列举了内镜治疗黏膜下肿瘤的术式, 包括ESD及其衍生技术ESE、EFR. 对于初学阶段, 为减低治疗风险. 本文研究者尝试在内镜操作前置入腹腔镜穿刺鞘卡, 以达到降低并发症的目的.
内镜治疗为消化系黏膜下肿瘤的患者带来了福音, 在明确诊断及达到治疗目的的同时, 使得患者术后恢复快、疼痛轻、术后进食早, 住院时间短. 但是微创技术治疗黏膜下肿瘤的报道仅限于个案报道或小样本量、单中心的回顾性分析. 因此, 仍需要进一步研究证实以上微创技术治疗黏膜下肿瘤的可行性, 尤其在安全、完全切除方面予以重视.
ESD: 利用普通或一些特殊用途的内镜, 选择适宜的电刀, 通过高频电的作用将消化管病变部位的黏膜一整片从黏膜下层剥离下来的诊断和治疗方法, 一次性完整切除较大面积的表浅病变是ESD的独特优势.
ESD及其衍生技术ESE、EFR作为一类内镜下治疗手段, 具有高效及低并发症的特点, 其并发症如出血及穿孔均可在内镜下成功处理, 部分病例需要腹腔镜帮助. 本文总结了不同内镜治疗方法治疗胃固有肌层肿瘤, 内容全面丰富, 对临床有一定的的指导意义.
编辑:郭鹏 电编:都珍珍
| 1. | Sepe PS, Brugge WR. A guide for the diagnosis and management of gastrointestinal stromal cell tumors. Nat Rev Gastroenterol Hepatol. 2009;6:363-371. [PubMed] [DOI] |
| 2. | Grover S, Ashley SW, Raut CP. Small intestine gastrointestinal stromal tumors. Curr Opin Gastroenterol. 2012;28:113-123. [PubMed] [DOI] |
| 3. | Hoteya S, Iizuka T, Kikuchi D, Yahagi N. Endoscopic submucosal dissection for gastric submucosal tumor, endoscopic sub-tumoral dissection. Dig Endosc. 2009;21:266-269. [PubMed] [DOI] |
| 5. | Zhou PH, Yao LQ, Qin XY, Cai MY, Xu MD, Zhong YS, Chen WF, Zhang YQ, Qin WZ, Hu JW. Endoscopic full-thickness resection without laparoscopic assistance for gastric submucosal tumors originated from the muscularis propria. Surg Endosc. 2011;25:2926-2931. [PubMed] [DOI] |
| 6. | Catalano F, Rodella L, Lombardo F, Silano M, Tomezzoli A, Fuini A, Di Cosmo MA, de Manzoni G, Trecca A. Endoscopic submucosal dissection in the treatment of gastric submucosal tumors: results from a retrospective cohort study. Gastric Cancer. 2013;16:563-570. [PubMed] [DOI] |
| 8. | ESMO/European Sarcoma Network Working Group. Gastrointestinal stromal tumours: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2014;25 Suppl 3:iii21-iii26. [PubMed] [DOI] |
| 9. | Demetri GD, von Mehren M, Antonescu CR, DeMatteo RP, Ganjoo KN, Maki RG, Pisters PW, Raut CP, Riedel RF, Schuetze S. NCCN Task Force report: update on the management of patients with gastrointestinal stromal tumors. J Natl Compr Canc Netw. 2010;8 Suppl 2:S1-41; quiz S42-S44. [PubMed] |
| 11. | Reddy P, Boci K, Charbonneau C. The epidemiologic, health-related quality of life, and economic burden of gastrointestinal stromal tumours. J Clin Pharm Ther. 2007;32:557-565. [PubMed] [DOI] |
| 12. | Zhang Y, Zhou P, Xu M, Chen W, Li Q, Ji Y, Yao L. Endoscopic diagnosis and treatment of gastric glomus tumors. Gastrointest Endosc. 2011;73:371-375. [PubMed] [DOI] |
| 13. | Shi Q, Zhong YS, Yao LQ, Zhou PH, Xu MD, Wang P. Endoscopic submucosal dissection for treatment of esophageal submucosal tumors originating from the muscularis propria layer. Gastrointest Endosc. 2011;74:1194-1200. [PubMed] [DOI] |
| 14. | Xu MD, Cai MY, Zhou PH, Qin XY, Zhong YS, Chen WF, Hu JW, Zhang YQ, Ma LL, Qin WZ. Submucosal tunneling endoscopic resection: a new technique for treating upper GI submucosal tumors originating from the muscularis propria layer (with videos). Gastrointest Endosc. 2012;75:195-199. [PubMed] [DOI] |
| 15. | Tanaka S, Oka S, Kaneko I, Hirata M, Mouri R, Kanao H, Yoshida S, Chayama K. Endoscopic submucosal dissection for colorectal neoplasia: possibility of standardization. Gastrointest Endosc. 2007;66:100-107. [PubMed] [DOI] |
| 16. | Miyamoto S, Muto M, Hamamoto Y, Boku N, Ohtsu A, Baba S, Yoshida M, Ohkuwa M, Hosokawa K, Tajiri H. A new technique for endoscopic mucosal resection with an insulated-tip electrosurgical knife improves the completeness of resection of intramucosal gastric neoplasms. Gastrointest Endosc. 2002;55:576-581. [PubMed] [DOI] |
| 17. | Li QL, Yao LQ, Zhou PH, Xu MD, Chen SY, Zhong YS, Zhang YQ, Chen WF, Ma LL, Qin WZ. Submucosal tumors of the esophagogastric junction originating from the muscularis propria layer: a large study of endoscopic submucosal dissection (with video). Gastrointest Endosc. 2012;75:1153-1158. [PubMed] [DOI] |