修回日期: 2015-06-01
接受日期: 2015-06-11
在线出版日期: 2015-07-28
目的: 探讨半乳凝集素-3(Galectin-3)和上皮钙黏附蛋白(E-cadherin)在胃腺癌组织中表达及其与微血管密度(microvascular density, MVD)的关系.
方法: 采用免疫组织化学方法检测60例胃腺癌组织中Galectin-3、E-cadherin和CD105蛋白的表达, 分析Galectin-3、E-cadherin蛋白表达与临床病理特征、MVD的关系及二者表达的相关性.
结果: 胃腺癌组织中Galectin-3、E-cadherin蛋白阳性表达率分别为78.3%和63.3%, 两者阳性表达呈负相关(P = 0.01). Galectin-3蛋白表达与组织浸润深度有关(P = 0.01), E-cadherin蛋白表达与淋巴结转移有关(P = 0.01). Galectin-3蛋白阳性表达组织中MVD显著高于阴性表达组织(25.64±8.81 vs 20.28±6.66, P<0.05), E-cadherin蛋白阳性表达组织中MVD显著低于阴性表达组织(22.57±7.18 vs 27.78±10.03, P<0.05).
结论: 胃癌组织中Galectin-3、E-cadherin蛋白表达呈负相关, 可能共同影响肿瘤血管生成参与胃癌发展及转移过程.
核心提示: 胃癌是我国常见消化系恶性肿瘤, 具有较高的发病率和死亡率. 研究发现半乳凝集素-3(Galectin-3)和上皮钙黏附蛋白(E-cadherin)与肿瘤的发生、发展、血管生成与转移等过程关系密切. 探讨Galectin-3和E-cadherin在胃癌组织中的表达及与肿瘤微血管密度(microvessel density)的关系, 有助于阐明Galectin-3与E-cadherin在胃癌组织表达与肿瘤血管生成的关系.
引文著录: 王世超, 张自森, 夏兴洲, 兰海涛, 刘谦, 吴诗文, 薛长年. Galectin-3和E-cadherin在胃腺癌组织中的表达及与血管生成的关系. 世界华人消化杂志 2015; 23(21): 3361-3365
Revised: June 1, 2015
Accepted: June 11, 2015
Published online: July 28, 2015
AIM: To investigate the expression of Galectin-3 and E-cadherin in gastric adenocarcinoma and their relationship with microvascular density (MVD).
METHODS: Immunohistochemistry was used to detect the expression of Galectin-3, E-cadherin and CD105 in gastric adenocarcinoma tissues. The relationship of Galectin-3 and E-cadherin expression with clinicopathological features, and the correlation between their expression were analyzed statistically.
RESULTS: Galectin-3 and E-cadherin proteins were expressed positively in 78.3% and 63.3% of gastric adenocarcinoma tissues, respectively, and there was a negative correlation between Galectin-3 and E-cadherin expression (P = 0.01). Galectin-3 expression was significantly associated with tumor invasion depth. E-cadherin expression was significantly associated with lymph node metastasis. MVD in the Galectin-3 positive group was significantly higher than that in the Galectin-3 negative group (25.64 ± 8.81 vs 20.28 ± 6.66, P < 0.05). MVD in the E-cadherin positive group was significantly lower than that in the E-cadherin negative group (22.57 ± 7.18 vs 27.78 ± 10.03, P < 0.05).
CONCLUSION: Galectin-3 and E-cadherin expression has a negative correlation in gastric adenocarcinoma. Galectin-3 and E-cadherin may participate in the development and metastasis of gastric cancer through regulating tumor angiogenesis.
- Citation: Wang SC, Zhang ZS, Xia XZ, Lan HT, Liu Q, Wu SW, Xue CN. Expression of Galectin-3 and E-cadherin in gastric adenocarcinoma tissue: Relationship with angiogenesis. Shijie Huaren Xiaohua Zazhi 2015; 23(21): 3361-3365
- URL: https://www.wjgnet.com/1009-3079/full/v23/i21/3361.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i21.3361
半乳凝集素-3(Galectin-3)是Galectin家族成员之一, 在正常细胞与肿瘤细胞中均有表达, 在增殖、黏附、迁移、侵袭、血管形成等肿瘤进展多个过程中发挥重要作用[1,2]. E型钙黏附蛋白(E-cadherin)是一种重要的细胞间黏附分子, 通过其介导的同型细胞间的黏附, 可抑制肿瘤细胞的侵袭和转移, 减少血管生成[3,4]. 有研究[5]表明Galectin-3和E-cadherin可能共同参与了肿瘤的发生与转移. 我们通过免疫组织化学检测了胃癌组织中Galectin-3、E-cadherin蛋白的表达及微血管密度(microvessel density, MVD), 分析其与胃癌患者临床病理特征之间的关系, 探讨其在胃癌组织中表达的相关性, 为预测胃癌转移提供理论参考依据.
选取郑州大学第五附属医院2013年胃癌手术切除标本60例, 均经组织病理学证实为胃腺癌. 其中男性38例, 女性22例, 平均年龄58岁, 有淋巴结转移30例, 无淋巴结转移30例. 临床资料证实所有病例手术前未接受放疗、化疗. 鼠抗人Galectin-3、E-cadherin、CD105单克隆抗体均购自北京中杉金桥公司. 本课题通过郑州大学第五附属医院伦理委员会审议.
Galectin-3、E-cadherin和CD105蛋白表达的免疫组织化学检测: 所有标本均经40 g/L甲醛固定, 常规石蜡包埋, 4 μm连续切片4张, 3张用于免疫组织化学染色, 1张用于阴性对照. 免疫组织化学法采用PV9000法. 按试剂盒说明说严格操作, 以已知阳性片为阳性对照, 以PBS缓冲液代一抗作为阴性对照. Galectin-3和E-cadherin的结果判定参考文献报道[6,7], 根据染色阳性肿瘤细胞的百分比进行评分, 阴性(-): 无表达; 弱阳性: 阳性细胞数<25%; 阳性: 阳性细胞数为25%-75%; 强阳性: 阳性细胞数>75%. CD105以细胞质内染成棕黄色颗粒为阳性反应细胞, MVD计数参照Weider方法[8], 任何被抗体染色的单个细胞或细胞团, 不管他是否形成管腔, 只要他与周围的血管、肿瘤细胞和其他连接组织成分有一个清楚的分隔, 都认为是一个可计数的微血管, 先用低倍镜扫视玻片, 寻找血管密度最高的5个区域, 然后在高倍镜下计数该区域内视野内被染色的血管数. 取其平均值为作为该组织的肿瘤MVD值.
统计学处理 采用SPSS17.0软件进行统计分析. 用χ2检验比较分析Galectin-3和E-cadherin蛋白表达与临床病理学参数的关系. 用t检验比较分析不同分组间MVD值. 用Pearson相关分析Galectin-3和E-cadherin蛋白表达相关性. P<0.05为差异有统计学意义.
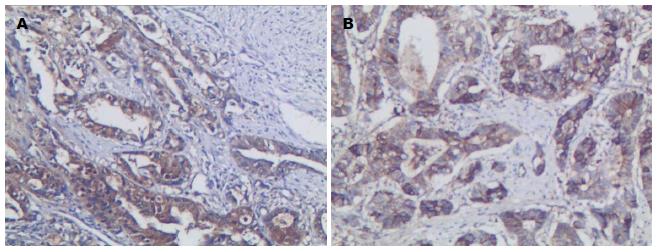
Galectin-3阳性表达主要存在于胃癌细胞质及细胞核中, 呈棕黄色颗粒, 其在胃癌组织中的阳性表达率为78.3%(47/60). E-cadherin阳性表达主要位于细胞膜, 其在胃癌组织中的阳性表达率为63.3%(38/60)(图1).
Galectin-3阳性表达与肿瘤浸润深度显著相关, E-cadherin阳性表达与淋巴结转移显著相关, MVD与年龄、性别、分化程度、浸润深度、淋巴结转移均无相关性(表1).
| 病理特征 | n | Galectin-3阳性n(%) | χ2(P)值 | E-cadherin阳性n(%) | χ2(P)值 | MVD | t(P)值 |
| 年龄(岁) | 0.65(0.42) | 0.00(0.95) | 0.62(0.54) | ||||
| <60 | 27 | 22(81.5) | 17(63.0) | 25.24±10.29 | |||
| ≥60 | 33 | 25(75.8) | 21(63.6) | 23.85±7.11 | |||
| 性别 | 2.12(0.15) | 0.01(0.93) | 0.28(0.78) | ||||
| 男 | 46 | 38(82.6) | 29(63.0) | 24.31±8.56 | |||
| 女 | 14 | 9(64.3) | 9(64.3) | 25.04±9.18 | |||
| 分化程度 | 0.35(0.55) | 1.37(0.24) | 1.32(0.19) | ||||
| 高中分化 | 41 | 33(80.5) | 28(68.3) | 23.49±7.36 | |||
| 低分化 | 19 | 14(73.7) | 10(52.6) | 26.62±10.82 | |||
| 浸润深度 | 5.86(0.01) | 1.32(0.25) | 1.54(0.13) | ||||
| T1-T2 | 13 | 7(53.8) | 10(76.9) | 21.25±6.52 | |||
| T3-T4 | 47 | 40(85.1) | 28(59.6) | 25.37±8.99 | |||
| 淋巴结转移 | 2.46(0.12) | 7.18(0.01) | 1.93(0.06) | ||||
| 有 | 30 | 21(70.0) | 14(46.7) | 22.37±9.30 | |||
| 无 | 30 | 26(86.7) | 24(80.0) | 26.59±7.49 |
胃癌组织中Galectin-3蛋白阳性表达共47例, MVD为25.64±8.81, Galectin-3蛋白阴性表达13例, MVD为20.28±6.66, t值为2.035, P = 0.046. Galectin-3与MVD呈显著正相关, E-cadherin蛋白阴性表达34例, MVD为27.78±10.03, 阳性表达26例, MVD为22.57±7.18, t值为2.337, P = 0.023, E-cadherin与MVD呈显著负相关.
60例胃癌组织中Galectin-3阴性E-cadherin阴性组织1例, Galectin-3阴性E-cadherin阳性组织21例, Galectin-3阳性E-cadherin阴性组织12例, Galectin-3阳性E-cadherin蛋白阳性26例, χ2 = 6.000, P = 0.014, 相关系数r = -0.316, Galectin-3和E-cadherin在胃癌组织中的阳性表达呈显著负相关.
胃癌是我国最常见的消化系肿瘤, 其发病率及死亡率均位居前列[9-11]. 胃癌标志物的研究有助于全面了解胃癌发生发展机制, 并有助于发现胃癌预后预测标志及有效治疗靶点[12-15]. Galectin-3在肿瘤细胞转化、侵袭和转移中发挥关键作用, 参与了胃癌的发生发展[16-18]. 近年来的研究[19-21]提示, Galectin-3与肿瘤血管生成关系密切, 如Galectin-3可通过促进血管生成导致乳腺癌的发生发展. 我们研究发现, Galectin-3在胃癌组织中的阳性表达与胃癌细胞浸润深度显著相关, 其阳性表达组织中MVD显著升高, 结果提示Galectin-3蛋白可能在胃癌原发肿瘤生长中发挥重要作用, 其导致胃癌局部浸润进展的机制可能与促进肿瘤血管生成有关.
E-cadherin是介导细胞间黏附的关键分子, 在正常细胞排列和肿瘤细胞侵袭转移中均发挥了重要作用[22,23]. E-cadherin低表达促进了胃癌的发生和转移, 是胃癌早期诊断、预后预测和治疗的重要标志物[24-26]. 有研究[27]表明, E-cadherin表达下调可能通过β-catenin信号通路的激活促进血管内皮生长因子(vascular endothelial growth factor, VEGF)表达增加, 从而增加肿瘤血管的生成, 导致MVD增加, 促进肿瘤转移的发生. 在胰腺癌和乳腺癌研究中发现, E-cadherin表达与淋巴结转移密切相关, 并具有一定预测价值[28-30]. 作者研究结果表明在胃癌组织中的E-cadherin表达与淋巴结转移显著相关, 而且其阳性表达组织MVD呈显著下降, 提示E-cadherin在胃癌组织中的表达下降可能促进了肿瘤血管生成, 从而导致肿瘤转移的发生.
Galectin-3和E-cadherin可能通过不同的作用机制或相互作用共同在肿瘤发展、转移和微血管形成中发挥作用[5]. 在本研究中, Galectin-3和E-cadherin在胃癌组织中的阳性表达呈显著负相关, MVD在Galectin-3和E-cadherin阳性和阴性表达组织中差异显著, 提示在胃癌发生发展过程中两者均可能通过影响胃癌组织微血管生成发挥促进作用.
胃癌的发生发展是一个多基因、多步骤共同参与的过程, 分子机制非常复杂. 半乳凝集素-3(Galectin-3)和上皮钙黏附蛋白(E-cadherin)与肿瘤的发生、发展、转移及血管生成关系密切, 是近年来的研究热点之一, 肿瘤转移的发生可能存在两者的共同作用, 在胰腺癌、肾癌、乳腺癌等恶性肿瘤中的研究发现Galectin-3、E-cadherin表达与肿瘤微血管密度(microvessel density, MVD)和淋巴结转移有关.
黄颖秋, 教授, 本溪钢铁(集团)总医院消化内科
国内外研究已初步证实Galectin-3和E-cadherin表达与肿瘤的发生与转移关系密切, Galectin-3在胃癌组织中呈高表达, 而E-cadherin在胃癌组织中表达则下调. 钱屹崟等研究发现Galectin-3在胃癌中的高表达与淋巴结转移及组织分化程度相关, E-cadherin在乳腺癌组织中的低表达与MVD、淋巴结转移有关.
本文首次探讨了Galectin-3和E-cadherin与胃腺癌组织MVD的关系, 研究其对肿瘤新生血管的影响, 提示Galectin-3能促进肿瘤组织血管生成, E-cadherin对肿瘤组织血管生成有一定的抑制作用.
免疫组织化学染色对了解胃癌组织中Galectin-3和E-cadherin表达以及综合判断患者的预后及指导治疗有一定的辅助作用.
CD105: 又名Endoglin, 是一种型二聚体细胞膜糖蛋白, CD105强烈表达于新生血管内皮细胞上, 如肿瘤组织内皮上, CD105标记MVD较CD34可更好地反映肿瘤组织中的新生血管密度.
采用免疫组织化学方法探讨Galectin-3和E-cadherin在胃癌组织中的表达及意义是近年来的研究热点, 相关内容已见多篇报道, 本文在此基础上探讨其与血管形成的关系, 观点新颖, 有一定的创新性, 具有相应的参考价值.
编辑: 韦元涛 电编:都珍珍
| 1. | Fortuna-Costa A, Gomes AM, Kozlowski EO, Stelling MP, Pavão MS. Extracellular galectin-3 in tumor progression and metastasis. Front Oncol. 2014;4:138. [PubMed] [DOI] |
| 2. | Funasaka T, Raz A, Nangia-Makker P. Galectin-3 in angiogenesis and metastasis. Glycobiology. 2014;24:886-891. [PubMed] [DOI] |
| 3. | Paredes J, Figueiredo J, Albergaria A, Oliveira P, Carvalho J, Ribeiro AS, Caldeira J, Costa AM, Sim窄es-Correia J, Oliveira MJ. Epithelial E- and P-cadherins: role and clinical significance in cancer. Biochim Biophys Acta. 2012;1826:297-311. [PubMed] [DOI] |
| 4. | Götte M, Kersting C, Radke I, Kiesel L, Wülfing P. An expression signature of syndecan-1 (CD138), E-cadherin and c-met is associated with factors of angiogenesis and lymphangiogenesis in ductal breast carcinoma in situ. Breast Cancer Res. 2007;9:R8. [PubMed] [DOI] |
| 5. | Xin M, Dong XW, Guo XL. Role of the interaction between galectin-3 and cell adhesion molecules in cancer metastasis. Biomed Pharmacother. 2015;69:179-185. [PubMed] [DOI] |
| 6. | Papotti M, Rodriguez J, De Pompa R, Bartolazzi A, Rosai J. Galectin-3 and HBME-1 expression in well-differentiated thyroid tumors with follicular architecture of uncertain malignant potential. Mod Pathol. 2005;18:541-546. [PubMed] [DOI] |
| 7. | 黄 美近, 彭 慧, 杨 祖立, 康 亮, 王 磊, 王 辉, 刘 焕亮, 汪 建平. 结直肠癌组织E-钙黏附素蛋白表达与甲基化的关系. 中山大学学报(医学科学版). 2012;33:630. |
| 8. | Weidner N. Intratumor microvessel density as a prognostic factor in cancer. Am J Pathol. 1995;147:9-19. [PubMed] |
| 13. | Liu HS, Xiao HS. MicroRNAs as potential biomarkers for gastric cancer. World J Gastroenterol. 2014;20:12007-12017. [PubMed] [DOI] |
| 14. | 王 岩, 徐 建明, 刘 建芝, 林 莉, 葛 飞娇, 李 珊珊, 刘 烈军. 赵传华人表皮生长因子受体2的表达与晚期胃癌患者临床病理特征及疗效和预后的关系. 中华肿瘤杂志. 2011;33:671-675. |
| 15. | 中国抗癌协会临床肿瘤学协作专业委员会, 中国抗癌协会胃癌专业委员会, 中国抗癌协会肿瘤病理专业委员会. 人表皮生长因子受体2阳性晚期胃癌分子靶向治疗的中国专家共识. 中华肿瘤杂志. 2013;35:315-319. |
| 16. | Song L, Tang JW, Owusu L, Sun MZ, Wu J, Zhang J. Galectin-3 in cancer. Clin Chim Acta. 2014;431:185-191. [PubMed] [DOI] |
| 17. | Cheong TC, Shin JY, Chun KH. Silencing of galectin-3 changes the gene expression and augments the sensitivity of gastric cancer cells to chemotherapeutic agents. Cancer Sci. 2010;101:94-102. [PubMed] [DOI] |
| 18. | Dange MC, Srinivasan N, More SK, Bane SM, Upadhya A, Ingle AD, Gude RP, Mukhopadhyaya R, Kalraiya RD. Galectin-3 expressed on different lung compartments promotes organ specific metastasis by facilitating arrest, extravasation and organ colonization via high affinity ligands on melanoma cells. Clin Exp Metastasis. 2014;31:661-673. [PubMed] [DOI] |
| 19. | Nangia-Makker P, Wang Y, Raz T, Tait L, Balan V, Hogan V, Raz A. Cleavage of galectin-3 by matrix metalloproteases induces angiogenesis in breast cancer. Int J Cancer. 2010;127:2530-2541. [PubMed] [DOI] |
| 20. | Machado CM, Andrade LN, Teixeira VR, Costa FF, Melo CM, dos Santos SN, Nonogaki S, Liu FT, Bernardes ES, Camargo AA. Galectin-3 disruption impaired tumoral angiogenesis by reducing VEGF secretion from TGFβ1-induced macrophages. Cancer Med. 2014;3:201-214. [PubMed] [DOI] |
| 21. | Jia W, Kidoya H, Yamakawa D, Naito H, Takakura N. Galectin-3 accelerates M2 macrophage infiltration and angiogenesis in tumors. Am J Pathol. 2013;182:1821-1831. [PubMed] [DOI] |
| 22. | Lecuit T, Yap AS. E-cadherin junctions as active mechanical integrators in tissue dynamics. Nat Cell Biol. 2015;17:533-539. [PubMed] [DOI] |
| 23. | Canel M, Serrels A, Frame MC, Brunton VG. E-cadherin-integrin crosstalk in cancer invasion and metastasis. J Cell Sci. 2013;126:393-401. [PubMed] [DOI] |
| 24. | Liu X, Chu KM. E-cadherin and gastric cancer: cause, consequence, and applications. Biomed Res Int. 2014;2014:637308. [PubMed] [DOI] |
| 25. | Onitilo AA, Aryal G, Engel JM. Hereditary diffuse gastric cancer: a family diagnosis and treatment. Clin Med Res. 2013;11:36-41. [PubMed] [DOI] |
| 26. | Carneiro P, Figueiredo J, Bordeira-Carriço R, Fernandes MS, Carvalho J, Oliveira C, Seruca R. Therapeutic targets associated to E-cadherin dysfunction in gastric cancer. Expert Opin Ther Targets. 2013;17:1187-1201. [PubMed] [DOI] |
| 27. | Ma L, Young J, Prabhala H, Pan E, Mestdagh P, Muth D, Teruya-Feldstein J, Reinhardt F, Onder TT, Valastyan S. miR-9, a MYC/MYCN-activated microRNA, regulates E-cadherin and cancer metastasis. Nat Cell Biol. 2010;12:247-256. [PubMed] [DOI] |
| 28. | 丁 耘峰, 平 金良, 周 余人, 马 志红, 王 晓红. Girdin在乳腺浸润性导管癌中的表达及与E-cadherin、MVD的关系. 江苏医药. 2014;40:316-319, 封2. |
| 30. | 孟 新, 张 程达, 牛 雅萱, 刘 秀玮, 王 蒙, 张 卫东. E-cadherin和CD44V6对乳癌腋窝淋巴结转移的预测价值. 郑州大学学报(医学版). 2013;48:112. |