修回日期: 2015-05-25
接受日期: 2015-06-10
在线出版日期: 2015-07-28
目的: 探讨复方血竭制剂对远端型溃疡性结肠炎(ulcerative colitis, UC)小鼠模型肺与肠的保护作用.
方法: 60只♂BALB/c小鼠随机分成4组(n = 15), 正常组、葡聚糖硫酸钠(dextran sulfate sodium, DSS)组、复方血竭制剂组、DSS+复方血竭制剂组. 全部小鼠适应环境喂养7 d, 第8天, 正常组、DSS组小鼠予以生理盐水1 mL灌胃, 复方血竭制剂组、DSS+复方血竭制剂组小鼠予以复方血竭制剂[0.075 g/(kg•d)]1 mL灌胃, 每只小鼠自由觅食, 继续喂养10 d. 通过疾病活动指数(disease activity index, DAI)评分、结肠组织病理评分(histopathology score, HI)、肺HI评分、苏木精-伊红(hematoxylin-eosin, HE)染色评价炎症严重程度. 通过酶联免疫吸附测定(enzyme-linked immunosorbent assay, ELISA)、免疫组织化学、实时荧光定量PCR(real-time quantitative PCR, RT-QPCR)测定结肠与肺组织中白介素(interleukin, IL)-6炎性因子的表达量.
结果: 与正常组、复方血竭制剂组比较, DSS组、DSS+复方血竭制剂组小鼠一般情况、DAI评分、结肠HI评分、肺HI评分均升高(P<0.05); 与DSS+复方血竭制剂组比较, DSS组小鼠结肠与肺组织炎症程度更重(P<0.05); 且小鼠肺与结肠组织中IL-6表达量显著升高(P<0.05).
结论: 复方血竭制剂可以下调炎性因子IL-6表达量, 缓解小鼠实验性UC及UC肺损伤.
核心提示: 溃疡性结肠炎(ulcerative colitis, UC)是免疫、环境等因素作用于肠道引发的一种慢性、复发性炎症, 主要累及黏膜和黏膜下层. 在UC模型的基础上, 小鼠肺功能障碍及炎性细胞浸润, 可使死亡风险增加, 口服复方血竭制剂可以减少化学诱导小鼠UC及肺损伤, 降低白介素-6炎性因子的表达量, 为治疗UC及UC肺损伤带来新的希望.
引文著录: 赵亚娇, 王雪明, 苏丽, 朱超慧, 翟俊山, 郑楠, 张萌, 李楠. 复方血竭制剂对远端型溃疡性结肠炎小鼠肺、肠白介素-6表达的影响. 世界华人消化杂志 2015; 23(21): 3352-3360
Revised: May 25, 2015
Accepted: June 10, 2015
Published online: July 28, 2015
AIM: To investigate the protective effect of compound dracorhodin enema on the lung and intestine of mice with distal ulcerative colitis (UC).
METHODS: Sixty male BALB/c mice were randomly divided into four groups (n = 15 each): a normal group, a dextran sulfate sodium (DSS) group, a compound dracorhodin enema group, and a DSS + compound dracorhodin enema group. After inducing UC, the normal group and DSS group were given 1 mL saline, and the other two groups were given compound dracorhodin enema [0.075 g/(kg•d), 1 mL] by gavage. After treatment, disease activity index (DAI) score, colonic histopathology score (HI), lung HI score, and hematoxylin-eosin (HE) staining were used to evaluate the severity of inflammation. Enzyme-linked immunosorbent assay (ELISA), immunohistochemistry, and real-time quantitative PCR (RT-QPCR) assay were used to detect the expression of interleukin (IL)-6 in the lung and colon.
RESULTS: Compared with the normal group and compound dracorhodin enema group, DAI score, colonic HI score, and lung HI score were significantly higher in the other two groups (P < 0.05). Compared with the DSS + compound dracorhodin enema group, colonic and pulmonary tissue inflammation was significantly more severe and pulmonary and colonic expression of IL-6 was significantly higher in the DSS group (P < 0.05).
CONCLUSION: Compound dracorhodin enema can decrease the expression of IL-6 and therefore alleviate UC and UC related lung injury in mice.
- Citation: Zhao YJ, Wang XM, Su L, Zhu CH, Zhai JS, Zheng N, Zhang M, Li N. Effect of compound dracorhodin enema on pulmonary and colonic expression of interleukin-6 in mice with distal ulcerative colitis. Shijie Huaren Xiaohua Zazhi 2015; 23(21): 3352-3360
- URL: https://www.wjgnet.com/1009-3079/full/v23/i21/3352.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i21.3352
溃疡性结肠炎(ulcerative colitis, UC)是一种慢性复发性炎症性肠病(inflammatory bowel disease, IBD), 临床表现为腹泻和直肠出血, 其病因复杂, 主要包括遗传、免疫、微生物、环境因素[1]. UC不仅临床症状比较多见, 其肠外表现也较常见, 包括皮肤、眼部、关节损害, 肺部也常受累. 文献[2]显示UC患病率为(150-250)/10万人口, 且成逐年上升的趋势. IBD患者间质性肺受累的发病率为44%[3], 肺泡内淋巴细胞浸润的发病率为48%[4], 肺泡弥散功能障碍的发病率为50%[5]. UC肺损伤与亚临床肺泡炎已被前人认可[6,7]. 20世纪60年代Turner-Warwick[8]首先报道了UC和呼吸系统之间可能存在联系, 直到20世纪70年代Kraft等[9]研究确定肺部受累成为UC肠外表现之一. UC发病后肺功能出现异常, 肺组织的任何部位都可受累, 表现显性或隐性症状, 与UC发病时间没有相关性. UC肺损伤发病机制为结肠与呼吸上皮起源于同一个胚胎组织, 结肠黏膜与呼吸黏膜免疫系统存在相似性[10], 肠道的致病变化可导致呼吸系统的损伤, 致使淋巴组织增敏与炎症的发生. 活化的炎性细胞在结肠组织产生炎性细胞因子, 如白介素(interleukin, IL)-6、肿瘤坏死因子(tumor necrosis factor, TNF)、IL-1β等, 与其他介质调节内皮细胞黏附分子, 促使白细胞迁移, 产生破坏性活性氧代谢产物, 诱发肺实质损害[11]. 复方血竭制剂可以通过血液流变学作用于全身[12], 具有活血化瘀、止血作用. 根据UC肺损伤的发病机制, 本实验通过BALB/c小鼠构建葡聚糖硫酸钠(dextran sulfate sodium, DSS)诱导的急性期UC动物模型, 复方血竭制剂干预作用后, 测定结肠和肺组织中IL-6表达量, 作为疗效观察与判断预后的指标, 为复方血竭制剂缓解UC及UC肺损伤提供实验依据.
SPF级♂BALB/c小鼠[北京维通利华实验动物中心, 许可证号: SCXK(京)2012-0001]60只, 7-8周龄, 体质量17.64-20.58 g, 饲养于中国人民解放军第309医院动物中心, 饲料购自北京科澳协力饲料有限公司. 所有的动物实验程序由该机构动物实验中心批准, 并通过动物伦理委员会批准. 复方血竭制剂[13]由中国人民解放军第309医院制剂室提供; DSS(美国MP公司, 分子量: 36000-50000, 含硫量: 17%); IL-6 ELISA试剂盒(美国BD公司); Anti-IL-6/HRP兔抗小鼠(博奥森生物); PV-6001山羊抗兔、DAB试剂盒(中杉金桥生物); Olympus BX51型显微镜; TRIzol(Ambion); SYBR(TOYOBO); 逆转录试剂盒(TOYOBO); 基因扩增仪(BIOER); 荧光定量PCR仪(Eppendorf).
1.2.1 造模: 根据Sobczak等[14]的方法建立4%DSS模型. 60只♂BALB/c小鼠通过随机化原则分成4组(n = 15), 正常组、DSS组、复方血竭制剂组、DSS+复方血竭制剂组, 实验室标准温度(23 ℃±2 ℃)和光(每12 h, 亮/暗循环), 全部小鼠适应环境喂养7 d. 第8天, 正常组小鼠自由饮用蒸馏水同时予以生理盐水1 mL灌胃; DSS组小鼠自由饮用4%DSS同时予以生理盐水1 mL灌胃; 复方血竭制剂组小鼠自由饮用蒸馏水同时予以复方血竭制剂[0.075 g/(kg•d)]1 mL灌胃; DSS+复方血竭制剂组小鼠自由饮用4%DSS同时予以复方血竭制剂[0.075 g/(kg•d)]1 mL灌胃, 每只小鼠自由觅食, 继续喂养10 d. 与DSS组小鼠比较DSS+复方血竭制剂组小鼠大便带血及便潜血明显减轻, 表明造模完成, 第11天处死小鼠取材.
1.2.2 标本采集: 低温环境中, 摘取小鼠眼球取血, 颈部脱臼处死小鼠, 沿腹中线开腹并开胸, 取出整个肺组织, 后钳夹盲肠部位, 分离距肛门6 cm结肠标本, 沿肠系膜纵向切开, 4 ℃生理盐水冲洗, 滤纸吸水后展开. 血液于室温静置后, 4 ℃、3000 r/min离心10 min, 取血清, 分装EP管, 储存于-20 ℃冰箱中, ELISA待用; 另取部分结肠与肺组织甲醛固定, 石蜡包埋, 留做病理与免疫组织化学; 部分结肠与肺组织储存-80 ℃冰箱, RT-QPCR待用.
1.2.3 症状体征观察及评分: 每日监测小鼠体质量变化、大便性状、大便隐血, 以及肉眼血便出现时间. 根据Naito等[15]方法进行疾病活动指数(disease activity index, DAI)评分. DAI评分: (1)体质量下降: 0 = 无; 1 = 1%-5%; 2 = 6%-10%; 3 = 11%-15%; 4 = 15%以上; DSS组小鼠体质量下降评分为3分, DSS+复方血竭制剂组小鼠体质量下降评分为1分或2分, 正常组、复方血竭制剂组小鼠体质量下降评分为1分; (2)大便性状: 0 = 正常; 2 = 稀便; 4 = 腹泻; (3)便血: 0 = 隐血(-); 2 = 隐血(+); 4 = 肉眼血便; DAI为体质量减轻、大便性状、便血总分的1/3. 根据Park等[16]方法进行结肠HI评分, 结肠石蜡切片后行HE染色, 显微镜下观察: (1)炎症的严重程度: 0 = 无; 1 = 轻度; 2 = 中度; 3 = 中度; (2)炎症深度: 0 = 无; 1 = 黏膜; 2 = 黏膜和黏膜下层; 3 = 全层; (3)隐窝损害: 0 = 无; 1 = 基底1/3损坏; 2 = 基底2/3损坏; 3 = 整个隐窝消失. 根据梁瑛等[17]方法进行HI评分: 炎性细胞浸润、上皮增生、黏膜损伤、基底增厚、炎性渗出、纤维组织增生、肺泡内出血、血栓形成, 以上每单项记1分, ≥3分认为存在呼吸系统症状.
1.2.4 ELISA方法检测结肠与肺组织中IL-6表达水平: -20 ℃冰箱中取出血清, 置于室温自溶. 严格按照ELISA试剂盒说明书操作. 最后测得450 nm处吸光度, 得出标准曲线计算IL-6浓度, 单位用pg/mg蛋白质表示.
1.2.5 免疫组织化学方法检测结肠与肺组织中IL-6表达量: 结肠与肺组织蜡块脱蜡、水化组织切片, 按Anti-IL-6/HRP、PV-6001、DAB染色试剂盒说明书操作, 复染、脱水、透明、封片. OLYMPUS BX51型光学显微镜进行观察, 染色结果以细胞内出现棕黄色颗粒为阳性表达, 每个样本观察5个高倍镜视野(×200目镜)计数阳性细胞百分比, 以阴性(-)、弱阳性(+-)、阳性(+)、强阳性(++)评估染色强度.
1.2.6 RT-QPCR检测结肠与肺组织中IL-6表达量: -80 ℃冰箱中取出待检测组织样品加TRIzol溶液, 提取mRNA, 根据逆转录试剂盒说明书, 配制逆转录体系, 置于基因扩增仪中, 37 ℃ 15 min, 98 ℃ 5 min, 4 ℃ 50 min, 将RNA逆转录成cDNA, 按SYBR荧光染料法配制扩增反应体系, 其中, IL-6上游引物: 5'-GAGGATACCACTCCCAACAGACC-3', 下游引物: 5'-AAGTGCATCATCGTTGTTCATACA-3'; β-actin上游引物: 5'-ATCACTATTGGCAACGAGCG-3', 下游引物: 5'-TCAGCAATGCCTGGGTACAT-3'. 配制反应体系后, 添加引物, 置于荧光定量PCR仪中, 反应条件为95 ℃ 30 s、95 ℃ 5 s、60 ℃ 5 s、72 ℃ 30 s, 40个循环. β-actin为内参对照, 结果以2-△△Ct表示IL-6 mRNA的相对表达量.
统计学处理 数据分析使用SPSS16.0, 各样本来自正态分布的总体, 且为相互独立的随机样本, 组间比较用单因素方差分析, 计数资料的组间比较用χ2检验. 连续变量分布说明用mean±SD表示, P<0.05为差异有统计学意义.
正常组、复方血竭制剂组小鼠活跃, 主动觅食, 呼吸均匀, 皮毛有光泽, 大便呈深褐色硬颗粒, 表面无黏液脓血. DSS组小鼠饮用4%DSS第3天开始活动减少, 蜷缩懒动, 嗜睡, 进食量下降, 体质量下降, 皮毛无光泽, 粪便变松软, 表面可见黏液脓血附着, 呼吸屏息或喘息样呼吸. DSS+复方血竭制剂组小鼠较正常组小鼠重, 较DSS组减轻.
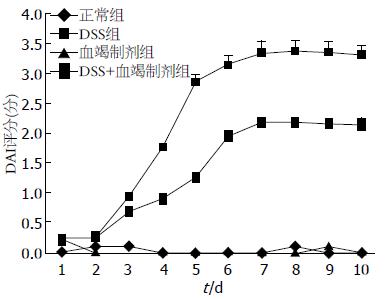
正常组、复方血竭制剂组小鼠饮食及活动状态正常, 体质量逐渐增加, 大便成型干燥, 无肉眼血便, 大便隐血实验阴性. DSS组小鼠于饮用4%DSS第3天, 部分小鼠便潜血阳性或弱阳性, 第4天, 便潜血阳性, 大便为糊状但不能黏附肛门的松散大便, 小鼠体质量下降. 饮用4%DSS第6天, 小鼠肛门周围红肿, 见肉眼血便, 大便糊状并黏着肛门, 体质量继续下降. 与DSS组小鼠比较, DSS+复方血竭制剂组症状减轻(图1).
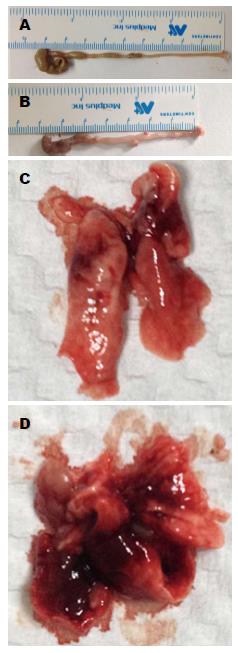
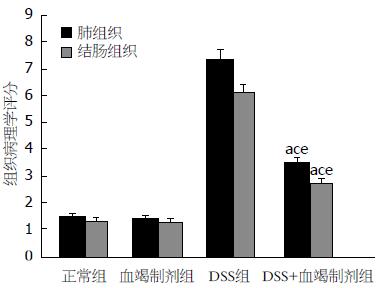
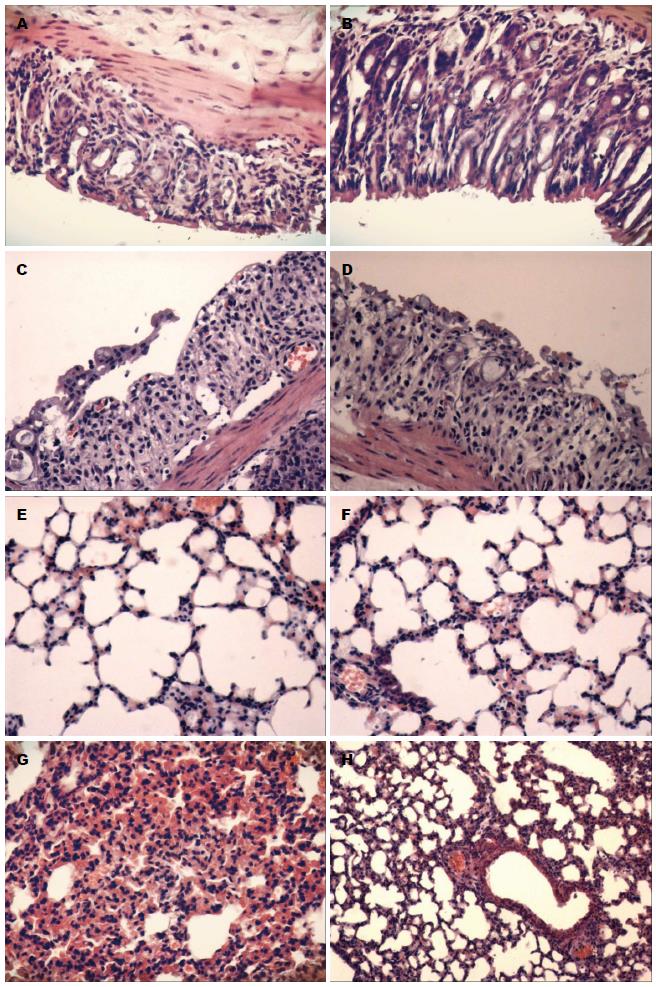
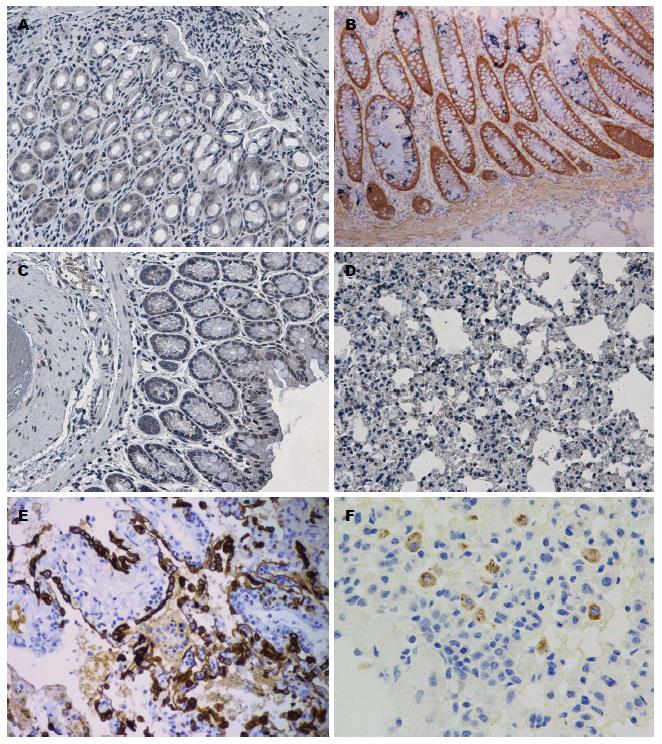
肉眼观察DSS组全部小鼠结肠标本缩短、水肿, 病变改变累及远端结肠与直肠; 肺脏可见明显淤血. 肺泡结构正常, 无炎性细胞及红细胞浸润. DSS组小鼠结肠病理组织可见中性粒细胞和淋巴细胞浸润, 黏膜与黏膜下层缺陷, 局部溃疡形成; 与正常组、复方血竭制剂组比较, DSS+复方血竭制剂组较重, 且结肠与肺组织发生炎症比率升高; 与DSS组比较, DSS+复方血竭制剂组减轻, 且结肠与肺组织发生炎症比率降低. 各组结肠组织与肺组织病理学评分, 结果差异有统计学意义(P<0.05)(图2-4).
显微镜下观察, 细胞内含有棕黄色颗粒为阳性细胞. 与正常组比较, DSS组、复方血竭制剂组阳性细胞个数明显增多(P<0.05); 与DSS组比较, DSS+复方血竭制剂组阳性细胞个数明显减少(P<0.05)(图5).
与正常组、复方血竭制剂组比较, DSS组和DSS+复方血竭制剂组IL-6均显著增高(P<0.05); 其中, DSS组IL-6明显高于DSS+复方血竭制剂组(P<0.05)(表1).
与正常组、复方血竭制剂组比较, DSS组和DSS+复方血竭制剂组IL-6均显著增高(P<0.05); 其中, DSS组IL-6明显高于DSS+复方血竭制剂组(P<0.05)(表2).
UC是免疫、环境等因素作用于肠道引发的一种慢性、复发性炎症[18], 主要累及黏膜和黏膜下层. 与克罗恩病(Crohn's disease, CD)一同被称为IBD. DSS诱导急性UC模型成熟, 国内外一致认可, 临床症状与病理组织镜下观察, 与人类UC相似. 在UC模型的基础上, 小鼠肺功能障碍及炎性细胞浸润, 说明小鼠结肠与肺组织之间存在密切联系. 血竭治疗UC的药理作用[19]包括: (1)活血化瘀、止血; (2)抗炎、镇痛; (3)抗菌; (4)降糖、降脂. 本课题组前期研究发现复方血竭制剂可以下调树突状细胞的抗原提呈能力, 阻断Toll样受体(Toll-like receptor, TLR)4/核因子-κB(nuclear factor κB, NF-κB)信号通路的转导[20], 可以降低促炎因子, 增加抑炎因子, 并取得较好的临床疗效, 也无明显不良反应[21], 但其具体作用机制有待进一步研究.
国外大量研究[22-24]表明UC患者常伴有肺部疾病, 包括间质性肺炎、广泛细支气管炎、炎症性气管狭窄、肺部纤维化、肉芽肿形成等. UC肺损伤是炎症过程驱动的, 属全身性疾病, 具有流行病学相关性. 最新研究[25]发现IL-6在UC肺损伤发生、发展中起重要作用, 是人类UC最主要的炎性细胞因子, 是炎症反应的重要调节剂, 是UC肺损伤重要的中间介质, 是先天性与适应性之间的桥梁, 可以通过反式信号传导激活细胞, 促进黏膜炎症反应, 导致症状发生. 针对炎性细胞因子可进一步了解肺部病变, 发现UC肠外疾病新的治疗策略[26,27]. 本实验, 与DSS组比较, DSS+复方血竭制剂组小鼠的一般情况、DAI评分、病理镜下观察及评分、免疫组织化学等结果明显减轻且有统计学意义(P<0.05). DSS诱导的急性UC, 主要是便血、体质量下降, 与DSS组比较, DSS+复方血竭制剂组小鼠体质量下降不明显, 便潜血减轻, DAI评分降低, 这些结果表明, 复方血竭制剂可以改善DSS诱导的急性UC的症状.
UC肺损伤可引起炎性细胞浸润, 产生炎性细胞因子、趋化因子、黏附分子、活性氧成分, 与免疫细胞和炎性细胞整合, 进入肠道与肺组织, 引发炎症反应[28]. IL-6上调内皮细胞表达, 募集嗜酸性粒细胞与单核细胞, 炎性细胞与内皮细胞之间相互作用, 使结肠与肺内皮功能障碍, 镜下病理观察支气管上皮的炎症病变类似于UC上皮病变, 尽管大部分UC患者临床症状不明显, 但潜在的肺部疾病仍然存在, 随着疾病进展可以导致气道壁破坏及不可逆的改变, 形成终末期肺部病变[5]. 本实验中, 通过ELISA测得DSS组小鼠血液中IL-6表达量明显升高, 从整体水平说明UC小鼠炎性因子表达升高, 而服用复方血竭制剂后的小鼠血液水平炎性因子表达下降, 说明复方血竭制剂对UC有缓解作用. 通过RT-QPCR在mRNA水平测得小鼠结肠与肺组织IL-6表达量, 说明IL-6在炎症作用中发挥作用, 与DSS+复方血竭制剂组比较DSS组小鼠IL-6炎性因子表达量明显上升, 提示复方血竭制剂在UC治疗过程中发挥作用, 对肺损伤也有缓解作用, 同时病理镜下观察及免疫组织化学观察阳性细胞表达个数, 更有利于说明复方血竭制剂有缓解炎症作用.
Yilmaz等[29]研究发现, UC肺损伤通过高分辨率CT和肺功能检查进行检测, 大多数患者有亚临床表现, 因此, UC肺损伤不可忽视, 否则将会破坏气道壁产生不可逆改变, 形成终末期肺病. 目前治疗UC的药物主要包括5-氨基水杨酸、抗生素、糖皮质激素, 尽管他们疗效得到肯定, 但患者容易形成耐受, 不能承受药物带来的不良反应, 并对患者生活质量产生影响[30], 因此需制定新药物. 本实验研究结果表明, 口服复方血竭制剂可以减少化学诱导小鼠UC及肺损伤, 降低IL-6炎性因子的表达量.
本实验测定结肠组织与肺组织中IL-6炎性细胞因子, 证实结肠发生损伤的同时, 肺组织也产生了炎症变化, 为UC肺损伤提供了理论依据, 为临床治疗提供实验证据, 可作为观察疗效及治疗指标之一. 本实验初步探讨UC模型中小鼠结肠组织与肺组织IL-6的表达, 以及复方血竭制剂治疗后IL-6表达, 从实验水平说明复方血竭制剂可以下调炎性因子IL-6表达量, 缓解小鼠实验性UC及UC肺损伤, 有关具体治疗调控机制还有待进一步研究. UC的肺外表现越来越多的受到认可, 呼吸系统参与UC的发生与发展, 肺功能可以从无症状发展到肺组织纤维化, 患者死亡风险增加, 且症状较重时, 会危及生命[31]. 本实验探讨复方血竭制剂, 为治疗UC及UC肺损伤带来新的希望.
近年来溃疡性结肠炎(ulcerative colitis, UC)的发病率逐年升高, 其UC肺损伤的发病率也呈逐年上升的趋势, UC肺损伤进一步发展, 可发生呼吸衰竭, 危及生命. 本实验探讨复方血竭制剂为治疗UC及UC肺损伤带来新的希望.
吴焕淦, 教授, 博士生导师, 上海市针灸经络研究所
中药及植物提取物是现在治疗UC的热点, 但复方血竭制剂少有报道. 通过测得小鼠结肠与肺组织白介素(interleukin, IL)-6表达量, 说明复方血竭制剂在UC治疗过程中发挥作用, 对肺损伤也有缓解作用.
本实验通过测定结肠组织与肺组织中IL-6炎性细胞因子, 证实结肠发生损伤的同时, 肺组织也产生了炎症变化, 为UC肺损伤提供了理论依据, 为临床治疗提供实验证据, 为治疗UC及UC肺损伤带来新的希望.
葡聚糖硫酸钠: 硫酸葡聚糖是葡聚糖的聚阴离子衍生物, 由葡聚糖和氯磺酸的酯化反应形成. 小鼠自由饮用, 可以制成类似人类UC的经典UC模型; 结肠组织病理学评分: 结肠组织病理学评分, 从炎症严重程度、炎症的深度、隐窝损害等方面综合评分, 来评价疾病的炎症轻重.
本文能从结肠和肠外表现研究, 具有一定的创新性, 对于临床研究具有一定的参考价值.
编辑: 韦元涛 电编:都珍珍
| 1. | Low D, Nguyen DD, Mizoguchi E. Animal models of ulcerative colitis and their application in drug research. Drug Des Devel Ther. 2013;7:1341-1357. [PubMed] [DOI] |
| 2. | Halpin SJ, Ford AC. Prevalence of symptoms meeting criteria for irritable bowel syndrome in inflammatory bowel disease: systematic review and meta-analysis. Am J Gastroenterol. 2012;107:1474-1482. [PubMed] [DOI] |
| 3. | Songür N, Songür Y, Tüzün M, Doğan I, Tüzün D, Ensari A, Hekimoglu B. Pulmonary function tests and high-resolution CT in the detection of pulmonary involvement in inflammatory bowel disease. J Clin Gastroenterol. 2003;37:292-298. [PubMed] [DOI] |
| 4. | Douglas JG, McDonald CF, Leslie MJ, Gillon J, Crompton GK, McHardy GJ. Respiratory impairment in inflammatory bowel disease: does it vary with disease activity? Respir Med. 1989;83:389-394. [PubMed] [DOI] |
| 5. | Ceyhan BB, Karakurt S, Cevik H, Sungur M. Bronchial hyperreactivity and allergic status in inflammatory bowel disease. Respiration. 2003;70:60-66. [PubMed] [DOI] |
| 6. | Saltzman K, Rossoff LJ, Gouda H, Tongia S. Mesalamine-induced unilateral eosinophilic pneumonia. AJR Am J Roentgenol. 2001;177:257. [PubMed] [DOI] |
| 7. | Sossai P, Cappellato MG, Stefani S. Can a drug-induced pulmonary hypersensitivity reaction be dose-dependent? A case with mesalamine. Mt Sinai J Med. 2001;68:389-395. [PubMed] |
| 8. | Turner-Warwick M. Fibrosing alveolitis and chronic liver disease. Q J Med. 1968;37:133-149. [PubMed] |
| 9. | Kraft SC, Earle RH, Roesler M, Esterly JR. Unexplained bronchopulmonary disease with inflammatory bowel disease. Arch Intern Med. 1976;136:454-459. [PubMed] [DOI] |
| 10. | van Lierop PP, Samsom JN, Escher JC, Nieuwenhuis EE. Role of the innate immune system in the pathogenesis of inflammatory bowel disease. J Pediatr Gastroenterol Nutr. 2009;48:142-151. [PubMed] [DOI] |
| 11. | Williams H, Walker D, Orchard TR. Extraintestinal manifestations of inflammatory bowel disease. Curr Gastroenterol Rep. 2008;10:597-605. [PubMed] [DOI] |
| 12. | 李 楠, 王 雪明, 吴 凯, 石 玉玲, 李 娜, 翟 俊山, 王 艳梅, 朱 超慧. 复方血竭灌肠液对慢性非特异性溃疡性结肠炎患者血液流变学的影响. 中国全科医学. 2006;9:2073-2074. |
| 14. | Sobczak M, Zakrzewski PK, Cygankiewicz AI, Mokrowiecka A, Chen C, Sałaga M, Małecka-Panas E, Kordek R, Krajewska WM, Fichna J. Anti-inflammatory action of a novel orally available peptide 317 in mouse models of inflammatory bowel diseases. Pharmacol Rep. 2014;66:741-750. [PubMed] [DOI] |
| 15. | Naito Y, Takagi T, Katada K, Uchiyama K, Kuroda M, Kokura S, Ichikawa H, Watabe J, Yoshida N, Okanoue T. Partially hydrolyzed guar gum down-regulates colonic inflammatory response in dextran sulfate sodium-induced colitis in mice. J Nutr Biochem. 2006;17:402-409. [PubMed] [DOI] |
| 16. | Park MY, Ji GE, Sung MK. Dietary kaempferol suppresses inflammation of dextran sulfate sodium-induced colitis in mice. Dig Dis Sci. 2012;57:355-363. [PubMed] [DOI] |
| 17. | 梁 瑛, 姚 天樵, 张 蔚, 刘 双, 杨 京华, 高 明哲, 廖 松林, 高 冬霞, 刘 从容. 哮喘与慢性支气管炎气道炎症的临床病理对比性研究. 中华结核与呼吸杂志. 1998;21:668-671. |
| 18. | Kim DS, Kim SJ, Kim MC, Jeon YD, Um JY, Hong SH. The therapeutic effect of chelidonic acid on ulcerative colitis. Biol Pharm Bull. 2012;35:666-671. [PubMed] [DOI] |
| 20. | 李 楠, 王 雪明, 翟 俊山, 稽 杨, 石 玉玲, 王 欣, 李 娜, 苏 丽, 沙 丽娜. 复方血竭对实验性结肠炎大鼠Toll样受体4/核因子-κB影响及树突状细胞表型的变化的研究. 中国组织工程研究. 2015;19:752-758. |
| 21. | 翟 俊山, 李 楠, 王 雪明, 张 林, 朱 超慧, 吴 凯. 复方血竭与柳氮磺吡啶灌肠治疗溃疡性结肠炎的疗效观察. 中国医院用药评价与分析. 2009;9:380-381. |
| 22. | Larsen S, Bendtzen K, Nielsen OH. Extraintestinal manifestations of inflammatory bowel disease: epidemiology, diagnosis, and management. Ann Med. 2010;42:97-114. [PubMed] [DOI] |
| 23. | Marten K, Fend F, Hautmann H, Kremer M, Rummeny EJ, Engelke C. Case report: Fatal acute exacerbation of usual interstitial pneumonia in ulcerative colitis. Br J Radiol. 2005;78:762-766. [PubMed] [DOI] |
| 24. | Kelly MG, Frizelle FA, Thornley PT, Beckert L, Epton M, Lynch AC. Inflammatory bowel disease and the lung: is there a link between surgery and bronchiectasis? Int J Colorectal Dis. 2006;21:754-757. [PubMed] [DOI] |
| 25. | Al-Rejaie SS, Abuohashish HM, Al-Enazi MM, Al-Assaf AH, Parmar MY, Ahmed MM. Protective effect of naringenin on acetic acid-induced ulcerative colitis in rats. World J Gastroenterol. 2013;19:5633-5644. [PubMed] [DOI] |
| 26. | Keely S, Talley NJ, Hansbro PM. Pulmonary-intestinal cross-talk in mucosal inflammatory disease. Mucosal Immunol. 2012;5:7-18. [PubMed] [DOI] |
| 27. | Liu Y, Wang XY, Yang X, Jing S, Zhu L, Gao SH. Lung and intestine: a specific link in an ulcerative colitis rat model. Gastroenterol Res Pract. 2013;2013:124530. [PubMed] [DOI] |
| 28. | Christophi GP, Rong R, Holtzapple PG, Massa PT, Landas SK. Immune markers and differential signaling networks in ulcerative colitis and Crohn's disease. Inflamm Bowel Dis. 2012;18:2342-2356. [PubMed] [DOI] |
| 29. | Yilmaz A, Yilmaz Demirci N, Hoşgün D, Uner E, Erdoğan Y, Gökçek A, Cağlar A. Pulmonary involvement in inflammatory bowel disease. World J Gastroenterol. 2010;16:4952-4957. [PubMed] [DOI] |
| 30. | Cui L, Feng L, Zhang ZH, Jia XB. The anti-inflammation effect of baicalin on experimental colitis through inhibiting TLR4/NF-κB pathway activation. Int Immunopharmacol. 2014;23:294-303. [PubMed] [DOI] |
| 31. | Ji XQ, Wang LX, Lu DG. Pulmonary manifestations of inflammatory bowel disease. World J Gastroenterol. 2014;20:13501-13511. [PubMed] [DOI] |