修回日期: 2014-10-22
接受日期: 2014-10-29
在线出版日期: 2014-12-08
目的: 研究四君子汤(Sijunzi decoctum, SJZD)对3%葡聚糖硫酸钠5000(dextran sulphate sodium, DSS)诱导的大鼠实验性溃疡性结肠炎的保护作用及对结肠组织GABA含量及其受体表达的影响.
方法: 40只♂Wistar大鼠随机分为正常组、模型组、SJZD低剂量(5.0 g/kg)组、SJZD中剂量(10.0 g/kg)组、SJZD高剂量(30.0 g/kg)组, 正常组正常饮食蒸馏水, 其余各组先以3%DSS诱导7 d建立大鼠溃疡性结肠炎模型, 后SJZD组按照不同剂量(5.0、10.0、30.0 g/kg)灌胃给予SJZD, 每天观察大鼠疾病活动指数(disease active index, DAI)评分. 2 wk后处死所有动物, 分离结肠, 行结肠组织损伤程度(colon macroscopic damage index, CMDI)评分. ELISA法测量血清白介素1β(interleukin-1β, IL-1β)、IL-4水平, 结肠组织匀浆测定超氧化物歧化酶(superoxide dismutase, SOD)、丙二醛 (malondialdehyde, MDA)含量, HE染色镜下观察病理变化, 免疫组织化学法SP法检测病变组织GABAA受体、GABAB受体的表达水平.
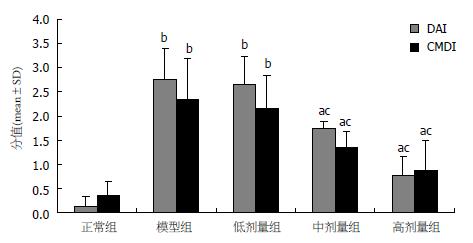
结果: 模型组动物结肠组织溃疡形成, 伴有大量炎性细胞浸润及充血、间质水肿等明显病理变化, SJZD摄入不同剂量可不同程度的改善病变, 模型组大鼠DAI、CMDI评分、血清IL-1β水平、组织匀浆MDA含量、结肠组织GABAA受体表达与正常比较均有明显升高(P<0.01); SJZD低、中、高剂量组上述各项指标亦明显增高; 模型组、SJZD低、中、高剂量组血清IL-4水平, 组织匀浆SOD含量与正常比较则明显降低(P<0.01); 各实验组结肠组织GABAB受体表达与正常比较无明显差异(P>0.05). 与模型组比较, SJZD中、高剂量摄入可有效逆转上述变化, 以高剂量组差异最为明显. SJZD低剂量组在血清IL-1β、IL-4水平, DAI、CMDI评分及GABAA受体、GABAB受体的表达水平几方面与模型组比较差异并无统计学意义(P>0.05). 各实验组结肠组织GABAB受体表达与模型组比较差异无统计学意义(P>0.05).
结论: 四君子汤可以明显改善DSS诱导的溃疡性结肠炎大鼠的炎症反应, 其作用机制可能与改善抗氧化自由基以及细胞因子水平有关; GABA主要通过其GABAA受体参与溃疡性结肠炎的病理生理过程, 四君子汤可明显影响GABAA受体表达水平.
核心提示: 四君子汤可以明显改善硫酸葡聚糖(dextran sulphate sodium)诱导的溃疡性结肠炎(ulcerative colitis, UC)大鼠的炎症反应, 其作用机制可能与改善抗氧化自由基以及改变细胞因子水平有关; γ-氨基丁酸(gamma-aminobutyric acid, GABA)受体在UC模型中表达明显增强, 四君子汤可明显影响GABA受体表达水平.
引文著录: 张燕翔, 鲁兵, 张恒文, 余万桂. 四君子汤抗大鼠溃疡性结肠炎及对结肠组织GABA受体表达的影响. 世界华人消化杂志 2014; 22(34): 5258-5265
Revised: October 22, 2014
Accepted: October 29, 2014
Published online: December 8, 2014
AIM: To observe the effects of Sijunzi decoction (SJZD) on expression of gamma-aminobutyric acid (GABA) receptors in dextran sulphate sodium (DSS)-induced ulcerative colitis (UC) in rats.
METHODS: Forty male Wistar rats were randomly divided into five groups: a normal group, a model group, low-, medium- and high-dose SJZD groups. The rats were given 3% DSS by intragastric administration for 7 consecutive days to induce UC. The normal group was given the distilled water, and SJZD (5.0, 10.0, and 30.0 g/kg) were given by intragastric administration in the three treatment groups. Scores of disease active index (DAI) were calculated. After 2 wk, all rats were sacrificed. Scores of colon macroscopic damage index (CMDI) were calculated; levels of serum IL-1β and IL-4 were measured by ELISA; colonic superoxide dismutase (SOD), malondialdehyde (MDA) and histological changes were recorded. Expression of GABAA and GABAB receptors in colonic tissue was examined by immunohistochemistry.
RESULTS: Rats of the model group showed ulcers, hyperemia, interstitial edema and infiltrated inflammatory cells. SJZD attenuated the severity of gross lesions and reduced the histopathological injuries. Compared with the normal group, DAI, CMDI, levels of serum IL-1β, MDA activity and expression of GABAA receptor had a significant increase in the model group (P < 0.01), as well as in the three SJZD groups. Levels of serum IL-4 and colonic SOD activity were significantly decreased in the model group and the three SJZD groups (P < 0.01). Expression of GABAB receptor showed no significant changes compared with the normal group (P > 0.05). Compared with the model group, medium- and high-dose SJZD groups had improvement of the above indexes, with the effects being more prominent in the high-dosage group. DAI, CMDI, levels of serum IL-1β, IL-4, expression of GABAA receptor and GABAB receptor in the low-dose SJZD group showed no significant changes compared with the model group (P > 0.05). Expression of GABAB receptor showed no significant changes compared with the normal group (P > 0.05).
CONCLUSION: SJZD can ameliorate inflammation in DSS-induced UC rats via mechanisms that are most likely due to anti-oxidation and inhibition of inflammatory cytokines. GABA may play an important role in the pathogenesis of UC thorough its GABAA receptor. The expression of GABAA receptor can be significantly changed by SJZD treatment.
- Citation: Zhang YX, Lu B, Zhang HW, Yu WG. Effect of Sijunzi decoction on expression of gamma-aminobutyric acid receptors in dextran sulfate-induced ulcerative colitis in rats. Shijie Huaren Xiaohua Zazhi 2014; 22(34): 5258-5265
- URL: https://www.wjgnet.com/1009-3079/full/v22/i34/5258.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i34.5258
大脑中主要的抑制性神经递质γ-氨基丁酸(gamma-aminobutyric acid, GABA)在哺乳动物体内广泛存在, 也是肠神经丛(enteric nervous system, ENS)内重要的神经递质之一[1]. 已有研究[2]表明, 在GABA受体介导下, GABA不仅可以影响消化运动和功能, 还可能参与到上皮细胞的增殖调节与分化成熟过程[3,4]. 溃疡性结肠炎(ulcerative colitis, UC)是炎性肠道疾病(inflammatory bowel disease, IBD)中一种重要类型, 是以肠道黏膜溃疡形成和慢性非特异性炎症为主的一种消化系疾病, 以腹痛、腹泻、黏液脓血便和里急后重为主要临床表现, 病程迁延, 难以治愈, 易于复发和癌变, 是现代难治病之一[5-7]. 流行病学资料提示UC的发病率不论在国内和国外都有逐年增高的趋势[8,9]. 四君子汤(Sijunzi decoctum, SJZD)具有调节胃肠运动、改善肠道黏膜免疫功能、抗衰老、抗肿瘤、抗消化性溃疡等作用[10,11], 但对溃疡性结肠炎的治疗目前尚未见相关实验研究的报道. 本研究以SJZD几种常用剂量为参考, 观察三种不同剂量SJZD对UC大鼠的治疗效果, 并初步探讨作用机制及对GABA受体表达的影响.
成年♂Wistar大鼠40只, 体质量250 g±10 g, SPF级, 由湖北省实验动物研究中心提供(动物中心许可证号为SCXK2008-005, 动物合格证号为00003033); 硫酸葡聚糖(dextran sulphate sodium, DSS)购自上海西宝生物科技有限公司; 四君子汤以人参、白术、茯苓、甘草按照体质量比10:9:9:6配方而成; GABAA受体和GABAB受体由Sigma公司提供; 免疫组织化学SP试剂盒、DAB显色试剂盒购自福州迈新生物制品有限公司; 白介素-1β(interleukin-1β, IL-1β)、IL-4 ELISA试剂盒购自南京建成生物工程研究所.
1.2.1 分组与给药: 40只大鼠随机分为5组: 正常组、模型组、SJZD低剂量组、SJZD中剂量组、SJZD高剂量组, 每组各8只. 正常组自由饮用蒸馏水, 其余各组先自由饮用含3%DSS的蒸馏水7 d诱导建立大鼠溃疡性结肠炎模型, 7 d后正常组及模型组每天给予生理盐水5 mL灌胃, SJZD低、中、高剂量组分别以5.0、10.0、30.0 g/kg灌胃治疗, 1次/d, 连续2 wk.
1.2.2 血清IL-1β、IL-4含量测定: 治疗2 wk后乙醚麻醉, 颈动脉取血, 按ELISA试剂盒说明书操作检测血清IL-1β、IL-4含量, 结果用ng/L表示.
1.2.3 大鼠疾病活动指数(disease active index, DAI)评分及行结肠组织损伤程度(colon macroscopic damage index, CMDI)评分: 所有大鼠实验过程中密切监测体质量和大便性状, 按照标准[12], 进行DAI评分(表1). 乙醚麻醉, 颈动脉取血完毕立刻开腹, 全取结肠, 沿结肠系膜剪开肠腔, 寻找组织水肿, 溃疡病灶处剪取长2 cm及2 mm肠段2段, 其中2 mm肠管经4%中性甲醛(分析纯甲醛110 mL、无水磷酸氢二钠16 g、磷酸二氢钠4 g、加纯化水至1000 mL)固定, 梯度乙醇脱水, 常规石蜡包埋后切片行HE染色, 参考标准[13], CMDI评分(表2).
| 分数 | 体质量下降(%) | 大便性状 | 便血 |
| 0 | 无 | 正常 | 正常 |
| 1 | 1-5 | ||
| 2 | 6-10 | 松散 | 潜血阳性 |
| 3 | 11-15 | ||
| 4 | >15 | 腹泻 | 肉眼血便 |
| 分数 | 肉眼观察结肠特征 |
| 0 | 无损伤 |
| 1 | 黏膜充血、水肿, 未出现黏膜糜烂或溃疡 |
| 2 | 黏膜充血、水肿、黏膜粗糙, 轻度糜烂或肠黏连 |
| 3 | 黏膜高度充血、水肿、中度糜烂, 有溃疡形成, 但溃疡直径<1 cm |
| 4 | 包含3分病变, 且溃疡直径≥1 cm, 或全肠壁坏死 |
1.2.4 结肠组织GABAA受体和GABAB受体免疫组织化学测定: 石蜡切片按照SP试剂盒说明书进行免疫组织化学染色, 以PBS代替一抗作阴性对照, DAB显色, 苏木素衬染, 中性树胶封固. ImagePro Plus 6.0医学图像分析系统(Media Cybernetics, USA)光镜下(×400)分析免疫组织化学切片, 对各切片中各抗体不透光率密度(A)半定量分析, 以A值代表染色强度, A值越大, 染色强度越大. 所得数据采取mean±SD表示.
1.2.5 大鼠结肠组织超氧化物歧化酶(superoxide dismutase, SOD)、丙二醛(malondialdehyde, MDA)含量测定: 溃疡病灶处剪取长2 cm肠管入液氮速冻, 冰浴研磨成10%组织匀浆, -70 ℃冻存, 后采用黄嘌呤氧化酶法测定SOD含量, TBA法测定MDA含量.
统计学处理 各组间数据采取t检验分析, 应用SPSS13.0软件进行统计分析, 各项数据采取mean±SD表示, P<0.05为差异有统计学意义.
与正常组比较, 模型组IL-1β水平显著升高(P<0.01), SJZD低、中、高剂量组IL-1β水平亦升高(P<0.05), 与模型组比较, SJZD中、高剂量组IL-1β水平降低(P<0.05), SJZD低剂量组与模型组比较差异无统计学意义(P>0.05). 与正常组比较, 模型组IL-4含量显著降低(P<0.01), SJZD低、中、高剂量组亦降低(P<0.05). 与模型组比较, SJZD中、高剂量组IL-4水平升高(P<0.05), 低剂量组IL-4水平升高不明显(P>0.05)(表3).
与正常组比较, 模型组大鼠结肠匀浆中SOD活力显著降低(P<0.01), SJZD低剂量组亦降低(P<0.05), SJZD中、高剂量组SOD活力差异无统计学意义(P>0.05); 与模型组比较, SJZD低剂量组SOD活力升高(P<0.05), SJZD中、高剂量组SOD活力则显著升高(P<0.01). 与正常组比较, 模型组大鼠结肠匀浆中MDA显著升高(P<0.01), SJZD低剂量组亦升高(P<0.05), 中、高剂量组MDA差异无统计学意义(P>0.05); 与模型组比较, SJZD低剂量组MDA降低(P<0.05), 中、高剂量组MDA显著降低(P<0.01)(表4).
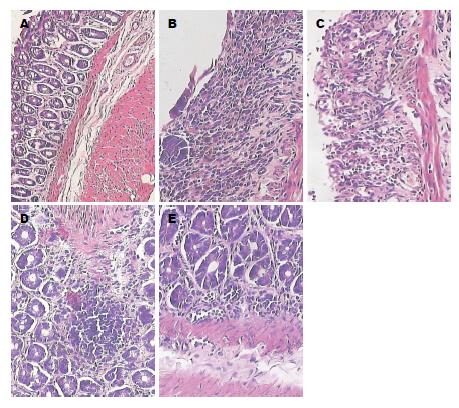
正常组大鼠如常活动, 饮食、体质量、排便情况均无异常. 结肠黏膜光滑无黏连, 镜下黏膜完整, 未见糜烂及溃疡. 其余各组摄入3%DSS后, 当日即可观察到大鼠精神萎靡, 毛发蓬松, 第5天, 均可见到大便性状改变, 为暗黄色稀便或半稀便, 潜血阳性, 到第7天, 出现明显肉眼血便, 匍匐不动, 进食减少, 体质量下降. 模型组镜下见结肠黏膜充血水肿, 病灶可见溃疡形成. 溃疡面上皮已缺失, 上皮下层及肌层破坏, 炎性细胞浸润, 肉芽组织形成. SJZD低剂量组上皮修复不佳, 病灶处依然充血水肿, 有溃疡形成, 炎性细胞浸润. SJZD中、高剂量组大鼠给药7 d症状有不同程度缓解, 饮食、体质量均有所恢复, 便血例数也明显减少, 2 wk后, 黏液血便明显减轻, 粪便已成形, 镜下见溃疡愈合, 充血水肿明显减轻, 上皮层修复. 与正常组比较, 模型组、SJZD低剂量组DAI及CMDI显著高于正常组(P<0.01), SJZD中、高剂量组亦显著增高(P<0.05). 与模型组比较, SJZD中、高剂量组DAI及CMDI显著降低(P<0.05). SJZD低剂量组与模型组比较, 差异无统计学意义(P>0.05), 各组DAI及CMDI变化如图1, 组织形态改变如图2.
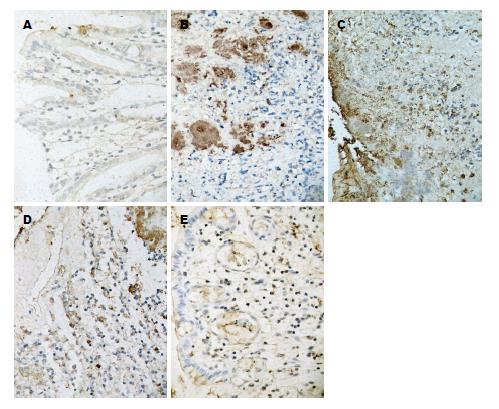
正常组大鼠结肠上皮GABAA受体和GABAB受体免疫阳性反应主要定位于腔面顶部和隐窝上皮细胞的胞质, 呈零星表达, 棕黄色, 此外肌层中肌间神经丛的神经纤维亦可涉及. 与正常组比较, 模型组溃疡面上皮脱失, GABAA受体免疫阳性反应主要定位于附近残存的腺上皮细胞胞质以及肉芽组织的间质细胞胞质中, 此外肌层中肌间神经丛的神经纤维亦可涉及, 其表达明显增强, A值明显升高(P<0.01), GABAB受体表达依然零星, 与正常组差异无统计学意义(P>0.05). SJZD低、中、高剂量组GABAA受体表达与正常组比较亦明显升高, A值升高明显(P<0.05)(图3). 与模型组比较, SJZD中、高剂量组GABAA受体表达A值显著降低(P<0.05)SJZD低剂量组GABAA受体表达A值与模型组比较差异无统计学意义(P>0.05), GABAB受体在各实验组中均呈零星表达, 各组表达均无统计学意义(P>0.05)(表5).
以DSS造模的方法是化学药物诱导建立实验性UC模型的常用方法之一, 其他能够诱导建立UC模型的常见药物还有乙酸[14]、恶唑酮[15]和2,4,6-三硝基苯磺酸(TNBS)[16]等. DSS是由蔗糖合成的硫酸盐形式结合形成的脂多糖, 可通过抑制肠道上皮细胞增生, 破坏肠道黏膜屏障功能, 进而使肠腔免疫功能紊乱, 菌群失调, 导致UC的形成[17,18]. 实验操作简单方便, 成功率高. 本实验以DSS诱导建立UC模型, 产生的临床症状与UC相同, DAI指数较正常组明显升高, 且结肠大体病变与镜下形态改变均与人类UC类似, CMDI指数较正常组亦明显增高. SJZD能有效下调DAI和CMDI指数, 说明SJZD治疗能有效患者UC临床症状, 减轻结肠黏膜损伤.
在大量的关于IBD的探讨中, 各种调节免疫的细胞因子都不可避免的涉及其中, 他们不但能够驱动中性粒细胞和巨噬细胞的炎性浸润, 还参与介导了肠道黏膜免疫的异常和的黏膜损伤[19,20]. IL-1由单核巨噬细胞产生, 可以对中性粒细胞产生趋化作用, IL-1β是其分泌形式, IL-1β水平升高会引起肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)等致炎因子水平增高加重炎症反应, 被公认为是能够介导UC发病的主要细胞因子[21]. IL-4是CD4+ T细胞来源的细胞因子, 可通过激活STAT6途径, 诱导CD4细胞向Th2细胞表型分化, 进而产生IgE等抗体介导超敏反应和体液免疫[22]. IL-4不仅可抑制单核巨噬细胞产生IL-1β和TNF-α, 抑制前列腺素E2和IL-8产生, 抑制单核巨噬细胞活化后的氧自由基的分泌, 还能通过诱导IL-1α产生, 提高IL-1α/IL-1β比例, 从而发挥其抑炎作用[23,24]. 在本实验中, 模型组相较于正常组大鼠, 其血清IL-1β水平明显升高而IL-4明显下降, 但SJZD治疗能有效的下调IL-1β, 上调IL-4, 通过调节免疫, 达到抗炎的效果, 并在实验范围内, 随剂量增加, 效应随之增强.
已有临床研究[25,26]资料表明, UC患者结肠抗氧化系统缺陷, 氧自由基代谢障碍, 大量的自由基残存能加重炎性反应, 损伤自身, 抗氧化治疗能有效的防治结肠黏膜的损伤. 在本实验中, 模型组相较于正常组大鼠, 结肠匀浆中SOD活力显著降低, MDA显著升高, 符合临床UC研究资料; 而SJZD治疗能有效逆转这种变化, 并在实验范围内, 随剂量增加, 效应增强, 说明SJZD具有一定程度的抗自由基损伤的作用.
GABA在脑内由谷氨酸脱羧经由GABA旁路生成, 构型灵活多变, 以两性离子的形式存在, 可与多种受体结合发挥多种生理功能, 其受体主要可分为两类: 即GABAA受体和GABAB受体[27]. GABA不仅是大脑中主要的抑制性神经递质, 还对中枢神经系统以外的多种组织的形态发生及成熟起重要作用[3]. GABA不仅能通过GABAA受体影响肝细胞的再生活性[28], 还能影响前列腺癌以及结肠癌细胞的增殖活性[29,30]. GABAB受体则主要在上皮细胞的恶性转化、浸润及转移的过程中起作用[30,31], 亦可在GABA诱导肿瘤细胞凋亡过程中起到重要作用[32]. 在本试验中, 可以观察到GABAA受体和GABAB免疫阳性反应主要定位于腔面顶部和隐窝上皮细胞的胞质中, 呈棕黄色零星表达. 在UC模型中, GABAA受体免疫阳性反应主要定位于附近残存的腺上皮细胞胞质以及肉芽组织的间质细胞胞质中, 此外肌层中肌间神经丛的神经纤维亦可涉及, 亦与相关报道吻合, 在UC模型中, GABAA受体表达增强, GABAB的表达却未明显增强的情况, 可能说明GABA主要是通过GABAA受体介导细胞内钙离子浓度升高, 诱导细胞膜去极化, 抑制DNA合成, 从而降低UC上皮细胞的修复性增生活性. SJZD治疗后, 上皮细胞修复, GABAA受体表达明显减少, 说明SJZD可以有效治疗UC, 降低炎症反应, 从而辅助上皮细胞的修复.
总之, 四君子汤可以明显改善DSS诱导的溃疡性结肠炎大鼠的炎症反应, 其作用机制可能与改善抗氧化自由基以及改变细胞因子水平有关; GABA主要通过其GABAA受体参与溃疡性结肠炎的病理生理过程, 四君子汤可明显影响GABAA受体表达水平.
溃疡性结肠炎(ulcerative colitis, UC)是以肠道黏膜溃疡形成和慢性非特异性炎症为主的一种消化系疾病, 至今尚无良好的根治办法. 目前, 有文献认为祖国传统中药四君子汤(Sijunzi decoctum, SJZD)制剂对UC有一定治疗作用. 大脑中主要的抑制性神经递质γ-氨基丁酸(gamma-aminobutyric acid, GABA)在其受体介导下, 参与上皮细胞的增殖调节与分化成熟, 抑制细胞的再生活性, 从而在UC上皮细胞损伤过程中起作用.
杜奕奇, 副教授, 中国人民解放军第二军医大学长海医院
GABA在脑内由谷氨酸脱羧经由GABA旁路生成, 构型灵活多变, 以两性离子的形式存在, 可与多种受体结合发挥多种生理功能. GABA不仅是大脑中主要的抑制性神经递质, 还对中枢神经系统以外的多种组织的形态发生及成熟起重要作用. 本研究以SJZD几种常用剂量为参考, 观察三种不同剂量SJZD对UC大鼠的治疗效果, 并初步探讨作用机制及对GABA受体表达的影响.
Wang等研究认为GABA在GABA受体介导下, 可能参与到上皮细胞的增殖调节与分化成熟过程; Kaita等则报道了环丙沙星拮抗GABAA受体表达后, 能显著增强肝细胞的再生活性; 在结肠癌、前列腺癌、胃癌相关研究的文献报道中, 肿瘤组织内亦能观察到GABA受体表达明显影响肿瘤细胞增殖活性、浸润、转移以及肿瘤细胞凋亡的病理生理过程.
本研究首次观察到在UC病程发展过程中GABA受体表达的不同变化, 发现GABA主要是通过GABAA受体介导细胞内钙离子浓度升高, 诱导细胞膜去极化, 抑制DNA合成, 从而降低UC上皮细胞的修复性增生活性; 并首次应用传统中药制剂进行干预, 发现SJZD可以明显改善DSS诱导的UC大鼠的炎症反应, 其作用机制可能与改善抗氧化自由基以及改变细胞因子水平有关, 并能明显影响GABAA受体表达水平.
课题研究以硫酸葡聚糖5000(DSS)诱导大鼠UC动物模型, 按照不同剂量(5.0、10.0、30.0 g/kg)灌胃给予SJZD, 观察细胞因子水平抗氧化自由基水平的变化, 探讨不同药物剂量下UC结肠组织的病理改变和GABA受体表达差异, 以期对以UC等炎性肠道疾病的防治提供科学依据.
本文对于阐明中药SJZD对UC的治疗作用有较高价值, 具有较高的临床指导意义.
编辑: 郭鹏 电编:闫晋利
| 1. | Watanabe M, Maemura K, Kanbara K, Tamayama T, Hayasaki H. GABA and GABA receptors in the central nervous system and other organs. Int Rev Cytol. 2002;213:1-47. [PubMed] |
| 2. | Seifi M, Brown JF, Mills J, Bhandari P, Belelli D, Lambert JJ, Rudolph U, Swinny JD. Molecular and functional diversity of GABA-A receptors in the enteric nervous system of the mouse colon. J Neurosci. 2014;34:10361-10378. [PubMed] [DOI] |
| 3. | Wang FY, Zhu RM, Maemura K, Hirata I, Katsu K, Watanabe M. Expression of gamma-aminobutyric acid and glutamic acid decarboxylases in rat descending colon and their relation to epithelial differentiation. Chin J Dig Dis. 2006;7:103-108. [PubMed] |
| 4. | Tamayama T, Maemura K, Kanbara K, Hayasaki H, Yabumoto Y, Yuasa M, Watanabe M. Expression of GABA(A) and GABA(B) receptors in rat growth plate chondrocytes: activation of the GABA receptors promotes proliferation of mouse chondrogenic ATDC5 cells. Mol Cell Biochem. 2005;273:117-126. [PubMed] |
| 5. | Hisamatsu T, Kanai T, Mikami Y, Yoneno K, Matsuoka K, Hibi T. Immune aspects of the pathogenesis of inflammatory bowel disease. Pharmacol Ther. 2013;137:283-297. [PubMed] [DOI] |
| 7. | Seo GS, Chae SC. Biological therapy for ulcerative colitis: An update. World J Gastroenterol. 2014;20:13234-13238. [PubMed] [DOI] |
| 8. | Jiang XL, Cui HF. An analysis of 10218 ulcerative colitis cases in China. World J Gastroenterol. 2002;8:158-161. [PubMed] |
| 9. | Park SJ, Kim WH, Cheon JH. Clinical characteristics and treatment of inflammatory bowel disease: a comparison of Eastern and Western perspectives. World J Gastroenterol. 2014;20:11525-11537. [PubMed] [DOI] |
| 12. | Wang X, Yang J, Cao Q, Tang J. Therapeutic efficacy and mechanism of water-soluble extracts of Banxiaxiexin decoction on BALB/c mice with oxazolone-induced colitis. Exp Ther Med. 2014;8:1201-1204. [PubMed] [DOI] |
| 13. | Myers KJ, Murthy S, Flanigan A, Witchell DR, Butler M, Murray S, Siwkowski A, Goodfellow D, Madsen K, Baker B. Antisense oligonucleotide blockade of tumor necrosis factor-alpha in two murine models of colitis. J Pharmacol Exp Ther. 2003;304:411-424. [PubMed] [DOI] |
| 14. | Minaiyan M, Ghassemi-Dehkordi N, Mahzouni P, Ahmadi NS. Anti-inflammatory effect of Helichrysum oligocephalum DC extract on acetic acid - Induced acute colitis in rats. Adv Biomed Res. 2014;3:87. [PubMed] [DOI] |
| 15. | Kaneko A, Kono T, Miura N, Tsuchiya N, Yamamoto M. Preventive Effect of TU-100 on a Type-2 Model of Colitis in Mice: Possible Involvement of Enhancing Adrenomedullin in Intestinal Epithelial Cells. Gastroenterol Res Pract. 2013;2013:384057. [PubMed] [DOI] |
| 16. | Motavallian A, Minaiyan M, Rabbani M, Andalib S, Mahzouni P. Involvement of 5HT3 Receptors in Anti-Inflammatory Effects of Tropisetron on Experimental TNBS-Induced Colitis in Rat. Bioimpacts. 2013;3:169-176. [PubMed] [DOI] |
| 17. | Okayama M, Tsubouchi R, Nishio H, Kato S, Takeuchi K. Protective effect of intra-rectal administration of rebamipide on dextran sulfate sodium-induced rat colitis. Digestion. 2004;70:240-249. [PubMed] |
| 18. | Randhawa PK, Singh K, Singh N, Jaggi AS. A review on chemical-induced inflammatory bowel disease models in rodents. Korean J Physiol Pharmacol. 2014;18:279-288. [PubMed] [DOI] |
| 19. | Aleisa AM, Al-Rejaie SS, Abuohashish HM, Ola MS, Parmar MY, Ahmed MM. Pretreatment of Gymnema sylvestre revealed the protection against acetic acid-induced ulcerative colitis in rats. BMC Complement Altern Med. 2014;14:49. [PubMed] [DOI] |
| 20. | Wirtz S, Neurath MF. Animal models of intestinal inflammation: new insights into the molecular pathogenesis and immunotherapy of inflammatory bowel disease. Int J Colorectal Dis. 2000;15:144-160. [PubMed] [DOI] |
| 21. | Al-Rejaie SS, Abuohashish HM, Al-Enazi MM, Al-Assaf AH, Parmar MY, Ahmed MM. Protective effect of naringenin on acetic acid-induced ulcerative colitis in rats. World J Gastroenterol. 2013;19:5633-5644. [PubMed] [DOI] |
| 22. | Roberts-Thomson IC, Fon J, Uylaki W, Cummins AG, Barry S. Cells, cytokines and inflammatory bowel disease: a clinical perspective. Expert Rev Gastroenterol Hepatol. 2011;5:703-716. [PubMed] [DOI] |
| 23. | Peng X, Li X, Wang W, Li N, Ma J, Shen S. [Expression of Th1/Th2 inflammatory cytokines in rat treatment model of ulcerative colitis]. Zhongnan Daxue Xuebao Yixueban. 2013;38:1020-1028. [PubMed] [DOI] |
| 24. | Műzes G, Molnár B, Tulassay Z, Sipos F. Changes of the cytokine profile in inflammatory bowel diseases. World J Gastroenterol. 2012;18:5848-5861. [PubMed] [DOI] |
| 25. | Dagli U, Balk M, Yücel D, Ulker A, Over H, Saydam G, Sahin B. The role of reactive oxygen metabolites in ulcerative colitis. Inflamm Bowel Dis. 1997;3:260-264. [PubMed] |
| 26. | Dryden GW, Deaciuc I, Arteel G, McClain CJ. Clinical implications of oxidative stress and antioxidant therapy. Curr Gastroenterol Rep. 2005;7:308-316. [PubMed] |
| 27. | 赵 华颖, 章 劲夫. γ-氨基丁酸及其受体的研究进展. 中华临床医师杂志(电子版). 2012;6:4026-4028. |
| 28. | Kaita KD, Assy N, Gauthier T, Zhang M, Meyers AF, Minuk GY. The beneficial effects of ciprofloxacin on survival and hepatic regenerative activity in a rat model of fulminant hepatic failure. Hepatology. 1998;27:533-536. [PubMed] |
| 29. | Miao Y, Zhang Y, Wan H, Chen L, Wang F. GABA-receptor agonist, propofol inhibits invasion of colon carcinoma cells. Biomed Pharmacother. 2010;64:583-588. [PubMed] [DOI] |
| 30. | Abdul M, Mccray SD, Hoosein NM. Expression of gamma-aminobutyric acid receptor (subtype A) in prostate cancer. Acta Oncol. 2008;47:1546-1550. [PubMed] [DOI] |
| 31. | 朱 人敏, 秦 苏堤, 汪 芳裕, 何 小平, 王 震凯, 许 文安, 金 鑫鑫, 王 琳. 人胃癌组织中γ-氨基丁酸含量及其受体和谷氨酸脱羧酶的表达. 中华消化杂志. 2005;25:684-685. |
| 32. | Tian H, Wu JX, Shan FX, Zhang SN, Cheng Q, Zheng JN, Pei DS. Gamma-Aminobutyric Acid Induces Tumor Cells Apoptosis via GABABR1·β-Arrestins·JNKs Signaling Module. Cell Biochem Biophys. 2014; Sep 19. [Epub ahead of print]. [PubMed] [DOI] |