修回日期: 2014-05-25
接受日期: 2014-06-06
在线出版日期: 2014-07-28
目的: 观察水飞蓟素(silymarin)对实验性高脂血症模型小鼠脂质代谢的影响.
方法: 喂饲法建立高脂血症模型小鼠, 实验设空白对照组、模型对照组、阳性对照组、水飞蓟素组和虎杖提取物组共5组, 灌胃给药4 wk, 每周称质量1次. 4 wk后分别测定血清中总胆固醇(total cholesterol, TC)、甘油三酯(triglyceride, TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholestero, HDL-C)、丙二醛(malondialdehyde, MDA)含量和谷丙转氨酶(alanine transaminase, ALT)、谷草转氨酶(aspartate transaminase, AST)、超氧化物歧化酶(superoxide dismutase, SOD)的活性. 实时定量PCR和Western blot检测Sirt1基因的表达, 以确定Sirt1的活性.
结果: 灌胃给药4 wk后, 与空白对照组和模型对照组比较, 阳性对照组、水飞蓟素组和虎杖提取物组均能够显著降低小鼠血液中TC、TG和MDA含量水平(P<0.05), 升高血清中HDL-C水平和SOD活性(P<0.05); 此外, 阳性对照组、水飞蓟素组和虎杖提取物组中ALT、AST活性升高(P<0.05). PCR和Western blot结果显示阳性对照组和水飞蓟素组对Sirt1基因的表达具有抑制作用(P<0.05). 而虎杖提取物对Sirt1基因的表达具有上调作用(P<0.05).
结论: 中药虎杖提取物及水飞蓟素成分有拮抗高脂血症的功效, 但其作用的分子机制有一定的差异.
核心提示: 水飞蓟素干预以喂饲法建立高脂血症模型小鼠, 可以降低大鼠血脂, 筛选出降血脂的中药处方, 应用实验动物研究其降脂作用, 为进一步临床应用提供依据.
引文著录: 计慧. 水飞蓟素和虎杖提取物对高脂血症模型小鼠脂质代谢的影响及其机制. 世界华人消化杂志 2014; 22(21): 3072-3076
Revised: May 25, 2014
Accepted: June 6, 2014
Published online: July 28, 2014
AIM: To investigate the effect of silymarin and Polygonum cuspidatum extract on lipid metabolism in mice with hyperlipidemia and the underlying molecular mechanisms.
METHODS: Mice were randomly divided into five groups: a control group, a model group, a positive group, a silymarin group and a Polygonum cuspidatum extract group. The control group was given a normal diet, while the other groups were fed a high-fat diet to induce hyperlipidemia. After induction, the silymarin group and Polygonum cuspidatum extract group were intragastrically administered with silymarin and Polygonum cuspidatum extract for 4 wk, respectively, while the normal control and positive group were administrated with saline and simvastatin, respectively. After 4 wk, all the rats were sacrificed and serum contents of total cholesterol (TC), triglyceride (TG), high-density lipoprotein cholesterol (HDL-C), and malondialdehyde (MDA), and activities of alanine transaminase (ALT), aspartate transaminase (AST), and superoxide dismutase (SOD) were measured. Real-time quantitative PCR and Western blot were used to measure Sirt1 expression.
RESULTS: After treatment for 4 wk, TC, TG and MDA levels were significantly decreased, and HDL-C levels and SOD activity were significantly increased in the positive group, silymarin group and Polygonum cuspidatum extract group compared with the model group (P < 0.05). Compared with the model group, the activities of ALT and AST were significantly increased in the three treatment groups (P < 0.05). PCR and Western blot results showed that simvastatin and silymarin had an inhibitory effect on Sirt1 expression (P < 0.05), while Polygonum cuspidatum extract promoted Sirt1 expression (P < 0.05).
CONCLUSION: Silymarin and Polygonum cuspidatum extract have therapeutic effects on hyperlipidemia possibly via different mechanisms.
- Citation: Ji H. Effect of silymarin and Polygonum cuspidatum extract on lipid metabolism in mice with hyperlipidemia. Shijie Huaren Xiaohua Zazhi 2014; 22(21): 3072-3076
- URL: https://www.wjgnet.com/1009-3079/full/v22/i21/3072.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i21.3072
虎杖入药的历史悠久, 中医上对其的评价是其味微苦, 性平, 具有活血通络, 清热利湿功效. 现代的药学研究表明其主要含蒽醌类大黄素等和芪类衍生物白藜芦醇(resveratrol, Res)等成分[1]. 研究发现虎杖中可提取出白藜芦醇[2]. 洪志哲等[3]的研究表明其具有抗氧化、清除自由基、防止老化、抗肿瘤、保护心血管和保肝的生物学功效, 且被认为是Sirt1激动剂, 可以上调Sirt1的表达. 水飞蓟素(silymarin)是菊科水飞蓟属植物水飞蓟干燥种子中提取分离出来的有效成分的总称, 主要用于治疗急、慢性肝炎、肝硬化及肝损伤等临床疾病[4]. 此外, 近年来研究表明其还具有一系列的生物学功能, 如抗氧化作用、肝脏保护、抗肿瘤、抗炎、降血脂、治疗糖尿病等[5,6]. 其具体作用机制主要是通过上调线粒体中Bax/Bcl-2的表达比率与Sirt1蛋白的表达, 来参与改善线粒体的氧化代谢功能[7-9].
60只清洁级♂SD大鼠, 体质量150-180 g, 由郑州大学医学院动物场购置、饲养, 在专业的动物饲养房中进行动物实验操作. 水飞蓟素是菊科水飞蓟属植物水飞蓟干燥种子中萃取的有效成分; 虎杖提取物是从虎杖中提取, 其主要有效成份为白藜芦醇, 益肝灵片(每片含水飞蓟宾38.5 mg), 辛伐他汀(杭州默沙东制药有限公司, 批号: 08048, 规格: 20 mg, 7片). 胆固醇、胆酸钠; 总胆固醇(total cholesterol, TC)、甘油三酯(triglyceride, TG)、高密度脂蛋白(high-density lipoprotein cholestero, HDL-C)测定试剂盒均为上海生工生物工程有限公司生产; 超氧化物歧化酶(superoxide dismutase, SOD)、丙二醛(malondialdehyde, MDA)、谷丙转氨酶(alanine transaminase, ALT)、谷草转氨酶(aspartate transaminase, AST)测定试剂盒均购自南京建成生物工程研究所. Sirt1试剂盒为Sigma公司生产; 体视显微镜为Foitu Ao Scientific instruments公司生产; 离心沉淀器为Eppendorf生产; 电子天平为德国Sartorius公司生产(GGT500型); 图形采集系统为德国Leica公司制造(DM4000B型); 快速血糖仪为罗氏ACCU-CHEKActive型.
1.2.1 高脂饲料配方: 高热量饲料, 40%脂肪供能高脂高糖胰岛素抵抗诱导模型饲料(M04-F), 购自上海斯莱克实验动物有限责任公司(主要成分为: 基料54.6%, 猪油16.9%, 蔗糖14%, 酪蛋白10.5%).
1.2.2 造模及分组: 饲养环境温度25 ℃, 自然光照, 给予动物自由摄食和饮水的条件. ♂SD小鼠在实验环境下给予普通饲料式饲养, 在饲养1 wk适应环境后, 随机分为5组: 空白对照组、模型对照组、阳性对照组、虎杖提取物组及水飞蓟素组, 每组各8只. 其中空白对照组继续喂养普通饲料, 其他组喂高脂饲料, 3 wk末尾静脉取血分离血清检测TC与TG, TC与TG升高说明动物造模成功. 从第4周开始, 阳性组给予辛伐他汀, 剂量为6 mg/(kg•d); 虎杖提取物组及水飞蓟素组给以水飞蓟素(剂量100 mg/kg); 空白对照组、模型对照组同法给以蒸馏水. 分别按各自灌胃剂量给药, 1次/d, 连续给药4 wk, 并作实验记录, 记录动物的各种生理情况.
1.2.3 分析测定: (1)血清与标本采集, 各组动物分别在造模成功时, 禁食不禁水12 h后尾静脉取血, 4 ℃冷藏1 h, 3500 r/min离心15 min, 分离出血清. 在灌胃4 wk后摘除眼球取血, 用同样的方法分离处理血清. 实验末期采血后对动物进行安乐死, 解刨采集心脏、肝脏、脾脏、肺脏和肾脏等动物标本; (2)测定对照组和实验组中各组小鼠血清中的指标, 按试剂盒说明书方法测定TC、TG、HDL-C、SOD、MDA、ALT、AST.
1.2.4 RT-PCR检测mRNA水平: 破碎细胞后, 提取RNA, 反转录成cDNA, 引物序列为: 上游序列5'-CCA GAT CCT CAA GCC ATG T-3'; 下游序列5'-TTG GAT TCC TGC AAC CTG-3'. 上下游引物各1 μL, cDNA模板5 μL, 2×Taq PCR Master Mix 8 μL, ddH2O补足至25 μL. 预变性95 ℃ 5 min; 变性94 ℃ 30 s; 退火58 ℃ 30 s; 延伸72 ℃ 1 min, 共32个循环; 终末延伸72 ℃ 5 min. 取扩增产物用1.5%的琼脂糖凝胶(含有0.5 mg/L EB替代物)电泳. 凝胶成像仪对电泳凝胶进行观察拍照, 用凝胶图像分析软件读取目的条带和内参的光密度(A)扫描值, 以其比值分析各目标基因的表达情况.
1.2.5 Western blot检测蛋白的表达: 各组细胞或动物组织样本, 加入细胞裂解液, 提取总蛋白、定量后, 取50 μg/孔上样于SDS-PAGE, 电泳分离转膜后, 分别与抗Sirt1一抗孵育4 ℃过夜, PBS清洗3次, 加入相应的二抗孵育, ECL发光液显色, 暗室压片或直接凝胶成像冷CCD采集图像分析.
统计学处理 数据用SPSS19.0软件进行方差齐性检验、单因素方差分析(One-way ANOVA). 组间比较用LSD法. 实验结果均以mean±SD表示. P<0.05为差异有统计学意义.
由试验结果可以看出, 实验大鼠高脂血对照组血清总TC、TG、及HDL-C水平与正常对照组相比较差异显著(P<0.05); 高脂给药组血清TC和TG水平明显低于高脂对照组, 而血清HDC-C水平显著高于高脂血对照组(P<0.05); 水飞蓟素组和虎杖提取物组两组血清TC水平较高于正常对照组而低于模型组(P<0.05), TC水平较低于正常对照组和模型组(P<0.05), 而血清LDL-C亦高于正常对照组(P<0.05), 与阳性组相比差异无统计学意义(P>0.05)(表1).
实验结果表明, 给药阳性组、水飞蓟素组和虎杖提取物组血清SOD含量显著高于高脂血模型组(P<0.05), 与空白对照组相比差异无统计学意义. 而MDA含量则显著低于高脂血模型组(P<0.05), 与空白对照组无明显差异(表2).
实验结果表明, 给药阳性组、水飞蓟素组和虎杖提取物组血清ALT和AST显著高于高脂血模型组与空白对照组(P<0.05)(表3).
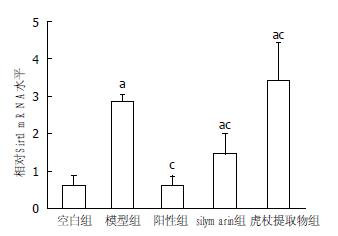
实时定量PCR实验结果显示: 给药阳性组中Sirt1 mRNA水平低于高脂血对照组(P<0.05), 与空白对照组无统计学差异. 水飞蓟素组中Sirt1 mRNA表达水平高于空白对照组而低于高脂血对照组(P<0.05), 说明水飞蓟素组具有下调Sirt1 mRNA表达水平的作用, 虎杖提取物组中Sirt1蛋白表达水平高于高脂血对照组, 对Sirt1具有上调作用(图1).
Western blot结果显示给药阳性组中Sirt1蛋白表达水平低于高脂血对照组(P<0.05), 与空白对照组相比差异无统计学意义. 水飞蓟素组中Sirt1蛋白表达水平高于空白对照组而低于高脂血对照组(P<0.05), 说明水飞蓟素组具有下调Sirt1蛋白表达水平的作用, 虎杖提取物组中Sirt1蛋白表达水平高于高脂血对照组, 对Sirt1具有上调作用(图2).
高脂血症是由于脂肪代谢或运转异常导致的血中一种或多种脂质高于正常值的范围, 对患者的身体进行性和全身性的损害[10,11]. 高脂血症易造成血管内膜病变, 使血管变硬, 内径变小, 弹性及张力降低, 进而导致微循环障碍和动脉粥样硬化[12]. 降低血脂水平对于防治和治疗心脑血管疾病具有极其重要的意义. 目前他汀类药物已成为治疗高脂血症的首选药物[13], 他汀类药物(statins)是3-羟基-3-甲基戊二酸辅酶A(HMG-CoA)还原酶的抑制剂, 能够有效降低总胆固醇和低密度脂蛋白胆固醇, 降低心血管疾病的发病率和病死率[14]. 本文选用辛伐他汀作为阳性对照药物进行研究.
通过此次实验发现, 相比较于模型对照组, 水飞蓟素和虎杖组小鼠血清中TC、TG水平显著降低, HDL-C水平显著升高, 说明水飞蓟素和虎杖提取物具有降血脂作用. 值得注意的是水飞蓟素和虎杖组明显降低血清中的TG, 辛伐他汀降低TG的作用较弱, 这显示水飞蓟素和虎杖降脂作用相较于化学药品具有更复杂的作用机制. 这可能与中药的多成分、多靶点等自身性质相关. 与空白对照组、模型对照组相比较, 水飞蓟素组和虎杖提取物组小鼠血清中SOD活力显著升高、血清MDA含量显著性降低, SOD是特异性的氧自由基清除剂, MDA是脂质过氧化产物, 本实验中的水飞蓟素组和虎杖提取物组的SOD活性升高而MDA含量降低, 这些结果提示水飞蓟素和虎杖提取物可通过清除氧自由基和抗脂质过氧化对高脂血症的发生中起到抑制作用.
本文的研究对象是中药的活性成分, 目前中药、植物药在代谢性疾病的治疗和防治上具有重要的进展, 基于以往的研究表明显示Sirt1在高脂血症发生过程中发挥重要作用, 本文特意以Sirt1将作为中药活性成分的作用靶点, 并做了前期的初步研究, 观察了虎杖提取物以及水飞蓟素对高脂血症模型小鼠脂质代谢的影响. 结果显示: 虎杖提取物以及水飞蓟素对以高脂高糖喂养小鼠的脂质代谢具有重要的调控作用, 可以显著降低小鼠的血脂, 改善其肝、肾功能, 并对主动脉内膜具有一定保护作用, 但Sirt1表达显示出一定的不确定性. 以往的的研究认为水飞蓟素对由β2肾上腺素受体激动剂异丙肾上腺素引起的培养乳鼠心肌细胞损伤有显著的保护作用, 但是具体的作用机制是通过上调线粒体上游Bax/Bcl-2的表达比率以及Sirt1蛋白的表达来参与生物学功能的, 加强改善线粒体的功能[15]. 前人的这些研究和本文的结果表明水飞蓟素具有刺激Sirt1表达的作用. 这些研究对于对抗代谢性疾病的预防和治疗具有重要临床参考意义. 也为进一步需找药物作用靶点提供了理论基础.
随着人类社会的进步和科技的发展, 人们的生活获得了不断的改善, 由此带来的营养过剩, 以及由此而导致的肥胖和心血管相关疾病, 已逐渐成为一个世界范围内备受关注的社会和医学问题, 有关的代谢性疾病和心脑血管疾病将成为危害人们健康的主要杀手.
汤静, 主管药师,上海交通大学附属第一人民医院药学部
从现代医学角度来审视, 基因调控异常、细胞衰老、炎性物质生成、活性氧簇、脂质代谢紊乱等等, 与中医所言"正虚邪聚"有着共通之处. 因此, 基于病理产物湿、瘀、热、毒等邪实的清热祛湿化瘀排毒等方法及药物, 在代谢性疾病中的应用日益受到重视.
目前, 国内外相关报道, 研究发现虎杖中可提取出大量高纯度成份的白藜芦醇, 其具有抗氧化、清除自由基、防止老化、抗肿瘤、保护心血管、植物雌激素作用和保肝的功效. 此外, 水飞蓟素对实验大鼠高脂血症的降脂作用明显.
探讨该中药对脂质代谢的改善作用是否与Sirt1表达、AMPK激活以及相关途径的作用有关, 以探讨中药在治疗与代谢有关疾病中的作用与靶点. 旨在通过系列研究探寻防治与代谢有关疾病以及治疗代谢疾病的有效药物及作用机制.
以从作用机制上探讨中药在治疗与代谢有关疾病中的作用. 旨在通过系列研究探寻防治与代谢有关疾病以及治疗代谢疾病的有效药物及作用机制.
本文具有一定指导意义.
编辑 田滢 电编 都珍珍
| 5. | Velussi M, Cernigoi AM, De Monte A, Dapas F, Caffau C, Zilli M. Long-term (12 months) treatment with an anti-oxidant drug (silymarin) is effective on hyperinsulinemia, exogenous insulin need and malondialdehyde levels in cirrhotic diabetic patients. J Hepatol. 1997;26:871-879. [PubMed] [DOI] |
| 6. | Ramakrishnan G, Elinos-Báez CM, Jagan S, Augustine TA, Kamaraj S, Anandakumar P, Devaki T. Silymarin downregulates COX-2 expression and attenuates hyperlipidemia during NDEA-induced rat hepatocellular carcinoma. Mol Cell Biochem. 2008;313:53-61. [PubMed] [DOI] |
| 7. | Katiyar SK, Roy AM, Baliga MS. Silymarin induces apoptosis primarily through a p53-dependent pathway involving Bcl-2/Bax, cytochrome c release, and caspase activation. Mol Cancer Ther. 2005;4:207-216. [PubMed] |
| 8. | Li LH, Wu LJ, Tashiro SI, Onodera S, Uchiumi F, Ikejima T. Activation of the SIRT1 pathway and modulation of the cell cycle were involved in silymarin's protection against UV-induced A375-S2 cell apoptosis. J Asian Nat Prod Res. 2007;9:245-252. [PubMed] [DOI] |
| 9. | Zhou B, Wu LJ, Li LH, Tashiro S, Onodera S, Uchiumi F, Ikejima T. Silibinin protects against isoproterenol-induced rat cardiac myocyte injury through mitochondrial pathway after up-regulation of SIRT1. J Pharmacol Sci. 2006;102:387-395. [PubMed] |
| 11. | Gong WH, Zheng WX, Wang J, Chen SH, Pang B, Hu XM, Cao XL. Coexistence of hyperlipidemia and acute cerebral ischemia/reperfusion induces severe liver damage in a rat model. World J Gastroenterol. 2012;18:4934-4943. [PubMed] [DOI] |
| 13. | 朱 春频. 他汀类药物治疗冠心病合并高脂血症的效果分析. 中西医结合心脑血管病杂志. 2012;10:144. |