修回日期: 2013-01-21
接受日期: 2013-02-20
在线出版日期: 2013-03-18
目的: 建立L-精氨酸诱导的重症急性胰腺炎大鼠模型, 研究腹膜透析液腹腔灌洗治疗下Toll样受体4(Toll like receptor 4, TLR4)、单核-巨噬细胞表面可溶性抗原(soluble CD14, sCD14)、核因子κB(nuclear factor κB, NF-κB)在其免疫机制中的作用.
方法: 腹腔注射70 g/L的L-精氨酸(3.5 g/100 g)制成重症急性胰腺炎大鼠模型. 48只大鼠, 随机分成3组: SAP模型组(12、24、36 h, 每组6只); 对照组(12、24、36 h, 每组4只); 灌洗组(12、24、36 h, 每组6只). 模型组和对照组分别腹腔注射70 g/L的L-精氨酸(3.5 g/100 g, 分3次注射, 1次/h)和等量0.9%生理盐水(分3次注射, 1次/h)后12、24、36 h麻醉处死. 灌洗组在造模后1 h于腹部上、下方置管行腹膜透析液腹腔灌洗(1次/6 h, 100 mL/次, 灌洗速度60滴/min左右; 12 h组灌洗2次, 24 h组灌洗4次, 36 h组灌洗6次), 完成灌洗后即刻处死大鼠. 测定血清淀粉酶、脂肪酶含量及血TLR4、sCD14浓度, 观察胰腺组织病理学改变和胰腺组织NF-κB表达水平.
结果: L-精氨酸诱导重症急性胰腺炎大鼠模型成功. 灌洗组血清淀粉酶、脂肪酶含量较模型组降低(12 h: 1 253.3±195.2 vs 1 953.3±316.9, 20.0 ±6.5 vs 86.3 ±36.8; 24 h: 2 299.2±416.4 vs 4 047.7±589.3, 33.7±15.5 vs 238.2±73.2; 36 h: 1 581.3±391.6 vs 2 327.8±354.6, 22.0±9.3 vs 158.3±38.5, 均P<0.05), 较对照组无明显统计学意义(P>0.05). 灌洗组胰腺组织病理学评分较模型组和对照组均有统计学意义(P<0.05). 灌洗组血TLR4、sCD14浓度在各时点较模型组降低(P<0.05), 较对照组无明显统计学意义(P>0.05). 灌洗组胰腺组织NF-κB表达水平较模型组下降, 对照组NF-κB表达较少或基本无表达.
结论: 短期间歇性闭合式腹腔灌洗对早期重症急性胰腺炎大鼠有较好的免疫抑制作用.
引文著录: 杨超, 范红, 岳伟, 陈艳敏, 宋正己, 寻琳婷. 短期间歇性闭合式腹腔灌洗治疗大鼠早期重症胰腺炎的免疫机制. 世界华人消化杂志 2013; 21(8): 641-646
Revised: January 21, 2013
Accepted: February 20, 2013
Published online: March 18, 2013
AIM: To analyze the role of Toll-like receptor 4 (TLR4), soluble CD14 (sCD14) on monocyte-macrophage cell surface, and nuclear factor kB (NF-kB) in immune mechanisms involved in the therapeutic effect of peritoneal lavage against L-arginine-induced severe acute pancreatitis in rats.
METHODS: Severe acute pancreatitis was induced in rats by intraperitoneal injection of L-arginine (3.5 g/100 g) at a concentration of 70 g/L. Forty-eight rats were randomly divided into three groups: severe acute pancreatitis group (for testing at 12, 24, and 36 h, 6 rats per subgroup), control group (12, 24, and 36 h, 4 rats per subgroup), and lavage group (12, 24, and 36 h, 6 rats per subgroup). Rats of the severe acute pancreatitis group were killed at 12, 24 and 36 h after modeling. Rats of the control group were also killed at the above point of time after intraperitoneal injection of normal saline. Rats of the lavage group were catheterized in the upper and lower abdomen for peritoneal lavage at 1 h after modeling (100 mL, once per 6 h, lavage speed at 60 drops/min; 12 h subgroup, twice, 24 h subgroup 4 times, 36 h group 6 times). After the lavage was finished, the rats were killed. The contents of serum amylase and lipase and the concentrations of TLR4 and sCD14 in the blood were determined, and histopathological changes and expression levels of NF-kB in the pancreatic tissue were observed.
RESULTS: The rat model of severe acute pancreatitis was successfully replicated by intraperitoneal injection of L-arginine. The contents of serum amylase and lipase in the lavage group were significantly lower those in the severe acute pancreatitis group (12 h: 1 253.3 ± 195.2 vs 1 953.3 ± 316.9, 20.0 ± 6.5 vs 86.3 ± 36.8; 24 h: 2 299.2 ± 416.4 vs 4 047.7 ± 589.3, 33.7 ± 15.5 vs 238.2 ± 73.2; 36 h: 1 581.3 ± 391.6 vs 2 327.8 ± 354.6, 22.0 ± 9.3 vs 158.3 ± 38.5, all P < 0.05), but showed no significant difference compared to the control group (all P > 0.05). Pathological changes in the pancreatic tissue in the lavage group were significantly improved compared to the severe acute pancreatitis group and control group (both P < 0.05). The concentrations of TLR4 and sCD14 in the blood were significantly lower in the lavage group than in the severe acute pancreatitis group (P < 0.05), but showed no statistically significant difference compared with the control group at various time points. Expression of NF-kB in the pancreatic tissue was lower in the lavage group than that in the severe acute pancreatitis group, but was almost undetectable in the control group.
CONCLUSION: Short-term intermittent peritoneal lavage has a remarkable inhibitory effect on immune function in rats with early severe acute pancreatitis.
- Citation: Yang C, Fan H, Yue W, Chen YM, Song ZJ, Xun LT. Effect of short-term intermittent peritoneal lavage on immune function in rats with early severe acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2013; 21(8): 641-646
- URL: https://www.wjgnet.com/1009-3079/full/v21/i8/641.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i8.641
尽管重症监护水平得到加强, 但重症急性胰腺炎(severe acute pancreatic, SAP)的死亡率仍很高, 达10%-25%[1]. 随着对SAP发病机制的深入探索, 对其治疗策略逐渐由首选手术治疗转变为首选综合治疗[2]. 近年来发现促抗炎机制紊乱与其发病密切相关, 研究证实多种细胞因子如肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白介素-1β(interleukin-1β, IL-1β)、IL-6等活化在急性胰腺炎的发生进展中起着重要作用[3], 而Toll样受体4(Toll like receptor 4, TLR4)、核因子κB(nuclear factor κB, NF-κB)与这些细胞因子的活化关系紧密. 可溶性抗原(soluble CD14, sCD14)介导脂多醣(lipopolysaccharide, LPS)性细胞反应, 能诱导产生IL-1、IL-6等细胞因子[4], 以及细胞不良反应, 干预免疫. 本实验通过腹膜透析液腹腔灌洗治疗L-精氨酸诱导的重症急性胰腺炎大鼠模型, 研究TLR4、NF-κB、sCD14在其免疫机制中的作用, 为进一步分析奠定理论基础.
健康♂SD大鼠(清洁级)48只. 2-3 mo, 体质量250 g±20 g, 由昆明医科大学动物科提供, 随机分成3组: SAP模型组(n = 18, SAP 12 h, SAP 24 h, SAP 36 h, 每组6只); 对照组(n = 12, 生理盐水12 h, 生理盐水24 h, 生理盐水36 h, 每组4只); 灌洗组(n = 18, 灌洗12 h, 灌洗24 h, 灌洗36 h, 每组6只).
1.2.1 造模: 模型组参照尚宏清等[5]方法经改良[6]大剂量L-精氨酸(浓度70 g/L, 3.5 g/100 g)ip制备大鼠AP模型. 对照组腹腔注射等量0.9%生理盐水. 灌洗组在造模后1 h于腹部上、下方置管行腹膜透析液腹腔灌洗. 1次/6 h, 100 mL/次, 灌洗速度60滴/min左右; 12 h组灌洗2次, 24 h组灌洗4次, 36 h组灌洗6次. 所有大鼠实验前禁食12 h, 自由饮水.
1.2.2 标本采集和保存: (1)血样采集: 经腹主动脉采血10 mL, 分离上清液(1 500 r/min, 5 min)至4 ℃冷藏送检, 剩余血浆-20 ℃保存; (2)胰腺组织取样: 取下胰腺组织置于40 g/L甲酫溶液保存.
1.2.3 观察指标和检测: 血清淀粉酶、脂肪酶活性测定, 采用全自动生化检测仪检测, 单位U/L. 血TLR4、sCD14浓度测定, 采用双抗夹心ELISA法(试剂盒购自美国RD公司). 病理学检查, 取胰腺组织置于40 g/L甲酫溶液固定24 h后, 石蜡包埋切片5 μm, HE染色后以Olympus显微镜观察, 并参考Kusske等[7]标准进行组织病理学评分. 对大鼠胰腺组织在光镜下的表现按水肿、炎细胞浸润、坏死3方面的轻重程度评分. 胰腺组织NF-κB表达水平检测, 采用免疫组织化学染色DAB法(试剂盒购自上海劲马实验设备有限公司), 切片处理同前, DAB染色后以Olympus显微镜观察并照相.
统计学处理 所有计量资料以mean±SD表示, 应用SPSS17.0统计软件分析, 组与组间均数比较采用方差分析和q检验, 3组间病理评分应用秩和检验, SigmaPlot12.0版科学绘图软件进行相关作图.
灌洗组血清淀粉酶、脂肪酶含量较模型组降低(P<0.05), 较对照组无明显统计学意义(P>0.05); 模型组血清淀粉酶、脂肪酶含量在各时点均较对照组高, 在24 h达高峰, 其脂肪酶水平升高, 提示胰腺组织有坏死(表1).
| 分组 | 观测时点(h) | n | 血清淀粉酶(U/L) | 脂肪酶(U/L) |
| 模型组 | 12 | 6 | 1 953.3±316.9 | 86.3±36.8 |
| 24 | 6 | 4 047.7±589.3 | 238.2±73.2 | |
| 36 | 6 | 2 327.8±354.6 | 158.3±38.5 | |
| 对照组 | 12 | 4 | 921.75±208.6 | 11.0±4.2 |
| 24 | 4 | 1 371.2±109.6 | 16.3±1.5 | |
| 36 | 4 | 1 209.8±78.6 | 15.5±4.0 | |
| 灌洗组 | 12 | 6 | 1 253.3±195.2 | 20.0±6.5 |
| 24 | 6 | 2 299.2±416.4 | 33.7±15.5 | |
| 36 | 6 | 1 581.3±391.6 | 22.0±9.3 |
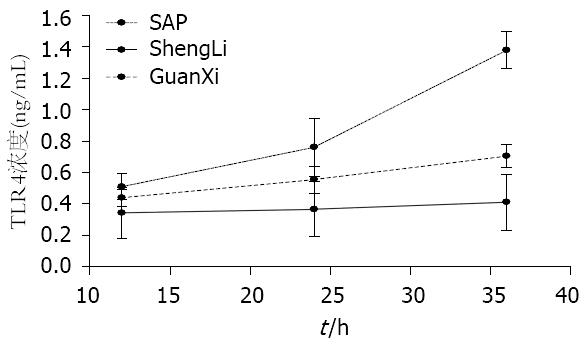
灌洗组血TLR4浓度在各时点较模型组降低(P<0.05), 较对照组无明显统计学意义(P>0.05). 黑线为对照组血TLR4浓度趋势线, 基本随时点无变化(图1).
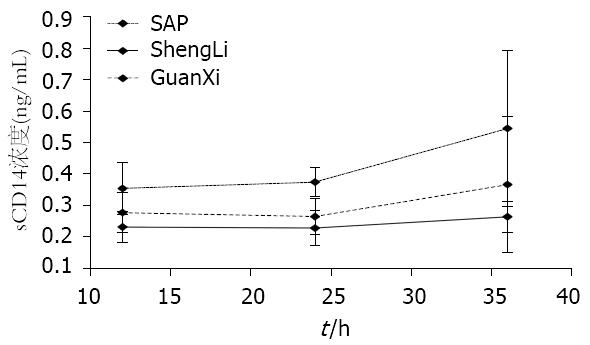
灌洗组血sCD14浓度较模型组明显降低(P<0.05), 12、24 h较对照组无明显统计学意义, 36 h较明显(P>0.05). 红线为对照组血sCD14浓度趋势线, 基本随时点无变化(图2).
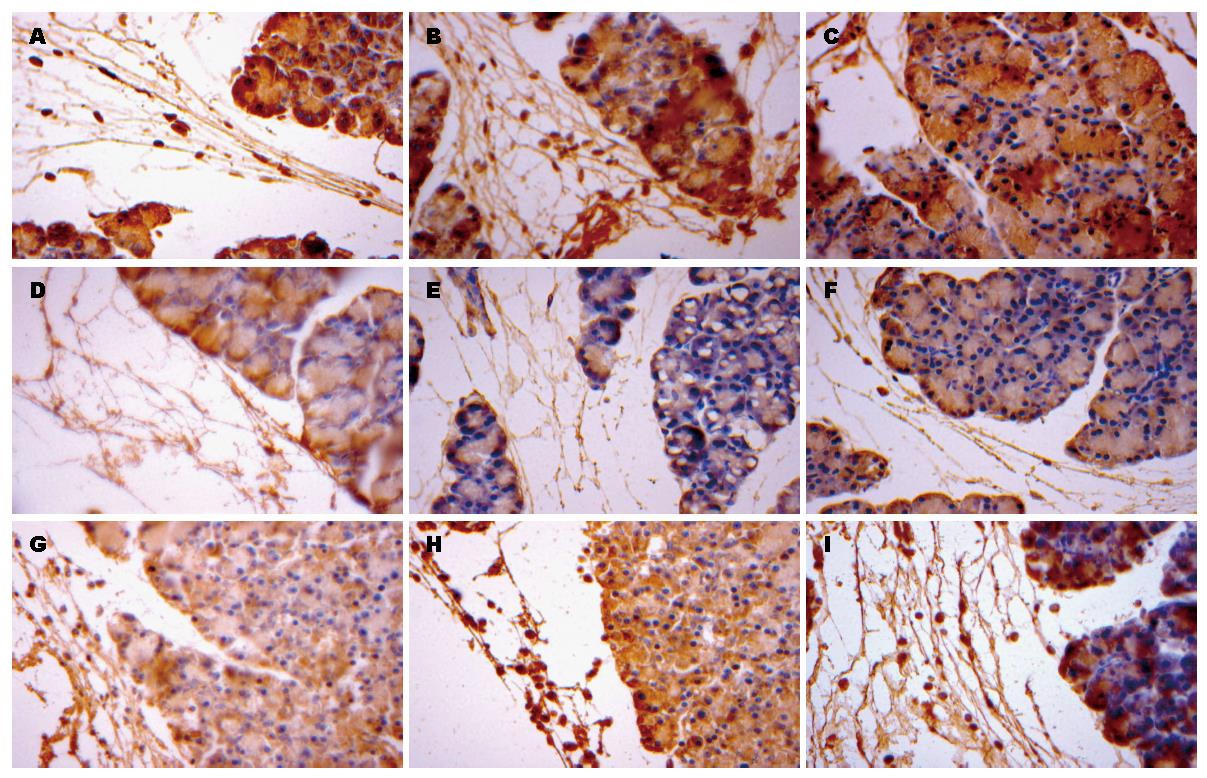
灌洗组胰腺组织NF-κB表达水平较模型组下降, 对照组NF-κB表达较少或基本无(图3).
腹腔注射L-精氨酸诱导急性胰腺炎模型, 方法简便、成本低、可重复性好、动物损伤小, 病变程度在不同的胰腺部位比较一致, 克服了侵入性模型需行剖腹术的缺点, 减少了外源性细菌污染机会, 与人类ANP的病程及组织学改变相似, 是目前研究ANP发病机制及防治措施较为理想、值得推广的动物模型[8]. 由于L-精氨酸诱导大鼠ANP所使用方法、剂量和浓度在国内外报道不一[9], 之前有文献报道[10], 使用80 g/L及以上L-精氨酸浓度注射时大鼠死亡率高, 不利于观察12 h以后的变化; 当注射浓度降低到6%时胰腺损伤以水肿为主, 坏死少见, 且须增加ip次数(3次)才能诱导出满意的ANP模型. 本实验通过70 g/L ip预实验摸索, 在注射L-精氨酸4 h后得到理想的重症急性胰腺炎模型. 大鼠重症胰腺炎目前尚无明确的判定标准及类似于APACHⅡ或者RANSON评分报道, 主要通过淀粉酶, 脂肪酶升高及病理组织改变进行确定.
本次试验中, 模型组大鼠全部发生了重症急性胰腺炎(大鼠正常淀粉酶值从450-2 300 U/L均有报道[10-12]). 其血清淀粉酶、脂肪酶水平增高,高峰出现在24 h. 灌洗组大鼠血清淀粉酶、脂肪酶水平各时点均较模型组下降. 随观察时点的延长, 模型组大鼠组织病理学改变加重, 胰腺组织坏死明显、病理评分高. 灌洗组大鼠组织病理学改变及评分各时点均较模型组降低. 腹腔灌洗对早期大鼠SAP模型有较好的免疫抑制作用, 初步研究可能与下列因素有关: (1)TLR4: Toll样受体的发现使人们认识到其作为炎症反应上游始动环节的重要作用[13], 其中TLR4被认为是最重要的成员之一, 对革兰氏阴性菌反应起作用, 主要介导内毒素的信号转导[14]. 重症急性胰腺炎时, TLR4表达不仅在胰腺中存在上调趋势[15], 其他组织如肝、肺、回肠等表达也明显增加[16]. 研究表明, 内毒素、炎症因子与发病密切相关, 并对病情发展与转归起决定性作用[17]. 同时, TLR4经过一系列信号转导途径激活NF-κB, 随之产生大量细胞因子(如TNF-α、IL-1)的过度释放[18], 而这些与急性胰腺炎关系密切的细胞因子, 在基因表达上均受NF-κB调控. 虽然TLR4缺失并不影响胰腺炎的严重程度, 但能引起早期前炎症因子的释放减少和腹部脓毒症时细菌的繁殖增加[19]. 本实验血TLR4浓度随炎症性反应时点增高而增高, 但在腹腔灌洗后增高趋势下降明显; (2)NF-κB: NF-κB是一类能与多种基因启动子部位的κB点发生特异性结合促进转录的DNA结合蛋白总称. 目前认为其是参与胰腺炎合并意外器官损伤的关键因子[20]. 研究表明, 多种ANP动物模型的共同机制都与其相关, 他能与多种细胞因子、黏附分子的基因启动子结合, 增强这些基因的转录和表达[21]. NF-κB的早期激活可能通过扳机样作用触发炎症递质的级联放大反应, 使得炎症不断扩散, 恶化[22], 在急性胰腺炎炎性细胞的浸润、聚集过程中起着极其重要的介导和促进作用[23]. 本实验诱导ANP模型后12-36 h观察到胰腺组织NF-κB表达水平增强, 应用腹腔灌洗治疗可抑制其表达, 减轻病理损害. 研究发现, 当NF-κB表达被抑制后, 炎症细胞因子合成减少, 这对减轻ANP有利[24]; (3)sCD14: CD14作为脂多糖受体, 在免疫系统中发挥着非常重要的作用[25]. sCD14是介导内毒素反应应答的功能性受体, 他与循环中的LPS结合形成sCD14-LPS复合物, 可提高多种细胞对内毒素的敏感性, 使内毒素的活性增高数倍, 产生增敏效应, 影响预后, 针对CD14进行免疫调理成为新的研究途径之一[26]. 急性胰腺炎早期单核细胞对sCD14表达和分泌明显增加, 其信号途径的激活也明显加强[27].
在临床工作中, 连续性血液净化治疗重症急性胰腺炎取得了很好的临床疗效. 不同人群[28-30](老年人、儿童、孕妇及并发症患者)临床指标及症状上均较对照组有明显改善.
SAP早期, 胰酶活化、炎性介质、细胞因子和氧自由基的诱生引发的机体超强的炎症反应,是造成早期病理损害的主要原因. 随后的肠源性细菌移位导致的严重感染、内毒素血症、细胞因子诱生及DIC的发生造成了后期病理生理的恶性循环, 引起严重的多器官功能障碍综合征, 形成SAP病损变化的第二"高峰".
TLR4、NF-κB、sCD14在介导炎症反应中起重要作用, 他们触发了炎症递质的级联放大反应, 从而引发恶性循环. 腹腔灌洗能够有效地降低这些化学因子, 在胰腺炎发病的早期有效地起到抑制免疫的作用.
重症急性胰腺炎(SAP)是病死率较高的疾病, 其发病机制尚未完全阐明, 近年来发现促抗炎失衡与其发病密切相关, 该过程中免疫因子的研究已成为热点. 作为血液净化治疗的手段之一, 腹腔灌洗可非选择性清除过度释放的促抗炎因子, 调节免疫及恢复机体内稳态, 取得了较好的治疗效果. 本文采用腹腔灌洗治疗早期SAP, 并对重要免疫因子进行初步研究, 结合下一步的临床实验, 希望为探索SAP的新疗法提供一些帮助.
潘阳林, 副主任医师, 副教授, 中国人民解放军第四军医大学西京医院消化病医院消化六科
目前, 腹腔灌洗引流还存在很大争议, 临床治疗发现: 腹腔镜腹腔灌洗引流可以有效控制炎症反应, 对免疫起到抑制作用. 但其确切机制尚不明确, 其对SAP病程中炎性反应干预机制还有待研究.
血液净化治疗临床不同人群(老年人、儿童、孕妇及并发症患者)都取得了较好的临床疗效, 具有广泛的治疗前景. 但报道多为临床回顾分析, 缺少基础研究支持.
腹腔注射大剂量L-精氨酸诱导急性胰腺炎模型, 具有方法简便、成本低、可重复性好的优点, 且动物模型成功率高, 模拟出的组织改变较为一致. 采用经皮穿刺置管的闭合式腹腔灌洗法, 避免了开放式操作充分暴露腹腔可能引发的感染等, 并减少了实验动物的创伤.
对探索实验动物模拟急性胰腺炎模型有一定意义, 在研究药物治疗方式和评价疗效上有优势, 可作为一种新的分析策略, 并可成为进一步开展临床治疗方法的前期工作之一.
本文设计及统计分析合理, 对探索重症急性胰腺炎的新疗法有一定意义.
编辑: 李军亮 电编: 闫晋利
| 1. | Bai Y, Liu Y, Jia L, Jiang H, Ji M, Lv N, Huang K, Zou X, Li Y, Tang C. Severe acute pancreatitis in China: etiology and mortality in 1976 patients. Pancreas. 2007;35:232-237. [PubMed] [DOI] |
| 3. | Liu HS, Pan CE, Liu QG, Yang W, Liu XM. Effect of NF-kappaB and p38 MAPK in activated monocytes/macrophages on pro-inflammatory cytokines of rats with acute pancreatitis. World J Gastroenterol. 2003;9:2513-2518. [PubMed] |
| 4. | Yehuda S, Mostofsky DI. Nutrients, Stress, and Medical Disorders. Totowa: Humana Press 2005; 267-278. |
| 7. | Kusske AM, Rongione AJ, Ashley SW, McFadden DW, Reber HA. Interleukin-10 prevents death in lethal necrotizing pancreatitis in mice. Surgery. 1996;120:284-288; discussion 289. [PubMed] |
| 8. | Bell WH, Fonseca RJ, Kenneky JW, Levy BM. Bone healing and revascularization after total maxillary osteotomy. J Oral Surg. 1975;33:253-260. [PubMed] |
| 9. | Czakó L, Takács T, Varga IS, Hai DQ, Tiszlavicz L, Hegyi P, Mándi Y, Matkovics B, Lonovics J. The pathogenesis of L-arginine-induced acute necrotizing pancreatitis: inflammatory mediators and endog. enous cholecystokinin. J Physiol Paris. 2000;94:43-50. [PubMed] [DOI] |
| 11. | 向 珂, 田 伏洲, 汤 礼军, 刘 文清, 罗 皓, 崔 建峰, 唐 铭骏, 李 永继. 蛋白酶抑制剂短期腹腔灌洗治疗重症急性胰腺炎的实验观察. 西南国防医药. 2009;19:485-487. |
| 12. | 余 少鸿, 雷 正明, 张 培明, 陈 永兵. 大黄素对大鼠重症胰腺炎TNFα、IL-6及胰腺腺泡细胞凋亡的影响. 中国中西医结合外科杂志. 2003;9:209-211. |
| 13. | Ding SP, Li JC, Jin C. A mouse model of severe acute pancreatitis induced with caerulein and lipopolysaccharide. World J Gastroenterol. 2003;9:584-589. [PubMed] |
| 14. | Hietaranta A, Mustonen H, Puolakkainen P, Haapiainen R, Kemppainen E. Proinflammatory effects of pancreatic elastase are mediated through TLR4 and NF-kappaB. Biochem Biophys Res Commun. 2004;323:192-196. [PubMed] [DOI] |
| 15. | Li Y, Zhou ZG, Xia QJ, Zhang J, Li HG, Cao GQ, Wang R, Lu YL, Hu TZ. Toll-like receptor 4 detected in exocrine pancreas and the change of expression in cerulein-induced pancreatitis. Pancreas. 2005;30:375-381. [PubMed] |
| 16. | Akira S, Takeda K. Toll-like receptor signalling. Nat Rev Immunol. 2004;4:499-511. [PubMed] [DOI] |
| 17. | Oruc N, Ozutemiz AO, Yukselen V, Nart D, Celik HA, Yuce G, Batur Y. Infliximab: a new therapeutic agent in acute pancreatitis? Pancreas. 2004;28:e1-e8. [PubMed] |
| 18. | Sawa H, Ueda T, Takeyama Y, Yasuda T, Shinzeki M, Nakajima T, Kuroda Y. Role of toll-like receptor 4 in the pathophysiology of severe acute pancreatitis in mice. Surg Today. 2007;37:867-873. [PubMed] [DOI] |
| 19. | van Westerloo DJ, Weijer S, Bruno MJ, de Vos AF, Van't Veer C, van der Poll T. Toll-like receptor 4 deficiency and acute pancreatitis act similarly in reducing host defense during murine Escherichia coli peritonitis. Crit Care Med. 2005;33:1036-1043. [PubMed] [DOI] |
| 20. | Rakonczay Z, Hegyi P, Takács T, McCarroll J, Saluja AK. The role of NF-kappaB activation in the pathogenesis of acute pancreatitis. Gut. 2008;57:259-267. [PubMed] [DOI] |
| 21. | Wu HS, Zhang L, Chen Y, Guo XJ, Wang L, Xu JB, Wang CY, Zhang JH. Effect of nitric oxide on toll-like receptor 2 and 4 gene expression in rats with acute lung injury complicated by acute hemorrhage necrotizing pancreatitis. Hepatobiliary Pancreat Dis Int. 2005;4:609-613. [PubMed] |
| 24. | Rakonczay Z, Jármay K, Kaszaki J, Mándi Y, Duda E, Hegyi P, Boros I, Lonovics J, Takács T. NF-kappaB activation is detrimental in arginine-induced acute pancreatitis. Free Radic Biol Med. 2003;34:696-709. [PubMed] |
| 25. | Ziegler-Heitbrock HW, Ulevitch RJ. CD14: cell surface receptor and differentiation marker. Immunol Today. 1993;14:121-125. [PubMed] [DOI] |
| 26. | Kitchens RL, Thompson PA. Impact of sepsis-induced changes in plasma on LPS interactions with monocytes and plasma lipoproteins: roles of soluble CD14, LBP, and acute phase lipoproteins. J Endotoxin Res. 2003;9:113-118. [PubMed] [DOI] |