修回日期: 2013-11-01
接受日期: 2013-11-18
在线出版日期: 2013-12-08
目的: 总结施行同种异体肝移植治疗原发性肝癌经验.
方法: 回顾性分析2005-11/2011-01我院经肝移植治疗46例原发性肝癌患者的病灶数目、大小、血管浸润和围手术期处理探讨与肝癌术后复发的关系.
结果: 采用背驮式肝移植42例, 经典式4例, 其中1例采用术中静脉转流, 手术成功45例, 19例存活至今, 最长无瘤存活时间63 mo. 术后病理证实均为肝细胞性肝癌. 2例患者分别于术后2、17 mo肿瘤复发.
结论: 门静脉一、二级分支的癌栓是肝移植的禁忌证. 改良背驮式肝移植术可以成为原发性肝癌的有效治疗方法. 术前采用冷循环射频的局部治疗是肝移植术前治疗的理想选择.
核心提示: 在肝癌肝移植相关治疗中, 严格把握好手术适应证和禁忌证是关键, 完备的术前检查是前提, 联合TACE术或者射频固化治疗能有效有很好的辅助效果, 术中对于解剖清楚认识和仔细操作是手术成功的必要条件, 围手术期的精细处理是不可缺少的措施.
引文著录: 吴星宇, 仇毓东, 丁义涛. 原发性肝癌肝移植治疗的病例选择及对策. 世界华人消化杂志 2013; 21(34): 3876-3880
Revised: November 1, 2013
Accepted: November 18, 2013
Published online: December 8, 2013
AIM: To summarize our experience with the treatment of hepatocellular carcinoma (HCC) by liver transplantation.
METHODS: The clinic data for 46 HCC patients treated by liver transplantation from November 2005 to January 2011 were analyzed retrospectively. The effects of factors such as the number and diameter of tumors, vascular invasion and perioperative management on the prognosis were analyzed.
RESULTS: Piggy-back liver transplantation was performed in 42 cases, and conventional liver transplantation was performed in 4 cases. Liver transplantation was successful in 45 cases, and 19 patients are still alive. The longest tumor-free survival was 63 mo. Recurrence occurred in 2 patients at 2 and 17 mo after operation, respectively.
CONCLUSION: Portal vein invasion should be the contradiction for liver transplantation. Modified piggy-back liver transplantation could be the choice for the treatment of primary liver carcinoma. Perioperative management with cool-tip radiofrequency ablation (RFA) is beneficial to the prognosis.
- Citation: Wu XY, Qiu YD, Ding YT. Criteria for case selection and perioperative management in liver transplantation for primary liver carcinoma. Shijie Huaren Xiaohua Zazhi 2013; 21(34): 3876-3880
- URL: https://www.wjgnet.com/1009-3079/full/v21/i34/3876.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i34.3876
肝移植目前被公认为治疗各种终末期肝病的最为有效的治疗手段. 我院2005-11/2011-01对46例肝细胞肝癌合并终末期肝病患者进行了同种异体肝移植术, 现将临床经验进行总结和分析.
选取2005-11/2011-01我院收治的肝细胞肝癌合并终末期肝病患者46例, 男42例, 女4例, 年龄39-62岁, 平均年龄为49.5岁, 入院诊断均为肝细胞肝癌, 乙型肝炎后肝硬化, 肝功能评分均为Child-Pugh C级; 其中5例为肝癌切除术后复发, 5例患者术前接受冷循环射频固化治疗, 3例患者术前接受TACE治疗[1](表1).
| 复发情况 | 灶数目 | 病灶直径(cm) | 血管浸润 | 甲胎蛋白(ng/mL) | ||||||
| 单个 | 多发 | <2 | 2-5 | >5 | 无 | 镜下 | 肉眼 | <360 | >360 | |
| 无 | 37 | 9 | 13 | 24 | 9 | 32 | 10 | 4 | 29 | 17 |
| 有 | 1 | 1 | 0 | 1 | 1 | 0 | 0 | 2 | 0 | 2 |
1.2.1 供肝的切取技术: 采用快速联合肝肾切取技术, 供肝热缺血时间<5 min, 冷保存时间<10 h[2,3].
1.2.2 病肝切除: 本组46例患者术中见肝脏呈明显肝硬化表现, 腹腔均无种植病灶, 肝门部淋巴结无肿大. 门静脉、肝静脉主干及一级分支均无癌栓. 探查明确指征后, 先分离第一肝门, 依次游离出肝固有动脉、胆总管、门静脉, 先切断供应肿瘤侧肝脏的血管分支, 再游离肝脏周围韧带. 42例采用背驮式肝移植, 少许分离第三肝门, 逐次缝扎切断所遇肝短静脉[4]. 4例采用经典式肝脏移植, 1例术中采用静脉转流, 然后游离肝脏周围韧带的方法. 病肝切除后常规剖开标本检查病灶数目、大小、有无肉眼可见的肿瘤血管浸润.
1.2.3 供肝植入技术: 46例肝移植术中, 42例采用改良背驮式肝移植, 暂时性阻断肝上下腔静脉和肝下下腔静脉, 行受体腔静脉成形, 切除部分腔静脉前壁, 修剪成倒三角形开口, 行供受体腔静脉端侧吻合重建流出道[5].
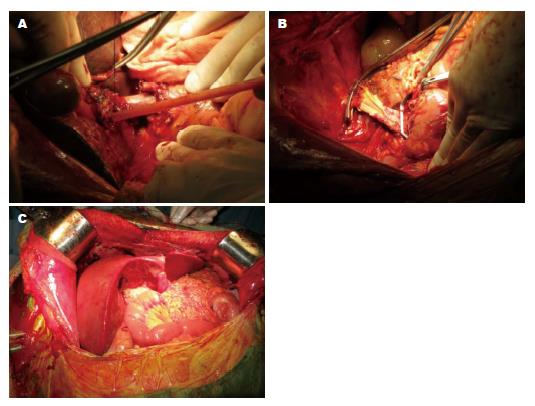
46例患者中, 手术成功45例(图1), 1例因术中肺栓塞死亡. 5例术前行冷循环射频治疗的患者, 术前复查增强CT示病灶均为低密度坏死改变, 复查甲胎蛋白(α-fetoprotein, AFP)2例患者示阴性, 3例患者均<100 ng/mL. 术中见病灶大部固化坏死, 术后均为肝细胞癌(hepatocellular carcinoma, HCC), 9例存在显微镜下肿瘤血管浸润.
7例术后出现并发症. 动脉栓塞3例, 均为术前多次行TACE的患者. 1例术后10 d出现急性肝动脉栓塞, 急诊手术取栓, 行抗凝治疗后好转, 患者存活. 2例手术30 d后发生慢性肝动脉栓塞, 出现胆道狭窄、胆漏. 1例于术后175 d死于肝脏功能衰竭. 另1例于术后122 d行再次肝移植, 术后恢复良好, 存活至今. 胆道并发症2例, 均出现胆漏合并严重腹腔感染和肺部感染, 分别于术后33、47 d死亡. 流出道梗阻2例, 均行传统的背驮式肝移植, 术后出现严重腹水合并腹腔感染, 分别于术后91、118 d死亡.
全部患者均得到随访, 19例患者存活至今, 最长无瘤存活时间63 mo, 生活质量良好. 1例单发小肝癌(2 cm)手术切除后复发(出现肝内多发病灶, 总和约7 cm)的患者于术后60 d出现肿瘤肺部转移, 1例单发小肝癌合并终末期肝硬化的患者于术后470 d肝内肿瘤复发, 经过生长抑素和冷循环射频治疗, 带瘤存活至今. 该两例术后病理均证实存在肿瘤的血管浸润.
肝移植是否适合治疗原发性肝癌, 历来存在较大争议[6]. 近年来多项研究表明肝癌肝移植后的生存时间与患者的某些临床特征以及病理类型有着密切的关系, 因而又掀起了肝移植治疗肝癌的研究热潮[7]. 目前, 部分肝移植中心制定了肝癌肝移植标准[8], 我院亦对此进行了初步探讨.
合并肝功能衰竭的小肝癌是肝移植的理想适应证. 一般而言, Child-Pugh C级患者禁忌行任何肝叶切除手术[9]. 肝移植为此类患者提供了可能治愈的机会. 本组24例患者中, 有9例肿瘤直径<2 cm术后生存均在1年以上. 进展期肝癌肝移植是目前最负争议领域[10]. 由于传统的肝癌切除术的5年术后复发率高达70%, 各国学者正在探索肝移植对进展期肝癌的治疗经验, 但至今尚无统一的适应证标准[11]. 国际上普遍认为, 术前有证据表明存在门静脉或肝静脉一、二级分支癌栓是肝移植的禁忌证[12]. 就肿瘤大小和数目而言, 米兰标准认为单个病灶直径<5 cm, 多个(不超过3个)肿瘤总直径<8 cm的病例即适合行肝移植术[13]. 这一观点并未得到广泛的支持. 原发性肝癌的最新TNM分期强调了肿瘤血管浸润的地位, 我们针对血管浸润情况对我组24例患者进行回顾分析, 结果显微镜下有血管浸润的9例患者, 2例术后出现转移和复发. 因此我们认为肿瘤的数目以及大小应结合血管浸润进行综合判断, 在手术前应尽量取得病理学证据[14]. Jonas认为复发性肝癌肝移植其疗效也可能十分乐观, 但术前必须进行严格的筛选. 本组有5例为肝癌术后局部复发患者, 术前影像学检查均未见有肝内外转移门静脉浸润; 1例患者术后出现肺部转移. 肝癌患者AFP水平与移植术后肿瘤复发具有密切关联, AFP明显升高的患者, 术后病理多见肿瘤小血管的侵犯, 本组17例患者术前血清AFP升高, 术后有微血管侵犯9例, 其中2例术后复发其中2例术后复发.
术前处理包括两方面内容: 术前的检查、治疗. 肝癌肝移植, 术前要充分利用影像学的检查, 判断有无转移及肝内血管的侵犯, 血管侵犯对于决定是否施行手术具有重要意义[15]. 我们始终将存在大血管癌栓和远处转移列为手术禁忌证. 术前治疗主要为介入治疗, 在施行肝癌肝移植初期阶段, 我们主要采用TACE治疗, 但术后出现肝动脉并发症是最大的威胁, 本组肝动脉栓塞3例, 均为术前反复行TACE的患者. 最近我们术前采用冷循环射频固化治疗, 取得良好效果. 2例患者治疗后AFP降至正常水平, 术后病理示肝细胞凝固坏死, 未见肿瘤细胞, 为等待肝移植赢得了时间. 初步结果显示射频固化治疗是肝癌肝移植有效的辅助治疗措施.
由于肝癌肝移植的特殊性, 术中应足够地重视防止肿瘤细胞播散. 我们认为术中贯彻肿瘤根治原则要做好以下5个方面的工作: (1)做好术中探查, 如发现有肝外的转移灶, 应放弃手术; (2)术中联合射频固化治疗. 术中射频能够很好地判断射频固化的范围, 病灶的充分固化, 可减少肿瘤细胞播散; (3)手术操作轻柔, 避免术中对肝脏明显的挤压和搬动, 减少由此引起的肿瘤播散; (4)先行肝十二指肠韧带的解剖, 游离入肝动脉、门静脉及胆管. 根据肿瘤所在的部位, 先行结扎切断门静脉、肝动脉的左支或右分支, 这样可以减少术中肿瘤血运转移的机会[16]. 对施行经典式肝移植的患者, 可采用先进行静脉转流, 后游离肝脏的办法, 本组中有1例复发性肝癌, 在第一次手术后8年行肝脏移植. 由于8年间患者反复进行TACE、放疗、无水乙醇注射等治疗, 我们采用了上述先进行静脉转流, 后游离肝脏的办法使手术顺利完成, 术中患者血液动力学平稳, 出血约2000 mL, 术后恢复良好; (5)对传统的背驮式肝移植进行有效地改良. 以往认为, 肝癌肝移植不宜采用背驮式肝移植的术式, 这主要由于传统背驮式肝移植在游离肝脏、处理第三肝门和第二肝门时易导致肿瘤残留或转移. 我们对传统术式进行改良, 采用暂时性阻断受体腔静脉的快速切肝和供受体腔静脉成形技术[17]. 这样能很好解决传统背驮式肝移植的不足. 我们的经验表明, 改良背驮式肝移植在绝大多数肝癌肝移植中可以取得良好的疗效.
由于术后化疗并不能减少肝癌肝移植术后的肿瘤复发率, 本组病例术后均未给予术后化疗. 我们认为术前及术中完善的处理较之术后化疗在防治肝癌肝移植术后复发方面具有更重要的意义[18]. 术后常规使用免疫移植剂方案[环孢素A(CsA)+硫唑嘌呤(Aza)+激素], 如发生排斥现象, 行激素冲击治疗, 同时替换CsA为FK506(他克莫司); 围手术期中出现药物性肝损害, 我们通常减少CsA用量或者及时替换CsA为FK506, 一般肝损害均能得到不同程度的改善[19]. 此外, 肝癌患者术后激素治疗可能导致疾病复发, 对于此类患者我们采用激素术后早期撤除方案[20].
总之, 通过严格的病例选择, 认真的围手术期处理, 肝移植能够成为原发性肝癌的有效治疗措施.
我国是世界上肝癌发病最集中的国家, 发病人数约占全球人数的30%-40%, 但是目前对于肝癌肝移植并无统一标准. 经过大量肝癌肝移植实践, 国内已经积累了一定的经验, 同时也存在适应证掌握不严格的问题. 为进一步规范肝移植的治疗, 为得到更好的治疗效果, 我们按照循证医学的原则行相关研究, 为临床肝癌肝移植的治疗提供一定参考. .
朱亮, 副教授, 大连医科大学生理教研室
对于肝癌合并肝硬化的患者, 肝移植可能是根本的治疗方法. 免疫、辅助化学治疗有助于防止肿瘤复发和使肝移植获得更好的治疗效果, 随着对肿瘤生物学特性了解和不断深入, 将有助于发现哪些患者在术后有更低的复发率, 从而制定更合理的肝癌肝移植适应证标准.
目前我国学者对于肝癌肝移植进行了大量探索, 以期找到符合我国国情的肝癌肝移植标准, UCFS标准可能是比较符合我国国情肝癌肝移植的筛选标准, 并在此基础上将肿瘤数目由≤3个扩大到5个, 将微血管癌栓或局限于单侧的静脉小分支癌栓也列入相对适应证.
本研究中我们始终将存在大血管癌栓和远处转移列为手术禁忌证. 术前治疗主要为介入治疗, 在施行肝癌肝移植初期阶段, 我们主要采用TACE治疗, 但术后出现肝动脉并发症是最大的威胁. 本研究中术前采用冷循环射频固化治疗, 取得良好效果, 为等待肝移植赢得了时间, 初步结果显示射频固化治疗是肝癌肝移植有效的辅助治疗措施.
(1)做好术中探查, 如发现有肝外的转移灶, 应放弃手术; (2)术中联合射频固化治疗. 术中射频能够很好地判断射频固化的范围, 病灶的充分固化, 可减少肿瘤细胞播散; (3)手术操作轻柔, 避免术中对肝脏明显的挤压和搬动, 减少由此引起的肿瘤播散; (4)先行肝十二指肠韧带的解剖, 游离入肝动脉、门静脉及胆管. 根据肿瘤所在的部位, 先行结扎切断门静脉、肝动脉的左支或右分支, 这样可以减少术中肿瘤血运转移的机会.
本文病例资料来源可靠, 数量充足, 资料选取有一定的标准, 资料的构成比等相对合理, 符合统计学要求, 具有科学性, 对临床治疗具有一定指导意义.
编辑:田滢 电编:闫晋利
| 2. | Zimmerman MA, Ghobrial RM, Tong MJ, Hiatt JR, Cameron AM, Hong J, Busuttil RW. Recurrence of hepatocellular carcinoma following liver transplantation: a review of preoperative and postoperative prognostic indicators. Arch Surg. 2008;143:182-188; discussion 188. [PubMed] [DOI] |
| 3. | Chok KS, Chan SC, Cheung TT, Chan AC, Fan ST, Lo CM. Late recurrence of hepatocellular carcinoma after liver transplantation. World J Surg. 2011;35:2058-2062. [PubMed] [DOI] |
| 4. | Mergental H, Porte RJ. Liver transplantation for unresectable hepatocellular carcinoma in patients without liver cirrhosis. Transpl Int. 2010;23:662-667. [PubMed] [DOI] |
| 5. | Crippin JS. Treatment of hepatocellular carcinoma after transplantation and human rights. Hepatology. 2007;45:263-265. [PubMed] [DOI] |
| 6. | Merli M, Giusto M, Gentili F, Novelli G, Ferretti G, Riggio O, Corradini SG, Siciliano M, Farcomeni A, Attili AF. Nutritional status: its influence on the outcome of patients undergoing liver transplantation. Liver Int. 2010;30:208-214. [PubMed] [DOI] |
| 7. | Bates MJ, Farkas E, Taylor D, McFadden PM. Pulmonary resection of metastatic hepatocellular carcinoma after liver transplantation. Ann Thorac Surg. 2008;85:412-415. [PubMed] [DOI] |
| 8. | Di Sandro S, Giacomoni A, Slim A, Lauterio A, Mangoni I, Mihaylov P, Pirotta V, Aseni P, De Carlis L. Living donor liver transplantation for hepatocellular carcinoma: the impact of neo-adjuvant treatments on the long term results. Hepatogastroenterology. 2012;59:505-510. [PubMed] [DOI] |
| 9. | Herrero JI, Sangro B, Pardo F, Quiroga J, Iñarrairaegui M, Rotellar F, Montiel C, Alegre F, Prieto J. Liver transplantation in patients with hepatocellular carcinoma across Milan criteria. Liver Transpl. 2008;14:272-278. [PubMed] [DOI] |
| 11. | Chen CL, Concejero AM, Wang CC, Wang SH, Liu YW, Yang CH, Yong CC, Lin TS. Inferior vena cava replacement in living donor liver transplantation for hepatocellular carcinoma. Liver Transpl. 2009;15:1637-1640. [PubMed] [DOI] |
| 12. | Ravaioli M, Zanello M, Grazi GL, Ercolani G, Cescon M, Del Gaudio M, Cucchetti A, Pinna AD. Portal vein thrombosis and liver transplantation: evolution during 10 years of experience at the University of Bologna. Ann Surg. 2011;253:378-384. [PubMed] [DOI] |
| 13. | Fan HL, Chen TW, Hsieh CB, Jan HC, His SC, De-Chuan C, Chu CH, Yu JC. Liver transplantation is an alternative treatment of hepatocellular carcinoma beyond the Milan criteria. Am J Surg. 2010;200:252-257. [PubMed] [DOI] |
| 14. | Taketomi A, Fukuhara T, Morita K, Kayashima H, Ninomiya M, Yamashita Y, Ikegami T, Uchiyama H, Yoshizumi T, Soejima Y. Improved results of a surgical resection for the recurrence of hepatocellular carcinoma after living donor liver transplantation. Ann Surg Oncol. 2010;17:2283-2289. [PubMed] [DOI] |
| 15. | Castillo E, Pelletier S, Kumer S, Abouljoud M, Divine G, Moonka D. Incidental hepatocellular carcinoma after liver transplantation: population characteristics and outcomes. Transplant Proc. 2009;41:219-221. [PubMed] [DOI] |
| 16. | Sun H, Teng M, Liu J, Jin D, Wu J, Yan D, Fan J, Qin X, Tang H, Peng Z. FOXM1 expression predicts the prognosis in hepatocellular carcinoma patients after orthotopic liver transplantation combined with the Milan criteria. Cancer Lett. 2011;306:214-222. [PubMed] [DOI] |
| 17. | Compagnon P, Grandadam S, Lorho R, Turlin B, Camus C, Jianrong Y, Lainé F, Meunier B, Deugnier Y, Boudjema K. Liver transplantation for hepatocellular carcinoma without preoperative tumor biopsy. Transplantation. 2008;86:1068-1076. [PubMed] [DOI] |
| 19. | Decaens T, Roudot-Thoraval F, Badran H, Wolf P, Durand F, Adam R, Boillot O, Vanlemmens C, Gugenheim J, Dharancy S. Impact of tumour differentiation to select patients before liver transplantation for hepatocellular carcinoma. Liver Int. 2011;31:792-801. [PubMed] [DOI] |
| 20. | Yu CY, Ou HY, Huang TL, Chen TY, Tsang LL, Chen CL, Cheng YF. Hepatocellular carcinoma downstaging in liver transplantation. Transplant Proc. 2012;44:412-414. [PubMed] [DOI] |