修回日期: 2013-11-06
接受日期: 2013-11-19
在线出版日期: 2013-12-08
目的: 研究不同程度腹内高压对大鼠肠黏膜屏障功能的影响及可能机制.
方法: 将45只成年♂SD大鼠随机分为对照组、腹内压10和20 mmHg组, 每组15只. 运用氮气气腹法制作大鼠腹内高压动物模型, 两气腹组各按维持气腹第1、2、4小时分为3组, 每组5只SD大鼠, 解除气腹后术后24 h用分光光度计测量各组动物不同小肠段蓝色葡聚糖2000浓度的情况, 检测肠黏膜组织匀浆中丙二醛(malondialdehyde, MDA)、还原型谷胱甘肽(reduced glutathione, GSH)、超氧化物歧化酶(superoxide dismutase, SOD), 血浆中二胺氧化酶(diamine oxidase, DAO)和D-乳酸含量, 光镜及电镜下观察肠组织病理形态学变化, 以上各组设有相应对照组, 对照组不充入氮气.
结果: (1)腹内压(intra-abdominal pressure, IAP)为10和20 mmHg组大鼠肠道转运功能明显减弱; (2)两组气腹组肠黏膜SOD、GSH水平及MDA含量与相应对照组比较无显著差异(P>0.05); (3)血浆D-乳酸与相应对照组比较差异无显著变化; 血浆DAO值在IAP 10 mmHg组与相应对照组比较差异无显著变化, IAP 20 mmHg组与对照组有明显改变(P<0.05); (4)在光镜下看, 对照组术后肠道黏膜未见明显损害. IAP 10 mmHg组肠黏膜绒毛上皮细胞结构完整, 排列整齐, 小肠黏膜上皮下间隙偶尔增大提示小肠绒毛毛细血管充血, IAP 20 mmHg组观察到不同程度的肠黏膜上皮细胞改变, 小肠黏膜淤血, 黏膜上皮水肿, 上皮下细胞间隙扩张, 部分肠黏膜绒毛顶端上皮细胞变性、坏死、自绒毛脱落, 部分绒毛顶端破损, 一些腺体显示不清; (5)电镜超微结构分析显示IAP 10 mmHg下肠壁绒毛细胞间紧密连接(tight junction, TJ)轻度肿胀, IAP 20 mmHg下部分视野可见微绒毛变钝, 绒毛倒伏, 线粒体结构不清.
结论: (1)腹内压为10和20 mmHg的N2气腹可导致SD大鼠肠道转运功能明显减弱; (2)20 mmHg N2气腹使血浆DAO活性增强, 肠黏膜屏障功能损伤; 而10 mmHg气腹不影响血浆DAO活性和肠黏膜屏障功能; (3)N2气腹压升高所致肠黏膜氧化应激可能是肠黏膜屏障功能损伤的机制之一; (4)腹腔压力升高能造成小肠上皮细胞的显著损害和细胞间TJ的显著肿胀, 导致肠黏膜通透性增加.
核心提示: (1)腹内压为10 mmHg和20 mmHg的N2气腹可导致SD大鼠肠道转运功能明显减弱; (2)N2气腹压升高所致肠黏膜氧化应激可能是肠黏膜屏障功能损伤的机制之一; (3)腹腔压力升高能造成小肠上皮细胞的显著损害和细胞间紧密连接(tight junction)的显著肿胀, 导致肠黏膜通透性增加.
引文著录: 赵晓琴, 陈英, 邝晓聪, 陈强, 覃桦, 蒙永毅, 叶永康. 腹内高压对肠黏膜屏障功能损伤的影响. 世界华人消化杂志 2013; 21(34): 3790-3798
Revised: November 6, 2013
Accepted: November 19, 2013
Published online: December 8, 2013
AIM: To study the effect of different degrees of intra-abdominal high pressure on intestinal mucosal barrier dysfunction and to explore the possible mechanisms involved.
METHODS: Forty-five adult male SD rats were randomly divided into a normal control group, a 10 mmHg and a 20 mmHg group (n = 15 for each). Nitrogen pneumoperitoneum was induced to generate intra-abdominal high pressure in animal models. The two pneumoperitoneum groups were further divided into three subgroups (five rats in each subgroup) for testing when pneumoperitoneum was maintained for 1, 2 and 4 h, respectively. Twenty-four hours after the relief of pneumoperitoneum, a spectrophotometer was used to measure the concentration of blue dextran 2000 in different segments of the small intestine. Malondialdehyde (MDA), reduced glutathione (GSH) and superoxide dismutase (SOD) in intestinal tissue homogenates, as well as plasma diamine oxidase (DAO) and D-lactic acid were measured. Morphological changes in the intestinal tissue were observed by light microscopy and electron microscopy.
RESULTS: Compared to the control group, intestinal transit was significantly delayed, but intestinal SOD, GSH and MDA levels and plasma D-lactate level showed no significant changes in the two high intra-abdominal pressure groups (all P > 0.05). Plasma DAO level did not differ significantly between the 10 mmHg group and control group, but was significantly different between the 20 mmHg and control groups (1412.93 ± 1397.19 vs 542.41 ± 314.93, P < 0.05). Under the light microscope, postoperative intestinal mucosa showed no damage in the control group; however, mild (increase in small intestinal subepithelial gaps and villus capillary congestion) and severe (varying degrees of intestinal mucosal changes, small intestinal mucosal congestion and edema, expansion of small intestinal subepithelial gaps, and intestinal villus degeneration, necrosis or loss) pathological changes were observed in the 10 and 20 mmHg groups, respectively. Electron microscopy demonstrated that intestinal villus cells in the 10 mmHg group showed mild swelling of tight junctions, and the 20 mmHg group showed significant changes in the microvillus and mitochondrial structures.
CONCLUSION: High intra-abdominal pressure can delay intestinal transit, alter plasma DAO activity, cause significant damage to intestinal epithelial cells, and increase intestinal permeability.
- Citation: Zhao XQ, Chen Y, Kuang XC, Chen Q, Qin H, Meng YY, Ye YK. Intra-abdominal high pressure induces intestinal barrier dysfunction in rats. Shijie Huaren Xiaohua Zazhi 2013; 21(34): 3790-3798
- URL: https://www.wjgnet.com/1009-3079/full/v21/i34/3790.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i34.3790
腹腔室隔综合征(intra-abdominal compartment syndrome, ACS)广义地定义为增加腹内压(intra-abdominal pressure, IAP)增高导致的器官功能障碍, 是多种内外科危重疾病的并发症, 其危害性近年来逐渐被人们认识和重视[1,2]. 我们已发现, 腹内高压(intra-abdominal hypertension, IAH)可导致肠道血流量大幅度降低、产生大量的氧自由基, 在这个过程中可能会损伤肠黏膜屏障损, 脂质过氧化作用可能起主要作用. 黏膜屏障能保持相对稳定的机体内环境. 当酸中毒、氧自由基、细胞因子和炎症介质对肠道黏膜屏障功能损伤后, 肠道细菌内毒素通过肠道黏膜在肠系膜淋巴结、肝、脾及其他组织和器官, 进一步加重原发病的病情, 甚至诱发多器官功能障碍、全身炎症反应综台征等.
本研究的目的在于观察腹腔高压状态下氧化应激对肠道的损害作用. 该试验着重于腹内高压时肠黏膜对抗氧化剂的易感性和肠细胞的氧化损伤. 通过对肠黏膜氧化还原相关酶的检测及病理形态学、细胞超微结构的观察, 揭示IAH对肠道氧化还原的影响, 为临床防治相关疾病提供实验依据.
实验动物45只健康♂SD大鼠(购自广西医科大学动物实验中心), 体质量为250-320 g. 丙二醛(malondialdehyde, MDA)、还原型谷胱甘肽(reduced glutathione, GSH)、超氧化物歧化酶(superoxide dismutase, SOD)酶活性检测试剂盒购自南京建成生物公司; 紫外分光光度计(LAMB DABIO20, 美国); 酶标仪(MK3, Thermo ElECIRON Corpcration, 美国); H-600透射电镜(日本日立公司).
1.2.1 IAH动物模型制作: 采用氮气气腹[3]动物术前禁食12 h, 自由饮水. 按照0.35 mL/kg体质量腹腔内注射10%水合氯醛注射液进行动物麻醉. 麻醉后仰面固定, 腹壁备皮, 头皮针通过腹肌穿刺入左腹腔, 荷包缝合结扎腹壁穿刺孔. 外接气体注入装置充入氮气, 维持一定的压力值以制作大鼠IAH模型.
1.2.2 实验过程: 依据腹内压力不同将实验动物随机分为腹内压10 mmHg组和20 mmHg组两气腹组各按维持气腹第1、2、4小时分为3组, 每组5只SD大鼠对照组(假手术组)不充氮气, 解除气腹后立即处死大鼠. 参照楼征等[4]大鼠于处死前1 h, 经口灌入2%BD-2000溶液0.4 mL. 每组实验末期, 正中剖腹5 cm, 所有实验组均无静脉输液, 以排除其他因素所致的腹内压增高. 实验末期, 正中剖腹, 切取近端空肠5 cm, 生理盐水清洗干净, 分别做光镜和透射电镜检查. 其余肠段于冰上刮取肠黏膜, 滤纸吸干水分, -80 ℃冰箱贮存待测.
统计学处理 定量检测数据用mean±SD表示, 应用统计软件SPSS13.0. 3组数据间的比较采用单因素方差分析分析, 多个样本均数间的两两比较采用SNK检验. 两组间比较采用t检验, P<0.05为差异有统计学意义.
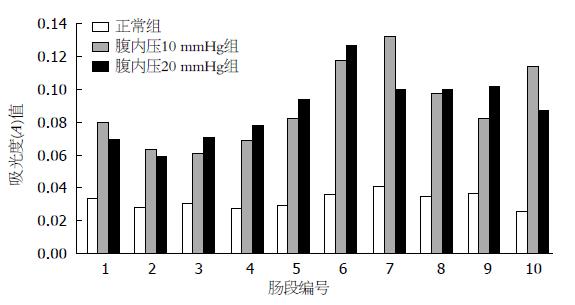
在IAP 20 mmHg组大鼠肠道转运功能明显减弱, 其中正常对照组和IAP 10 mmHg组浓度高峰位于下段空肠, IAP 20 mmHg组浓度高峰位于中上段空肠(图1).
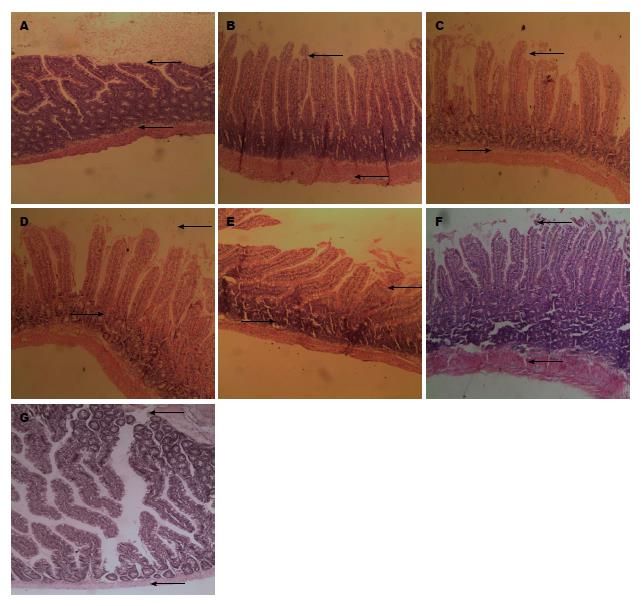
在光镜下看, 对照组术后肠道黏膜未见明显损害, 显示正常柱状上皮(图2A). 实验组在IAH后表现从上皮水肿到不同程度蜕变的结构改变, 以及绒毛剥脱和萎陷. 损害程度与IAH压力和维持的时间相关. IAP 10 mmHg组肠黏膜绒毛上皮细胞结构完整, 排列整齐, 小肠黏膜上皮下间隙偶尔增大提示小肠绒毛毛细血管充血(图2B-D), IAP 20 mmHg组观察到不同程度的肠黏膜上皮细胞改变, 小肠黏膜淤血, 黏膜上皮水肿, 上皮下细胞间隙扩张, 部分肠黏膜绒毛顶端上皮细胞变性、坏死、自绒毛脱落, 部分绒毛顶端破损, 一些腺体显示不清(图2E-G). 与IAH维持的时间相关. IAP 20 mmHg 1 h组标本显示柱状上皮不规则变形, 胞浆基底空泡形; IAP 20 mmHg 2 h组表皮细胞上浮并在绒毛顶端脱落; IAP 20 mmHg 4 h组显示绒毛广泛脱落、萎陷, 绒毛上部的肠上皮细胞上浮, 与绒毛分离.
透射电镜下观察: 紧密连接(tight junction, TJ)和其他超微结构的形态学变化如图3. 正常对照组TJ完整(图3A), 其他超微结构正常. 黏膜屏障功能正常. 腹内压10 mmHg组: A组, 在IAH 10 mmHg维持1 h情况下, TJ轻度疏松, 线粒体结构清晰(图3B). B组, IAH 10 mmHg维持2 h, TJ轻度疏松, 线粒体清晰(图3C). C组, IAH 10 mmHg维持4 h, TJ明显膨胀, 线粒体结构模糊(图3D). 腹内压20 mmHg组: D组, 在IAH 20 mmHg维持1 h情况下, TJ轻度疏松, 线粒体结构模糊(图3E). E组, IAH 20 mmHg维持2 h, TJ肿胀, 线粒体出现灶性空化, 嵴断裂, 绒毛倒伏, 与肠上皮细胞分离(图3F). F组, IAH 20 mmHg维持4 h, TJ和细胞周围明显膨胀, 线粒体出现灶性空化, 嵴断裂; 黏着的上皮细胞明显松散, 部分视野可见微绒毛变钝, 倒伏(图3G). 提示IAH状态下, TJ完全疏松, 上皮通透性显著增加.
两组气腹组肠黏膜SOD、GSH水平及MDA含量与相应对照组比较差异不显著(P>0.05). 结果表明, 不同压力大小及作用时间没有改变氧化还原物质MAD、GSH及氧化还原相关酶SOD的活性(表1-3).
| 分组 | 气腹维持时间(h) | ||
| 1 | 2 | 4 | |
| 对照组 | 0.032±0.022 | 0.064±0.059 | 0.022±0.013 |
| 腹内压10 mmHg组 | 0.024±0.020 | 0.022±0.010 | 0.043±0.020 |
| 腹内压20 mmHg组 | 0.034±0.012 | 0.041±0.014 | 0.049±0.022 |
| P值 | 0.398 | 0.504 | |
| 分组 | 气腹维持时间(h) | ||
| 1 | 2 | 4 | |
| 对照组 | 28.564±13.161 | 31.749±23.165 | 28.650±12.000 |
| 腹内压10 mmHg组 | 27.750±8.778 | 38.025±20.298 | 19.362±8.574 |
| 腹内压20 mmHg组 | 30.604±5.166 | 32.150±7.141 | 24.027±10.874 |
| P值 | 0.594 | 0.126 | |
| 分组 | 气腹维持时间(h) | ||
| 1 | 2 | 4 | |
| 对照组 | 3.853±3.506 | 3.321±1.206 | 1.909±0.811 |
| 腹内压10 mmHg组 | 2.237±1.512 | 2.028±1.512 | 4.138±2.594 |
| 腹内压20 mmHg组 | 2.251±0.229 | 2.0035±0.748 | 3.673±1.441 |
| P值 | 0.704 | 0.802 | |
血浆D-乳酸与相应对照组比较差异无显著变化; 血浆二胺氧化酶(diamine oxidase, DAO)值在IAP 10 mmHg组与相应对照组比较差异无显著变化, IAP 20 mmHg组与对照组有明显改变(P<0.05)(表4, 5).
| 分组 | 气腹维持时间(h) | ||
| 1 | 2 | 4 | |
| 对照组 | 195.15±189.89 | 81.72±68.20 | 66.97±37.95 |
| 腹内压10 mmHg组 | 93.55±40.62 | 161.56±137.81 | 104.10±41.93 |
| 腹内压20 mmHg组 | 177.41±159.70 | 210.22±203.40 | 178.90±117.03 |
| P值 | 0.229 | ||
早在19世纪末20世纪初, 人们已经认识到增高的腹内压可以导致呼吸功能的减弱, 与IAH相关的其他器官功能恶化. 1984年, Kron和他的同事就认识到ACS, IAH具有破坏性的结果. 腹内压升高, 胃肠道反应最为敏感, 是最早受损的器官. 小肠黏膜缺血程度与腹内压水平有着密切的关系, 增加腹内压, 肠缺血程度越严重. 我们以往研究表明, IAH可导致呼吸、循环功能的紊乱, 并显著降低肠黏膜血流量. 程君涛等[5]指出增加腹内压增高引起的小肠血流量显著降低, 20和30 mmHg肠黏膜血流量较正常对照组减少44%和80%.
造成ACS的方法很多, 可以有林格氏液、等渗盐水、聚乙二醇以及二氧化碳吹入法来增加 IAP[6,7]. 本研究应用氮气吹入法增加lAP, 方法简便、经济、安全. 2006年腹腔间隔室综合征世界联合会(World Society of the Abdominal Compartment Syndrome, WSACS)第二次会议中将腹腔内高压及腹腔间隔室综合征的定义统一下来. 定义为在标准测压中记录到的IAP数值持续≥12 mmHg. 腹腔室间隔综合征是指IAP数值逐渐稳定上升, 并且>20 mmHg[伴或不伴有腹腔灌注压(abdominal perfusion pressure, APP)<60 mmHg], 同时合并有新的器官功能障碍和衰竭[8]. 最近的研究表明, 相对较低的腹内压(10-15 mmHg)也可引起器官功能的明显改变[9]. 程君涛等[10]在新西兰兔的气腹模型研究中发现"IAP>20 mmHg可导致明显的低氧血症、高碳酸血症及酸中毒, 30 mmHg持续2 h以上可导致全部动物的死亡". 该项研究的预实验中我们观察到当IAP达到25 mmHg时, 只有1只大鼠存活时间超过4 h, 其余大鼠在4 h内全部死亡; 当IAP达到30 mmHg时, 只有1只大鼠存活超过90 min, 其余大鼠存活时间均没达到1 h. 因此, 我们选择了10 mmHg和20 mmHg作为IAP不利影响的检查.
正常生理状态下, 肠黏膜屏障可阻止肠腔中细菌、毒素进入机体并维持机体内环境的相对稳定[11]. 肠上皮细胞和具有特别结构的上皮细胞间紧密连接构成的机械屏障是最重要的组成部分. 危重病患者胃酸分泌减少[12], 加之H2受体阻滞剂的应用, 胃肠道内微生态环境失衡, 胃和结肠内条件致病菌大量繁殖, 并向小肠内迁移,经破溃的肠黏膜屏障侵入循环系统细菌内毒素易位[13], 进而导致脓毒血[14]. Border等[15]认为, 胃肠道黏膜屏障破损, 经久不愈, 所以在消化系统中的细菌和毒素持续侵入循环血内, 激活全身白细胞系统, 特别是单核-巨噬细胞系统, 持续释放大量的细胞因子和炎症介质, 导致全身炎症反应综合征(systemic inflammatory response syndrome, SIRS)失控, 最终发展为多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS).
肠蠕动功能状态是影响危重患者病程和预后的因素之一. 一旦肠蠕动恢复, 即可进行肠内营养(eternal nutrition, EN), 这对于维持肠黏膜的完整性有重要意义. 当腹腔高压时, 往往导致肠黏膜缺血缺氧损害, 肠蠕动功能障碍, 严重者可出现中毒性肠麻痹. 既往多采用碳素墨汁活性炭灌胃的方法进行研究. 本实验利用分光光度计结合肠道比例法进行大鼠肠蠕动功能研究. 本实验表明肠道转运功能的变化在IAP 20 mmHg组大鼠肠道转运功能明显减弱, 在IAP 10 mmHg组改变不明显, 提示IAP 20 mmHg可以导致肠蠕动功能障碍.
D-乳酸是肠道细胞特有的代谢产物, 不参与体内的代谢过程, D-乳酸可作为反映肠道组织缺血缺氧的客观指标, 其变化可反映肠道组织氧合代谢状态. 当肠道发生急性缺血时, 生物屏障肠黏膜受损, 肠道细菌产生大量的D-乳酸, 通过受损的肠黏膜进入血液循环中, 检测血浆中的D-乳酸含量可即时反映肠黏膜通透性的改变和受损程度. 这个实验表明模型组血浆D-乳酸水平在IAH维持2 h后达高峰后又下降, IAH 20 mmHg组D-乳酸值明显高于10 mmHg组, 但是无统计学意义(P>0.05), 考虑存在其他损伤机制, 可能缺血再灌注损伤起了主要作用. 孙晓庆等[16]报道: 缺血1.0-1.5 h血浆D-乳酸水平在再灌注1 h达高峰后呈下降趋势.
肠上皮细胞和肠上皮细胞紧密连接形成肠黏膜屏障肠黏膜是最重要的. 肠上皮细胞内存在的DAO, 他是一种高活性的细胞酶, 在人类和所有哺乳动物的肠上皮细胞中存在. 其活性与小肠绒毛高度和黏膜细胞的核酸和蛋白质的合成密切相关[17], 人类绒毛顶部小肠DAO活性尤其高[18].
血浆中DAO活性相对稳定, 其含量增加与肠上皮细胞受损后细胞膜通透性增加和细胞坏死是密切相关的, 可以直接反映构成肠黏膜屏障得肠上皮细胞的破坏和修复状态[19]. 因此检测外周血DAO可以较好地反应小肠黏膜屏障功能, 有学者认为检测外周血DAO活动能够反映肠道损伤状态[20], 是反映肠黏膜的完整性的血浆标志物[21].
本实验显示10 mmHg组血浆DAO活性与相应的对照组血浆DAO活性相比较无显著性差异(P>0.05); 20 mmHg组血浆DAO活性和相应的对照组血浆DAO活性相比较, 差异显著(P = 0.04, P<0.05). 提示20 mmHg气腹损伤小肠黏膜屏障功能. 10 mmHg气腹对小肠黏膜屏障功能不产生影响. 有文献报道, 使用N2气体, 形成高腹内压气腹模型在腹内压20 mmHg和10 mmHg分别维持1 h, 解除气腹后立即检测血浆DAO活性, 发现腹腔内压力20 mmHg时的血浆DAO活性高于10 mmHg时, 差异显著(P<0.05), 正常对照组与10 mmHg的活性无显著差异(P>0.05)[22], 本实验与之有相近之处.
胃肠黏膜屏障破坏是危重病患者并发多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS)最初的病理生理反应[23]. 研究表明氧自由基损伤是引起胃肠黏膜屏障破坏的重要病理因素[24,25]. 氧自由基介导的脂质过氧化反应是细胞膜损害和破碎的重要原因. 并且氧自由基除了直接作用, 还能激活白细胞的聚集并由此造成组织的间接损伤. 本实验进一步证实, IAH可导致肠道氧化还原状态的改变, 这可能是导致肠黏膜屏障功能损害的重要原因之一. 氧自由基的生成主要通过黄嘌呤氧化酶系和髓过氧化物酶系, 其中主要为MDA, 故检测肠黏膜组织中MDA含量, 可反映肠道脂质过氧化损伤[26], 间接反映出机体细胞受氧自由基攻击的严重程度. GSH是体内抗氧化防御系统的主要组成部分, 起着重要的作用, 能拮抗外源性毒素, 氧自由基损伤, 调节机体免疫功能, 抑制细胞凋亡, 以维持细胞蛋白的结构和功能.
正常状态下, 体内抗氧化性物质和氧化性物质通过各种酶和蛋白质的精密基因表达调控, 保持氧化还原状态处于动态平衡[27]. 抗氧化酶系统在活性氧清除的过程中起了极其重要的作用. SOD是广泛存在于动植物体内的一类金属酶, 能够催化超氧阴离子等自由基发生歧化反应, 维持机体内氧自由基动态平衡. 超氧阴离子在超氧化物歧化酶SOD(包括Mn-SOD和Cu/Zn-SOD)的作用下发生了电子转移, 生成H2O2, Cu/Zn-SOD在CAT作用下转变为无毒性的H2O分子, 从而达到氧自由基的清除. 我们研究表明两组气腹组肠黏膜SOD、GSH水平均与相应对照组略有减少, MDA有增加, 但无统计学意义(P>0.05). 提示通过氧化应激可以造成肠黏膜的损害, 但不是唯一, 除上述氧化还原应激指标外, IAH还可能通过其他机制造成肠黏膜组织结构的损害. 近年研究表明[28], 缺血/再灌注损伤也可能导致ACS. 预计在此类型的损伤是可逆的变化, 但在高温的IAP, 组织可能不可逆的损坏.
目前认为线粒体损伤是细胞缺血缺氧损害的一个中心环节, 其对于缺血缺氧等因素十分敏感. 近年研究表明, 线粒体在细胞凋亡中起着中心调控的作用, 是决定细胞凋亡或坏死的共同通路. 但关于缺血缺氧线粒体结构与功能损害的原因尚不完尚不完全清楚, 目前认为与氧化应激等有关[29]. 肠道覆盖单层柱状上皮细胞, 并由一系列TJ紧密相连. 单层上皮细胞和细胞间TJ, 通过选择性溶质转运, 同时防止有害物质的进入肠腔中的功能成为肠屏障功能. 肠道可以防止有害物质的侵袭肠屏障功能. 上皮细胞的屏障功能受到上皮细胞顶部细胞间的TJ调节. TJ由跨膜蛋白组成, 并由胞质斑蛋白、zonula occludens-1与细胞骨架连接[30]. 本研究发现, 当腹内压为10 mmHg时, TJ轻度骨质疏松; 腹内压达20 mmHg时, 肠黏膜细胞结构变化显著, TJ显著扩大. 然而, TJ破坏和ACS之间的关系尚不清楚. ACS对肠屏障功能的损害可能有如下两种原因: (1)肠黏膜缺血: 大量的研究表明, 增加腹压, 减少内脏灌注, 以减少肠黏膜的血液供应. Turner等[31]观察到, IAP 20 mmHg时, 心输出量没有变化显著, 但肠系膜上动脉和黏膜血流量显著减少. Diebel等[32]也观察到, 猪IAH模型随腹内压增加, 心输出量和血压在正常范围内, 然而肠黏膜和系膜血流量显著下降. 肠黏膜缺血是肠屏障功能障碍的一个重要机制[33]; (2)TJ形成了一个物理屏障能抵挡有毒抗原和预防肠道细菌易位的发生. 黏膜的TJ破坏显著降低了肠黏膜的屏障功能. 本研究结果表明, IAH造成了肠黏膜屏障的严重损害, 肠上皮细胞和肠道紧密连接的显著扩张, 导致黏膜屏障通透性增加, 细菌通过疏松的TJ, 形成脓毒症. 这也许可以解释为什么IAH常引起细菌易位和脓毒症, 甚至多器官功能障碍.
感谢邝晓聪、莫非、秦志丹及曹卫在本试验中给予的大力帮助.
随着基础医学和临床医学研究的进展, 腹腔内高压和腹腔间隔室综合征日益受到重视, 腹内压增高可见于ICU内的多种疾病,可导致的器官功能障碍. 腹内压升高, 胃肠道反应最为敏感, 是最早受损的器官.
王炳元, 教授, 中国医科大学附属第一医院消化内科
本文就腹内高压对肠道影响的病理生理及肠黏膜损伤机制做实验研究.
该试验着重于腹内高压时肠黏膜对抗氧化剂的易感性和肠细胞的氧化损伤. 通过对肠黏膜氧化还原相关酶的检测及病理形态学、细胞超微结构的观察, 揭示IAH对肠道氧化还原的影响.
腹内压增高导致的器官功能障碍. 是多种内外科危重疾病的并发症, 其危害性近年来逐渐被人们认识和重视. 本研究的目的在于观察腹腔高压状态下氧化应激对肠道的损害作用. 为临床防治相关疾病提供实验依据.
本文科研创造性较强, 对临床的医疗实践具有较大的理论指导意义.
编辑:田滢 电编:闫晋利
| 1. | Malbrain ML, Vidts W, Ravyts M, De Laet I, De Waele J. Acute intestinal distress syndrome: the importance of intra-abdominal pressure. Minerva Anestesiol. 2008;74:657-673. [PubMed] |
| 6. | Schachtrupp A, Graf J, Tons C, Hoer J, Fackeldey V, Schumpelick V. Intravascular volume depletion in a 24-hour porcine model of intra-abdominal hypertension. J Trauma. 2003;55:734-740. [PubMed] [DOI] |
| 7. | Malbrain ML, Chiumello D, Pelosi P, Bihari D, Innes R, Ranieri VM, Del Turco M, Wilmer A, Brienza N, Malcangi V. Incidence and prognosis of intraabdominal hypertension in a mixed population of critically ill patients: a multiple-center epidemiological study. Crit Care Med. 2005;33:315-322. [PubMed] |
| 8. | Cirocchi R, Barillaro I, Boselli C, Covarelli P, Grassi V, Cacurri A, Koltraka B, Santoro A, Spizzirri A, Trastulli S. [The abdominal compartment syndrome and the importance of decompressive re-laparotomy]. G Chir. 2010;31:560-574. [PubMed] |
| 9. | Malbrain ML, Deeren D, De Potter TJ. Intra-abdominal hypertension in the critically ill: it is time to pay attention. Curr Opin Crit Care. 2005;11:156-171. [PubMed] [DOI] |
| 11. | 黄 英, 易 成, 龙 洋, 赵 秋玲, 江 从勋, 崔 勇霞, 贺 荣华, 王 树人. 重组人生长激素对败血症大鼠肠粘膜屏障功能保护作用的机制研究. 四川大学学报(医学版). 2006;37:10-13. |
| 13. | 刘 金保, 冉 丕鑫. 粘附分子在缺血再灌注损伤中的作用. 国外医学生理学与病理科临床分册. 1997;17:247-248. |
| 14. | Diebel LN, Dulchavsky SA, Brown WJ. Splanchnic ischemia and bacterial translocation in the abdominal compartment syndrome. J Trauma. 1997;43:852-855. [PubMed] |
| 17. | Kaya Y, Coskun T, Demir MA, Var A, Ozsoy Y, Aydemir EO. Abdominal insufflation-deflation injury in small intestine in rabbits. Eur J Surg. 2002;168:410-417. [PubMed] [DOI] |
| 18. | Sukhotnik I, Bejar J, Srugo I, Krausz MM, Bernshteyn A, Hirsh M, Mogilner JG. Adverse effects of increased intra-abdominal pressure on small bowel structure and bacterial translocation in the rat. J Laparoendosc Adv Surg Tech A. 2006;16:404-410. [PubMed] |
| 20. | Unsal MA, Imamoglu M, Kadioglu M, Aydin S, Ulku C, Kesim M, Alver A, Kalyoncu NI, Yaris E, Bozkaya H. The acute alterations in biochemistry, morphology, and contractility of rat-isolated terminal ileum via increased intra-abdominal pressure. Pharmacol Res. 2006;53:135-141. [PubMed] [DOI] |
| 21. | Cay A, Imamoğlu M, Unsal MA, Aydin S, Alver A, Akyol A, Sarihan H. Does anti-oxidant prophylaxis with melatonin prevent adverse outcomes related to increased oxidative stress caused by laparoscopy in experimental rat model? J Surg Res. 2006;135:2-8. [PubMed] |
| 24. | 陈 德昌, 李 红江. 大黄对烫伤后大鼠体内氧自由基的清除作用. 中国中西医结合急救杂志. 2000;7:21-23. |
| 26. | Ozmen MM, Zulfikaroglu B, Besler TH, Col C, Cinel L, Cinel I. The correlation between reactive oxygen species and histopathology of the liver, gut, and kidneys in animals with elevated intra-abdominal pressure. J Laparoendosc Adv Surg Tech A. 2009;19:339-343. [PubMed] [DOI] |
| 27. | Foyer CH, Noctor G. Redox regulation in photosynthetic organisms: signaling, acclimation, and practical implications. Antioxid Redox Signal. 2009;11:861-905. [PubMed] |
| 28. | Cheatham ML, Malbrain ML, Kirkpatrick A, Sugrue M, Parr M, De Waele J, Balogh Z, Leppäniemi A, Olvera C, Ivatury R. Results from the International Conference of Experts on Intra-abdominal Hypertension and Abdominal Compartment Syndrome. II. Recommendations. Intensive Care Med. 2007;33:951-962. [PubMed] |
| 30. | Turner JR. Molecular basis of epithelial barrier regulation: from basic mechanisms to clinical application. Am J Pathol. 2006;169:1901-1909. [PubMed] [DOI] |
| 31. | Turner JR, Rill BK, Carlson SL, Carnes D, Kerner R, Mrsny RJ, Madara JL. Physiological regulation of epithelial tight junctions is associated with myosin light-chain phosphorylation. Am J Physiol. 1997;273:C1378-C1385. [PubMed] |
| 32. | Diebel LN, Dulchavsky SA, Brown WJ. Splanchnic ischemia and bacterialTranslocation in the abdominalcompartment syndrome. J Trauma. 1997;43:852-855. [PubMed] |
| 33. | Hunter JD, Damani Z. Intra-abdominal hypertension and the abdominal compartment syndrome. Anaesthesia. 2004;59:899-907. [PubMed] [DOI] |