修回日期: 2013-11-17
接受日期: 2013-11-27
在线出版日期: 2013-12-08
目的: 了解白介素-10(interleukin-10, IL-10)在骨髓间充质干细胞分泌的因子(mesenchymal stem cell-derived molecules, MSC-CM)逆转急性肝衰竭中的作用.
方法: D-氨基半乳糖(D galactosamine, D-GaIN)和脂多糖(lipopolysaccharide, LPS)诱导建立Balb/c小鼠急性肝衰竭模型; 贴壁筛选法培养纯化小鼠BMSCs和获得MSC-CM. 健康Balb/c小鼠♂随机均分为肝衰竭对照组、MSC-CM治疗组和MSC-CM+IL-10抗体组, 每组18只. Kaplan-Meier法进行生存分析, 生化检测各实验组丙氨酸转氨酶(alanine transaminase, ALT)和天冬氨酸转氨酶(aspartate aminotransferase, AST), 36 h每组处死1-2只动物, 取肝脏进行肝脏病理检测. ELISA检测血清高迁移率蛋白B1(high mobility group box 1, HMGB1)、IL-1β、肿瘤坏死因子α(tumor necrosis factor α, TNF-α)和IL-10水平.
结果: MSC-CM治疗组1 wk生存率为88.9%, 显著高于肝衰竭对照组的39%, P<0.01. 12、24和48 h血清ALT和AST峰值显著低于肝衰竭对照组(P<0.01). 36 h肝脏炎症坏死较对照明显减轻. MSC-CM治疗组在6、12和24 h HMGB1水平以及24 h的TNF-α和IL-1β水平显著低于肝衰竭对照组(P<0.01), 而抗炎因子IL-10显著高于对照组(P<0.01). IL-10抗体阻断致MSC-CM治疗的生存率降低和ALT水平升高, 肝脏炎症坏死增加, 血清HMGB1、TNF-α和IL-1β水平升高.
结论: IL-10在MSC-CM逆转小鼠急性肝衰竭中发挥重要作用.
核心提示: 骨髓间充质干细胞分泌的因子(mesenchymal stem cell-derived molecules)治疗上调急性肝衰竭小鼠抗炎因子白介素-10(interleukin-10, IL-10)水平, IL-10抗体阻断后小鼠生存率降低、ALT水平升高, 肝脏炎症坏死增加, 血清高迁移率蛋白B1(high mobility group box 1)、肿瘤坏死因子α(tumor necrosis factor α)和IL-1β水平升高.
引文著录: 雷延昌, 梁青, 罗盼, 李雯. IL-10在骨髓间充质干细胞分泌的因子逆转急性肝衰竭中的作用. 世界华人消化杂志 2013; 21(34): 3783-3789
Revised: November 17, 2013
Accepted: November 27, 2013
Published online: December 8, 2013
AIM: To explore the role of interleukin-10 (IL-10) in mediating the therapeutic effects of bone marrow mesenchymal stem cell-derived molecules (MSC-DM) on acute live failure (ALF).
METHODS: D-galactosamine (D-GaIN) and lipopolysaccharide (LPS) were used to induce ALF in male BALB/c mice. Bone marrow MSCs were cultured and purified by the adherent method and medium containing MSC-CM was harvested. Healthy BALB/c mice were randomly assigned to three groups (n = 18 for each): ALF group, MSC-CM treatment group and MSC-CM plus IL-10 antibody group. Kaplan-Meier method was used for survival analysis. Serum alanine transaminase (ALT) and aspartate aminotransferase (AST) levels were detected at different time points, liver tissue pathological changes were examined after 24 h, and high mobility group box 1 (HMGB1), IL-1β, tumor necrosis factor α (TNF-α) and IL-10 were detected by ELISA.
RESULTS: The survival rate was significantly higher in the MSC-CM treatment group than in the ALF group (88.9% vs 39%, P < 0.01). MSC-CM treatment decreased ALT/AST levels at12, 24 and 48 h more significantly compared with the ALF group (all P < 0.01). Serum HMGB1 at 6, 12, and 24 h, and TNF-α and IL-1β at 24 h were also decreased significantly in the MSC-CM treatment group (all P < 0.01), however, IL-10 level was increased significantly in the MSC-CM treatment group (P < 0.01). The inflammation and necrosis in liver tissues were mitigated more significantly in the MSC-CM treatment group than in the ALF group (P < 0.01). In MSC-CM treated mice, administration of IL-10 antibody neutralized the therapeutic effects of MSC-CM: survival rate was decreased, and ALT level, serum HMGB1, TNF-α, IL-1β and inflammation or necrosis in liver tissues at 24 h were increased.
CONCLUSION: IL-10 plays an important role in mediating the therapeutic effects of MSC-CM on ALF.
- Citation: Lei YC, Liang Q, Luo P, Li W. Mesenchymal stem cell-derived molecules attenuate mouse acute live failure by up-regulating IL-10. Shijie Huaren Xiaohua Zazhi 2013; 21(34): 3783-3789
- URL: https://www.wjgnet.com/1009-3079/full/v21/i34/3783.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i34.3783
骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)具有高度自我更新和多向分化潜能, 已经用于多种组织器官损伤的修复. 研究发现, BMSCs能在特定环境下分化为类肝细胞样细胞, 抑制肝脏炎症反应和促进受损肝脏细胞再生降低肝衰竭动物死亡率[1-5], BMSCs分泌的因子(mesenchymal stem cell-derived molecules, MSC-CM)也可减轻肝衰竭动物肝细胞坏死, 促进肝细胞再生, 从而提高动物生存率[6,7], 其作用机制目前知之较少. 目前认为, 白介素-10(interleukin-10, IL-10)是一种重要的抗炎因子, BMSC通过前列腺E2介导巨噬细胞上调IL-10分泌发挥对败血症的治疗作用[8]. 与之一致, 急性肝衰竭小鼠给予MSC-CM其IL-10水平有显著升高[6]. 此外, BMSCs高度表达转化生长因子-β(transforming growth factor-β, TGF-β)和IL-6可以诱导IL-10产生[9,10]. 为了解IL-10在MSC-CM逆转急性肝衰竭中的作用进行本研究.
6-8 wk Balb/c小鼠♂, 体质量20 g±0.5 g, 由南昌大学医学院动物科学部提供(动物质量合格证编号: 2013091206), 动物饲养和处理严格按照美国国立卫生研究院实验动物饲养和使用指南. 胎牛血清、胰蛋白酶(GIBCO公司, 美国); DMEM低糖培养基(Hyclone公司, 美国); 脂多糖(lipopolysaccharide, LPS)(Sigma公司, 美国); D-氨基半乳糖(D galactosamine, D-GaIN)(Solarbio公司, 中国); 血清高迁移率蛋白B1(high mobility group box 1, HMGB1)和IL-1β、TNF-α、IL-6和IL-10试剂盒(NEB公司, 美国); 兔抗鼠IL-10(ABGENT公司, 美国).
1.2.1 MSCs提取纯化和MSC-CM获取: 参照文献[11,12]用贴壁法培养法提取MSCs, 无菌获取2-3 wk ♂Balb/c小鼠双侧股骨和胫骨, 用生理盐水冲洗, 剔除表面的组织, 中间剪断, 暴露骨髓腔, DMEM培养基冲洗反复骨髓腔, 将冲洗液吹打成细胞悬液, 1000 r/min离心10 min, 弃上清, 用含有10%胎牛血清DMEM培养液重悬细胞, 接种于25 cm2培养瓶. 48 h全量更换培养液, 弃悬浮细胞, 每2-3 d换液一次, 直至长至80%-90%融合时, 用0.25%胰酶消化1:2传代. MSCs的鉴定采用免疫荧光检测CD34/CD29表达[11,12]. 取第二或三代MSCs(1×107个细胞)更换无血清培养液24 h, 上清为MSC-CM用于本研究.
1.2.2 动物模型及分组: Balb/c小鼠♂实验前12 h禁食, 不禁水. 动物随机分为3组, 肝衰竭组(对照组)、MSC-CM组和MSC-CM+IL-10抗体组, 每组18只. 急性肝衰竭组(对照组)给予600 mg/kg D-氨基半乳糖和10 μg/kg细菌LPS, MSC-CM治疗组在腹腔注射D-GaIN/LPS前2 h腹腔注射MSC-CM(MSCs培养上清)0.3 mL, MSC-CM+IL-10抗体组在MSC-CM治疗基础上给予IL-10抗体5 μg.
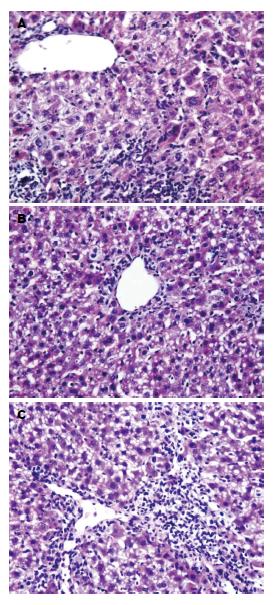
1.2.3 标本收集: 分别于腹腔注射D-GaIN/LPS后12、24、48 h麻醉动物眼眶采血分离血清置于-80 ℃保存. 每组1-2只动物于36 h处死, 肝组织用40 g/L中性甲酫固定, 进行HE染色.
1.2.4 血清生化和细胞因子检测: 全自动生化分析仪检测丙氨酸转氨酶(alanine transaminase, ALT)/天冬氨酸转氨酶(aspartate aminotransferase, AST), 血清HMGB1和IL-1β、TNF-α、IL-6和IL-10检测按照生产厂家说明书进行, 根据系列浓度梯度的标准品获得标准曲线计算结果.
统计学处理 所有数据用SPSS18.0软件作统计学分析, 数据资料以mean±SD表示, 生存率比较采用Log-rank检验, 两组之间的组间比较应用独立样本t检验, P<0.05为差异具有统计学意义.
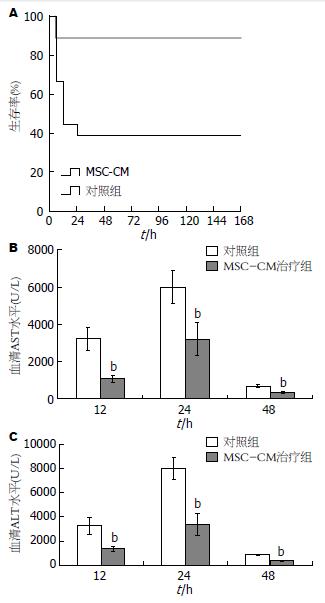
D-GalN/LPS腹腔注射小鼠1 wk生存率为39.0%, 显著低于MSC-CM治疗组的88.9%(P<0.01)(图1A). 急性肝衰竭小鼠血清ALT/AST在12 h升高, 24 h达峰值, 48 h逐渐恢复正常. MSC-CM治疗组血清ALT/AST水平在12、24和48 h显著低于肝衰竭对照组(P<0.01, 图1B, C).
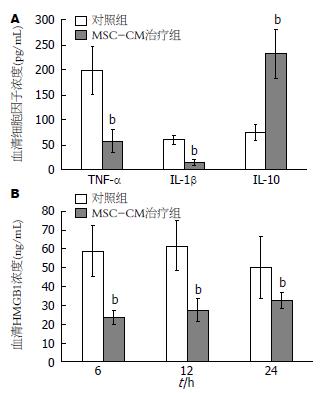
为了解 MSC-CM治疗对急性肝衰竭炎症因子的影响, 根据24 h血清ALT水平达峰值, ELISA检测血清24 h的TNF-α和IL-1β水平以及IL-10水平. 结果显示, MSC-CM治疗组抗炎因子IL-10显著高于对照组(P<0.01, 图2A). 而TNF-α和IL-1β显著低于肝衰竭对照组(P<0.01, 图2A). ELISA检测血清HMGB1水平发现, MSC-CM治疗组在6、12和24 h的水平显著低于肝衰竭对照组(P<0.01, 图2B).
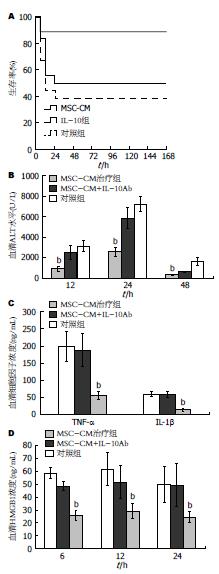
为了IL-10在MSC-CM治疗中的作用, 首先应了解IL-10是否来源于输注的MSC-CM, ELISA检测MSC-CM的浓度发现, 几乎检测不到IL-10水平. 表明小鼠血清中IL-10不是来源于MSC-CM, 而是MSC-CM治疗增加IL-10水平. 应用IL-10(5 μg)抗体阻断, 急性肝衰竭小鼠生存率(50%)较MSC-CM治疗组显著下降(P<0.01), 接近于肝衰竭对照组的39%(图4A). 血清ALT水平、TNF-α、IL-1β和HMGB1水平较MSC-CM治疗组显著升高(P<0.01, 图4B-D), 组织学显示肝脏炎症坏死增加(图3C).
D-GalN/LPS腹腔注射是目前比较成熟的小鼠急性肝衰竭模型. ♂Balb/c小鼠腹腔注射D-GalN/LPS 1 wk生存率为39%, 动物死亡发生在给药后6-24 h , 与作者之前的研究一致[11,12]. MSC-CM治疗组小鼠1 wk生存率为88.9%显著高于肝衰竭对照组的39%. 肝衰竭小鼠血清ALT和AST水平在12 h开始升高, 24 h达高峰, 48 h开始下降并逐渐恢复正常. 与国外的研究和作者近来的研究结果一致[6,7,12], MSC-CM治疗组血清ALT和AST水平24 h峰值较对照组显著降低, 表明MSC-CM治疗减轻肝细胞损伤.
内毒素血症和巨噬细胞活化释放炎症因子在急性肝衰竭发病中的重要作用目前已得到共识. 研究显示, 应用氯化钆部分清除肝脏枯否细胞, 显著降低D-GalN/LPS诱导小鼠急性肝损伤, 提高生存率[13]. 急性肝衰竭内毒素血症发生率可高达90%-100%, 急性肝衰竭Toll样受体(Toll-like receptors, TLRs)在各种免疫细胞表达增加[14]. 内毒素血症, 主要是革兰氏阴性菌的LPS刺激枯否细胞释放大量炎症因子, 进一步加重肝损伤[14,15]. 后期炎症因子HMGB1既可通过LPS刺激的巨噬细胞、中性粒白细胞和血管内皮细胞主动释放, 又可通过坏死细胞被动释放[16-19]. HMGB1可直接促进TNF-α、IL-1β、IL-6和IL-8释放和外周单核细胞趋化因子释放[20,21], 募集更多炎症细胞加剧炎症反应和组织损伤. 动物和临床研究显示, HMGBl与急性肝衰竭发生和疾病的严重程度密切相关[11,12,22,23].
研究者前期发现BMSC移植降低肝衰竭小鼠HMGB1水平和肝细胞HMGB1细胞内移位, 提高生存率[11,12]. 本研究显示, MSC-CM治疗组在6、12和24 h的HMGB1水平显著低于对照组. 与之相一致, MSC-CM治疗组血清TNF-α、IL-1β、IL-6水平显著低于肝衰竭对照组, 而抗炎因子IL-10显著高于对照组. 此外, MSC-CM治疗组肝脏炎症坏死程度较对照组明显减轻. 提示MSC-CM治疗增加抗炎因子IL-10水平, 降低HMGB1和多种炎症因子水平减轻肝脏炎症坏死.
为进一步了解抗炎因子IL-10在MSC-CM逆转急性肝衰竭中的作用, 应用IL-10抗体阻断显示, 急性肝衰竭小鼠生存率下降至50%, 略高于对照组的39%, 血清ALT和AST水平、TNF-α和IL-1β以及肝脏炎症坏死增加. 表明MSC-CM治疗增加IL-10水平在逆转急性肝衰竭中发挥重要作用.
研究发现, MSC-CM分泌的因子, 包括BMSCs高度表达TGF-β和IL-6可直接导致IL-10产生[9,10]. 此外, BMSC通过前列腺E2介导巨噬细胞上调IL-10分泌发挥对败血症的治疗作用[8]. 随后的研究显示, MSC-CM可减轻急性肝衰竭小鼠肝细胞坏死和促进肝细胞再生, 提高动物生存率, 同时伴有IL-10水平有显著升高[6,7]. 最近发现, BMSCs治疗下调肾脏和肺缺血再灌注损伤局部炎症因子和上调抗炎因子IL-10水平对抗组织炎症坏死[24,25], MSCs分泌的因子上调IL-10水平逆转急性肾损伤[26]. 表明, MSC-CM有可能通过上调IL-10水平对抗多种器官功能衰竭的炎症反应. 本研究显示, MSC-CM同时具有上调IL-10水平和下调包括HMGB1在内的炎症因子水平, 可能是MSC-CM治疗急性肝衰竭的机制之一.
最新研究显示, 细胞自噬可以选择性清除损伤的线粒体, 保护线粒体损伤诱导的细胞死亡. 研究显示, 促进肝细胞自噬可以保护对乙酰氨基酚、D-GalN/LPS以及酒精对小鼠的肝细胞毒性[27-29]. 抑制肝细胞自噬增加TNF-α和D-GalN诱导的肝细胞凋亡及损伤. 近来的研究显示, 血红素加氧酶1(heme oxygenase-1, HO-1)可以促进肝细胞自噬, 保护LPS引起的肝损伤[30]. 已知, HO-1是IL-10信号通路下游激活分子. 是否MSC-CM上调抗炎因子IL-10水平促进肝细胞自噬发挥肝细胞保护作用值得进一步研究.
本研究结果显示, MSC-CM治疗与BMSCs移植同样可以促进急性肝衰竭小鼠抗炎因子IL-10水平, 降低急性肝衰竭HMGB1和TNF-α、IL-1β、IL-6等炎症因子水平, 减轻肝脏炎症坏死, 提高生存率. IL-10抗体阻断了MSC-CM对及急性肝衰竭的治疗效应, 表明IL-10在MSC-CM逆转小鼠急性肝衰竭中发挥重要作用. 上述结果为BMSCs抗肝衰竭炎症反应治疗提供了新的理论基础, 具有重要的理论和应用价值.
国内外合作者研究显示骨髓间充质干细胞分泌的因子(mesenchymal stem cell-derived molecules, MSC-CM)减轻急性肝衰竭小鼠肝脏炎症坏死和促进肝细胞再生, 其中重要抗炎因子白介素-10(interleukin-10, IL-10)的水平升高显著, 但IL-10在治疗急性肝衰竭中的作用尚不清楚.
庄林, 主任医师, 昆明市第三人民医院肝病科
骨髓间充质肝细胞和MSC-CM对急性肝衰竭具有治疗作用, 但对单一细胞因子的作用尚不十分清楚. IL-10是一种重要的抗炎因子, 在MSC-CM治疗急性肝衰竭中的作用值得进一步探讨.
骨髓间充质肝细胞和MSC-CM对急性肝衰竭具有治疗作用, 作者最近研究提示MSC-CM移植急性肝衰竭肝细胞高迁移率蛋白B1(high mobility group box 1, HMGB1)胞浆移位, 但对IL-10在MSC-CM治疗急性肝衰竭中作用尚不清楚.
本研究发现IL-10在MSC-CM逆转急性肝衰竭中发挥重要作用.
本研究显示, IL-10在MSC-CM逆转急性肝衰竭中发挥重要作用, 为临床应用MSC-CM和诱导IL-10干预急性肝衰竭提供理论支持.
本文研究结果具较高的基础和临床应用价值.
编辑:郭鹏 电编:闫晋利
| 1. | Schwartz RE, Reyes M, Koodie L, Jiang Y, Blackstad M, Lund T, Lenvik T, Johnson S, Hu WS, Verfaillie CM. Multipotent adult progenitor cells from bone marrow differentiate into functional hepatocyte-like cells. J Clin Invest. 2002;109:1291-1302. [PubMed] |
| 2. | Mohamadnejad M, Namiri M, Bagheri M, Hashemi SM, Ghanaati H, Zare Mehrjardi N, Kazemi Ashtiani S, Malekzadeh R, Baharvand H. Phase 1 human trial of autologous bone marrow-hematopoietic stem cell transplantation in patients with decompensated cirrhosis. World J Gastroenterol. 2007;13:3359-3363. [PubMed] |
| 3. | Anzalone R, Lo Iacono M, Corrao S, Magno F, Loria T, Cappello F, Zummo G, Farina F, La Rocca G. New emerging potentials for human Wharton's jelly mesenchymal stem cells: immunological features and hepatocyte-like differentiative capacity. Stem Cells Dev. 2010;19:423-438. [PubMed] [DOI] |
| 4. | Kuo TK, Hung SP, Chuang CH, Chen CT, Shih YR, Fang SC, Yang VW, Lee OK. Stem cell therapy for liver disease: parameters governing the success of using bone marrow mesenchymal stem cells. Gastroenterology. 2008;134:2111-2121, 2121. e1-3. [PubMed] [DOI] |
| 5. | Campard D, Lysy PA, Najimi M, Sokal EM. Native umbilical cord matrix stem cells express hepatic markers and differentiate into hepatocyte-like cells. Gastroenterology. 2008;134:833-848. [PubMed] [DOI] |
| 6. | van Poll D, Parekkadan B, Cho CH, Berthiaume F, Nahmias Y, Tilles AW, Yarmush ML. Mesenchymal stem cell-derived molecules directly modulate hepatocellular death and regeneration in vitro and in vivo. Hepatology. 2008;47:1634-1643. [PubMed] [DOI] |
| 7. | Parekkadan B, van Poll D, Suganuma K, Carter EA, Berthiaume F, Tilles AW, Yarmush ML. Mesenchymal stem cell-derived molecules reverse fulminant hepatic failure. PLoS One. 2007;2:e941. [PubMed] [DOI] |
| 8. | Németh K, Leelahavanichkul A, Yuen PS, Mayer B, Parmelee A, Doi K, Robey PG, Leelahavanichkul K, Koller BH, Brown JM. Bone marrow stromal cells attenuate sepsis via prostaglandin E(2)-dependent reprogramming of host macrophages to increase their interleukin-10 production. Nat Med. 2009;15:42-49. [PubMed] [DOI] |
| 9. | Pittenger M. Sleuthing the source of regeneration by MSCs. Cell Stem Cell. 2009;5:8-10. [PubMed] [DOI] |
| 10. | McGeachy MJ, Bak-Jensen KS, Chen Y, Tato CM, Blumenschein W, McClanahan T, Cua DJ. TGF-beta and IL-6 drive the production of IL-17 and IL-10 by T cells and restrain T(H)-17 cell-mediated pathology. Nat Immunol. 2007;8:1390-1397. [PubMed] [DOI] |
| 13. | Zhang M, Xu S, Han Y, Cao X. Apoptotic cells attenuate fulminant hepatitis by priming Kupffer cells to produce interleukin-10 through membrane-bound TGF-β. Hepatology. 2011;53:306-316. [PubMed] [DOI] |
| 14. | 陈 煜, 时 红波, 张 帆, 丁 美, 赵 军, 刘 旭华, 段 钟平. TLR2、TLR4和TLR9在慢性重型肝炎患者及肝衰竭大鼠中的表达. 世界华人消化杂志. 2010;18:1320-1325. [DOI] |
| 15. | Rolando N, Wade J, Davalos M, Wendon J, Philpott-Howard J, Williams R. The systemic inflammatory response syndrome in acute liver failure. Hepatology. 2000;32:734-739. [PubMed] [DOI] |
| 16. | Tsung A, Sahai R, Tanaka H, Nakao A, Fink MP, Lotze MT, Yang H, Li J, Tracey KJ, Geller DA. The nuclear factor HMGB1 mediates hepatic injury after murine liver ischemia-reperfusion. J Exp Med. 2005;201:1135-1143. [PubMed] [DOI] |
| 17. | Wang H, Bloom O, Zhang M, Vishnubhakat JM, Ombrellino M, Che J, Frazier A, Yang H, Ivanova S, Borovikova L. HMG-1 as a late mediator of endotoxin lethality in mice. Science. 1999;285:248-251. [PubMed] [DOI] |
| 18. | Scaffidi P, Misteli T, Bianchi ME. Release of chromatin protein HMGB1 by necrotic cells triggers inflammation. Nature. 2002;418:191-195. [PubMed] [DOI] |
| 19. | Bonaldi T, Talamo F, Scaffidi P, Ferrera D, Porto A, Bachi A, Rubartelli A, Agresti A, Bianchi ME. Monocytic cells hyperacetylate chromatin protein HMGB1 to redirect it towards secretion. EMBO J. 2003;22:5551-5560. [PubMed] [DOI] |
| 20. | Andersson U, Wang H, Palmblad K, Aveberger AC, Bloom O, Erlandsson-Harris H, Janson A, Kokkola R, Zhang M, Yang H. High mobility group 1 protein (HMG-1) stimulates proinflammatory cytokine synthesis in human monocytes. J Exp Med. 2000;192:565-570. [PubMed] [DOI] |
| 21. | Raucci A, Palumbo R, Bianchi ME. HMGB1: a signal of necrosis. Autoimmunity. 2007;40:285-289. [PubMed] [DOI] |
| 24. | Tögel F, Hu Z, Weiss K, Isaac J, Lange C, Westenfelder C. Administered mesenchymal stem cells protect against ischemic acute renal failure through differentiation-independent mechanisms. Am J Physiol Renal Physiol. 2005;289:F31-F42. [PubMed] [DOI] |
| 25. | Ortiz LA, Dutreil M, Fattman C, Pandey AC, Torres G, Go K, Phinney DG. Interleukin 1 receptor antagonist mediates the antiinflammatory and antifibrotic effect of mesenchymal stem cells during lung injury. Proc Natl Acad Sci U S A. 2007;104:11002-11007. [PubMed] [DOI] |
| 26. | Milwid JM, Ichimura T, Li M, Jiao Y, Lee J, Yarmush JS, Parekkadan B, Tilles AW, Bonventre JV, Yarmush ML. Secreted factors from bone marrow stromal cells upregulate IL-10 and reverse acute kidney injury. Stem Cells Int. 2012;2012:392050. [PubMed] [DOI] |
| 27. | Lin CW, Zhang H, Li M, Xiong X, Chen X, Chen X, Dong XC, Yin XM. Pharmacological promotion of autophagy alleviates steatosis and injury in alcoholic and non-alcoholic fatty liver conditions in mice. J Hepatol. 2013;58:993-999. [PubMed] [DOI] |
| 28. | Ni HM, Bockus A, Boggess N, Jaeschke H, Ding WX. Activation of autophagy protects against acetaminophen-induced hepatotoxicity. Hepatology. 2012;55:222-232. [PubMed] [DOI] |
| 29. | Amir M, Zhao E, Fontana L, Rosenberg H, Tanaka K, Gao G, Czaja MJ. Inhibition of hepatocyte autophagy increases tumor necrosis factor-dependent liver injury by promoting caspase-8 activation. Cell Death Differ. 2013;20:878-887. [PubMed] [DOI] |
| 30. | Carchman EH, Rao J, Loughran PA, Rosengart MR, Zuckerbraun BS. Heme oxygenase-1-mediated autophagy protects against hepatocyte cell death and hepatic injury from infection/sepsis in mice. Hepatology. 2011;53:2053-2062. [PubMed] [DOI] |