修回日期: 2013-06-13
接受日期: 2013-07-03
在线出版日期: 2013-08-08
目的: 研究慢病毒介导的PLK1(Polo-like kinase 1)基因RNAi对食管鳞癌细胞侵袭转移的影响.
方法: 利用RT-PCR和Western blot检测不同食管鳞癌细胞中PLK1的表达. 根据人PLK1 mRNA序列设计干扰片段, Western blot检测干扰效率; 利用划痕愈合实验及Transwell实验研究靶向PLK1的RNAi对食管鳞癌细胞体外侵袭转移能力的影响. 将有效干扰序列构建至慢病毒干扰载体pGLV/H1/GFP+Puro中, 测序鉴定. 重组慢病毒载体与包装质粒共转染293T细胞包装病毒, 制备的重组病毒感染食管鳞癌细胞, 利用荧光定量PCR和Western blot检测干扰效率; 利用裸鼠肺转移模型实验研究慢病毒介导的PLK1基因RNAi对食管鳞癌细胞在体内侵袭转移能力的影响.
结果: 筛选出一种高表达PLK1的食管鳞癌细胞株TE-8用于实验研究; 筛选出有效的干扰片段, 并成功构建靶向干扰PLK1基因的慢病毒载体, 制备重组病毒颗粒用于感染食管鳞癌细胞; 靶向PLK1的RNAi在体内外均能明显抑制食管鳞癌细胞的侵袭与转移.
结论: 靶向干扰PLK1基因的重组慢病毒能够抑制食管鳞癌细胞的侵袭与转移, PLK1基因影响着食管鳞癌的恶性进展.
核心提示: PLK1(Polo-like kinase 1)在鳞状食管癌组织中呈高表达, 且表达程度与食管鳞癌的分化程度及淋巴结转移密切相关, 筛选有效的干扰片段, 成功构建靶向干扰PLK1基因的慢病毒载体, 靶向PLK1的RNAi在体内外均能明显抑制食管鳞癌细胞的侵袭与转移, PLK1基因影响着食管鳞癌的恶性进展.
引文著录: 于文静, 张宝刚, 陈丽梅, 王守训, 冯卫国, 杜长青, 刘顺梅, 赵春玲. PLK1基因RNAi慢病毒载体的构建及对食管鳞癌细胞侵袭转移的影响. 世界华人消化杂志 2013; 21(22): 2128-2135
Revised: June 13, 2013
Accepted: July 3, 2013
Published online: August 8, 2013
AIM: To investigate the inhibitory effect of lentiviral-mediated RNA interference targeting the PLK1 gene on invasion and metastasis of esophageal squamous cell carcinoma (ESCC) cells.
METHODS: RT-PCR and Western blot were used to detect the expression of PLK1 mRNA and protein in different ESCC cells. Based on the mRNA sequence of human PLK1 gene, interference fragments were designed, and interference efficiency was detected by Western blot. The in vitro effect of PLK1 siRNA on migration and invasion of ESCC cells was assessed by wound-healing assay and Matrigel chemoinvasion assay. The most efficient interference fragment was cloned into the lentiviral vector pGLV/H1/GFP+Puro and sequenced. The resulting recombinant lentiviral vector and packaging plasmids were transfected into 293T cells, and packaged virus particles were used to infect ESCC cells. Interference efficiency was assessed using fluorescence quantitative PCR and Western blot. The in vivo effect of recombinant lentiviral vector on invasion and metastasis of ESCC cells was studied using a nude mouse model of pulmonary metastasis.
RESULTS: The ESCC cell line TE-8 overexpressed PLK1, and the most efficient PLK1 siRNA could obviously inhibit migration and invasion of TE-8 cells in vitro. The lentiviral vector for RNA interference targeting the PLK1 gene was successfully constructed. The prepared recombinant virus particles could infect TE-8 cells and significantly inhibit the metastasis of ESCC cells in vivo.
CONCLUSION: Lentiviral-mediated RNA interference targeting PLK1 could obviously inhibit invasion and metastasis of ESCC cells. PLK1 may promote the malignant development of ESCC.
- Citation: Yu WJ, Zhang BG, Chen LM, Wang SX, Feng WG, Du CQ, Liu SM, Zhao CL. Lentiviral-mediated RNA interference targeting the PLK1 gene inhibits invasion and metastasis of esophageal squamous cell carcinoma cells. Shijie Huaren Xiaohua Zazhi 2013; 21(22): 2128-2135
- URL: https://www.wjgnet.com/1009-3079/full/v21/i22/2128.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i22.2128
PLK1(Polo-like kinase 1)是哺乳动物细胞内一种高度保守的丝氨酸/苏氨酸激酶, 在细胞有丝分裂的不同时期均起到十分重要的作用, 对中心体成熟、细胞周期的正常进行、胞质分裂等均有重要影响[1-4]. 研究发现, 在大多数人类肿瘤中PLK1均表现为高表达, 且PLK1的过高表达在非小细胞性肺癌、黑色素瘤患者均提示预后不良[5-8]. 但目前关于PLK1如何影响肿瘤的发生发展的研究报道较少, PLK1能否成为肿瘤治疗的靶点也成为新的研究热点.
目前对于PLK1与食管癌关系的研究正处于起步阶段, 我们的前期工作表明PLK1在鳞状食管癌组织中呈高表达, 且PLK1的表达程度与食管鳞癌的分化程度及淋巴结转移密切相关[9]. 但PLK1是否在食管鳞癌的侵袭转移中发挥作用及其作用机制尚未见相关报道. 本研究通过构建针对人PLK1基因RNAi的重组慢病毒载体LV-PLK1, 制备靶向PLK1基因的RNAi慢病毒, 用慢病毒感染食管鳞癌细胞, 研究靶向PLK1基因的RNAi慢病毒对食管鳞癌细胞侵袭转移能力的影响, 为靶向PLK1基因抗食管鳞癌转移的基因治疗提供实验依据.
食管鳞癌细胞株TE-8、TE-10、TE-15和Eca-109购自中国科学院上海细胞库; 293T细胞本实验室保存; 两个PLK1 siRNA的寡核苷酸序列siRNA-PLK1-1和siRNA-PLK1-2、非特异性siRNA(siRNA-NC)、DNA-shRNA-PLK1和DNA-shRNA-NC由Takara公司合成(表1); pGLV/H1/GFP+Puro载体和包装质粒Helper Vector均购自上海吉玛制药技术有限公司; RPMI 1640培养基和DMEM培养液购自Gibco公司; RNAiso Plus、PrimeScript® RT reagent Kit、SYBR® PrimeScript® RT-PCR Kit、BamHⅠ和EcoRⅠ限制性内切酶及T4 DNA连接酶均购自Takara公司; RIPA细胞裂解液、BCA蛋白浓度测定试剂盒均购自Beyotime公司; 兔抗人PLK1单抗、兔抗人actin单抗和HRP标记的羊抗兔二抗购自Santa Cruz公司; Matrigel购自Sigma公司; LipofectamineTM 2000 Transfection Reagent和Lipofectamine RNAiMax Transfection Reagent购自Invitrogen公司; Transwell小室(24孔, 0.8 μm)购自Corning公司; 本研究所用引物由赛百胜公司合成. PLK1上游引物: 5'-TGACGAGTTCTTTACTTCTGGC-3', 下游引物: 5'-CAGGCTGTCACCATCATTGTAG-3', 退火温度是60 ℃, 扩增片断长度是451 bp; actin上游引物: 5'-TGACGTGGACATCCGCAAAG-3', 下游引物: 5'-CTGGAAGGTGGACAGCGAGG-3', 退火温度是55 ℃, 扩增片断长度是206 bp.
| 分组 | 适应证 |
| 克罗恩病 | 维持缓解中重度克罗恩病(任何部位的疾病, 特别是广泛的疾病) |
| 维持缓解克罗恩病早期复发(经治疗后进入缓解期<3 mo)或频繁复发(每年2次以上) | |
| 瘘管克罗恩病(与抗生素合用, 如果没有尽早抗TNF治疗或手术必要) | |
| 术后预防克罗恩病复发(除非高风险的情况下, 如反复手术或当前吸烟者) | |
| 结合抗TNF制剂治疗严重克罗恩病(快速升阶梯或降阶梯治疗) | |
| 溃疡性结肠炎 | 激素依赖性溃疡性结肠炎维持缓解治疗 |
| (可联合5-氨基水 杨酸治疗) | 需类固醇治疗的溃疡性结肠炎早期复发维持缓解治疗 |
| 需类固醇治疗的溃疡性结肠炎频繁复发维持缓解治疗 | |
| 环孢素, 他克莫司, 或静脉注射类固醇激素诱导缓解溃疡性结肠炎的维持缓解治疗 | |
| 急性或慢性难治性憩室炎 |
1.2.1 RT-PCR检测食管鳞癌细胞株中PLK mRNA水平的表达: 利用RNAiso Plus和PrimeScript® RT reagent Kit从体外培养的食管鳞癌细胞株中提取总RNA并反转录为cDNA. 利用TaqTM进行PCR扩增, 具体步骤参考试剂盒说明书. 反应条件为: 94 ℃ 2 min; 94 ℃ 30 s, 60 ℃ 15 s, 72 ℃ 15 s, 30个循环; 72 ℃ 10 min.
1.2.2 Western blot检测食管鳞癌细胞株中PLK1基因在蛋白质水平的表达: 取对数生长期的食管鳞癌细胞株, 利用RIPA细胞裂解液试剂盒进行蛋白质样品制备, 并参照BCA蛋白浓度测定试剂盒说明书对蛋白质进行定量, 每孔上样30 μg蛋白样品进行SDS-PAGE电泳, 电泳后利用半干法转膜将凝胶中的蛋白质转移到PVDF膜上, 封闭后分别加入一抗(兔抗人PLK1单抗1:1000稀释; 兔抗人actin单抗1:2000稀释)和HRP标记的羊抗兔二抗(1:2000稀释), 洗涤后, 与ECL试剂反应处理曝光, 对蛋白质条带进行分析.
1.2.3 人PLK1基因siRNA靶序列的设计及重组慢病毒载体的构建: 基于人PLK1 mRNA序列(NM-005030.0), 利用在线设计软件http://www.ambion.com/techlib/misc/siRNA_ finder.html设计两段用于干扰人PLK1的干扰序列siRNA-PLK1-1和siRNA-PLK1-2及对照序列siRNA-NC, 委托Takara公司合成. 根据Lipofectamine RNAiMax Transfection Reagent说明书转染合成的siRNA至食管鳞癌细胞, Western blot检测干扰效率. 根据慢病毒载体特点设计有效干扰片段的DNA片段DNA-shRNA-PLK1及对照序列DNA-shRNA-NC, 并根据载体特点上下游分别引入BamHⅠ和EcoRⅠ酶切位点, 序列见表1, 委托Takara公司合成正反链并退火形成双链. 用BamHⅠ和EcoRⅠ双酶切慢病毒干扰载体pGLV/H1/GFP+Puro, 使其线性化, 割胶纯化回收, 用T4 DNA连接酶将上述合成的片段与线性化的载体于16 ℃连接过夜. 经转化获得单克隆, 送Takara公司测序分析, 测序正确的重组载体命名为LV-PLK1.
1.2.4 重组慢病毒颗粒的包装、滴度检测及感染食管鳞癌细胞: (1)病毒的包装: 上述重组慢病毒质粒LV-PLK1(LV-NC为对照)与包装质粒 Helper Vector, 按照Invitrogen LipofectamineTM 2000 Transfection Reagent使用说明书共转染293T细胞, 转染8 h后换为完全培养基; (2)病毒的收集与浓缩: 转染后48 h收集293T细胞上清液. 4 ℃, 4000 g离心10 min, 收集上清, 用0.45 μm滤器过滤后分装于小管中, -80 ℃长期保存; (3)慢病毒滴度检测: 准备5个无菌Ep管, 每管中加入90 μL的无血清培养基; 取待测定的病毒原液10 μL加入到第一个管中, 混匀后, 从第1管取10 μL加入第2管中, 继续相同的操作直到第5管; 除去培养的293T细胞的DMEM培养液, 加入稀释好的90 μL病毒溶液, 继续培养24 h后换成100 μL的完全培养基, 48 h后观察荧光表达情况; (4)感染食管鳞癌细胞: 在细胞培养瓶(75 cm2)中, 接种1×106个食管鳞癌细胞, 加入病毒上清稀释液(10 MOI)混合均匀后放入CO2培养箱(37 ℃, 50 mL/L CO2)24 h后移去病毒上清稀释液, 加入RPMI 1640培养基(10%FBS), 继续培养24 h后用于下游实验.
1.2.5 划痕愈合实验检测食管鳞癌细胞体外迁移能力: 将食管鳞癌细胞接种于6孔板, 当细胞密度达到90%时, 瞬时转染化学合成的siRNA-PLK1和对照siRNA-NC 48 h, 用200 μL的枪头尖以均匀的力度在六孔板上划线. 用无抗生素、无胎牛血清的培养基洗细胞3次, 换用含2%FBS的培养基培养24 h, 拍照.
1.2.6 Transwell实验检测食管鳞癌细胞体外侵袭能力: 瞬时转染化学合成的siRNA-PLK1和对照siRNA-NC至食管鳞癌细胞48 h, 胰酶消化细胞, 以5×104个细胞/孔的密度接种于Transwell(Matrigel包被)中, 静置1 h; 在下层中加入无抗生素、无胎牛血清的培养基; 培养16 h后取出WELL, 4%多聚甲醛固定10 min, PBS洗两次, 结晶紫染色30 min; 用棉签小心擦拭WELL内部, 擦掉内表面的细胞, PBS洗3次, 显微镜下观察照相; 随机取10个视野计数, 统计数值, 绘制柱形图.
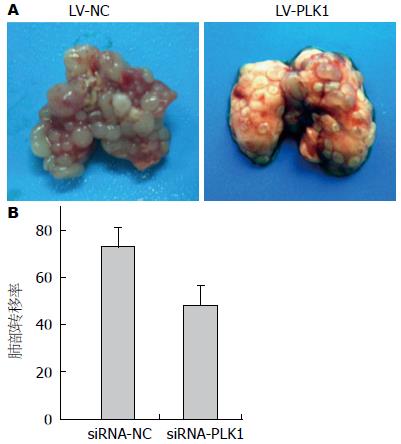
1.2.7 裸鼠肺转移模型实验检测食管鳞癌细胞的肺转移能力: 选取5-8 wk的裸鼠分成4组. 消化对数生长期的食管鳞癌细胞, 用无血清无抗生素培养基洗细胞2次, 将细胞配成4×105个/100 μL的浓度. 通过尾静脉注射的方式接种于裸鼠, 接种量约为4×105个细胞/只. 在接种后2 h, 开始通过尾静脉注射慢病毒的方式治疗. 每次每只裸鼠注射2×106 TU的慢病毒, 每3 d治疗1次, 共计治疗6次. 待空白组裸鼠出现明显呼吸急促, 行动迟缓的现象后, 统一处死裸鼠取肺脏, 计数肺部肿瘤转移结节的数目并拍照.
统计学处理 实验数据以mean±SD表示, 采用SPSS16.0软件进行统计学处理, 两组间均数比较用t检验, 以P<0.05为差异有统计学意义.
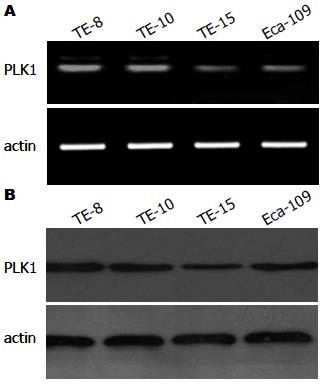
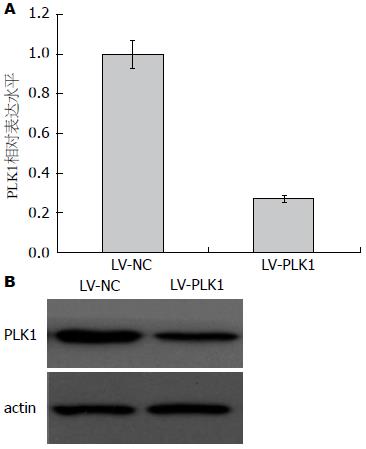
通过RT-PCR(图1A)和Western blot(图1B)的方法分别检测在mRNA和蛋白质水平PLK1在不同的食管鳞癌细胞株中的表达量. 在mRNA和蛋白质水平的检测结果一致, 以actin为内参, 结果均显示TE-8为高表达PLK1的细胞株. 故选用TE-8为后续研究的实验细胞.
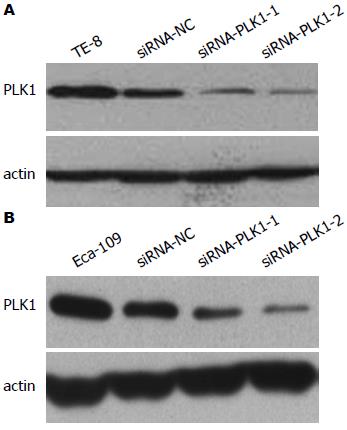
将合成的siRNA正反链退火形成双链后, 转染TE-8(图2A)和Eca-109(图2B). 以Western blot方法检测干扰效果, 发现在两种细胞株中的干扰效果一致, 与对照组(未转染的空白细胞和siRNA-NC组)相比, siRNA-PLK1-2转染的两株细胞中PLK1的蛋白表达水平均明显降低, 故选择该序列设计并构建至慢病毒载体中的DNA-shRNA-PLK1, 并进行体外的细胞生物学实验.
划痕愈合实验结果显示, 实验组(转染siRNA-PLK1)与对照组(siRNA-NC)相比, 划痕处细胞迁移的数目明显减少(图3), 表明靶向PLK1的RNAi对食管鳞癌细胞的迁移能力有明显抑制作用.
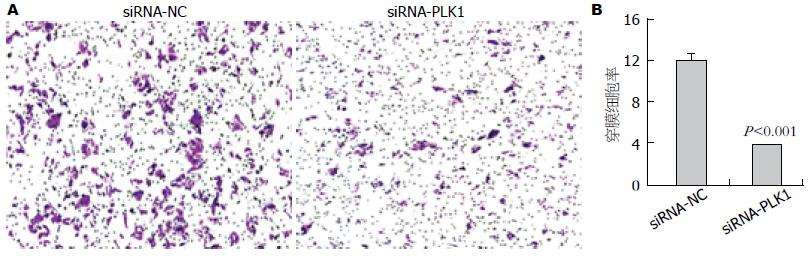
Transwell实验结果显示, 实验组(siRNA-PLK1)穿膜细胞数明显比siRNA-NC组少(图4A), 差异明显(P<0.001)(图4B), 表明PLK1基因表达沉默能明显抑制食管鳞癌细胞在体外的侵袭能力.
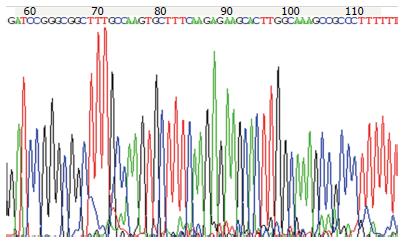
对插入慢病毒载体中的序列进行测序, 测序结果与理论预测序列完全一致(图5), 该序列能够转录靶向人PLK1基因的shRNA. 构建成功的慢病毒载体命名为LV-PLK1.
侵袭与转移是恶性肿瘤的重要特征, 也是肿瘤患者死亡的主要原因. 研究表明[10-13]肿瘤细胞的迁移和侵袭能力是肿瘤转移的限速环节, 而肿瘤的迁移和侵袭过程是一个多步骤、多阶段、多因素的复杂过程.
作为调控细胞周期的重要的丝氨酸/苏氨酸激酶, PLK1在许多肿瘤中表现为高表达[14-17]; 少量的研究表明PLK1的高表达参与了肿瘤的侵袭转移[18-20]或凋亡[21]. Wang等[22]研究表明在转移的肝细胞癌中异常的Plkl-Cdc25A信号通路起了重要作用. Lu等[23]研究发现PLK1表达在早期胚胎发育和抑制肿瘤生长方面均有作用. 在对侵袭性乳腺癌的研究中发现[24], PLK1通过磷酸化波形蛋白82位的丝氨酸, 进而调节细胞表面的β1整合素的蛋白水平, 从而诱导了乳腺癌细胞侵袭穿过富含粘连蛋白的细胞外基质, 但PLK1是否在食管鳞癌侵袭转移中发挥作用尚未见研究报道.
RNA干扰技术[25-29]的出现为我们提供了新的基因功能研究与基因治疗手段. 本研究首先筛选出高表达PLK1的食管鳞癌细胞TE-8及能明显降低食管鳞癌细胞中PLK1表达的siRNA干扰片段, 细胞划痕及Transwell实验证实该靶向PLK1的siRNA能明显抑制食管鳞癌细胞TE-8的迁移与侵袭能力. 为进一步在动物整体水平观察靶向PLK1的RNA干扰效果, 我们构建了能够干扰人PLK1基因表达的慢病毒载体. 慢病毒是一种逆转录病毒载体, 可以感染体内体外分裂细胞与非分裂细胞, 并整合到其基因组中长时间表达外源基因. 目前慢病毒作为siRNA载体使RNA干扰技术已广泛的应用于基因治疗领域[30]. 根据慢病毒质粒pGLV/H1/GFP+Puro的特点, 将设计合成的DNA-shRNA-PLK1插入到载体的BamHⅠ和EcoRⅠ之间, 测序正确. 成功构建的慢病毒载体能明显干扰食管鳞癌细胞中PLK1基因表达, 导致PLK1在转录和蛋白表达水平均下调. 体内实验裸鼠肺转移模型实验证明慢病毒介导的PLK1基因RNAi能明显抑制食管鳞癌细胞在体内的转移与生长, 这同时也表明PLK1在食管鳞癌的侵袭转移中发挥重要作用, 其机制还有待深入研究, 这将是我们下一步的研究重点.
总之, PLK1基因能促进食管鳞癌细胞的侵袭与转移, 在食管鳞癌的恶性进展中发挥重要作用, 以慢病毒为载体的PLK1基因RNAi能明显抑制其功能. 这为开发抗食管鳞癌转移的新型生物基因药物提供新思路, 具有重要的临床意义.
PLK1(Polo-like kinase 1)是哺乳动物细胞内一种高度保守的丝氨酸/苏氨酸激酶, 在细胞有丝分裂的不同时期均起到十分重要的作用, 对中心体成熟、胞质分裂等均有重要影响. 但目前关于PLK1影响肿瘤的发生发展, 尤其迁移和侵袭的研究报道较少.
肖恩华, 教授, 中南大学湘雅二医院放射教研室
以慢病毒为载体的PLK1基因RNAi, 为开发抗食管鳞癌转移的新型生物基因药物提供新思路, 具有重要的临床意义.
PLK1在多数人类肿瘤中均表现为高表达, 且PLK1的过高表达在非小细胞性肺癌、黑色素瘤患者中均提示预后不良; siRNA干扰PLK1的表达可对肿瘤细胞凋亡产生影响.
本研究通过构建针对人PLK1基因RNAi的重组慢病毒载体LV-PLK1, 制备靶向PLK1基因的RNAi慢病毒, 用慢病毒感染食管鳞癌细胞, 体内外实验结合研究靶向PLK1基因的RNAi慢病毒对食管鳞癌细胞侵袭转移能力的影响.
为靶向PLK1基因抗食管鳞癌转移的基因治疗提供实验依据.
本文选题新颖, 有良好的临床应用前景, 有一定的创新性.
编辑:田滢 电编:闫晋利
| 1. | Liu X, Erikson RL. Activation of Cdc2/cyclin B and inhibition of centrosome amplification in cells depleted of Plk1 by siRNA. Proc Natl Acad Sci U S A. 2002;99:8672-8676. [PubMed] [DOI] |
| 2. | Schmit TL, Nihal M, Ndiaye M, Setaluri V, Spiegelman VS, Ahmad N. Numb regulates stability and localization of the mitotic kinase PLK1 and is required for transit through mitosis. Cancer Res. 2012;72:3864-3872. [PubMed] [DOI] |
| 3. | Zhang L, Shao H, Huang Y, Yan F, Chu Y, Hou H, Zhu M, Fu C, Aikhionbare F, Fang G. PLK1 phosphorylates mitotic centromere-associated kinesin and promotes its depolymerase activity. J Biol Chem. 2011;286:3033-3046. [PubMed] [DOI] |
| 4. | Beck J, Maerki S, Posch M, Metzger T, Persaud A, Scheel H, Hofmann K, Rotin D, Pedrioli P, Swedlow JR. Ubiquitylation-dependent localization of PLK1 in mitosis. Nat Cell Biol. 2013;15:430-439. [PubMed] [DOI] |
| 5. | Takahashi T, Sano B, Nagata T, Kato H, Sugiyama Y, Kunieda K, Kimura M, Okano Y, Saji S. Polo-like kinase 1 (PLK1) is overexpressed in primary colorectal cancers. Cancer Sci. 2003;94:148-152. [PubMed] [DOI] |
| 6. | Takai N, Miyazaki T, Fujisawa K, Nasu K, Hamanaka R, Miyakawa I. Expression of polo-like kinase in ovarian cancer is associated with histological grade and clinical stage. Cancer Lett. 2001;164:41-49. [PubMed] [DOI] |
| 7. | Strebhardt K, Kneisel L, Linhart C, Bernd A, Kaufmann R. Prognostic value of pololike kinase expression in melanomas. JAMA. 2000;283:479-480. [PubMed] [DOI] |
| 8. | Wolf G, Elez R, Doermer A, Holtrich U, Ackermann H, Stutte HJ, Altmannsberger HM, Rübsamen-Waigmann H, Strebhardt K. Prognostic significance of polo-like kinase (PLK) expression in non-small cell lung cancer. Oncogene. 1997;14:543-549. [PubMed] [DOI] |
| 9. | Zhao C, Gong L, Li W, Chen L. Overexpression of Plk1 promotes malignant progress in human esophageal squamous cell carcinoma. J Cancer Res Clin Oncol. 2010;136:9-16. [PubMed] [DOI] |
| 10. | Xu Y, Chen Q, Yu X, Zhou X, Zheng X, Mao W. Factors influencing the risk of recurrence in patients with esophageal carcinoma treated with surgery: A single institution analysis consisting of 1002 cases. Oncol Lett. 2013;5:185-190. [PubMed] |
| 11. | Ni Y, Meng L, Wang L, Dong W, Shen H, Wang G, Liu Q, Du J. MicroRNA-143 functions as a tumor suppressor in human esophageal squamous cell carcinoma. Gene. 2013;517:197-204. [PubMed] [DOI] |
| 12. | Xia J, Wang F, Wang L, Fan Q. Elevated serine protease HtrA1 inhibits cell proliferation, reduces invasion, and induces apoptosis in esophageal squamous cell carcinoma by blocking the nuclear factor-κB signaling pathway. Tumour Biol. 2013;34:317-328. [PubMed] [DOI] |
| 13. | Li C, Li Z, Zhu M, Zhao T, Chen L, Ji W, Chen H, Su C. Clinicopathological and prognostic significance of survivin over-expression in patients with esophageal squamous cell carcinoma: a meta-analysis. PLoS One. 2012;7:e44764. [PubMed] [DOI] |
| 14. | Zhang XG, Lu XF, Jiao XM, Chen B, Wu JX. PLK1 gene suppresses cell invasion of undifferentiated thyroid carcinoma through the inhibition of CD44v6, MMP-2 and MMP-9. Exp Ther Med. 2012;4:1005-1009. [PubMed] |
| 15. | Zhao XY, Nie CL, Liang SF, Yuan Z, Deng HX, Wei YQ. Enhanced gemcitabine-mediated cell killing of human lung adenocarcinoma by vector-based RNA interference against PLK1. Biomed Pharmacother. 2012;66:597-602. [PubMed] [DOI] |
| 16. | Kawata E, Ashihara E, Kimura S, Takenaka K, Sato K, Tanaka R, Yokota A, Kamitsuji Y, Takeuchi M, Kuroda J. Administration of PLK-1 small interfering RNA with atelocollagen prevents the growth of liver metastases of lung cancer. Mol Cancer Ther. 2008;7:2904-2912. [PubMed] [DOI] |
| 17. | Liu X, Erikson RL. Polo-like kinase (Plk)1 depletion induces apoptosis in cancer cells. Proc Natl Acad Sci U S A. 2003;100:5789-5794. [PubMed] [DOI] |
| 18. | Han DP, Zhu QL, Cui JT, Wang PX, Qu S, Cao QF, Zong YP, Feng B, Zheng MH, Lu AG. Polo-like kinase 1 is overexpressed in colorectal cancer and participates in the migration and invasion of colorectal cancer cells. Med Sci Monit. 2012;18:BR237-BR246. [PubMed] [DOI] |
| 19. | Fristrup N, Ulhøi BP, Birkenkamp-Demtröder K, Mansilla F, Sanchez-Carbayo M, Segersten U, Malmström PU, Hartmann A, Palou J, Alvarez-Múgica M. Cathepsin E, maspin, Plk1, and survivin are promising prognostic protein markers for progression in non-muscle invasive bladder cancer. Am J Pathol. 2012;180:1824-1834. [PubMed] [DOI] |
| 20. | Mross K, Frost A, Steinbild S, Hedbom S, Rentschler J, Kaiser R, Rouyrre N, Trommeshauser D, Hoesl CE, Munzert G. Phase I dose escalation and pharmacokinetic study of BI 2536, a novel Polo-like kinase 1 inhibitor, in patients with advanced solid tumors. J Clin Oncol. 2008;26:5511-5517. [PubMed] [DOI] |
| 21. | Feng YB, Lin DC, Shi ZZ, Wang XC, Shen XM, Zhang Y, Du XL, Luo ML, Xu X, Han YL. Overexpression of PLK1 is associated with poor survival by inhibiting apoptosis via enhancement of survivin level in esophageal squamous cell carcinoma. Int J Cancer. 2009;124:578-588. [PubMed] [DOI] |
| 22. | Wang XQ, Zhu YQ, Lui KS, Cai Q, Lu P, Poon RT. Aberrant Polo-like kinase 1-Cdc25A pathway in metastatic hepatocellular carcinoma. Clin Cancer Res. 2008;14:6813-6820. [PubMed] [DOI] |
| 23. | Lu LY, Wood JL, Minter-Dykhouse K, Ye L, Saunders TL, Yu X, Chen J. Polo-like kinase 1 is essential for early embryonic development and tumor suppression. Mol Cell Biol. 2008;28:6870-6876. [PubMed] [DOI] |
| 24. | Rizki A, Mott JD, Bissell MJ. Polo-like kinase 1 is involved in invasion through extracellular matrix. Cancer Res. 2007;67:11106-11110. [PubMed] [DOI] |
| 25. | Tan FL, Yin JQ. Application of RNAi to cancer research and therapy. Front Biosci. 2005;10:1946-1960. [PubMed] [DOI] |
| 26. | Nogawa M, Yuasa T, Kimura S, Tanaka M, Kuroda J, Sato K, Yokota A, Segawa H, Toda Y, Kageyama S. Intravesical administration of small interfering RNA targeting PLK-1 successfully prevents the growth of bladder cancer. J Clin Invest. 2005;115:978-985. [PubMed] |
| 27. | Santamaria A, Neef R, Eberspächer U, Eis K, Husemann M, Mumberg D, Prechtl S, Schulze V, Siemeister G, Wortmann L. Use of the novel Plk1 inhibitor ZK-thiazolidinone to elucidate functions of Plk1 in early and late stages of mitosis. Mol Biol Cell. 2007;18:4024-4036. [PubMed] [DOI] |
| 28. | Lénárt P, Petronczki M, Steegmaier M, Di Fiore B, Lipp JJ, Hoffmann M, Rettig WJ, Kraut N, Peters JM. The small-molecule inhibitor BI 2536 reveals novel insights into mitotic roles of polo-like kinase 1. Curr Biol. 2007;17:304-315. [PubMed] [DOI] |
| 29. | Bu Y, Yang Z, Li Q, Song F. Silencing of polo-like kinase (Plk) 1 via siRNA causes inhibition of growth and induction of apoptosis in human esophageal cancer cells. Oncology. 2008;74:198-206. [PubMed] [DOI] |
| 30. | Sumimoto H, Kawakami Y. Lentiviral vector-mediated RNAi and its use for cancer research. Future Oncol. 2007;3:655-664. [PubMed] [DOI] |