修回日期: 2012-11-05
接受日期: 2012-11-07
在线出版日期: 2012-11-28
目的: 改进大鼠肝星状细胞的分离方法, 提高肝星状细胞分离的纯度和活力.
方法: 本研究主要依据Weiskirchen的方法并加以改进, 灌注后即将肝脏从原位分离, 随之使用0.25%的链霉蛋白酶E和0.025%的胶原酶Ⅳ消化, 经DNA酶Ⅰ分散, 筛网过滤、离心, 将细胞沉淀用18%Nycodenz密度梯度离心,获取肝星状细胞. 台盼蓝染色鉴定细胞活率, Desmin免疫细胞化学染色法鉴定肝星状细胞纯度.
结果: 本方法所建立的离体消化分离肝星状细胞方法,每只大鼠肝约获取2.7×107个肝星状细胞, 活率、纯度分别为99%、90%. 该方法可有效减少细胞污染、提高细胞活力,值得广泛应用.
结论: 本文所建立的大鼠离体消化法分离肝星状细胞, 方法简单可行, 较大程度避免了细胞污染, 提高了细胞的存活率和纯度.
引文著录: 樊文梅, 刘德忠, 肖漓, 马锡慧, 石炳毅. 离体消化法分离原代肝星状细胞. 世界华人消化杂志 2012; 20(33): 3244-3247
Revised: November 5, 2012
Accepted: November 7, 2012
Published online: November 28, 2012
AIM: To improve the Weiskirchen's method for isolation of hepatic stellate cells (HSCs) and increase cell purity and rate of survival.
METHODS: HSCs were isolated based on the Weiskirchen's method with some modifications. The rat liver was perfused with 0.25% pronase E after seperating in vitro. After digestion with 0.025% collagen IV and 0.01% DNAse I, cell homogenates were filtered using a cell mesh and centrifuged. Cell pellet was then subjected to density gradient centrifugation in the presence of 18% Nycodenz stock solution. The white cell layer was HSCs. Cell viability was assessed by trypan blue exclusion staining. The purity of HSCs was evaluated by immunocytochemistry to detect the expression of desmin.
RESULTS: The yield rate of HSCs was 2.7 × 107 per rat. The purity of HSCs was 90% and cell viability was 99%. This method could effectively reduce cell contamination and increase cell viability.
CONCLUSION: Our improved method for isolation of HSCs by in vitro digestion is simple and efficient, because it can avoid contamination and increase cell purity and survival.
- Citation: Fan WM, Liu DZ, Xiao L, Ma XH, Shi BY. Isolation of hepatic stellate cells by in vitro digestion. Shijie Huaren Xiaohua Zazhi 2012; 20(33): 3244-3247
- URL: https://www.wjgnet.com/1009-3079/full/v20/i33/3244.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i33.3244
自从1876年由德国人Kupffer[1]用氯化金染色的方法鉴定出富含维生素A的细胞以来, 先后被称为肝储脂细胞、Ito细胞、维生素A储存细胞等不同名称. 1996年美国肝病会议将其正式命名为肝星状细胞(hepatic stellate cell, HSCs)[2]. 虽然他在肝组织中含量极少, 但却是肝纤维化中的主要效应细胞, 因此HSCs的分离培养成为肝纤维化研究的基础工作之一. HSCs首先在20世纪80年代初由Knook等[3]用链霉蛋白酶、胶原酶原位循环灌注法首先由大鼠体内成功分离HSCs, 从此人们开始了对HSCs的研究. HSCs是肝纤维化发生发展的中心环节, 然而其分离步骤繁琐、条件严格, 初学者不易分离成功, 作者参考中外文献, 经过多次实验, 摸索出一套稳定、经济的分离方法, 现报道如下.
SD大鼠(♀, 体质量350-450 g, 清洁级), 由北京维通利化实验动物技术有限公司提供, 普通饲料喂养, 自由进食进饮, 实验前禁食12 h. 链酶蛋白酶E、Ⅳ型胶原酶、DNaseⅠ和Nycodenz均购自sigma公司; DMEM、胎牛血清、胰蛋白酶均购自invitrogen公司; 鼠抗人desmin单克隆抗体(与大鼠有交叉反应)购自DAKO公司; 即用型SABC免疫组织化学染色试剂盒、DAB显色试剂盒购自武汉博士德生物工程有限公司; Hank's平衡盐溶液(含Ca2+Mg2+): 0.185 g CaCl2·H2O, 0.4 g KCl, 0.06 g KH2PO4, 0.1 g MgSO4·7H2O, 8 g NaCl, 0.35 g NaHCO3, 0.048 g Na2HPO4, 1 g葡萄糖, 溶于1 000 mL的超纯水中, 过滤除菌. Hank's平衡盐溶液(不含Ca2+Mg2+): 0.4 g KCl, 0.06 g KH2PO4, 8 g NaCl, 0.35 g NaHCO3, 0.048 g Na2HPO4, 1 g葡萄糖, 定容至1 000 mL的超纯水中. 链酶蛋白酶溶液: 链酶蛋白酶250 mg溶于100 mL含Ca2+Mg2+的HBSS溶液中, 过滤除菌, 4 ℃保存备用. 胶原酶消化灌注液: 胶原酶25 mg溶于100 mL含Ca2+Mg2+的HBSS溶液中, 过滤除菌, 4 ℃保存备用. DNA酶Ⅰ溶液: 10 mg DNA酶Ⅰ溶于100 mL含Ca2+Mg2+的HBSS溶液中, 过滤除菌, 4 ℃保存备用. 18%Nycodenz的配制: 称取18 g Nycodenz溶于100 mL无NaCl有Ca2+Mg2+的HBSS溶液中, 过滤除菌.
1.2.1 原位消化: 大鼠以2%戊巴比妥那2 mL/kg腹腔麻醉后, 仰卧固定. 750 mL/L乙醇消毒皮毛, 而后十字型剖腹暴露内脏, 将肠管推向左侧, 暴露门静脉, 于近肝脏处穿丝线并打活结, 22号静脉留置针行门静脉穿刺, 退出针芯, 近肝门处用结扎线固定留置针, 先灌注无Ca2+Mg2+的HBSS, 并迅速剪开下腔静脉放血, 肝脏迅速变为黄白色, 约灌注10 min后, 小心将肝脏从原位分离, 保持灌注系统, 置于无菌布氏漏斗上, 换为0.25%链酶蛋白酶灌注液, 消化肝实质细胞. 灌注完毕后续用0.025%胶原酶灌注液, 消化肝脏胶原等结缔组织成份, 肝脏软化后停止灌流.
1.2.2 细胞分散: 快速取下肝脏, 撕除肝包膜及结缔组织, 放入盛有DNA酶Ⅰ分散液的硅化三角烧瓶内, 200 r/min, 37 ℃, 恒温震荡20 min.
1.2.3 细胞纯化: 将震荡分散后的细胞悬液通过250目和100目的尼龙网过滤在50 mL聚丙烯离心管. 1 500 r/min离心7 min, 弃上清, 将细胞沉淀合为一管, 加入2倍体积的18%Nycodenz, 上覆有Ca2+Mg2+的HBSS 2-3 mL, 2 600 r/min离心22 min, 仔细吸取HBSS和Nycodenz界面细胞层, 放入离心管内, 加入HBSS, 1 500 r/min, 离心7 min, 洗涤两次后, 去上清液, 将细胞悬浮在含20%胎牛血清的DMEM内.
1.2.4 细胞纯度及活力鉴定: 0.4%台盼蓝染色法检测细胞活力; 以Desmin抗体(1:100)鉴定HSCs的纯度.
1.2.5 培养及传代方法: HSCs培养48 h后首次以含10%胎牛血清DMEM换液. 培养14 d左右细胞融合, 0.25%胰蛋白酶消化, 1 500 r/min离心7 min, 以1:3传代培养.
1只SD大鼠HSCs的得率为2.7×107, 经台盼蓝染色, 细胞活力为99%. 在倒置显微镜下见刚分离的HSCs呈圆形, 胞浆有较多脂滴, 接种24 h后, 部分细胞贴壁, 呈多边形, 活率、纯度分别为99%和90%.
在倒置显微镜下观察新分离的HSCs, HSCs呈圆形, 胞浆中含较多脂滴, 具有很强的折光性, 且大小小于肝细胞. 培养48 h后部分细胞已伸展, 7 d后细胞几乎全部活化(图1A), 呈纤维样细胞, 14 d时细胞融合成片, 经0.25%胰酶消化后, 次日细胞全部伸展生长, 传代4 d后细胞如图1B, 约7 d后细胞长成单层.
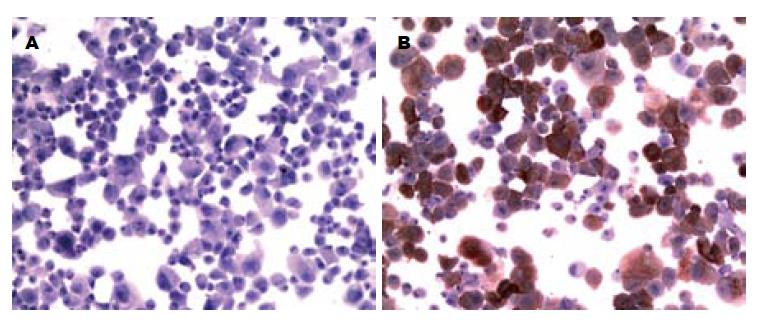
光镜下新分离未贴壁的HSCs胞浆中含丰富的脂滴, 折光性强, 在327 nm波长下具蓝绿色荧光, 但很快淬灭. 原代培养14 d的Desmin阳性率在90%左右(图2).
Weiskirchen等[4]的方法采用了自制的体外循环灌注系统, 并不适合我们国内的实验条件, 我们加以改良并成功地分离出大鼠的HSCs. 国内一些作者采用原位灌流法分离HSCs酶的用量较大, 且因门静脉穿刺的好坏、肝脏灌流的是否充分、胶原酶消化的程度都直接影响了HSCs的得率、活力和纯度, 本文HSCs分离方法是我们参照国内外文献[4-7], 经过数十次摸索出的简单、稳定的方法, 得率为2.7×107个左右/肝脏.
HSCs分离对于初学者难以掌握, 主要与门静脉插管的熟练程度、肝脏消化程度的判断和密度梯度离心后HSCs的吸取有关. 为成功分离大鼠HSCs, 应注意以下几点: (1)一般选用体质量350-450 g左右营养状况较好的大鼠, 这样细胞得率会较高, 这是国内学者普遍认同的观点[8-10]; (2)大鼠的门静脉较小, 门静脉穿刺不易成功, 容易刺破血管引起大出血, 门脉插管处不可离肝脏太近, 否则容易刺破肝脏, 且门静脉插管必须一次成功, 分别在远肝端与近肝端结扎固定, 防止静脉留置针中途脱落. 如果大鼠因出血等原因死亡, 进一步的灌流消化所得HSCs将很难贴壁; (3)充分的灌流对后续酶的消化至关重要, 本方法使用无Ca2+Mg2+的HBSS灌流肝脏, 对肝脏的灌流较为充分, 灌洗干净的肝脏外观呈均匀的黄白色. 如果灌洗不均匀, 可以将静脉留置针向远肝方向拽一下, 或通过棉签按摩灌洗不均匀的肝叶、或疏通下腔静脉的方式尽可能使肝脏充分的灌流干净; (4)灌洗干净的肝脏随之从原位分离, 此步为本方法的创新之处. 多数学者多在链酶蛋白酶消化后从原位分离[11-13], 此时肝脏已软化, 不易从原位分离, 操作过程的延长会增加污染风险, 在分离过程还易导致静脉留置针脱落. 基于原代HSCs分离步骤之繁琐, 细胞污染是HSCs分离培养失败的常见原因, 所以本文采用灌注后离体方式消化, 既避免了肝脏在原位消化不易剥离的情况, 而且防止了消化后软化的肝脏易污染的弊端, 这一方法是作者经多次摸索实践证明可有效防止污染. 国内学者冷希圣等[14]和郑伟达等[6]亦采用离体灌注法成功分离到HSCs, 但所用消化酶、Nycodenz浓度皆不同, 初学者不易把握, 作者亦经数十次试验, 所建立的离体消化法分离原代HSCs, 不仅可有效避免污染、同时能够保证细胞的得率、纯度和活力, 适合广泛应用; (5)胶原酶循环灌注3-4次, 肉眼观察肝包膜下组织几乎呈液化状态, 即可停止消化. 消化过度, 直接影响HSCs活力, 致后续细胞培养中不易存活[15], 初学者在判断肝脏消化程度方面往往没有经验, 作者总结出一般消化3-4次细胞得率和活力最高.
新分离的星状细胞含有大量脂滴, 在328 nm波长激发下, 呈蓝绿色荧光, 但在数秒内即淬灭. Desmin免疫组织化学是鉴定HSCs的可靠指标, 本试验分离的HSCs经Desmin抗体免疫组织化学鉴定, 细胞纯度达90%. 总之, 我们摸索出的离体消化分离原代HSCs培养及鉴定方法, 经多次实验证实, 在保证HSCs纯度的同时, 提高了产量和活力, 较大程度避免了细胞污染, 为进一步研究肝纤维化的发生发展奠定了基础.
肝星状细胞(HSCs)是肝纤维化发生发展的中心环节, 然而其分离步骤繁琐、条件严格, 初学者不易获得成功, 作者参考中外文文献, 经过多次实验, 摸索出一套稳定、经济的分离方法.
季菊玲, 副教授, 南通大学医学院病理教研室
HSCs是肝纤维化发生发展中最重要的细胞, 因此他的分离培养成为进行肝纤维化研究的一项必备技术. 国内外学者在这方面已进行了不懈的探索, 但是由于其分离步骤繁琐、易污染, 细胞不易存活等原因, 初学者不易掌握. 因此, 发展一种简便易行的分离方法十分必要.
HSCs分离常用Ficoll、Optiprep、Nycodenz等进行密度梯度离心, Ficoll和Optiprep均需调整浓度, 浓度配制的准确性将直接影响HSC得率和纯度. 本研究经过数十次的摸索, 采用2倍体积的18%的Nycodenz进行密度梯度离心, 细胞得率与纯度均可满足实验要求.
本研究的创新之处在于肝脏链酶蛋白酶E灌注后即从原位分离, 置于布氏漏斗上再进行胶原酶的循环灌注, 一方面有利于胶原酶的有效消化、防止消化不均匀; 另一方面减少了污染.
本实验所建立的HSCs分离方法, 和其他已建立的方法相比, 使初学者更易掌握, 所用材料均容易获得, 大大节省了实验成本, 提高了实验的可重复性, 未来可考虑制备成试剂盒.
原代肝星状细胞的分离和培养是一个多步骤、比较复杂的过程, 初学者不易掌握, 作者结合国内外文献, 经数十次摸索并加以改进, 为初学者提拱了一些有益的经验, 具有一定的应用价值.
编辑:翟欢欢 电编:鲁亚静
| 1. | Kupffer C. Ueber Sternzellen der Leber Briefliche Mittheilung an Prof. Waldeyer. Archiv für Mikroskopische Anatomie. 1876;353-358. [DOI] |
| 2. | Kumagai A, Dunphy WG. Molecular mechanism of the final steps in the activation of MPF. Cold Spring Harb Symp Quant Biol. 1991;56:585-589. [PubMed] [DOI] |
| 3. | Knook DL, Seffelaar AM, de Leeuw AM. Fat-storing cells of the rat liver. Their isolation and purification. Exp Cell Res. 1982;139:468-471. [PubMed] [DOI] |
| 4. | Weiskirchen R, Gressner AM. Isolation and culture of hepatic stellate cells. Methods Mol Med. 2005;117:99-113. [PubMed] |
| 8. | 王 文兵, 戴 立里, 郑 元义. 改良大鼠肝星状细胞分离及性质鉴定. 胃肠病学和肝病学杂志. 2005;14:239-242. |
| 11. | 姚 敏捷, 梁 兆祥, 李 艳. 大鼠肝贮脂细胞的分离、培养和鉴定. 细胞与分子免疫学杂志. 2003;19:297-298. |
| 12. | 翁 山耕, 冷 希圣, 魏 玉华, 彭 吉润, 郑 恩涛, 程 继华, 张 佑彬, 吕 建锋, 杜 如昱. 改良法大鼠肝星状细胞的分离培养及鉴定. 北京大学学报(医学版). 2001;33:83-86. |
| 15. | 许 伟华, 赵 延英, 杨 海燕, 吴 文秀. 肝星状细胞的分离和培养. 中华临床医学实践杂志. 2003;2:587-588. |