修回日期: 2012-10-16
接受日期: 2012-11-02
在线出版日期: 2012-11-18
目的: 研究重症急性胰腺炎(severe acute pancreatitis, SAP)患者外周血淋巴细胞Fas表达、淋巴细胞凋亡与并发脓毒症的关系.
方法: 流式细胞术检测18例SAP患者(10例并发脓毒症, 8例为非脓毒症)及20例轻症胰腺炎(mild acute pancreatitis, MAP)患者外周血淋巴细胞Fas表达、淋巴细胞凋亡, ELISA检测血清可溶性Fas(soluble Fas, sFas)水平, 以20例同期健康体检者作为正常对照.
结果: (1)与MAP及正常对照组相比, SAP组外周血淋巴细胞Fas表达、淋巴细胞凋亡率及血清sFas水平明显升高(均P<0.01), 并发脓毒症者升高更为显著(38.37%±4.33% vs 26.34%±2.65%, 13.45%±2.99% vs 6.33%±2.05%, 9.89 ng/mL±1.25 ng/mL vs 7.36 ng/mL±0.95 ng/mL, 均P<0.01); (2)MAP组外周血淋巴细胞Fas表达、淋巴细胞凋亡率及血清sFas水平较正常对照组轻度升高, 差异无显著性; (3)SAP脓毒症患者外周血淋巴细胞Fas表达与淋巴细胞凋亡呈正相关(r = 0.988, P<0.01).
结论: Fas信号通道介导的淋巴细胞凋亡与胰腺炎病情的严重程度密切相关, 可能由于淋巴细胞过度凋亡引起免疫抑制, 导致了SAP脓毒症的发生和发展.
引文著录: 覃月秋, 廖品琥, 周喜汉, 喻文强, 黄俊玲, 邓修民. 重症急性胰腺炎Fas表达、淋巴细胞凋亡及与并发脓毒症的关系. 世界华人消化杂志 2012; 20(32): 3107-3113
Revised: October 16, 2012
Accepted: November 2, 2012
Published online: November 18, 2012
AIM: To investigate Fas expression and apoptosis of lymphocytes in severe acute pancreatitis (SAP) patients with and without sepsis.
METHODS: Fas expression and apoptosis of lymphocytes were examined by flow cytometry. Serum soluble Fas (sFas) levels were measured by enzyme-linked immunosorbent assay (ELISA) in 18 SAP patients (10 cases with sepsis, 8 cases without sepsis), 20 patients with mild acute pancreatitis (MAP), and 20 healthy volunteers (control).
RESULTS: Compared to the MAP and control groups, Fas expression, apoptosis of lymphocytes, and serum sFas levels increased significantly in the SAP group (all P < 0.01), and these changes were more significant in SAP patients with sepsis than in those without sepsis (38.37% ± 4.33% vs 26.34% ± 2.65%, 13.45% ± 2.99% vs 6.33% ± 2.05%, 9.89 ng/mL ± 1.25 ng/mL vs 7.36 ng/mL ± 0.95 ng/mL, all P < 0.01). There was no significant difference in Fas expression, apoptosis of lymphocytes, and serum sFas levels between the normal control group and MAP group. A significant positive relationship was observed between Fas expression and apoptosis of lymphocytes in SAP patients with sepsis (r = 0.988, P < 0.01).
CONCLUSION: The Fas signaling pathway may be involved in apoptosis of lymphocytes and is closely related to the severity of pancreatitis. Excessive apoptosis of lymphocytes appears to be related to immunosuppression and thereby results in the occurrence and development of sepsis in SAP patients.
- Citation: Qin YQ, Liao PH, Zhou XH, Yu WQ, Huang JL, Deng XM. Correlation of Fas expression and apoptosis of lymphocytes with occurrence of sepsis in patients with severe acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2012; 20(32): 3107-3113
- URL: https://www.wjgnet.com/1009-3079/full/v20/i32/3107.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i32.3107
重症急性胰腺炎(severe acute pancreatitis, SAP)是临床常见的危急重症, 约占急性胰腺炎发病率的20%. 该病病情凶险、并发症多, 死亡率达10%-25%[1]. 免疫细胞的新生与凋亡是维持机体免疫稳态的重要机制, 免疫细胞过度凋亡将造成免疫稳态失衡, 引起免疫细胞数量减少、增殖能力下降、抗原递呈无效及免疫反应性低下等, 导致机体免疫抑制[2]. 研究发现SAP患者由于免疫细胞过度凋亡导致机体免疫抑制, 进而并发脓毒症、脓毒性休克和多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS), 是导致其晚期死亡的主要原因[3], 但确切的机制尚未明确. Fas(Apo-1, CD95)属于肿瘤坏死因子(tumor necrosis factor, TNF)受体家族, Fas及其配体FasL介导的信号转导通道是淋巴细胞凋亡的重要途径. 目前已发现Fas信号转导通道异常与系统性红斑狼疮、自身免疫性淋巴细胞增生综合征、自身免疫性甲状腺炎、多发性硬化症、肿瘤免疫逃逸及人体免疫缺陷病毒感染等人类疾病密切相关[4,5]. 此外, 近年研究发现Fas信号转导通道介导的胰腺腺泡细胞凋亡、肠上皮细胞凋亡、肝枯否细胞凋亡与急性胰腺炎病情进展有关[6-8], 而SAP患者Fas信号转导通道介导的淋巴细胞凋亡与继发感染、并发脓毒症的关系文献报道较少. 我们通过检测SAP患者外周血淋巴细胞Fas表达、淋巴细胞凋亡及血清sFas水平, 探讨Fas信号转导通道介导的淋巴细胞凋亡与SAP免疫抑制及并发脓毒症的关系.
收集2009-02/2012-02右江民族医学院附属医院及百色市人民医院消化内科、肝胆外科收治的胰腺炎患者38例: SAP患者18例, 男12例, 女6例, 年龄26-72岁, 平均年龄45.23岁±9.98岁, 其中合并脓毒症10例; MAP患者20例, 男15例, 女5例, 年龄21-66岁, 平均年龄36.85岁±7.56岁. 以20例同期健康体检者为正常对照组. 据中华医学会消化病学分会2003年制订的《中国急性胰腺炎诊治指南(草案)》[9], MAP诊断具备AP的临床表现和生化改变, 而无器官功能障碍或局部并发症, 对液体补充治疗反应良好, APACHE-Ⅱ评分<8, 或CT分级为A、 B、C级. SAP诊断具备AP的临床表现和生化改变, 且具下列之一者: 局部并发症(胰腺坏死, 假性囊肿, 胰腺脓肿); 器官衰竭; APACHEⅡ评分≥8; CT分级为D、E级. 按国际《拯救脓毒症运动: 2008严重脓毒症和脓毒症休克管理指南》[10]中脓毒症定义, SAP脓毒症诊断应同时满足以下条件: (1)具备SAP诊断条件; (2)符合全身炎症反应综合征(systemic inflammato response syndrome, SIRS)表现; (3)有胰腺坏死组织早期感染或腹腔感染依据[11,12]. 入选病例均排除自身免疫性疾病、肿瘤、心脑血管疾病及严重肝肾疾病, 也未使用任何影响免疫功能的药物. 患者外周血标本均于入院48 h内抽取. 人淋巴细胞分离液为加拿大CEDARLANE公司产品; 抗Fas(CD95)抗体及荧光二抗IgG(H+L)PE(藻红蛋白)分别购自英国Abcam公司及杭州MultiSciences公司; FITC Annexin V Apoptosis Detection Kit I购自美国BD公司; 人sFas ELISA试剂盒为美国Genzyme公司产品; 所用仪器为美国BD公司FACS CantoⅡ流式细胞仪、德国VIDAS酶标仪.
1.2.1 淋巴细胞Fas表达测定: 取EDTA(乙二胺四乙酸)抗凝静脉血100 μL, 加抗Fas(CD95)抗体, 孵育30 min; 加20 μL荧光二抗IgG(H+L) PE(藻红蛋白), 避光孵育30 min. 加1×溶血素1 mL裂解红细胞, 离心(1 500 r/min, 5 min), 弃上清. PBS洗涤, 离心(1 500 r/min, 5 min), 弃上清. 加500 μL PBS重悬细胞, 1 h内上机, 设P1门圈定淋巴细胞亚群, 流式细胞术分析门内淋巴细胞Fas表达, 利用BD FACSDiva Software进行参数获取和数据分析.
1.2.2 外周血淋巴细胞分离: 抽取EDTA抗凝静脉血2 mL, 采用密度梯度离心(2 000 r/min, 20 min)法于淋巴细胞分离液和血浆层间分离、收集单个核细胞, PBS洗涤、重悬细胞, 置于平皿中37 ℃孵化60 min, 使单核细胞贴壁, 再收集平皿中的细胞悬液, 即为淋巴细胞悬液. PBS洗涤, 离心(1 500 r/min, 5 min), 弃上清, 以PBS或1×buffer重悬细胞, 配成样本细胞数为1×106-5×106/mL备用.
1.2.3 淋巴细胞凋亡检测: 采用Annexin V-FITC/PI荧光双染流式细胞术检测, 取上述淋巴细胞悬液100 μL, 加入Annexin-V FITC、PI各5 μL, 避光孵育15 min, 加入1×buffer 400 μL, 1 h内上流式细胞仪分析淋巴细胞凋亡. 用BD FACSDiva Software进行参数获取和数据分析.
1.2.4 血清sFas水平测定: 抽取静脉血2 mL, 3 000 r/min离心20 min, 分离出血清, -80 ℃冰箱保存备用. 采用双抗体夹心酶联免疫吸附试验(ELISA)测定血清sFas水平, 操作步骤严格按产品说明书要求.
统计学处理 数据以mean±SD表示, 采用SPSS11.5软件对数据进行t检验、Spearman等级相关分析. 以P<0.05为差异有统计学意义.
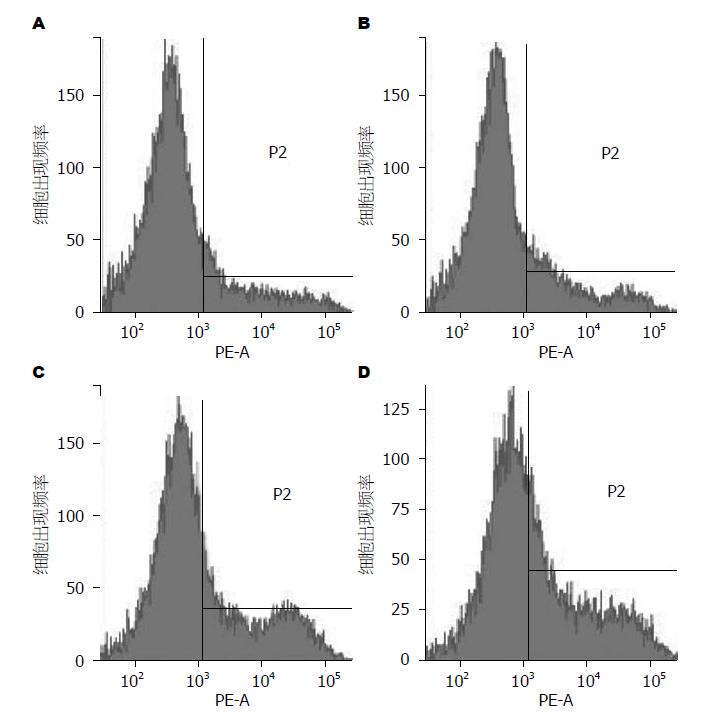
直方图记录淋巴细胞Fas表达, 横坐标为荧光强度, 纵坐标为细胞出现频率, 阴性对照设定正常荧光边界, P2区代表Fas阳性表达. 结果显示正常对照组外周血淋巴细胞有较低Fas表达, MAP组外周血淋巴细胞Fas表达较正常对照组轻度升高, 但差异无显著性(表1, 图1A和B). SAP非脓毒症组及脓毒症组外周血淋巴细胞Fas表达均明显高于MAP组及正常对照组(均P<0.01, 表1, 图1); 与非脓毒症组相比, 合并脓毒症组Fas表达升高更显著(38.37%±4.33% vs 26.34%±2.65%, P<0.01, 表1, 图1C和D).
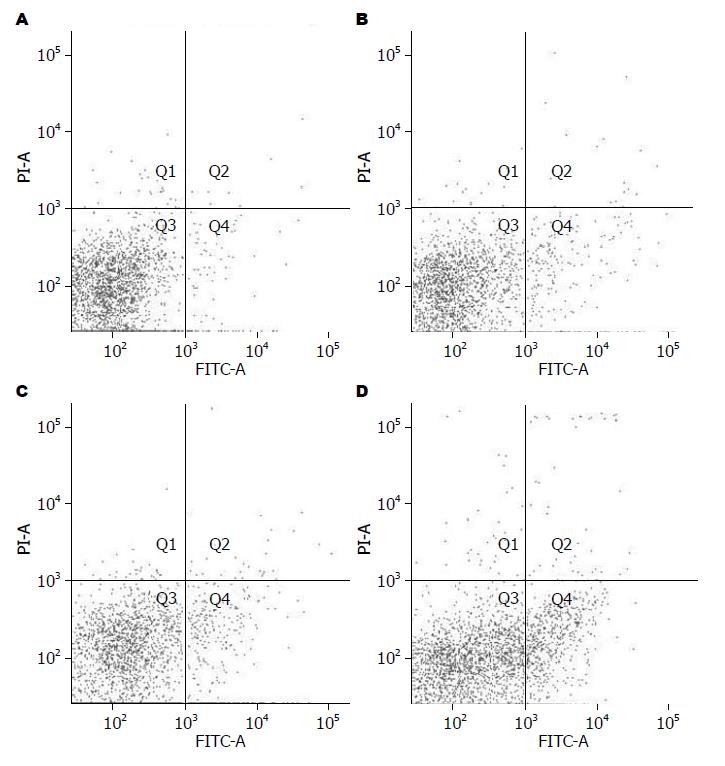
二维散点图记录淋巴细胞凋亡, Annexin-V FITC为横坐标, PI为纵坐标, 以阴性对照设定正常界限, 将淋巴细胞分为: 正常活细胞(左下象限Q3, Annexin-V FITC-、PI-); 早期凋亡细胞(右下象限Q4, Annexin-V FITC+、PI-); 死亡细胞(右上象限Q2, Annexin-V FITC+、PI+). 结果显示正常对照组外周血中有少量淋巴细胞凋亡; MAP组外周血淋巴细胞凋亡较正常对照组轻度升高, 但差异无显著性(表1, 图2A和B); SAP非脓毒症及脓毒症外周血血淋巴细胞凋亡均较MAP及正常对照组明显升高(均P<0.01, 表1, 图2); 与非脓毒症组相比, 合并脓毒症组淋巴细胞凋亡更显著 (13.45%±2.99% vs 6.33%±2.05%, P<0.01, 表1, 图2C和D).
MAP组血清sFas水平较正常对照组轻度升高, 但差异无显著性. SAP非脓毒症、脓毒症组血清sFas水平(7.36 ng/mL±0.95 ng/mL、9.89 ng/mL±1.25 ng/mL)均明显高于MAP组及正常对照组(均P<0.01); 与非脓毒症组相比, 合并脓毒症组血清sFas水平升高更显著(9.89 ng/mL±1.25 ng/mL vs 7.36 ng/mL±0.95 ng/mL, P<0.01, 表1).
SAP脓毒症组患者外周血淋巴细胞Fas的表达与淋巴细胞凋亡呈正相关(r = 0.988, P<0.01), 随着Fas的表达增高, 淋巴细胞凋亡数增加.
SAP是由炎症介质作用、肠道微循环障碍、腹腔内高压、肠动力障碍及肠道免疫功能受损等因素引起并加重的肠屏障功能障碍, 导致肠内菌群易位[13-17], 继发感染, 加重SAP的病情. 研究认为肠黏膜屏障破坏、肠道菌群易位是SAP脓毒症的启动因素[18], 而淋巴细胞、树突状细胞等免疫细胞的过度凋亡导致机体免疫抑制, 则是促使SAP脓毒症发生、发展及病情恶化的重要原因[19-21]: SAP早期机体爆发炎症反应, 淋巴细胞大量激活, 机体通过Fas凋亡通路介导淋巴细胞凋亡, 避免过激免疫反应对机体带来的损伤; 但随着病情进展, 各种细胞因子大量释放, 外周血淋巴细胞过度激活并经过激活-反应-凋亡一系列过程耗竭, 最终引起免疫抑制并继发脓毒症, 导致病情恶化. 淋巴细胞凋亡主要由Fas凋亡信号传导通道介导[22], Fas基因定位于染色体10q33, cDNA全长2 534 bp, 可编码含319个氨基酸, Fas分子分布于胸腺细胞、外周活化的淋巴细胞、中性粒细胞、单核细胞、内皮细胞, 在静止的淋巴细胞中Fas表达较低, 少量Fas以可溶性形式存在于胞浆和血清中. 活化的淋巴细胞能快速表达Fas, Fas与其天然配体FasL结合, 通过DD-DD(death domain)作用募集FADD(Fas-associated death-domain protein)组成死亡诱导信号复合体(death-inducing signaling complex, DISC), 激活Caspase-8及效应Caspases执行细胞凋亡[23-25].
Ayala等[26]体外培养脓毒症小鼠的脾淋巴细胞, 发现淋巴细胞凋亡的显著增加与Fas抗原、Fas mRNA表达增加密切相关; 进一步对FasL缺陷的脓毒的症小鼠进行研究, 证实脾淋巴细胞凋亡为Fas/FasL系统介导而非内毒素作用引起, 上调Fas/FasL介导的淋巴细胞凋亡将可能导致免疫抑制及诱发多重感染. Uehara等[27]的研究显示, SAP机体通过激活Fas信号传导通道促进CD4+淋巴细胞凋亡, 使CD4+淋巴细胞水平降低, 导致免疫功能损害及继发感染. 国内姚玮艳等[28]研究发现SAP大鼠存在细胞免疫功能的低下, 调节CD3/CD4细胞分化可减轻胰腺炎症反应. 党胜春等[29]研究认为Fas介导的Th细胞凋亡参与SAP大鼠肠损伤的病理过程, 从而导致肠黏膜屏障受损及继发感染. 上述研究表明, Fas通路介导的淋巴细胞凋亡与SAP机体免疫抑制及继发感染密切相关. 我们检测了健康体检者、MAP患者、SAP脓毒症患者及非脓毒症患者外周血淋巴细胞Fas表达及淋巴细胞凋亡, 结果发现MAP组外周血淋巴细胞Fas表达水平、淋巴细胞凋亡率较正常对照组比较仅轻度升高, 而SAP(非脓毒症、脓毒症)患者外周血淋巴细胞Fas表达水平、淋巴细胞凋亡率均明显高于MAP组及正常对照组, 提示Fas表达水平及淋巴细胞凋亡情况与胰腺炎病情的严重程度密切相关. 同时, 我们的研究还发现SAP脓毒症组外周血淋巴细胞Fas表达水平、淋巴细胞凋亡率显著高于非脓毒症组; 且SAP脓毒症组Fas的表达与淋巴细胞凋亡呈正相关, 提示Fas信号通路介导的淋巴细胞凋亡异常可能是导致SAP患者免疫抑制及并发脓毒症的重要原因之一.
SAP患者由于淋巴细胞过度凋亡, 超出机体的自我调节能力, 导致淋巴细胞耗竭, 最终引起免疫抑制并继发脓毒症. 血清中的sFas是Fas的可溶形式, 主要由Fas mRNA编码基因变异形成, 细胞表面形式的Fas经溶蛋白性裂解也产生少量sFas. sFas缺乏疏水跨膜区及死亡区, 不能诱导细胞凋亡. 研究表明sFas通过与Fas竞争结合FasL而阻断细胞凋亡, 对细胞凋亡具有抑制性调节作用[30,31]. 我们的研究发现MAP组血清sFas水平较正常对照组比较仅轻度升高, 而SAP非脓毒症及脓毒症组血清sFas水平均明显高于MAP及正常对照组, 合并脓毒症组升高更显著, 可见血清sFas水平与淋巴细胞Fas表达水平一致, 提示血清sFas水平升高可能是机体避免淋巴细胞过度凋亡的自我调节反应.
总之, Fas表达水平及淋巴细胞凋亡情况与胰腺炎病情的严重程度密切相关, Fas信号通路介导的淋巴细胞凋亡异常可能是导致SAP患者免疫抑制及并发脓毒症的重要原因之一, 明确SAP脓毒症Fas信号通路调节淋巴细胞凋亡的机制, 将为临床进行有效的免疫干预治疗及预后的改善提供理论基础.
重症急性胰腺炎(SAP)的高死亡率主要由失控的炎症反应导致. 近年研究发现SAP患者免疫细胞过度凋亡, 导致机体免疫抑制、继发感染, 进而并发脓毒症、脓毒性休克和多器官功能障碍综合征(MODS), 是导致SAP患者晚期死亡的主要原因, 但确切机制尚未明确.
江建新, 副主任医师, 贵阳医学院附属医院肝胆外科
体外研究表明, 淋巴细胞凋亡主要由Fas信号转导通道介导, 信号传导及网络调控机制错综复杂, 临床上SAP患者淋巴细胞表达Fas的情况, Fas表达、淋巴细胞凋亡和并发脓毒症之间的关系不明, 是目前研究的热点之一.
研究发现, Fas表达异常与自身免疫性疾病、肿瘤免疫逃逸及病毒感染密切相关; Fas介导的胰腺腺泡细胞凋亡、肠上皮细胞凋亡、肝枯否细胞凋亡与急性胰腺炎病情进展有关; 而Fas介导的淋巴细胞凋亡异常, 则可能是SAP免疫抑制及脓毒症发生和发展的重要原因.
SAP患者Fas介导的淋巴细胞凋亡与继发感染、并发脓毒症关系的文献报道较少, 本文通过检测外周血淋巴细胞Fas表达、淋巴细胞凋亡及sFas水平, 探讨Fas信号通路介导的淋巴细胞凋亡与SAP免疫抑制及并发脓毒症的关系.
本研究为进一步明确淋巴细胞凋亡的调控机制, 探讨SAP免疫抑制的确切机制及临床对SAP脓毒症进行有效的免疫干预治疗提供了科学的实验依据.
本文探讨Fas表达水平及淋巴细胞凋亡情况与胰腺炎病情的严重程度及并发脓毒症的关系, 选题较为新颖, 实验设计合理, 具有一定的临床意义.
编辑:翟欢欢 电编:闫晋利
| 1. | Tonsi AF, Bacchion M, Crippa S, Malleo G, Bassi C. Acute pancreatitis at the beginning of the 21st century: the state of the art. World J Gastroenterol. 2009;15:2945-2959. [PubMed] [DOI] |
| 2. | Pietruczuk M, Dabrowska MI, Wereszczynska-Siemiatkowska U, Dabrowski A. Alteration of peripheral blood lymphocyte subsets in acute pancreatitis. World J Gastroenterol. 2006;12:5344-5351. [PubMed] |
| 3. | Monneret G, Venet F, Pachot A, Lepape A. Monitoring immune dysfunctions in the septic patient: a new skin for the old ceremony. Mol Med. 2008;14:64-78. [PubMed] [DOI] |
| 4. | Ehrenschwender M, Wajant H. The role of FasL and Fas in health and disease. Adv Exp Med Biol. 2009;647:64-93. [PubMed] [DOI] |
| 6. | Li ZD, Ma QY, Luo YH. [Effect of resveratrol-induced FasL up-regulation on the apoptosis of pancreatic acinar cells in rats with severe acute pancreatitis]. Nanfang Yike Daxue Xuebao. 2009;29:454-457. [PubMed] |
| 7. | Dang SC, Zhang JX, Qu JG, Mao ZF, Wang XQ, Zhu B. Dynamic changes of IL-2/IL-10, sFas and expression of Fas in intestinal mucosa in rats with acute necrotizing pancreatitis. World J Gastroenterol. 2008;14:2246-2250. [PubMed] [DOI] |
| 8. | Peng Y, Sigua CA, Gallagher SF, Murr MM. Protein kinase C-zeta is critical in pancreatitis-induced apoptosis of Kupffer cells. J Gastrointest Surg. 2007;11:1253-1261. [PubMed] [DOI] |
| 10. | Dellinger RP, Levy MM, Carlet JM, Bion J, Parker MM, Jaeschke R, Reinhart K, Angus DC, Brun-Buisson C, Beale R. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock: 2008. Crit Care Med. 2008;36:296-327. [PubMed] [DOI] |
| 11. | Mishra G, Pineau BC. Infectious complications of pancreatitis: diagnosis and management. Curr Gastroenterol Rep. 2004;6:280-286. [PubMed] [DOI] |
| 12. | Bourgaux JF, Defez C, Muller L, Vivancos J, Prudhomme M, Navarro F, Pouderoux P, Sotto A. Infectious complications, prognostic factors and assessment of anti-infectious management of 212 consecutive patients with acute pancreatitis. Gastroenterol Clin Biol. 2007;31:431-435. [PubMed] [DOI] |
| 14. | Li Q, Zhang Q, Wang M, Zhao S, Ma J, Luo N, Li N, Li Y, Xu G, Li J. Interferon-gamma and tumor necrosis factor-alpha disrupt epithelial barrier function by altering lipid composition in membrane microdomains of tight junction. Clin Immunol. 2008;126:67-80. [PubMed] [DOI] |
| 15. | Shimizu K, Ogura H, Goto M, Asahara T, Nomoto K, Morotomi M, Yoshiya K, Matsushima A, Sumi Y, Kuwagata Y. Altered gut flora and environment in patients with severe SIRS. J Trauma. 2006;60:126-133. [PubMed] [DOI] |
| 16. | Qiao SF, Lu TJ, Sun JB, Li F. Alterations of intestinal immune function and regulatory effects of L-arginine in experimental severe acute pancreatitis rats. World J Gastroenterol. 2005;11:6216-6218. [PubMed] |
| 17. | Liu C, Li A, Weng YB, Duan ML, Wang BE, Zhang SW. Changes in intestinal mucosal immune barrier in rats with endotoxemia. World J Gastroenterol. 2009;15:5843-5850. [PubMed] [DOI] |
| 18. | Fritz S, Hackert T, Hartwig W, Rossmanith F, Strobel O, Schneider L, Will-Schweiger K, Kommerell M, Büchler MW, Werner J. Bacterial translocation and infected pancreatic necrosis in acute necrotizing pancreatitis derives from small bowel rather than from colon. Am J Surg. 2010;200:111-117. [PubMed] [DOI] |
| 19. | Ueda T, Takeyama Y, Yasuda T, Shinzeki M, Sawa H, Nakajima T, Ajiki T, Fujino Y, Suzuki Y, Kuroda Y. Immunosuppression in patients with severe acute pancreatitis. J Gastroenterol. 2006;41:779-784. [PubMed] [DOI] |
| 20. | Bosque A, Pardo J, Martínez-Lorenzo MJ, Iturralde M, Marzo I, Piñeiro A, Alava MA, Naval J, Anel A. Down-regulation of normal human T cell blast activation: roles of APO2L/TRAIL, FasL, and c- FLIP, Bim, or Bcl-x isoform expression. J Leukoc Biol. 2005;77:568-578. [PubMed] [DOI] |
| 21. | Ward NS, Casserly B, Ayala A. The compensatory anti-inflammatory response syndrome (CARS) in critically ill patients. Clin Chest Med. 2008;29:617-625, viii. [PubMed] [DOI] |
| 22. | Maher S, Toomey D, Condron C, Bouchier-Hayes D. Activation-induced cell death: the controversial role of Fas and Fas ligand in immune privilege and tumour counterattack. Immunol Cell Biol. 2002;80:131-137. [PubMed] [DOI] |
| 23. | Stewart JH, Nguyen DM, Chen GA, Schrump DS. Induction of apoptosis in malignant pleural mesothelioma cells by activation of the Fas (Apo-1/CD95) death-signal pathway. J Thorac Cardiovasc Surg. 2002;123:295-302. [PubMed] [DOI] |
| 24. | Contassot E, Gaide O, French LE. Death receptors and apoptosis. Dermatol Clin. 2007;25:487-501, vii. [PubMed] [DOI] |
| 25. | Chang HW, Jeng CR, Lin CM, Liu JJ, Chang CC, Tsai YC, Chia MY, Pang VF. The involvement of Fas/FasL interaction in porcine circovirus type 2 and porcine reproductive and respiratory syndrome virus co-inoculation-associated lymphocyte apoptosis in vitro. Vet Microbiol. 2007;122:72-82. [PubMed] [DOI] |
| 26. | Ayala A, Chung CS, Xu YX, Evans TA, Redmond KM, Chaudry IH. Increased inducible apoptosis in CD4+ T lymphocytes during polymicrobial sepsis is mediated by Fas ligand and not endotoxin. Immunology. 1999;97:45-55. [PubMed] [DOI] |
| 27. | Uehara S, Gothoh K, Handa H, Tomita H, Tomita Y. Immune function in patients with acute pancreatitis. J Gastroenterol Hepatol. 2003;18:363-370. [PubMed] [DOI] |
| 28. | 姚 玮艳, 诸 琦, 袁 耀宗, 乔 敏敏, 章 永平, 翟 祖康, 姚 季生, 程 琳琳, 沈 天伟. 大鼠重症急性胰腺炎时免疫机制及TAI的影响. 世界华人消化杂志. 2004;12:2214-2216. [DOI] |
| 29. | 党 胜春, 张 建新, 毛 正发, 瞿 建国, 王 旭青, 朱 蓓. 血清IL-2、IL-10及肠黏膜Fas在重症急性胰腺炎大鼠中的动态变化. 世界华人消化杂志. 2007;15:3697-3702. [DOI] |
| 30. | Cheng J, Zhou T, Liu C, Shapiro JP, Brauer MJ, Kiefer MC, Barr PJ, Mountz JD. Protection from Fas-mediated apoptosis by a soluble form of the Fas molecule. Science. 1994;263:1759-1762. [PubMed] [DOI] |
| 31. | Myśliwiec J, Okota M, Nikołajuk A, Górska M. Soluble Fas, Fas ligand and Bcl-2 in autoimmune thyroid diseases: relation to humoral immune response markers. Adv Med Sci. 2006;51:119-122. [PubMed] |