修回日期: 2012-04-30
接受日期: 2012-06-01
在线出版日期: 2012-07-08
目的: 构建重组人α1-抗胰蛋白酶(hAAT)因子的慢病毒表达载体, 并通过体外细胞水平和小鼠体内分析其表达情况.
方法: 通过RT-PCR的方法扩增出hAAT基因的编码序列, 并构建重组慢病毒质粒; 经体外包装后, 感染鼠成纤维细胞及注射小鼠. 荧光显微镜下观察GFP的表达情况, 同时对收获的细胞及感染小鼠的肝脏或血浆进行Western blot、ELISA检测.
结果: 获得重组hAAT因子的慢病毒表达质粒pLVX-ser; 包装后得到8×106 TU/mL滴度的慢病毒颗粒. 通过荧光显微镜下观察, 显示重组hAAT因子在成纤维细胞中正常表达; 对小鼠尾静脉注射病毒之后, 进行hAAT因子检测, Western blot结果说明hAAT因子在小鼠体内成功表达; 通过ELISA检测发现hAAT在小鼠体内的表达平均达190 μg/L左右, 而且在慢病毒的介导下hAAT在小鼠中的表达可持续3 mo以上.
结论: 重组慢病毒载体可高效、持续表达hAAT因子, 为通过基因工程生产重组hAAT因子以及为α1-AT缺乏症的基因治疗奠定基础.
引文著录: 欧海龙, 雷霆雯, 李红梅, 王筑婷, 莫晓川. 慢病毒介导的重组人α1-抗胰蛋白酶在小鼠体内的表达. 世界华人消化杂志 2012; 20(19): 1720-1725
Revised: April 30, 2012
Accepted: June 1, 2012
Published online: July 8, 2012
AIM: To construct a recombinant lentiviral vector carrying the human α1-antitrypsin (hAAT) gene,then express the hAAT in fibroblasts and mice.
METHODS: The coding sequence of the hAAT gene was amplified by RT-PCR and ligated into a lentiviral vector to construct a recombinant lentiviral vector (pLVX-ser). Lentiviral particles were packaged in vitro and used to infect fibroblasts and mice. GFP expression was detected by fluorescence microscopy. The supernatants of infected cells and liver samples from infected mice were used to detect the expression of hAAT by Western blot and ELISA.
RESULTS: The recombinant hAAT lentiviral vector pLVX-ser was successfully constructed. The titer of lentiviral particles reached 8×106 TU/mL after viral packaging. Fluorescence microscopic analysis showed that hAAT was successfully expressed in fibroblasts. Western blot analysis suggested that hAAT was expressed well in mice, and ELISA assay showed that the mean expression level amounted to 190 μg/L. The expression of hAAT in mice could even last for several months.
CONCLUSION: The recombinant lentiviral vector carrying the hAAT gene allows efficient and persistent expression of hAAT in mice, which paves the way to producing hAAT in industry and gene therapy for AATD disease.
- Citation: Ou HL, Lei TW, Li HM, Wang ZT, Mo XC. Lentivirus-mediated expression of human α1-antitrypsin in mice. Shijie Huaren Xiaohua Zazhi 2012; 20(19): 1720-1725
- URL: https://www.wjgnet.com/1009-3079/full/v20/i19/1720.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i19.1720
α1-抗胰蛋白酶(α1-antitrypsin, AAT)因子是体内一种重要的丝氨酸蛋白酶抑制剂, 主要由肝细胞合成并分泌到血液中, 同时巨噬细胞以及支气管上皮细胞中也合成少量的AAT. AAT可抑制多种蛋白酶活性包括弹性蛋白酶、胰蛋白酶、糜蛋白酶、纤维蛋白溶酶以及凝血酶等各种丝氨酸蛋白酶类, 维持组织、器官的正常功能. 人AAT(hAAT)因子由SerpinA1基因编码, 位于染色体的14q31-32.3位置上, 全长12.2 kb, 包含7个外显子和6个内含子. SerpinA1基因具有极大的异质性, 根据等电聚焦电泳进行分型,血浆中AAT水平由等位基因的不同类型决定,其中PiMM占95%以上, 存在于正常人群中, AAT浓度大约为20-53 μmol/L[1]. α1-抗胰蛋白酶缺乏症(α1-antitrypsin deficiency, AATD)是由于SerpinA1基因的某些碱基突变导致α1-抗胰蛋白酶因子缺失或功能异常引起的一种遗传性疾病. PiSS(Glu264→Val264)、PiZZ(Glu342→Lys342)以及杂合型PiSZ等亚型均可致病. 其中PiZZ最为常见, 占AATD病例的95%以上, 其血清中AAT含量是正常人的10%-15%[2-4]. AATD的临床表现多样, 新生儿表现为胆汁淤积、肝脾肿大. 青少年时最典型的临床表现为肺气肿, 这主要是由于AAT缺乏时, 体内蛋白酶与抗蛋白酶的平衡关系被打破, 中性粒细胞释放的弹力蛋白酶、组织蛋白酶不断累积并降解肺部组织的弹性蛋白, 损伤了肺泡结缔组织中的弹力纤维, 破坏肺泡间隔, 使气腔持续扩大, 从而导致肺气肿[5]. 另外由于合成的Z突变型AAT不能分泌到血浆, 聚集成多聚体, 累积在肝细胞内, 形成包涵体, 从而使某些AATD患者表现出不同程度的肝硬化[6,7].
目前对于AATD的治疗, 除了进行支持性疗法如对新生儿口服苯巴比妥、补充各种维生素以及远离烟尘空气, 避免肺部感染等外, 主要还是通过不断注射hAAT的方法, 维持体内蛋白酶与抗蛋白酶的平衡. 另外, 对于特别是如AATD、地中海贫血以及家族性高胆固醇血症等单基因遗传病, 基因治疗是有望根治这类疾病的有效方法. 本文以慢病毒载体为工具, 通过构建重组hAAT因子表达载体, 分析其表达情况. 该研究结果可为利用基因工程技术生产hAAT制剂提供新的思路, 同时为AATD基因治疗的研究提供可靠的实验依据.
大肠杆菌TPO10感受态细菌、293T细胞(本室保存); pLVX-AcGFP1-N1载体以及Lenti-X HTX Packaging Mix(Clontech)由本实验室保存; 聚凝胺(Polybrene, Sigma-Aldrich); 人α1抗胰蛋白酶酶联免疫分析试剂盒(上海希美生物公司); 琼脂糖凝胶DNA回收试剂盒(北京天根生物公司); 各种限制性内切酶、T4连接酶、Taq酶(Takara公司); 胎牛血清、RPMI 1640培养基及DMEM培养基(Hyclone公司); TRIzol试剂(北京天根生物公司); 逆转录酶(Promega公司); DNA Marker(北京全式金生物公司); 其他各种试剂为国产分析纯; PCR引物由南京金斯瑞生物有限公司合成.
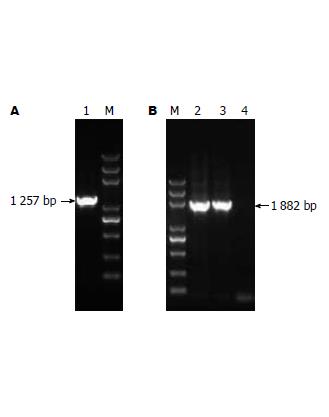
1.2.1 SerpinA1基因的扩增及慢病毒载体构建: 体外培养293T细胞, 当生长至对数末期后, 用0.25%胰酶消化并收获细胞. 稍离心后用TRIzol消化、异丙醇沉淀的方法获得总RNA. 并用紫外分光光度计测得吸光度(A)值. 取1 μg RNA作为模板依据相关说明进行第一链cDNA的合成. 根据NCBI公布的数据(NM_000295)设计SerpinA1基因编码序列的扩增引物, 上游引物ser1、下游引物ser2(表1), 引物5'分别连上限制性内切酶EcoRⅠ的识别序列. 取1 μL逆转录产物进行PCR反应, 扩增条件: 94 ℃ 5 min; 94 ℃ 45 s, 60 ℃ 45 s, 72 ℃ 45 s, 32 个循环; 72 ℃ 10 min. PCR产物进行凝胶回收纯化, 分别用EcoRⅠ酶对PCR回收片段和纯化好的慢病毒基因转移质粒pLVX-AcGFP1-N1过夜酶切, 经纯化回收后用T4连接酶连接. 将扩增片段连接进CMV启动子下游的EcoRⅠ酶切位点, 连接产物转化大肠杆菌, 挑取单克隆. 同时用pLVX-AcGFP1-N1载体上的EcoRⅠ识别位点的上游设计引物F1与ser2引物进行菌落PCR对插入的方向性进行鉴定, 可扩增出比1 257 bp稍大的1 882 bp片段为正确质粒, 将初步鉴定为正确的克隆进行测序, 将其命名为pLVX-ser.
| 引物名称 | 序列 5'- 3' |
| ser1 | ccg GAATTC ATG CCG TCT TCT GTC TCG TG |
| ser2 | ccg GAATTC TTA TTT TTG GGT GGG ATT CA |
| F1 | ATT GAC GTC AAT GGG TGG AG |
| GFP1 | TGA CCT ACG GCG TGC AGT GCT T |
| GFP2 | TCG TCC ATG CCG AGA GTG ATC C |
1.2.2 慢病毒的制备: 取纯化好的pLVX-ser质粒15 μg以及30 μL Lenti-X HTX Packaging Mix, 对培养至对数生长期的293T细胞采用磷酸钙沉淀的方法进行共转染, 转染6 h后换成含100 mL/L FBS的DMEM完全培养液, 并在37 ℃、50 mL/L CO2条件下继续培养, 完成假病毒颗粒的包装. 12、24 h后荧光显微镜下观察荧光表达情况, 2-3 d后收集上清液, 15 000 r/min超速离心0.5 h, 弃上清, 收集病毒, 保存于-70 ℃备用.
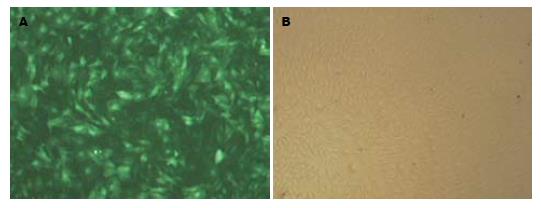
1.2.3 滴度测定及细胞感染: 转染前1 d, 在6孔板中分别对每孔接种2×105的293T细胞, 将所收集的病毒液按1、10-1、10-2、10-3、10-4及10-5比例进行梯度稀释, 将0.5 mL稀释后的病毒液分别加入到相应的每个孔中, 37 ℃培养12 h 后, 更换含100 mL/L血清的DMEM. 48-72 h后在荧光显微镜下观察各孔中GFP的表达, 统计阳性细胞个数, 将之乘以相应的稀释倍数再除于0.5 mL病毒原液即得到病毒滴度值(TU/mL). 根据所测得的病毒滴度, 在小鼠成纤维细胞中加入含有5 μL病毒液、8 mg/L聚凝胺的不含血清的培养液DMEM, 2 h后换成完全培养液, 于37 ℃、50 mL/L CO2条件下继续孵育、培养. 当长至80%-90%汇合度时, 进行传代、扩增培养, 并通过荧光显微镜下观察hAAT的表达.
1.2.4 动物实验: C57BL/6J纯系小鼠在贵阳医学院实验动物中心饲养、繁殖, 环境条件为室温20 ℃-25 ℃, 相对湿度40%-70%. 对8周龄左右、体质量为25-30 g的C57BL/6J纯系♂小鼠(n = 4)用200 μL含重组慢病毒的PBS瞬间经尾静脉注射, 以空质粒pLVX-AcGFP1-N1为对照组.
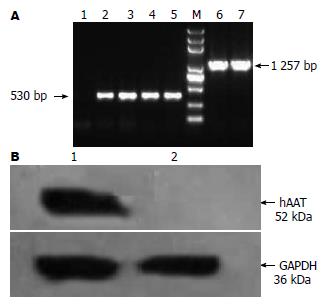
1.2.5 RT-PCR: 对注射后5 d的小鼠断颈处死, 获取肝组织, TRIzol裂解法抽提总RNA. 经逆转录之后, 分别用引物ser1、ser2和GFP1、GFP2(表1)对SerpinA1和GFP基因的cDNA进行PCR扩增.
1.2.6 Western blot检测: 对注射后5 d的小鼠肝组织提取总蛋白, 经浓缩后, 用BCA法定量, 取
20 μg进行SDS-PAGE电泳, 转至硝酸纤维素(NC)膜, NC膜经漂洗、封闭后用生物素标记的羊抗α-1抗胰蛋白酶抗体(一抗, 1:1 000)以及辣根过氧化物酶标记抗羊IgG抗体(二抗, 1:1 000)进行免疫检测, 最后冲洗、显影.
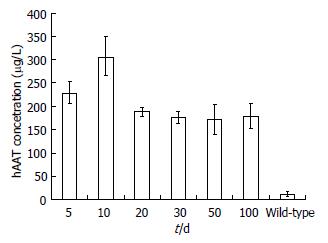
1.2.7 ELISA分析: 分别对pLVX-AcGFP1-N1空质粒感染的对照组以及实验组, 在注射后的5、10、20、30、50和100 d通过尾静脉采集血样, 进行α-1抗胰蛋白酶表达水平的检测, 根据ELISA试剂盒说明书进行相关操作, 最后用酶联仪在450 nm波长依序测量各孔的A值, 每样品重复3次.
统计学处理 基因表达定量分析每组实验均重复3次, 所有数据采用mean±SD表示, 用SPSS10.0软件处理, 两个样本均数间的比较采用t检验, 以P<0.05为差异显著.
从细胞中提取总RNA, 对SerpinA1基因进行扩增, 获得1 257 bp的目的条带(图1A). pLVX-AcGFP1-N1与扩增片段分别经EcoRⅠ酶切后连接, 获得重组人SerpinA1基因菌落. 接着用载体上的EcoRⅠ识别位点上游设计的引物F1与ser2配对, 对插入的方向性进行PCR鉴定, 结果从菌落中扩增出比1 257 bp稍大的1 882 bp片段(图1B), 说明在这些质粒中外源片段正确插入. 对初步鉴定为正确的质粒进行测序, 测序结果与NCBI上公布的一致. 这样我们获得CMV启动子表达人α1-抗胰蛋白酶的慢病毒载体pLVX-ser.
收获包装后的病毒, 根据293T细胞GFP的集落数, 我们获得约8×106 TU/mL病毒滴度值. 感染小鼠成纤维细胞48 h后, 荧光显微镜下观察慢病毒载体的GFP表达. 结果显示大部分细胞已被感染, 并成功表达外源基因(图2).
对注射后5 d的小鼠进行解剖获取肝脏组织mRNA, 并进行RT-PCR分析, 结果我们分别从GFP、SerpinA1 mRNA中分别扩出相应的530 bp、1 257 bp的目的条带(图3A). 这说明在慢病毒的介导下外源基因在小鼠内成功转录.
首先,对外源hAAT因子进行Western blot检测,在pLVX-ser病毒颗粒注射的小鼠中 得到大小相应的阳性条带, 而在对照的pLVX-AcGFP1-N1病毒颗粒感染的小鼠中检测不到(图3B). 说明,hAAT在小鼠体内正常表达. 接着, 进一步利用ELISA定量分析SerpinA1基因的表达水平, 并在含有pLVX-ser质粒的实验组中, 测得231 μg/L±0.25 μg/L hAAT的表达量. 另外, 对注射后10、20、30、50和100 d的小鼠分别采集血样, 分别检测hAAT的表达,分析hAAT在小鼠体内的持续性表达能力. 结果显示在注射后的第5-10天内, 表达量持续增高(图4), 到第10天时hAAT表达水平达到最高(308 μg/L). 而在10-100 d之间, hAAT在小鼠体内的表达水平波动不大, 维持在190 μg/L左右.
对于AATD, 现在还没有特别有效的治疗途径时, 对患者输入外源的hAAT, 是最直接的方法, 可以短时间内提高血液中蛋白酶抑制剂水平, 恢复或在一定程度上缓解弹性蛋白酶对肺部组织的损伤, 这需要充实的hAAT储备. 另外, hAAT是一种多功能蛋白, 除了与AATD有关外, hAAT还参与血液凝固过程[8,9], 其与抗凝血酶联合使用, 可对弥漫性血管内凝血进行治疗[10]. 而且hAAT也在细菌、病毒感染的免疫调节过程中起作用[11-15]. 研究发现在外周血单个核细胞和滤泡树突状细胞中, hAAT可通过下调NF-κB的活性, 抑制HIV病毒的复制[16]. hAAT的广阔用途使只依靠从血液中分离纯化的途径, 无法满足现实需要, 并且代价昂贵, 还存在感染的风险.
随着生物工程技术的不断发展, 人们开始通过基因重组进行体外生产hAAT以节约血浆、降低成本. 另外, 由于hAAT的编码序列不长, 又是一种分泌型蛋白, 使他在遗传操作上更加方便, 下游的蛋白纯化更加简单. Garver等[17]首先获得了能稳定、持续表达hAAT的鼠成纤维细胞克隆. 之后人们又分别在不同的细胞类型如CHO、COS-7、造血干细胞和单核吞噬细胞等[18-20]; 不同的物种如真菌、绵羊、狗甚至烟草中进行表达hAAT的研究[21-24]. 但到目前为止还没有一个重组hAAT制剂上市, 还需进一步深入的探索.
另外hAAT的半衰期很短, 仅为4-6 d, 这既给AATD患者的治疗带来麻烦, 同时也是影响重组hAAT成功开发的一个重要原因. 对于一些治疗性蛋白, 经常通过进行转录后的相关修饰, 从而改善该蛋白的某些属性或提高其治疗性能等[25]. 由于经聚乙二醇修饰的蛋白的溶解度和稳定性得到提高, 并增强耐酶水解的能力. 早期人们试图通过在hAAT的Cys232位置或者某些特定的糖基化位点进行聚乙二醇长链修饰, 解决hAAT半衰期短的问题[26-28]. 最近, Lindhout等[29]尝试利用一种可生物降解的, 免疫原性更低的唾液酸, 对hAAT的N聚糖进行修饰, 以延长hAAT的半衰期. 在今后的研究中, 除了追求成功高效表达外, 还希望能通过对hAAT的某些修饰进一步改善其相关的理化性质, 实现更好的疗效.
最有希望根治AATD应当是基因治疗, 通过原位纠正突变基因, 恢复其功能或体内异位表达外源的hAAT, 补充蛋白酶抑制剂的水平, 保护组织结构的完整性. 在基因治疗中病毒载体经常被作为输送外源基因的运载工具. 从HIV-1病毒改造过来的慢病毒载体, 与逆转录病毒载体、腺病毒载体等其他病毒类基因转移载体相比, 慢病毒载体具有对分裂细胞和非分裂细胞均具有感染能力的优点, 而且具有更广的宿主范围, 可以有效感染神经元细胞、肝细胞、心肌细胞、肿瘤细胞、内皮细胞、干细胞等多种类型的细胞, 引发机体免疫反应小等特点. 另外, 还可实现外源基因有效地在宿主染色体上整合, 从而实现持久表达. 特别是随着慢病毒载体技术的不断发展如通过多质粒的包装系统等, 其安全性大大增加. 所以慢病毒载体开发时间尽管不是很长, 已成功地被运用于如β-地中海贫血、血友病等多种遗传病的基因治疗中[30,31]. 本研究通过构建重组hAAT慢病毒表达载体, 研究其表达情况. 结果显示慢病毒在293T细胞中成功包装; 体内外的研究均显示hAAT在慢病毒载体的介导下持续、高效表达. 这为我们进行利用基因工程生产hAAT因子以及下一步开展AATD的基因治疗工作奠定基础.
α1-抗胰蛋白酶缺乏症是由于α1-抗胰蛋白酶(AAT)基因功能缺陷导致的一种单基因遗传病, 目前对AAT缺乏症的治疗, 除了注射外源的AAT外, 基因治疗是有望根治该病的有效方法.
丁士刚, 教授, 北京大学第三医院消化科
在AAT缺乏症的基因治疗中, 外源SerpinA1基因在宿主体内的表达水平高低以及能否持续性表达问题, 一直是受关注的热点, 也是研究重点之一.
最近, Mueller等通过miRNA手段抑制体内不正确折叠、功能异常的PiZ-AAT突变蛋白, 以减少其在肝组织内的积累; 同时转入具有正常功能的PiM-AAT亚型, 提高体内AAT蛋白水平, 实现对α1-抗胰蛋白酶缺乏症(AATD)的
治疗.
本研究以慢病毒为载体, 在其介导下, 外源SerpinA1基因有效地与宿主染色体整合, 实现AAT因子的高效、持续表达.
本研究通过慢病毒的介导, 成功实现重组人AAT因子在小鼠体内高效、稳定地表达, 为利用基因工程技术生产重组hAAT制剂提供新的思路, 同时也为AATD基因治疗的研究积累可靠的实验证据.
本文成功构建了SerpinA1基因的慢病毒表达载体, 并通过感染小鼠证实其可在体内表达AAT, 为AAT缺乏症的基因治疗提供了实验室基础, 因此本研究具有一定的临床价值.
编辑:张姗姗 电编:鲁亚静
| 2. | Knaupp AS, Bottomley SP. Serpin polymerization and its role in disease--the molecular basis of alpha1-antitrypsin deficiency. IUBMB Life. 2009;61:1-5. [PubMed] [DOI] |
| 3. | Gooptu B, Ekeowa UI, Lomas DA. Mechanisms of emphysema in alpha1-antitrypsin deficiency: molecular and cellular insights. Eur Respir J. 2009;34:475-488. [PubMed] [DOI] |
| 4. | Stoller JK, Aboussouan LS. A review of α1-antitrypsin deficiency. Am J Respir Crit Care Med. 2012;185:246-259. [PubMed] [DOI] |
| 5. | Sun Z, Yang P. Role of imbalance between neutrophil elastase and alpha 1-antitrypsin in cancer development and progression. Lancet Oncol. 2004;5:182-190. [PubMed] [DOI] |
| 6. | Ala A, Schilsky M. Genetic modifiers of liver injury in hereditary liver disease. Semin Liver Dis. 2011;31:208-214. [PubMed] [DOI] |
| 7. | Tsutsui Y, Dela Cruz R, Wintrode PL. Folding mechanism of the metastable serpin α1-antitrypsin. Proc Natl Acad Sci U S A. 2012;109:4467-4472. [PubMed] [DOI] |
| 8. | Hua B, Fan L, Liang Y, Zhao Y, Tuddenham EG. Alpha1-antitrypsin Pittsburgh in a family with bleeding tendency. Haematologica. 2009;94:881-884. [PubMed] [DOI] |
| 9. | Emmerich J. Alpha1-antitrypsin and the maintenance of hemostatic balance. Haematologica. 2009;94:762-763. [PubMed] [DOI] |
| 10. | Scully MF, Toh CH, Hoogendoorn H, Manuel RP, Nesheim ME, Solymoss S, Giles AR. Activation of protein C and its distribution between its inhibitors, protein C inhibitor, alpha 1-antitrypsin and alpha 2-macroglobulin, in patients with disseminated intravascular coagulation. Thromb Haemost. 1993;69:448-453. [PubMed] |
| 11. | Greene CM, McElvaney NG. Proteases and antiproteases in chronic neutrophilic lung disease - relevance to drug discovery. Br J Pharmacol. 2009;158:1048-1058. [PubMed] [DOI] |
| 12. | Meinert Niclasen L, Olsen JG, Dagil R, Qing Z, Sørensen OE, Kragelund BB. Streptococcal pyogenic exotoxin B (SpeB) boosts the contact system via binding of α-1 antitrypsin. Biochem J. 2011;434:123-132. [PubMed] |
| 13. | Burgener A, Rahman S, Ahmad R, Lajoie J, Ramdahin S, Mesa C, Brunet S, Wachihi C, Kimani J, Fowke K. Comprehensive proteomic study identifies serpin and cystatin antiproteases as novel correlates of HIV-1 resistance in the cervicovaginal mucosa of female sex workers. J Proteome Res. 2011;10:5139-5149. [PubMed] [DOI] |
| 14. | Whitney JB, Asmal M, Geiben-Lynn R. Serpin induced antiviral activity of prostaglandin synthetase-2 against HIV-1 replication. PLoS One. 2011;6:e18589. [PubMed] [DOI] |
| 15. | Bristow CL, Babayeva MA, LaBrunda M, Mullen MP, Winston R. α1Proteinase inhibitor regulates CD4+ lymphocyte levels and is rate limiting in HIV-1 disease. PLoS One. 2012;7:e31383. [PubMed] [DOI] |
| 16. | Zhou X, Shapiro L, Fellingham G, Willardson BM, Burton GF. HIV replication in CD4+ T lymphocytes in the presence and absence of follicular dendritic cells: inhibition of replication mediated by α-1-antitrypsin through altered IκBα ubiquitination. J Immunol. 2011;186:3148-3155. [PubMed] [DOI] |
| 17. | Garver RI, Chytil A, Courtney M, Crystal RG. Clonal gene therapy: transplanted mouse fibroblast clones express human alpha 1-antitrypsin gene in vivo. Science. 1987;237:762-764. [PubMed] [DOI] |
| 18. | Ghaedi M, Lotfi AS, Soleimani M, Shamsara M, Arjmand S, Adibi B. Expression of recombinant alpha-1 antitrypsin in CHO and COS-7 cell lines using lentiviral vector. Iranian Journal of Biotechnology. 2009;7:148-156. |
| 19. | Wilson AA, Kwok LW, Hovav AH, Ohle SJ, Little FF, Fine A, Kotton DN. Sustained expression of alpha1-antitrypsin after transplantation of manipulated hematopoietic stem cells. Am J Respir Cell Mol Biol. 2008;39:133-141. [PubMed] [DOI] |
| 20. | Wilson AA, Murphy GJ, Hamakawa H, Kwok LW, Srinivasan S, Hovav AH, Mulligan RC, Amar S, Suki B, Kotton DN. Amelioration of emphysema in mice through lentiviral transduction of long-lived pulmonary alveolar macrophages. J Clin Invest. 2010;120:379-389. [PubMed] [DOI] |
| 21. | Karnaukhova E, Ophir Y, Trinh L, Dalal N, Punt PJ, Golding B, Shiloach J. Expression of human alpha1-proteinase inhibitor in Aspergillus niger. Microb Cell Fact. 2007;6:34. [PubMed] [DOI] |
| 22. | Carver AS, Dalrymple MA, Wright G, Cottom DS, Reeves DB, Gibson YH, Keenan JL, Barrass JD, Scott AR, Colman A. Transgenic livestock as bioreactors: stable expression of human alpha-1-antitrypsin by a flock of sheep. Biotechnology (N Y). 1993;11:1263-1270. [PubMed] |
| 23. | Halbert CL, Madtes DK, Vaughan AE, Wang Z, Storb R, Tapscott SJ, Miller AD. Expression of human alpha1-antitrypsin in mice and dogs following AAV6 vector-mediated gene transfer to the lungs. Mol Ther. 2010;18:1165-1172. [PubMed] [DOI] |
| 24. | Nadai M, Bally J, Vitel M, Job C, Tissot G, Botterman J, Dubald M. High-level expression of active human alpha1-antitrypsin in transgenic tobacco chloroplasts. Transgenic Res. 2009;18:173-183. [PubMed] [DOI] |
| 25. | Walsh G, Jefferis R. Post-translational modifications in the context of therapeutic proteins. Nat Biotechnol. 2006;24:1241-1252. [PubMed] [DOI] |
| 26. | Cantin AM, Woods DE, Cloutier D, Dufour EK, Leduc R. Polyethylene glycol conjugation at Cys232 prolongs the half-life of alpha1 proteinase inhibitor. Am J Respir Cell Mol Biol. 2002;27:659-665. [PubMed] |
| 27. | Veronese FM, Mero A. The impact of PEGylation on biological therapies. BioDrugs. 2008;22:315-329. [PubMed] [DOI] |
| 28. | DeFrees S, Wang ZG, Xing R, Scott AE, Wang J, Zopf D, Gouty DL, Sjoberg ER, Panneerselvam K, Brinkman-Van der Linden EC. GlycoPEGylation of recombinant therapeutic proteins produced in Escherichia coli. Glycobiology. 2006;16:833-843. [PubMed] [DOI] |
| 29. | Lindhout T, Iqbal U, Willis LM, Reid AN, Li J, Liu X, Moreno M, Wakarchuk WW. Site-specific enzymatic polysialylation of therapeutic proteins using bacterial enzymes. Proc Natl Acad Sci U S A. 2011;108:7397-7402. [PubMed] [DOI] |
| 30. | Xie SY, Ren ZR, Zhang JZ, Guo XB, Wang QX, Wang S, Lin D, Gong XL, Li W, Huang SZ. Restoration of the balanced alpha/beta-globin gene expression in beta654-thalassemia mice using combined RNAi and antisense RNA approach. Hum Mol Genet. 2007;16:2616-2625. [PubMed] [DOI] |
| 31. | Tsui LV, Kelly M, Zayek N, Rojas V, Ho K, Ge Y, Moskalenko M, Mondesire J, Davis J, Roey MV. Production of human clotting Factor IX without toxicity in mice after vascular delivery of a lentiviral vector. Nat Biotechnol. 2002;20:53-57. [PubMed] [DOI] |