修回日期: 2011-10-10
接受日期: 2011-10-14
在线出版日期: 2011-10-18
目的: 评价结直肠癌肝转移的临床预后因素及治疗方案对预后的影响.
方法: 收集71例结直肠癌肝转移患者的临床资料及预后情况, 用Kaplan-Meier生存分析及Log-rank检验进行单因素分析, 将有统计学意义的预后因素纳入Cox回归模型进行多因素分析.
结果: Kaplan-Meier单因素分析及Log-rank检验显示, 肝转移灶最大直径、有无区域淋巴结转移及诊断肝转移时碱性磷酸酶(ALP)最高值3个因素对其预后影响有显著意义; 将这3个预后因素纳入Cox回归多因素分析显示, 有无区域淋巴结转移、诊断肝转移时ALP最高值是结直肠癌肝转移的独立预后因素. 全组3种治疗方式比较差别无统计学意义, 但对手术切除组和化疗组两组进行比较, 差异有统计学意义(P<0.05), 而局部治疗组和手术组之间, 局部治疗组和化疗组之间差别无统计学意义.
结论: 肝转移灶最大直径、原发病灶有无区域淋巴结转移、诊断肝转移时最高ALP值是结直肠癌肝转移患者的预后因素; 肝转移灶最大直径越小、无区域淋巴结转移、诊断肝转移时最高ALP值正常的患者预后越好; 手术切除联合化疗目前是结直肠癌肝转移的首选治疗方案, 可获得较好的远期生存.
引文著录: 王科伟, 范海银, 孔凡民, 董明. 结直肠癌肝转移的预后因素. 世界华人消化杂志 2011; 19(29): 3088-3093
Revised: October 10, 2011
Accepted: October 14, 2011
Published online: October 18, 2011
AIM: To evaluate the clinical prognostic factors for colorectal liver metastases and to analyze the impact of different treatments on prognosis.
METHODS: The clinical and prognostic data for 71 patients with colorectal liver metastases were analyzed. Univariate analysis was performed using the Kaplan-Meier method and Log-rank test to find significant prognostic factors, while multivariate analysis was performed using the Cox regression model.
RESULTS: Univariate analysis showed that the maximum diameter of liver metastases, presence or absence of regional lymph node metastasis and highest ALP level were significant prognostic factors. Cox multivariate regression analysis revealed that presence or absence of regional lymph node metastasis and highest ALP level were independent prognostic factors for colorectal liver metastases. The prognosis differed significantly between patients undergoing surgical resection and those undergoing chemotherapy (P = 0.049), but showed no significant difference between patients undergoing local treatment and those undergoing surgical resection as well as between patients undergoing local treatment and those undergoing chemotherapy.
CONCLUSION: The maximum diameter of liver metastases, presence or absence of regional lymph node metastasis, and highest ALP level are significant prognostic factors for colorectal liver metastases. Curative surgical resection combined with chemotherapy is the preferred treatment option for colorectal liver metastases since it was associated with better long-term survival.
- Citation: Wang KW, Fan HY, Kong FM, Dong M. Analysis of prognostic factors for colorectal liver metastases. Shijie Huaren Xiaohua Zazhi 2011; 19(29): 3088-3093
- URL: https://www.wjgnet.com/1009-3079/full/v19/i29/3088.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i29.3088
结直肠癌是消化系统的常见恶性肿瘤之一, 我国结直肠癌发病率约为206/10万, 近年每年以2%的速度增加, 占肿瘤死亡的第4位[1]. 肝转移是结直肠癌主要的死亡原因之一, 约20%-25%的患者在初诊时发现伴有肝转移, 有60%以上的结直肠癌最终发生肝转移[2]. 肝转移无法切除患者的中位生存时间仅6-9 mo, 5年生存率几乎为零, 而肝转移灶能根治性切除患者的5年生存率可达30%-40%. 近年多学科干预治疗结直肠癌肝转移, 使结直肠癌肝转移患者的预后得到了一定的改善. 现对我院收治的71例结直肠癌肝转移(colorectal liver metastases, CRLM)病例的临床特点, 治疗过程及预后进行回顾性分析, 了解其预后因素, 不同治疗方案对预后的影响, 为临床治疗提供参考.
2005-01/2010-06我院收治的CRLM患者中, 将仍然存活但随访时间少于1年之病例予以剔除, 共收集到符合入组标准的患者71例. 全组男41例, 女30例, 男女比例为1.37:1, 年龄39-82岁, 中位年龄59岁. 同时肝转移53例, 异时肝转移18例, 均有影像学或病理学检查支持, 平均出现肝转移的时间29.75 mo(最长术后16年出现肝转移). 结直肠癌原发部位: 直肠33例(46.5%)、乙状结肠18例(25.3%)、脾曲和降结肠3例(4.2%)、盲肠、升结肠和肝曲18例(25.3%), 横结肠1例(1.4%). 肿瘤分化程度: 高分化腺癌15例(21.1%), 中分化50(70.4%), 低分化及黏液腺癌6例(8.5%). 原发肿瘤有区域淋巴结转移51例(71.8%), 无区域淋巴结转移20例(28.2%). 转移灶累及肝右叶的24例(33.8%), 肝左叶的13例(18.3%), 双叶均累及34(47.9%). 单发肝转移灶者35例(49.3%), 多发转移灶者36例(50.7%). 肝转移灶最大直径≥5 cm 28例(39.4%), <5 cm 43例(60.6%). 全组诊断结直肠癌肝转移时CEA≥200 ng/L 6例(8.5%), <200 ng/L 65例(91.5%); 全组诊断结直肠癌肝转移时ALP最高值≥130 U/L 16(22.5%)例, <130 U/L 55例(77.5%).
1.2.1 患者入组标准: (1)肿瘤原发于结直肠; (2)原发病灶有明确的病理诊断; (3)经超声、增强CT, PET/CT检查和(或)术后病理学检查证实为肝转移; (4)首发转移为肝转移; (5)排除合并其他原发肿瘤和其他转移; (6)原发肿瘤均手术切除; (7)除外患有肝硬化、肝炎、梗阻性黄疸等其他肝脏疾病的患者; (8)ALP值为诊断肝转移时最高值(正常值范围38-128 U/L); (9)有完整的临床及随访资料.
1.2.2 治疗方案: (1)肝转移灶手术切除组29例(40.8%): 包括直接接受手术治疗和非手术治疗后获得二期手术治疗的患者, 该组患者术后接受辅助FOLFOX4方案(奥沙利铂、四氢叶酸钙、氟尿嘧啶)或IFL方案(依立替康, 四氢叶酸钙, 氟尿嘧啶)化疗; (2)化疗组34例(47.9%): 包括全身化疗和局部肝动脉化疗栓塞术(TACE), 全身化疗是用FOLFOX方案、FOLFOX4方案或IFL方案; 肝动脉化疗栓塞术是采用经肝动脉的碘油栓塞加化疗药物灌注(表阿霉素、丝裂霉素、替加氟); (3)局部治疗组8例(11.3%): 包括射频消融(RFA)、无水酒精注射(PEI)等.
1.2.3 随访: 随访截止日期2011-01-31, 存活29例, 死亡42例. 随访时间6-60 mo, 中位随访时间22 mo. 均通过电话方式或病案检索随访.
统计学处理 生存时间指患者自确诊肝转移至死亡或截止的时间. 结果应用SPSS13.0进行统计分析. 以生存时间为因变量对结直肠癌肝转移患者的预后因素分析, 单因素分析采用Kaplan-Meier法和Log rank检验, 多因素分析采用Cox回归模型, 显著性水平P<0.05.
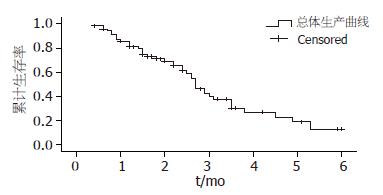
71例结直肠癌肝转移患者的中位生存时间为27.0 mo±1.6 mo, 1年生存率81.2%, 3年生存率26.7%, 5年生存率12.7%(图1). 同时肝转移中平均生存时间27.0 mo±1.6 mo, 1年生存率77.2%, 3年生存率60.8%. 异时肝转移平均生存时间27.0 mo±4.0 mo, 1年生存率87.2%, 3年生存率44.4%, 差异无统计学意义.
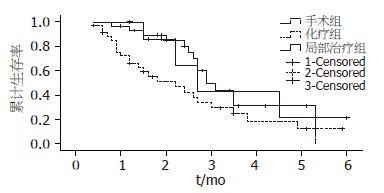
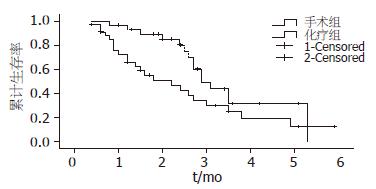
手术切除组中位生存时间为29.0 mo±2.7 mo, 1年生存率93.0%, 3年生存率31.2%; 化疗组中位生存时间22.0 mo±5.9 mo, 1年生存率65.9%, 3年生存率24.7%; 局部治疗组中位生存时间为27.0±1.6 mo, 1年生存率100%, 3年生存率42.9%, 全组3种治疗方式比较差别无统计学意义(图2). 但对手术切除组和化疗组患者进行比较发现,差异有统计学意义(P = 0.049, 图3), 而局部治疗组和手术组之间, 局部治疗组和化疗组之间差别无统计学意义.
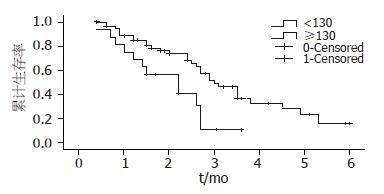
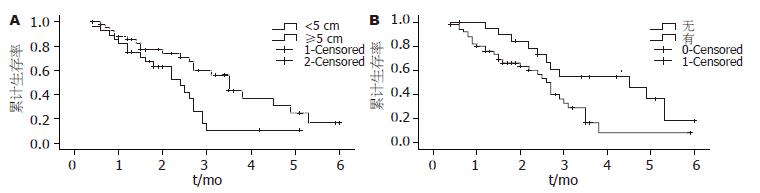
ALP值<130 U/L者组中位生存时间30 mo, 1年生存率为84.9%, 3年生存率为32%; ≥130 U/L 者组中位生存时间22 mo, 1年生存率68.8%, 3年生存率为10.0%(图4), 差异有统计学意义.
2.4.1 单因素分析: 用Kaplan-Meier单因素分析和Log rank检验对患者的年龄、性别、肝转移灶的数目、肝转移灶最大直径、针对肝转移灶治疗方式、有无区域淋巴结转移、肝转移时间、肿瘤分化程度、CEA值、ALP值等因素进行了分析, 结果显示肝转移灶最大直径、有无区域淋巴结转移, ALP值3个因素对其预后影响有显著意义(表1).
| 预后因素 | n | 中位生存时间(mo) | 3年生存率% | P值 |
| 年龄(岁) | ||||
| ≥ 60 | 34 | 29.0 | 30.7 | 0.86 |
| < 60 | 37 | 25.0 | 27.9 | |
| 性别 | ||||
| 男 | 41 | 27.0 | 22.9 | 0.55 |
| 女 | 30 | 27.0 | 27.4 | |
| 原发肿瘤位置 | ||||
| 直肠 | 33 | 27.0 | 21.9 | 0.24 |
| 结肠 | 38 | 27.0 | 19.7 | |
| 转移灶最大直径 | ||||
| ≥ 5 cm | 28 | 24.0 | 10.5 | 0.01 |
| < 5 cm | 43 | 35.0 | 37.1 | |
| 肝转移灶个数 | ||||
| 单发 | 35 | 29.0 | 33.7 | 0.14 |
| 多发 | 36 | 25.0 | 26.9 | |
| 区域淋巴结转移 | ||||
| 无 | 20 | 45.0 | 45.6 | 0.02 |
| 有 | 51 | 27.0 | 16.6 | |
| 肝转移时间 | ||||
| 同时 | 53 | 27.0 | 25.6 | 0.40 |
| 异时 | 18 | 27.0 | 33.3 | |
| 治疗方式 | ||||
| 手术组 | 29 | 29.0 | 31.2 | 0.09 |
| 化疗组 | 34 | 22.0 | 24.7 | |
| 局部治疗组 | 8 | 27.0 | 42.9 | |
| 肿瘤分化程度 | ||||
| 高分化 | 15 | 26.0 | 11.4 | 0.53 |
| 中分化 | 50 | 27.0 | 26.9 | |
| 低分化 | 6 | 35.0 | 25.0 | |
| CEA值 | ||||
| ≥ 200 ng/mL | 6 | 27.0 | 16.5 | 0.06 |
| < 200 ng/mL | 65 | 22.0 | 30.0 | |
| AL P值 | ||||
| ≥ 130 U/L | 16 | 22.0 | 10.0 | 0.01 |
| < 130 U/L | 55 | 30.0 | 32.0 |
2.4.2 多因素分析: 将单因素分析有统计学意义的预后因素引入Cox回归模型进行多因素分析, 结果显示: 有无区域淋巴结转移和不同肝转移灶是肝转移患者的独立预后因素(图5, 表2).
| 影响因素 | B | SE | Wald | df | P值 | RR值 | 95%CI | |
| Lower | Upper | |||||||
| 肝转移灶最大直径 | 0.658 | 0.342 | 3.708 | 1 | 0.054 | 1.932 | 0.988 | 3.776 |
| 区域淋巴结转移 | 0.851 | 0.373 | 5.211 | 1 | 0.022 | 2.342 | 1.128 | 4.865 |
| ALP值 | 0.810 | 0.376 | 4.624 | 1 | 0.032 | 2.247 | 1.074 | 4.699 |
肝脏是结直肠癌转移的主要部位, 这是由于结直肠门静脉血回流的解剖学特点所决定的. 结直肠癌脱落的癌细胞首先转移到肝脏, 在肝脏形成转移灶后再通过血流转移到肺、骨等其他脏器. 结直肠癌死亡病例尸检发现肝转移率达80%, 肝转移是结直肠癌患者的主要死亡原因, 结直肠癌肝转移能获得手术切除的患者仅占10%-20%, 而不经治疗的肝转移中位生存期为5-9 mo[3]. 因此, 探讨结直肠癌肝转移的临床特征及采取什么样的治疗方案对患者的预后影响有重要意义.
结直肠癌肝转移有许多临床预后危险因素, 许多学者进行了相关的研究. 国外有学者用Meta分析的方法对结直肠癌肝转移的预后因素进行了总结, 主要因素有肝转移灶的大小、肝转移灶的个数、肝转移时间、无瘤间期的长短、原发灶分期、术前CEA值、肝转移灶治疗方式等. Fong等[4]对肝转移临床预后因素进行了临床危险评分研究, 把发现肝转移的时间、原发灶有无区域淋巴结转移、肝转移灶的数目, 术前CEA值, 最大转移灶直径这5个预后因素作为结直肠癌肝转移的临床危险因素评分的因素, 其研究发现无区域淋巴结转移的5年生存率41%、有区域淋巴结转移者为32%; 肝转移时间>12 mo者5年生存率41%、<12 mo为30%; 单发肝转移灶患者5年生存率44%、多发肝转移灶患者为28%; 术前CEA值>200 ng/mL的患者5年生存率为24%、≤200 ng/mL的患者为38%; 肝转移灶最大直径>5 cm的患者5年生存率为31%、<5 cm的患者为40%. Artigas等[5]研究表明: 肝转移灶最大直径<4 cm, 肝转移灶数目<4个的患者术后有较好的生存率. 但是也有研究表明[6]: 肝转移时间、原发灶的Dukes分期、肝转移的数目与预后无明显相关性. Taniai等[7]对同时异时肝转移的预后研究表明: 同时肝转移和异时肝转移术后生存时间差别无统计学意义. 本研究表明: 肝转移灶的最大直径≥5 cm、有区域淋巴结转移患者预后较差, 肝转移灶最大直径≥5 cm者中位生存时间24 mo, 3年生存率为10.5%; <5 cm者中位生存时间为35 mo, 3年生存率为37.1%, 差别有统计学意义.
无区域淋巴结转移者中位生存时间45 mo, 3年生存率45.6%; 有区域淋巴结转移者中位生存时间为27 mo, 3年生存率为16.6%, 差别有统计学意义. 而肝转移的预后与原发灶的部位, 肝转移灶的个数、诊断肝转移时CEA值及肝转移时间无明显相关性, 差别无统计学意义.
一般我们认为原发肿瘤的分化程度是结直肠癌患者的预后因素, Yokoyama等[8]对212例高分化和71例中分化患者进行了分析, 研究表明: 中分化腺癌的区域淋巴结转移、淋巴浸润、静脉浸润、肝转移, 腹腔转移与高分化腺癌相比, 差异有统计学意义, 生存分析显示中分化腺癌预后较差. 同样Kanemitsu等[9]对2 678例结肠癌根治术后患者的病理类型进行了预后分析, 其中97例患者为黏液腺癌患者, 对患者的年龄、性别、肿瘤位置、肿瘤病理类型、肿瘤分期等因素进行预后分析表明, 黏液腺癌预后较差. 但是本研究表明: 结直肠肝转移预后与病理类型无明显相关性, 可能与研究样本量较小, 随访时间较短有关.
ALP是广泛分布于人体肝脏、骨骼、肠、肾和胎盘等组织经肝脏向胆外排出的一种酶. 碱性磷酸酶主要用于阻塞性黄疸、原发性肝癌、继发性肝癌、胆汁淤积性肝炎等的检查. ALP异常升高临床上主要见于: (1)生理性增高: 儿童在生理性的骨骼发育期, 碱性磷酸酶活力可比正常人高1-2倍; (2)病理性升高: 阻塞性黄疸、肝硬化、肝坏死, 碱性磷酸酶明显升高; 原发性和继发性肝癌时碱性磷酸酶亦明显升高, 与癌组织中或癌肿周围肝细胞合成碱性磷酸酶增加有关. 其他肿瘤如乳腺癌、肺癌、卵巢癌、骨细胞瘤、骨肉瘤等, 碱性磷酸酶增高时, 提示可能有肝脏转移; 变形性骨炎、成骨细胞癌、佝偻病、骨软化、甲状腺及甲状旁腺功能亢进、肾小管性酸中毒、遗传性磷酸酶过多症. 我们可见许多结直肠癌患者出现肝转移时ALP值增高. Saif等[10]对105例结直肠癌肝转移患者的术前ALP值进行研究(正常值范围39-117 U/l), 把ALP值分为3组>120 U/L, 20-120 U/L, <20 U/L, 结果表明ALP水平增高和原发肿瘤的T分期有明显相关性(P = 0.0003); ALP>120组患者与正常ALP组相比预后较差(RR = 4.4, 95%CI, 1.0-19.1); CEA值和ALP值有明显的相关性(P = 0.002). 同样在临床工作中我们可见患者许多结直肠癌患者出现肝转移时ALP值增高. 本研究表明: ALP≥130 U/L的患者中位生存时间为22 mo, 3年生存率为10%; 而ALP<130 U/L的患者中位生存时间为30 mo, 3年生存率32%(P = 0.01), Cox多因素分析显示P = 0.032、RR值 = 2.247(95%CI, 1.074-4.699), 表明ALP是结直肠癌肝转移的独立预后因素.
结直肠癌肝转移手术切除治疗是唯一可能获得治愈的治疗方式. Kavlakoglu等[11]对42例结直肠癌肝转移手术切除的患者进行了回顾性研究, 研究表明中位生存时间为56 mo, 3年生存率为71.3%, 单因素分析显示肝转移灶的个数<4个、肝转移灶最大直径<4 cm、切除方式、阴性手术切缘是结直肠癌肝转移的预后因素. 多因素分析显示肝转移灶个数>4个、肝转移灶最大直径>4 cm是结直肠癌肝转移患者的独立预后因素(RR值分别为2.18和5.89). 新兴技术如射频消融技术(RFA)[12], 冷冻技术等的出现和发展, 为结直肠癌肝转移患者提供了多种治疗方案. 另有文献报道[13]抗体治疗可以明显提高结直肠癌肝转移患者的生存率, 但该项技术尚未在我院开展, 因此可作为未来的研究方向. 目前结直肠癌肝转移患者是手术治疗还是RFA治疗存在一些争议, 许多国外的结直肠癌肝转移治疗指南把RFA治疗也列为结直肠癌肝转移治疗方案的一种. 许多学者对手术治疗和RFA治疗的预后进行了回顾性分析. Abdalla等[14]对418例结直肠癌肝转移患者进行回顾性研究, 研究表明手术切除患者的4年生存率为65%, 而RFA治疗组为22%, 差异有统计学意义. 而Berber和Siperstein等[15]对158例肝转移灶RFA和90例单发肝转移灶手术切除的患者的预后进行了回顾性研究, 研究表明: RFA治疗组5年生存率为30%, 手术组为50%, 差异无统计学意义. 本研究表明: 手术切除组29例, 中位生存时间为29.0 mo±2.7 mo,1年生存率93.0%, 3年生存率31.2%; 化疗组34例中位生存时间22.0 mo±5.9 mo, 1年生存率65.9%, 3年生存率24.7%, 局部治疗组(RFA组)8例, 中位生存时间为27.0 mo±1.6 mo, 1年生存率100%, 3年生存率42.9%, 全组3种治疗方式差别无统计学意义, 但对手术切除组和化疗组患者进行了比较发现差异有统计学意义(P = 0.049), 而局部治疗组和化疗组, 手术切除和局部治疗组之间差异无显著意义, 这可能与局部治疗组样本量较小有关. 所以本研究认为手术切除联合化疗是结直肠癌肝转移患者首选治疗方式, 可获得较好的远期生存.
结直肠癌是消化系统的常见恶性肿瘤之一, 肝转移是结直肠癌主要的死亡原因之一, 了解其预后因素, 以及不同治疗方案对预后的影响, 会对临床治疗起到明显的指导作用.
汤朝晖, 副主任医师, 上海交大医学院附属新华医院普外科; 王忠裕, 教授, 大连医科大学附属第一医院普通外科二科
Artigas等研究表明: 肝转移灶最大直径<4 cm, 肝转移灶数目<4 个的患者术后有较好的生存率.
收集结直肠癌肝转移患者的临床资料及预后情况, 用Kaplan-Meier生存分析及Log-rank检验进行单因素分析, 将有统计学意义的预后因素纳入Cox回归模型进行多因素分析, 从而得出结直肠癌肝转移的临床预后因素及治疗方案对预后的影响.
本文为回顾性临床分析, 文中应用了多种统计学方法对可能影响结直肠肝转移预后的多个因素进行了分析, 得出肝转移灶大小、有无淋巴结转移以及ALP值与患者预后有关. 阅后感觉文章不错, 对本病的治疗具有一定的指导意义.
编辑:曹丽鸥 电编:闫晋利
| 1. | Parkin DM, Pisani P, Ferlay J. Global cancer statistics. CA Cancer J Clin. 1999;49:33-64, 1. [PubMed] |
| 2. | Steele G, Ravikumar TS. Resection of hepatic metastases from colorectal cancer. Biologic perspective. Ann Surg. 1989;210:127-138. [PubMed] [DOI] |
| 3. | Pawlik TM, Choti MA. Surgical therapy for colorectal metastases to the liver. J Gastrointest Surg. 2007;11:1057-1077. [PubMed] [DOI] |
| 4. | Fong Y, Fortner J, Sun RL, Brennan MF, Blumgart LH. Clinical score for predicting recurrence after hepatic resection for metastatic colorectal cancer: analysis of 1001 consecutive cases. Ann Surg. 1999;230:309-318; discussion 318-321. [PubMed] [DOI] |
| 5. | Artigas V, Marín-Hargreaves G, Marcuello E, Pey A, González JA, Rodríguez M, Moral A, Monill JM, Sancho J, Pericay C. [Surgical resection of liver metastases from colorectal carcinoma. Experience in Sant Pau Hospital]. Cir Esp. 2007;81:339-344. [PubMed] [DOI] |
| 6. | Umekita N, Maeshiro T, Miyamoto S, Suzuki T, Inoue S, Awane Y. [Preoperative CEA level predicts outcomes of hepatic resection for liver metastases from colorectal cancer]. Gan To Kagaku Ryoho. 1998;25:1426-1428. [PubMed] |
| 7. | Taniai N, Yoshida H, Mamada Y, Matsumoto S, Mizuguchi Y, Suzuki H, Furukawa K, Akimaru K, Tajiri T. Outcome of surgical treatment of synchronous liver metastases from colorectal cancer. J Nihon Med Sch. 2006;73:82-88. [PubMed] [DOI] |
| 8. | Yokoyama S, Takifuji K, Hotta T, Matsuda K, Tominaga T, Oku Y, Nasu T, Tamura K, Ieda J, Yamaue H. Moderately differentiated colorectal adenocarcinoma as a lymph node metastatic phenotype: comparison with well differentiated counterparts. BMC Surg. 2010;10:8. [PubMed] [DOI] |
| 9. | Kanemitsu Y, Kato T, Hirai T, Yasui K, Morimoto T, Shimizu Y, Kodera Y, Yamamura Y. Survival after curative resection for mucinous adenocarcinoma of the colorectum. Dis Colon Rectum. 2003;46:160-167. [PubMed] [DOI] |
| 10. | Saif MW, Alexander D, Wicox CM. Serum Alkaline Phosphatase Level as a Prognostic Tool in Colorectal Cancer: A Study of 105 patients. J Appl Res. 2005;5:88-95. [PubMed] |
| 11. | Kavlakoglu B, Ustun I, Oksuz O, Pekcici R, Ergocen S, Oral S. Surgical treatment of liver metastases from colorectal cancer: experience of a single institution. Arch Iran Med. 2011;14:120-125. [PubMed] |
| 12. | Gwak JH, Oh BY, Lee RA, Chung SS, Kim KH. Clinical applications of radio-frequency ablation in liver metastasis of colorectal cancer. J Korean Soc Coloproctol. 2011;27:202-210. [PubMed] [DOI] |
| 13. | Davies JM, Goldberg RM. Treatment of metastatic colorectal cancer. Semin Oncol. 2011;38:552-560. [PubMed] [DOI] |
| 14. | Abdalla EK, Vauthey JN, Ellis LM, Ellis V, Pollock R, Broglio KR, Hess K, Curley SA. Recurrence and outcomes following hepatic resection, radiofrequency ablation, and combined resection/ablation for colorectal liver metastases. Ann Surg. 2004;239:818-825; discussion 825-827. [PubMed] [DOI] |
| 15. | Berber E, Tsinberg M, Tellioglu G, Simpfendorfer CH, Siperstein AE. Resection versus laparoscopic radiofrequency thermal ablation of solitary colorectal liver metastasis. J Gastrointest Surg. 2008;12:1967-1972. [PubMed] [DOI] |