修回日期: 2011-07-27
接受日期: 2011-09-01
在线出版日期: 2011-09-08
目的: 探讨精准肝切除在巨大肝血管瘤治疗中的应用.
方法: 回顾性分析南京鼓楼医院2008-01/2010-12手术治疗26例巨大肝血管瘤临床资料.
结果: 26例均行精准的肝段或联合肝段切除术治疗, 术中出血100-2 600(平均775±132) mL. 术中输血0-2 200(平均为384±123) mL. 4例出现不同程度并发症, 其中胆漏1例, 胸腔积液和(或)腹腔积液3例, 均经保守治疗后短期治愈. 全组无死亡.
结论: 对于基本占据肝叶及多肝段的巨大血管瘤可在严格把握适应证的情况下, 行精准的肝段切除术治疗.
引文著录: 冯伟, 仇毓东. 精准肝切除巨大肝血管瘤26例. 世界华人消化杂志 2011; 19(25): 2684-2687
Revised: July 27, 2011
Accepted: September 1, 2011
Published online: September 8, 2011
AIM: To evaluate the safety of regular hepatic segmentectomy for giant hemangioma of the liver.
METHODS: The clinical data for patients with giant hemangioma of the liver who underwent surgical resection between January 2008 and December 2010 in Nanjing Drum Tower Hospital were analyzed retrospectively.
RESULTS: A total of 26 patients were included in the study. All patients underwent regular hepatic segmentectomy. There were no deaths, but 4 patients developed complications. The intraoperative bleeding ranged from 100 to 2 600 mL (average, 775 mL ± 132 mL), and intraoperative blood transfusion ranged between 0 and 2 200 mL (average, 384 mL ± 123 mL).
CONCLUSION: Regular hepatic segmentectomy is safe in the management of giant hemangioma occupying the liver lobe or segment.
- Citation: Feng W, Qiu YD. Regular hepatic segmentectomy for giant hemangioma of the liver: An analysis of 26 cases. Shijie Huaren Xiaohua Zazhi 2011; 19(25): 2684-2687
- URL: https://www.wjgnet.com/1009-3079/full/v19/i25/2684.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i25.2684
肝血管瘤是一种常见的肝脏良性肿瘤, 其尸检发生率在0.40%-7.13%[1]. 分为海绵状血管瘤、硬化性血管瘤、血管内皮细胞瘤、毛细血管瘤4类. 临床常见的是海绵状血管瘤. 常见人群为30-50岁女性. 随着B超等现代体检手段的普及, 越来越多的肝血管瘤患者被发现, 并成为肝脏门诊随诊最主要的人群之一. 对于肝血管瘤的治疗也就得以引起重视. 根据国外巨大血管瘤的标准[2], 我们自2008-01/2010-12对直径≥4 cm经B超有典型血管瘤表现的152例成年患者进行每3-6 mo/年的B超随诊, 并对其中26例采取了手术治疗. 现总结报告如下.
本组26例中, 男6例, 女20例, 男女比例约为1∶3. 年龄28-73(平均47.7)岁. 肿瘤单发16例, 多发10例. 肿瘤最小直径5.5 cm, 最大直径20 cm. 主要肿瘤位于肝左叶9例, 肝右叶12例, 肝中叶3例, 单独尾叶2例. 其中位于左叶的肿瘤中3例位于S2、3; 5例位于S2、3、4; 1例位于S1、2、3、4. 位于右叶12例中5例位于S6、7; 5例位于S5、6、7、8; 1例位于S4、5、6、7、8; 1例位于S1、5、6、7、8. 全组合并肝硬化1例. 随诊过程中近期明显增大23例, 其中有明显上腹胀痛、腰背部酸痛等临床症状7例, 紧贴肝门血管16例; 无法和肝癌鉴别2例; 行介入栓塞术后1例. 本组每例患者常规术前评估肝脏功能. 结合术前生化检查, 进行Child-Pugh评分. 26例均为A级5分. 同时常规采用脉动色素法检测吲哚氰绿(ICG)排泄试验15 min滞留率进行肝脏储备功能的评估. 以明确是否能够耐受肝段以及联合肝段的切除. 本组患者26例ICGR15均<10%, 行精准肝段切除术治疗. 全组检测AFP均正常. 对于需行联合肝段切除的患者, 常规行CT三维血管重建分型及行余肝体积测定. 中央型和尾叶巨大血管瘤加行MRCP.
1.2.1 一般情况: 本组病例均采用右上腹反"L"型切口, 充分暴露. 常规先充分离断周围韧带. 然后行术中B超检查确定血管瘤与周围血管关系, 并同时检查肿瘤是否多发及位置, 是否需行联合肝段切除. 最主要是根据精准肝切除的原则, 确定预阻断肝段肝蒂位置以及作为规则肝段切除边界标志的肝静脉在肝内的走形. 术中一定要保证肝静脉主干的完整, 确保残肝静脉回流, 并联合麻醉医师将中心静脉压切肝时维持在2-3 mmHg, 有利于减少断面肝静脉渗血[3]. 然后根据肿瘤位置做相应的处理.
1.2.2 根据肿瘤位置的不同采取不同的处理: (1)对于位于左侧肝段(叶)巨大血管瘤, 多属边缘外生型, 与肝门血管关系不密切. 但由于肿瘤巨大, 基本占据整个左侧肝段(叶), 且紧靠肝蒂血管, 手术需切除左侧联合肝段. 牵拉肝圆韧带, 显露门静脉脐部肝外段, 分别在肝外阻断左侧各肝蒂分支, 即可见明显肝段表面分界[4]. 结合术中B超定位肝左、中静脉主干作为段间分界, 即可切除相应联合肝段. 肝左静脉可一直追至根部在肝内处理5-0 prolene缝闭. S4由于有来自S5、8的分支供应, 在经门静脉脐部行肝段分支离断时应术中B超定位肝中静脉, 结合血管三维重建明确段间界面, 由浅入深以Kelly钳在断面内精细钳夹出S5、8通向S4各肝蒂分支, 分别在肝内予以断扎. 断面血管采用电凝及钛夹、结扎的方法处理; (2)对于位于右侧肝段但尚未对肝门造成影响的巨大血管瘤, 需先切除胆囊, 经胆囊管置入一细硅胶管待用. 此时根据术前CT三维重建血管成像, 明确门静脉分型[5]. 如为Ⅱ型在切除胆囊后经肝十二指肠韧带右侧肝门平面打开肝十二指肠韧带, 游离出肝右、中动脉, 及门静脉右前、后干, 分别根据预切除范围作相应肝段肝蒂的肝外阻断. 如为Ⅰ型, 右侧肝蒂分叉较高, 无法在肝门处完成Glisson肝蒂阻断. 此时需术中B超定位预切除段肝蒂位置, 直接劈开肝实质, 在肝内以CT三维血管重建影像为指导阻断肝段肝蒂及每一通向荷瘤段肝蒂分支, 同时结合术中B超定位肝中或肝右静脉, 以肝静脉主干及肝内分支作为段间平面分界, 指导完成相应肝段切除. 肝实质同样采取精细钳夹离断. 肝右静脉在分离至第二肝门处时处理. 对S5、6、7、8联合切除病例还可采用Belghiti悬吊[6,7]辅助完成; (3)对于中央型且与肝门关系密切的巨大血管瘤(如S4、5、8), 由于其对第一、二、三肝门都产生影响, 应充分利用血管瘤的可压缩性. 先行解剖第三肝门, 逐一结扎切断肝短静脉, 第二肝门处分离出肝右静脉及肝中、肝左共干, 分别预置阻断带预防术中大出血及气栓. 处理胆囊同前, 并需行胆道造影, 再予以阻断中肝动脉及门静脉右前支. 如肝门处分离困难, 则需根据术前血管重建, 通过劈肝径路阻断肝内相应肝蒂, 肿瘤缺血后将明显瘪陷. 但由于肿瘤的长期挤压致肝门处Glisson鞘已不完整, 往往成网格状, 与瘤体紧贴, 其间无正常肝细胞组织, 表现类似于恶性肿瘤的浸润生长, 其间往往有大量毛细侧支形成. 需在谨慎分辨肝门管道情况下用CUSA进行分离. 此时手术时间和出血量明显增加, 需备自体血回输装置, 充分利用自体血. 术中B超显露并严格保护肝中及肝右静脉主干, 分离时沿肝静脉走形分离, 而不随意离断, 以保证回流. 经两侧分别向第二肝门汇合后, 可将联合肝段切除; (4)尾叶巨大血管瘤由于其位置的特殊性, 除联合肝段切除能得到充分暴露和血管阻断外, 单独的切除往往采用肝门肝蒂解剖后先结扎通向尾叶肝蒂, 充分游离肝脏, 同中央型血管瘤一样处理第三、第二肝门后, 劈开肝脏实质将其完整切除[8,9].
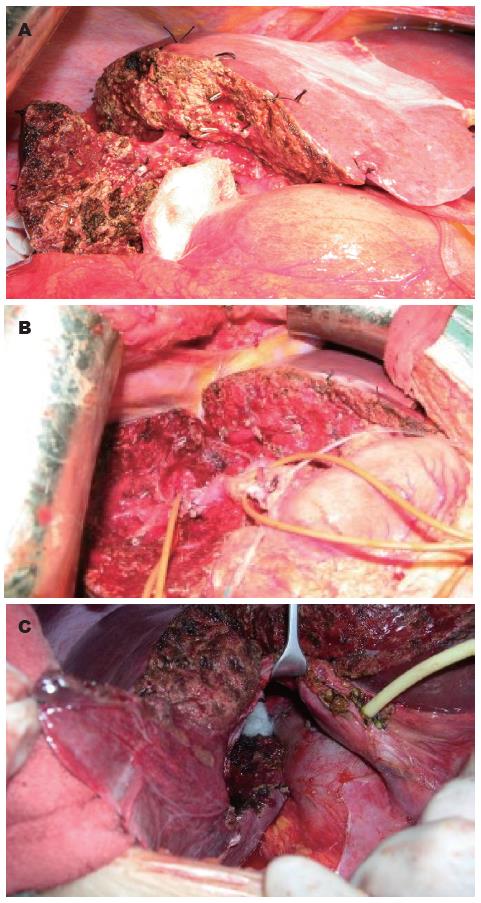
本组病例术中出血100-2 600(平均775±132) mL. 术中输血0-2 200(平均为384±123) mL. 全组患者无死亡. 本组患者均顺利治愈出院. 术后在1 wk内肝功能均恢复正常. 术后出现一般性并发症: 胆漏1例, 胸腔积液和(或)腹腔积液3例, 均经保守治疗后短期治愈. 并发症发生率15.4%. 术后病理证实海绵状血管瘤25例, 血管内皮细胞瘤1例(图1).
对于肝脏血管瘤的治疗, 由于各学科的发展, 出现不同的治疗方法, 如手术治疗、微波固化治疗、射频热毁损治疗和肝动脉栓塞以及栓塞后手术治疗等[10,11]. 但是由于微创治疗存在大出血风险和毁损不完全性以及存在胆管炎、胆道狭窄等严重远期并发症[12,13], 目前效果尚不肯定. 手术治疗仍较广泛地应用于临床上需要处理的巨大血管瘤. 但对于明确的巨大血管瘤手术指征仍应该严格掌握. 我们总结的适应证包括: (1)位于肝脏边缘外生型, 直径≥10 cm, 近期增大明显并且出现明显腹胀等临床症状, 可排除其他疾病引起者; 对于没有临床症状患者, 虽然血管瘤破裂很罕见[14], 如果患者从事剧烈运动仍建议手术治疗; (2)位于肝内但与血管关系不密切, 直径≥10 cm, 近期如出现增长明显有腰背酸痛等临床症状, 同时基本占据肝叶, 并对周围管道造成推移的, 可以考虑手术治疗; (3)紧邻肝门血管或位于尾叶, 直径≥5 cm, 近期增长明显, 特别是年轻女性, 即使没有临床症状, 应尽早手术治疗; (4)合并凝血功能障碍(Kasabach-Merrit综合征)患者[15]; (5)合并肝硬化, 影像学表现不典型, 无法和肝癌鉴别者.
传统手术方式以血管瘤剥除术为主[16,17], 兼有部分非规则性肝切除术. 但随着血管瘤手术指征的越来越严格, 需要手术切除的血管瘤要么巨大占据多个肝段, 要么位置特殊与血管关系密切, 剥离时术中一旦分破菲薄的瘤包膜出血不易控制, 而且此时整个剥离创面大且均为供瘤支血管断端, 存在大量渗血的风险. 近年随着精准肝切除理念[18]及Fan[19]提出的循肝静脉肝切除手术技术的进步, 解剖性肝段切除目前可作为多种局限性肝脏病变外科治疗的首选[20]. 由于精准地将荷瘤肝段切除, 并不增加较多正常肝脏的损失. 相反, 由于是在正常肝段组织间隙的乏血管区离断, 避开丰富的血管瘤体, 使得处理更从容、出血更容易控制也更安全. 同时由于完整保留了余肝的回流血管, 所以最大程度的保证了余肝功能体积的最大化, 也更符合传统血管瘤手术避免损失周围正常肝组织的治疗理念. 有研究表明[21], 如术前ICG R15>20%的患者不适合采用精准肝切除治疗. 所以术前的肝脏储备评估对肝巨大血管瘤能否行精准肝切除治疗具有重要指导作用.
在本组术中通过与CT血管三维重建影像的反复比对, 明确预切除肝段的肝蒂. 经行肝蒂阻断可使瘤体瘪陷, 除可进一步明确了预切除肝段的表面边界外, 还可减少入肝血流阻断时间, 减少了正常肝组织的缺血再灌注损伤, 也进一步增加了操作空间. 而在切肝前采取术中超声明确主要肝静脉主干及分支的肝内走形, 术中结合频谱分析, 保证在切肝过程中能够清晰显露作为边界保留的肝静脉主干, 保障了余肝血液回流, 最大程度的保留了余肝功能体积. 使得全组术中无不可控大出血, 术后肝功能均很快恢复正常而无肝功能衰竭等严重并发症发生.
由于患者无胆道扩张等病理情况存在, 本组1例中央型巨大血管瘤虽经精细评估和操作, 仍发生术后胆漏并发症, 所以术中一定要注意胆道系统的保护, 尤其是在中央型巨大血管瘤肝内Glisson鞘不完整的情况. 除术前的MRCP评估, 常规在切除胆囊后经胆囊管造影检查. 术毕需经胆囊管注射亚甲蓝溶液检查肝断面, 必要时胆总管"T"管引流防止胆漏的发生.
由于对于肝巨大血管瘤病变, 精准肝段切除仍存在正常肝组织的损失, 特别是位于特殊部位肿瘤切除时间长, 失血量较多, 所以术后3 d连续予以羟乙基淀粉应用, 减少创面渗出[22]. 并在术后早期常规予以肠外联合肠内营养1 wk. 根据肝功能情况保肝等治疗. 1 wk内肝功能均恢复正常.
虽然尚缺乏大宗前瞻性的临床研究分析, 但在严格把握手术指征, 遵循精准肝切除理念以及个体化治疗原则的情况下, 精准肝切除在巨大肝血管瘤特别是特殊位置肝巨大血管瘤治疗中将发挥一定的作用.
肝血管瘤是一种常见的肝脏良性肿瘤, 其尸检发生率在0.40%-7.13%. 分为海绵状血管瘤、硬化性血管瘤、血管内皮细胞瘤、毛细血管瘤四类. 临床常见的是海绵状血管瘤.
金山, 副主任医师, 内蒙古医学院附属医院普外科; 李永翔, 主任医师, 安徽医科大学第一附属医院普外科; 禹正杨, 副教授, 南华大学附属第一医院肿瘤外科
有研究表明, 如术前ICG R15>20%的患者不适合采用精准肝切除治疗.
对于基本占据肝叶及多肝段的巨大血管瘤可在严格把握适应证的情况下, 可行精准的肝段切除术治疗.
论文选题有一定创新, 内容对肝血管瘤的外科治疗有一定参考价值.
编辑:李薇 电编:何基才
| 1. | Ishak KG, Rabin L. Benign tumors of the liver. Med Clin North Am. 1975;59:995-1013. [PubMed] [DOI] |
| 2. | Terkivatan T, Vrijland WW, Den Hoed PT, De Man RA, Hussain SM, Tilanus HW, IJzermans JN. Size of lesion is not a criterion for resection during management of giant liver haemangioma. Br J Surg. 2002;89:1240-1244. [PubMed] |
| 3. | Smyrniotis V, Kostopanagiotou G, Theodoraki K, Tsantoulas D, Contis JC. The role of central venous pressure and type of vascular control in blood loss during major liver resections. Am J Surg. 2004;187:398-402. [PubMed] [DOI] |
| 4. | Takasaki K. Glissonean pedicle transection method for hepatic resection: a new concept of liver segmentation. J Hepatobiliary Pancreat Surg. 1998;5:286-291. [PubMed] [DOI] |
| 5. | Nakamura T, Tanaka K, Kiuchi T, Kasahara M, Oike F, Ueda M, Kaihara S, Egawa H, Ozden I, Kobayashi N. Anatomical variations and surgical strategies in right lobe living donor liver transplantation: lessons from 120 cases. Transplantation. 2002;73:1896-1903. [PubMed] [DOI] |
| 6. | Belghiti J, Guevara OA, Noun R, Saldinger PF, Kianmanesh R. Liver hanging maneuver: a safe approach to right hepatectomy without liver mobilization. J Am Coll Surg. 2001;193:109-111. [PubMed] [DOI] |
| 9. | Xu LN, Huang ZQ. Resection of hepatic caudate lobe hemangioma: experience with 11 patients. Hepatobiliary Pancreat Dis Int. 2010;9:487-491. [PubMed] |
| 10. | Gourgiotis S, Moustafellos P, Zavos A, Dimopoulos N, Vericouki C, Hadjiyannakis EI. Surgical treatment of hepatic haemangiomas: a 15-year experience. ANZ J Surg. 2006;76:792-795. [PubMed] [DOI] |
| 11. | Seo HI, Jo HJ, Sim MS, Kim S. Right trisegmentectomy with thoracoabdominal approach after transarterial embolization for giant hepatic hemangioma. World J Gastroenterol. 2009;15:3437-3439. [PubMed] [DOI] |
| 13. | Erdogan D, Busch OR, van Delden OM, Bennink RJ, ten Kate FJ, Gouma DJ, van Gulik TM. Management of liver hemangiomas according to size and symptoms. J Gastroenterol Hepatol. 2007;22:1953-1958. [PubMed] [DOI] |
| 14. | Jr MA, Papaiordanou F, Gonçalves JM, Chaib E. Spontaneous rupture of hepatic hemangiomas: A review of the literature. World J Hepatol. 2010;2:428-433. [PubMed] [DOI] |
| 15. | Concejero AM, Chen CL, Chen TY, Eng HL, Kuo FY. Giant cavernous hemangioma of the liver with coagulopathy: adult Kasabach-Merritt syndrome. Surgery. 2009;145:245-247. [PubMed] [DOI] |
| 16. | 李 国威, 杨 少毅. 肝脏海绵状血管瘤剥离术及组织、解剖学基础. 中华普通外科学文献(电子版). 2010;4:194-196. |
| 17. | Singh RK, Kapoor S, Sahni P, Chattopadhyay TK. Giant haemangioma of the liver: is enucleation better than resection? Ann R Coll Surg Engl. 2007;89:490-493. [PubMed] [DOI] |
| 19. | Fan ST. Precise hepatectomy guided by the middle hepatic vein. Hepatobiliary Pancreat Dis Int. 2007;6:430-434. [PubMed] |
| 20. | Ueno S, Kubo F, Sakoda M, Hiwatashi K, Tateno T, Mataki Y, Maemura K, Shinchi H, Natsugoe S, Aikou T. Efficacy of anatomic resection vs nonanatomic resection for small nodular hepatocellular carcinoma based on gross classification. J Hepatobiliary Pancreat Surg. 2008;15:493-500. [PubMed] [DOI] |