修回日期: 2011-08-24
接受日期: 2011-09-01
在线出版日期: 2011-09-08
目的: 检测胃癌患者及健康者血清可溶性E钙粘蛋白(sE-Cadherin)浓度; 探讨sE-Cadherin浓度与胃癌临床病理学及生存期之间的关系.
方法: 收集2003-03/2004-09 127例胃癌患者术前及31例健康者外周血标本, 用酶联免疫吸附双抗体夹心法检测sE-Cadherin浓度, 所有胃癌患者均接受手术治疗, 收集癌组织临床病理学数据, 并随访获得生存期.
结果: 127 例胃癌患者 sE-Cadherin浓度为43.83 μg/L±15.77 μg/L, 31例健康者为17.17 μg/L±5.38 μg/L, 前者显著高于后者(P = 0.000, t = 8.34), sE-Cadherin浓度与胃癌分化程度、浸润深度、淋巴结转移密切相关(P<0.05), sE-Cadherin浓度较低者具有显著的生存优势(P<0.01), 且独立于浸润深度、淋巴结转移及分化程度.
结论: sE-Cadherin可作为一种新的辅助胃癌诊断, 评价病变程度及判断预后的血清学指标.
引文著录: 赵越, 周永宁, 冉俊涛, 邹邵静, 李强, 陈兆锋. 血清可溶性E钙粘蛋白与胃癌生物学行为的关系. 世界华人消化杂志 2011; 19(25): 2668-2672
Revised: August 24, 2011
Accepted: September 1, 2011
Published online: September 8, 2011
AIM: To measure serum levels of soluble E-cadherin (sE-cadherin) in patients with gastric cancer and to evaluate the relationship of serum levels of sE-cadherin with tumor clinicopathological features and patient survival.
METHODS: Peripheral blood samples were collected from 127 gastric cancer patients and 31 healthy controls from March 2003 to September 2004. Serum levels of sE-cadherin were measured using double-antibody sandwich enzyme-linked immunosorbent assay. The clinical pathological data and survive data for all patients were recorded.
RESULTS: Serum levels of sE-cadherin were significantly higher in patients with gastric cancer than in healthy controls (43.83 μg/L ± 15.77 μg/L vs 17.17 μg/L ± 5.38 μg/L, P = 0.000, t = 8.34). Serum levels of sE-cadherin were closely associated with tumor differentiation, depth of invasion and lymph node metastasis (all P < 0.05). Patients with lower levels of serum sE-cadherin had significant survival advantage over those with higher levels of serum sE-cadherin (P < 0.001), and such survival advantage was independent of depth of invasion, lymph node metastasis and tumor differentiation.
CONCLUSION: sE-cadherin may serve as a potential biological marker for the diagnosis and prognosis of gastric cancer.
- Citation: Zhao Y, Zhou YN, Ran JT, Zou SJ, Li Q, Chen ZF. Clinical significance of serum levels of soluble E-cadherin in patients with gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2011; 19(25): 2668-2672
- URL: https://www.wjgnet.com/1009-3079/full/v19/i25/2668.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i25.2668
黏附丧失是胃癌细胞侵袭生长的重要因素. 上皮细胞钙黏蛋白(E-Cadherin, E-Cad)所介导的黏附系统早已被公认为"浸润抑制系统", 但关于其降解片段-血清可溶性E钙粘蛋白(sE-Cadherin)与胃癌生物学行为间的关系研究尚少且结果不一, 本实验研究sE-Cadherin与胃癌生物学行为的关系.
清取自2003-03/2004-09兰州大学第一医院127例经病理确诊的胃癌患者及31例健康者(男22例, 女9例), 胃癌患者不合并其他恶性肿瘤, 均接受手术治疗, 收集术后临床病理资料, 男105例, 女22例, 年龄28-75(中位年龄59)岁; 浸润局限于黏膜或黏膜下层(T1)9例、至肌层(T2)43例、至浆膜层(T3)36例、至浆膜层以外者(T4)39例; 无淋巴结转移59例, 淋巴转移68例; 肿瘤低、中、高分化分别为64、41、22例. 并随访获5年生存期. sE-Cadherin定量检测ELISA试剂盒购自美国R&D Systems Inc, 酶标仪(Powerwave X Bio-tek Instruments Inc, 美国)、微量离心机(BECKMAN Microfuge lite, 美国)、超净水机(MILLIPORE water purification systems, 日本)均由兰大一院中心实验室提供.
胃癌患者及健康者基础代谢状态下采集患者末梢静脉3mL, 即刻分离血清, -70 ℃保存. 每份血样重复检测2次. sE-Cadherin检测采用ELISA双抗体夹心法: 96孔板预包被E-Cadherin特异性鼠抗人单克隆抗体, 加入20倍稀释血样和标准品, 反应后洗涤去除未结合标本; 加入酶标E-Cadherin特异性抗体反应后洗涤去除未反应酶标抗体; 加入底物显色; 30 min内测定各标本光密度值(波长450nm, 参考波长570nm); 通过标准品曲线得出待测血样中sE-Cadherin浓度.
统计学处理 采用SPSS15.0软件统计, sE-Cadherin与胃癌临床病理学的关系用t检验, 与患者生存期之间的关系用Kaplan-meier曲线分析, Log-rank检验. 多因素生存分析用Cox回归分析法. 均以P<0.05为有统计学意义.
127例胃癌患者sE-Cadherin 浓度为43.83 µg/L±15.77 µg/L. 31例健康者sE-Cadherin浓度为17.17 µg/L±5.38 µg/L, 胃癌患者 sE-Cadherin浓度显著高于健康者(t = 8.34, P = 0.000).
sE-Cadherin 浓度与淋巴结转移、分化程度和浸润深度密切相关(P<0.05), 而与年龄、性别无关(P>0.05, 表1).
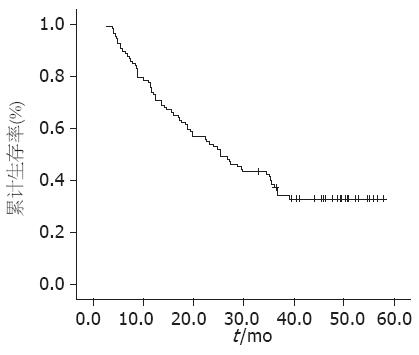
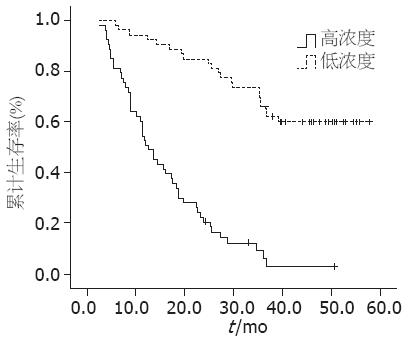
到随访结束时, 获得127例患者中106例的生存期数据, 21例失访, 失访率为16.54%, 所得数据中, 生存期为2.6-57.87 mo, 平均为27.03 mo±16.42 mo, 半数生存期为28 mo, 3年生存率为44.2%, 5年生存率为39.6%(图1). 以sE-Cadherin浓度中位数41.04 µg/L将106例分为低浓度组和高浓度组, 每组各53例. 应用 Kaplan-Meier 生存分析显示: sE-Cadherin浓度(图2)与生存期密切相关(P = 0.000), 浓度较低组具有显著的生存优势. COX多因素生存分析显示: sE-Cadherin浓度与生存期密切相关(P<0.05), 并且是独立于胃癌分化程度、浸润深度及淋巴结转移的生存预测因素.
sE-Cadherin相对分子质量为80 000-84 000 Da, 首先由Damsky等于1983年在人乳腺癌细胞MCF-7无血清培养液中发现. Katayama等于1994年首先发现癌症患者血清中也存在这个片段, 并且较正常人水平高. sE-Cadherin一经发现就引起了广泛关注, 试图探讨其作为一种肿瘤诊断及预后判断的新指标. 现已发现sE-Cadherin浓度在膀胱癌[1]、非小细胞肺癌[2]、肝癌[3]、皮肤黑素瘤[4]、乳腺癌[5]等恶性肿瘤均明显的升高, 我们的实验表明胃癌患者sE-Cadherin浓度明显高于正常人, 且与胃癌的浸润深度、淋巴结转移成正相关, 而与分化程度呈负相关. 有实验证明, sE-Cadherin浓度与膀胱癌的临床病理学间也有类似的关系[6], sE-Cadherin浓度还是预测胃癌手术复发的敏感指标[7].
E-Cadherin作为重要的细胞黏附分子, 存在于上皮细胞膜上, 为Ⅰ型跨膜糖蛋白, 在建立与保持上皮细胞极性和细胞细胞紧密连接中起到关键的作用. 其相对分子质量为120 000 Da, 由细胞外肽段、跨膜区和细胞内肽段构成. 其胞外部分含5个(E-Cadherin1-E-Cadherin5)重复的结构域(motif), 每个结构域含一个由组氨酸-精氨酸-缬氨酸(histidine arginine valine, HAV)组成的模体, 长度约为110个氨基酸. E-Cadherin跨膜、胞内段主要与连接素(catenin)结合, 从而形成完整的E-Cadherin/catenin复合体. Catenin是与E-Cadherin关系最为密切的细胞质黏附相关蛋白, 主要包括α、β和γ-Catenin. E-Cadherin的嗜同性特异黏附作用主要是细胞间的E-Cadherin的胞外段共同形成"拉链(Zipper)"结构的黏附连接.
健康个体无论性别和年龄, 代谢过程中E-Cadherin可通过降解产生少量的sE-Cadherin, 在血清中可微量检测. 恶性肿瘤的病理过程中, 快速的细胞增殖和生长可引起 E-Cadherin代谢和蛋白降解作用加快, 从而导致sE-Cadherin浓度升高. 实验证明, 恶性肿瘤的病理过程中, sE-Cadherin浓度的升高常常伴随着基质金属蛋白酶(matrix metalloproteinases, MMPs)的过表达[8], 进一步研究发现, MMPs是降解E-Cadherin蛋白的关键分子[9], 他作用于E-Cadherin蛋白胞外段根部, 发挥蛋白水解作用, 产生蛋白质片段(E-Cadherin1-E-Cadherin5及 E-Cadherin5和跨膜段胞外端之间的部分氨基酸残基, 共约含有545个氨基酸残基), 即sE-Cadherin. MMPs家族中又以MMP-7作用最为活跃[10]. 在体外培养的肿瘤细胞中加入MMP-7, 培养基中出现sE-Cadherin, 并且肿瘤细胞的浸润能力明显加强[10]. 在用博来霉素治疗后的野生型小鼠支气管肺泡灌洗液中可检测到sE-Cadherin, 而在同等条件下的MMP-7基因敲除小鼠的支气管肺泡灌洗液中却检测不到[11]. 因此证明MMP-7能以E-Cadherin为底物进行降解, 从而破坏细胞之间的正常连接, 导致细胞分散能力和肿瘤浸润能力增强. MMPS的调控机制复杂, Wnt/β-catenin信息通路起着非常重要的作用[12], β-catenin是Wnt/β-catenin信息通路的关键因子, 他具有双重作用: 在胞膜正常表达的β-catenin可与E-Cadherin结合形成复合体参与介导上皮细胞黏附, 保持细胞极性, 抑制肿瘤转移; 而进入胞质中的β-catenin如不能被及时分解, 将在胞质、胞核中积累及异常表达. 异常表达的β-catenin不但可以启动Wnt/β-catenin信息通路的下游靶基因, 从而上调MMPS[13], 还可以在细胞核内与TCF形成复合物, β-catenin/TCF复合物可作为转录因子上调MMPs表达, 后者可降解E-Cadherin蛋白[14]. TGF-β通过 TGF-β/Smad通路中的Smad7介导降解细胞膜上的β-catenin并造成β-catenin在胞质中的积累[15]. 此外, MMPs的活性增强还与MMP与组织抑制因子(tissue inhibitor of metalloproteinase, TIMP)之间的比例失衡密切相关[16]. 因此, sE-Cadherin浓度增高意味着组织E-Cadherin蛋白降解增加, 而E-Cadherin蛋白作为重要的黏附分子与胃癌的分化、转移及患者生存期密切相关[17]. 另外, sE-Cadherin还有其独特的作用: 可与相邻细胞E-Cadherin胞外段结合, 抑制细胞黏附, 并引起异常信号传导, 进一步提高肿瘤细胞浸润转移能力[18]. 但也有学者[19]对81例胃癌患者进行研究, 结果发现sE-Cadherin浓度较健康者明显升高, 但是与胃癌临床病理学仅有相互关联的趋势, 却无统计学差异. 这可能是因为样本小导致了较大抽样误差所致, 有待于扩大样本进一步研究.
sE-Cadherin浓度增高不仅意味着组织E-Cadherin蛋白降解增加, 细胞黏附作用下降, 而且还可通过与相邻细胞E-Cadherin胞外段结合, 进一步抑制细胞黏附, 引起细胞间异常的信号传导, 从而导致了胃癌细胞的异常分化和浸润转移, 而这正是影响患者生存期的主要因素. 我们对获得随访的106例应用Kaplan-Meier曲线和Cox多元回归方法进行分析, 结果表明sE-Cadherin是一种独立的生存预后因素, 其浓度与生存期密切相关, 浓度较低者具有显著的生存优势, 这与Chan等[20]的研究结果一致.
总之, 本实验发现, 胃癌患者sE-Cadherin浓度显著高于健康者, sE-Cadherin浓度与胃癌的浸润深度、淋巴结转移成正相关, 而与分化程度呈负相关, 并与患者生存期密切相关, 是独立于浸润深度、淋巴结转移及分化程度的生存预后因素, sE-Cadherin可作为一种新的辅助胃癌诊断, 评价病变程度及判断预后的血清学指标.
胃癌是严重威胁人类健康的疾病, 其发生、发展的机制尚不十分清楚, 目前可作为胃癌诊断及疗效观察、判断预后的指标较少, 因此有必要寻找可作为胃癌诊断及疗效观察, 对监测肿瘤转移、复发、预后具有意义的新指标.
王小众, 教授, 福建医科大学附属协和医院消化内科
黏附丧失是恶性肿瘤细胞具备侵袭性生长的主要因素, E-cadherin作为一种重要的细胞黏附分子, 已经发现与多种恶性肿瘤的生物学行为密切相关, 其在恶性肿瘤中异常表达的分子机制已成为目前研究热点之一.
E钙粘蛋白所介导的黏附系统已被公认为"浸润抑制系统", 但关于其降解片段-血清可溶性E钙粘蛋白(sE-Cadherin)与胃癌生物学行为间的关系研究尚少且结果不一, 本实验研究了sE-Cadherin与胃癌生物学行为的关系.
寻找可作为胃癌诊断及疗效观察, 有助于胃癌患者病情动态分析, 对监测肿瘤转移、复发、预后、指导临床治疗具有意义的新指标.
本文对胃癌患者血清可溶性E钙粘蛋白进行检测, 结果对胃癌的临床诊断具有一定辅助价值.
编辑:李军亮 电编:何基才
| 1. | Jäger T, Becker M, Eisenhardt A, Tilki D, Tötsch M, Schmid KW, Romics I, Rübben H, Ergün S, Szarvas T. The prognostic value of cadherin switch in bladder cancer. Oncol Rep. 2010;23:1125-1132. [PubMed] |
| 2. | Gogali A, Charalabopoulos K, Zampira I, Konstantinidis AK, Tachmazoglou F, Daskalopoulos G, Constantopoulos SH, Dalavanga Y. Soluble adhesion molecules E-cadherin, intercellular adhesion molecule-1, and E-selectin as lung cancer biomarkers. Chest. 2010;138:1173-1179. [PubMed] [DOI] |
| 3. | Soyama A, Eguchi S, Takatsuki M, Kawashita Y, Hidaka M, Tokai H, Nagayoshi S, Mochizuki S, Matsumoto S, Hamasaki K. Significance of the serum level of soluble E-cadherin in patients with HCC. Hepatogastroenterology. 2008;55:1390-1393. [PubMed] |
| 4. | George E, Polissar NL, Wick M. Immunohistochemical evaluation of p16INK4A, E-cadherin, and cyclin D1 expression in melanoma and Spitz tumors. Am J Clin Pathol. 2010;133:370-379. [PubMed] [DOI] |
| 5. | Najy AJ, Day KC, Day ML. The ectodomain shedding of E-cadherin by ADAM15 supports ErbB receptor activation. J Biol Chem. 2008;283:18393-18401. [PubMed] [DOI] |
| 6. | Shi B, Laudon V, Yu S, Dong D, Zhu Y, Xu Z. E-cadherin tissue expression and urinary soluble forms of E-cadherin in patients with bladder transitional cell carcinoma. Urol Int. 2008;81:320-324. [PubMed] [DOI] |
| 7. | Chan AO, Chu KM, Lam SK, Cheung KL, Law S, Kwok KF, Wong WM, Yuen MF, Wong BC. Early prediction of tumor recurrence after curative resection of gastric carcinoma by measuring soluble E-cadherin. Cancer. 2005;104:740-746. [PubMed] [DOI] |
| 8. | Zhou Y, Li G, Wu J, Zhang Z, Wu Z, Fan P, Hao T, Zhang X, Li M, Zhang F. Clinicopathological significance of E-cadherin, VEGF, and MMPs in gastric cancer. Tumour Biol. 2010;31:549-558. [PubMed] [DOI] |
| 9. | Delassus GS, Cho H, Hoang S, Eliceiri GL. Many new down- and up-regulatory signaling pathways, from known cancer progression suppressors to matrix metalloproteinases, differ widely in cells of various cancers. J Cell Physiol. 2010;224:549-558. [PubMed] [DOI] |
| 10. | Manicone AM, Huizar I, McGuire JK. Matrilysin (Matrix Metalloproteinase-7) regulates anti-inflammatory and antifibrotic pulmonary dendritic cells that express CD103 (alpha(E)beta(7)-integrin). Am J Pathol. 2009;175:2319-2331. [PubMed] [DOI] |
| 11. | Kitamura T, Biyajima K, Aoki M, Oshima M, Taketo MM. Matrix metalloproteinase 7 is required for tumor formation, but dispensable for invasion and fibrosis in SMAD4-deficient intestinal adenocarcinomas. Lab Invest. 2009;89:98-105. [PubMed] [DOI] |
| 12. | Zuidervaart W, Pavey S, van Nieuwpoort FA, Packer L, Out C, Maat W, Jager MJ, Gruis NA, Hayward NK. Expression of Wnt5a and its downstream effector beta-catenin in uveal melanoma. Melanoma Res. 2007;17:380-386. [PubMed] [DOI] |
| 13. | Dilek FH, Topak N, Aktepe F, Sahin O, Türel KS, Sahin DA, Dilek ON. E-cadherin, beta-catenin adhesion complex and relation to matrilysin expression in pT3 rectosigmoid cancers. Pathol Res Pract. 2008;204:809-815. [PubMed] [DOI] |
| 14. | Du R, Xia L, Sun S, Lian Z, Zou X, Gao J, Xie H, Fan R, Song J, Li X. URG11 promotes gastric cancer growth and invasion by activation of beta-catenin signalling pathway. J Cell Mol Med. 2010;14:621-635. [PubMed] |
| 15. | Shafer SL, Towler DA. Transcriptional regulation of SM22alpha by Wnt3a: convergence with TGFbeta(1)/Smad signaling at a novel regulatory element. J Mol Cell Cardiol. 2009;46:621-635. [PubMed] [DOI] |
| 16. | Lukaszewicz-Zajac M, Mroczko B, Szmitkowski M. [The significance of metalloproteinases and their inhibitors in gastric cancer]. Postepy Hig Med Dosw (Online). 2009;63:258-265. [PubMed] |
| 17. | Czyzewska J, Guzińska-Ustymowicz K, Ustymowicz M, Pryczynicz A, Kemona A. The expression of E-cadherin-catenin complex in patients with advanced gastric cancer: role in formation of metastasis. Folia Histochem Cytobiol. 2010;48:37-45. [PubMed] [DOI] |
| 18. | Pedrazzani C, Caruso S, Corso G, Marrelli D, Neri A, Berardi A, Roviello F. Influence of age on soluble E-cadherin serum levels prevents its utility as a disease marker in gastric cancer patients. Scand J Gastroenterol. 2008;43:765-766. [PubMed] [DOI] |
| 19. | Gofuku J, Shiozaki H, Doki Y, Inoue M, Hirao M, Fukuchi N, Monden M. Characterization of soluble E-cadherin as a disease marker in gastric cancer patients. Br J Cancer. 1998;78:1095-1101. [PubMed] [DOI] |
| 20. | Chan AO, Chu KM, Lam SK, Wong BC, Kwok KF, Law S, Ko S, Hui WM, Yueng YH, Wong J. Soluble E-cadherin is an independent pretherapeutic factor for long-term survival in gastric cancer. J Clin Oncol. 2003;21:2288-2293. [PubMed] [DOI] |