修回日期: 2011-08-03
接受日期: 2011-09-01
在线出版日期: 2011-09-08
目的: 研究脱氧胆酸溶液灌肠对大鼠结肠敏感性和脊髓背根神经节上c-fos mRNA表达的影响.
方法: 以脱氧胆酸溶液连续灌肠3 d建立大鼠炎症后慢性内脏痛觉过敏模型, 在灌肠前及灌肠后第1, 2, 3, 4周采用结直肠扩张法(CRD)测定腹壁回撤反射(AWR)评分和内脏感觉压力阈值, 然后处死大鼠, 取出远端结肠组织, 行髓过氧化物酶(MPO)测定、HE染色和肥大细胞计数, 取脊髓背根神经节L5-S2用RT-PCR法测定c-fos mRNA的表达量.
结果: 灌肠后第1, 2, 3, 4周, 在20, 40 mmHg压力下, AWR评分实验组与对照组相比差异无统计学意义, 而在60 mmHg以上, 实验组AWR评分均明显高于对照组(60 mmHg: 3.54±0.17 vs 3.31±0.23, 3.58±0.17 vs 2.96±0.44, 3.53±0.14 vs 3.07±0.30, 3.60±0.13 vs 3.03±0.33, 均P<0.05), 且腹部抬起和骨盆抬起压力阈值实验组均低于对照组(P<0.05); 灌肠后第2, 3周, MPO值实验组高于对照组(0.39±0.12 vs 0.12±0.05, 0.40±0.08 vs 0.12±0.05, 均P<0.05), 而第1, 4周, 两组间差异无统计学意义. 灌肠后1w, 实验组肥大细胞计数明显高于对照组(4.20±1.87 vs 1.10±0.74, P<0.05).在第1周, c-fos mRNA的表达量实验组明显高于对照组(0.74±0.04 vs 0.68±0.02, P<0.05).
结论: DCA溶液反复灌肠诱导了大鼠短暂轻微的结肠炎症和持续稳定的内脏痛觉过敏, 并且增加了脊髓背根神经节上c-fos mRNA的表达. DCA可能在某些肠易激综合征的痛觉过敏中发生作用.
引文著录: 王劲松, 余保平, 胡柳丹, 张丽静, 田亭亭. 脱氧胆酸溶液灌肠对大鼠内脏敏感性及脊髓c-fos mRNA表达的影响. 世界华人消化杂志 2011; 19(25): 2629-2636
Revised: August 3, 2011
Accepted: September 1, 2011
Published online: September 8, 2011
AIM: To investigate the effect of rectal instillation of deoxycholic acid solution (DAS) on colorectal visceral sensitivity and the expression of c-fos mRNA in the spinal dorsal horn in rats.
METHODS: Rat models were established by giving a rectal perfusion of DSA for 3 days. Rectal distention test was performed to examine rectal sensitivity using AWR score and pressure threshold before and after treatment (1, 2, 3 and 4 wk). The distal colon was used for myeloperoxidase (MPO) assay, and histological examination and mast cell counting were performed after treatment. L5-S2 dorsal root ganglia (DRG) were taken to examine the expression of c-fos mRNA by RT-PCR.
RESULTS: The AWR score of the experiment group was increased in response to noxious intensities of CRD (60 mmHg) compared to the control group (1 wk: 3.54 ± 0.17 vs 3.31 ± 0.23, 2 wk: 3.58 ± 0.17 vs 2.96 ± 0.44, 3 wk: 3.53 ± 0.14 vs 3.07 ± 0.30, 4 wk: 3.60 ± 0.13 vs 3.03 ± 0.33, all P < 0.05), but not to innocuous intensities. DCA treatment significantly decreased pressure threshold of visceral perception at each time point after rectal perfusion in both groups (all P < 0.05). MPO activity was increased at weeks 2 and 3 (0.39 ± 0.12 vs 0.12 ± 0.05, 0.40 ± 0.08 vs 0.12 ± 0.05, both P < 0.05), but not at week 1 and week 4. The levels of c-fos mRNA and mast cell number were significantly increased at week 1 in the experimental group compared to the control group (c-fos mRNA: 0.74 ± 0.04 vs 0.68 ± 0.02; mast cell number: 4.20 ± 1.87 vs 1.10 ± 0.74, both P < 0.05).
CONCLUSION: Repetitive colorectal instillation of DCA induces mild, transient colonic inflammation, results in persistent visceral hyperalgesia and referred pain, and increases spinal c-fos mRNA expression in rats.
- Citation: Wang JS, Yu BP, Hu LD, Zhang LJ, Tian TT. Rectal instillation of deoxycholic acid solution enhances visceral hypersensitivity and up-regulates c-fos mRNA expression in the spinal dorsal horn in rats. Shijie Huaren Xiaohua Zazhi 2011; 19(25): 2629-2636
- URL: https://www.wjgnet.com/1009-3079/full/v19/i25/2629.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i25.2629
肠易激综合征(irritable bowel syndrome, IBS)一组多因素引起的慢性疾病, 多种因素可诱发其发作, 如饮食改变、生活方式改变、肠道感染、心理因素等[1]. 通常社会心理因素、胃肠道运动与分泌异常和内脏高敏感可导致IBS患者出现各种症状, 目前, 内脏高敏感的形成一般被认为是IBS的主要发病机制[2]. 在IBS的发病过程中, 大约有26%的患者在曾患过急性肠胃炎[3]. 炎症是否也参与了致敏过程也需进一步探索. Bourdu等[4]发现丁酸钠溶液直肠滴注可造成大鼠结肠感觉过敏, 但结肠不发生明显炎症反应, 不属于炎症后内脏敏感模型. 本研究以脱氧胆酸(deoxycholic acid, DCA)溶液灌肠建立大鼠PI-IBS结肠感觉过敏模型, 观察其内脏感觉功能和结肠黏膜改变, 并进一步研究脊髓背根神经节上c-fos mRNA的表达量.
DCA购自Sigma公司. 髓过氧化物酶(myeloperoxidase, MPO)试剂盒购自南京建成生物工程研究所. Kreb's溶液成分(mmol/L): NaCl, 122; KCl, 3.5; NaHCO3, 25; KH2PO4, 1.2; MgCl2, 1.2; 4 mmol/L DCA用Kreb's溶液配制, 用HCl调pH至7.4. 引物设计参考文献[5], c-fos上游引物: 5'-ATGATGTTCTCGGGTTTCAA-3', 下游引物: 5'-TGACATGGTCTTCACCAC TC-3', 扩增片段348 bp; β-actin上游引物: 5'-TCATGAAGTGTGACGTTGACATCCGT-3', 下游引物: 5'-CCTAGA AGCATTTGCGGTGCACGATG-3', 扩增片段285 bp, 引物由英淮捷基(上海)贸易有限公司合成.
1.2.1 分组及模型制备[6]: 成年♂清洁级SD大鼠20只, 体质量250-300 g, 健康活泼, 由武汉大学人民医院动物中心提供, 动物使用许可证号: SYXK(鄂)2008-0013. 分笼饲养, 每笼5只, 自由进食和进水. 饲养环境为: 温度20 ℃-25 ℃, 湿度40%-60%. 按完全随机的方法将20只大鼠分成实验组和对照组, 每组10只. 经大鼠肛门插入导管至距肛门6 cm处, 实验组注入1 mL 4 mmol/L的DCA溶液, 对照组注入1 mL生理盐水, 每天1次(09:00), 连续3 d, 每次注药后大鼠保持头低位5 min, 避免灌肠液从肛门溢出.
1.2.2 内脏感觉功能测定: 采用结直肠扩张(colo rectal distension, CRD)法, 以腹壁回撤反射(abdominal withdrawl reflex, AWR)评分[7]和内脏感觉压力阈值来反映内脏感觉功能. (1)AWR评分. 在灌肠前3 d及灌肠后第1, 2, 3, 4周, 用Braun 8F带气囊导尿管外涂石蜡油后经肛门插入经三通管与血压计和注射器相连, 将表面涂有石蜡油的带气囊导尿管经肛门插至距肛门6 cm, 用胶布固定导尿管于大鼠尾根部, 将大鼠置入20 cm×8 cm×7 cm的透明盒内, 随机时相快速注气, 两名观察者分别在20, 40, 60, 80 mmHg的压力下同步观察AWR并评分, 最后取平均值, 评分标准: 0分, 对扩张无反应; 1分, 仅出现短暂、轻微的头部运动; 2分, 腹部肌肉收缩; 3分, 腹部上抬; 4分, 身体呈弓状, 胯部上抬. 每一压力维持30 s, 重复3次, 每次间隔3 min; (2)内脏感觉压力阈值. 缓慢向气囊内注气, 观察大鼠的反应, 记录腹部抬起的压力阈值和骨盆抬起的压力阈值.
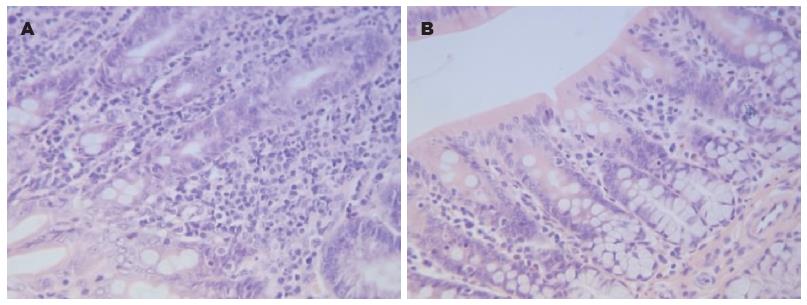
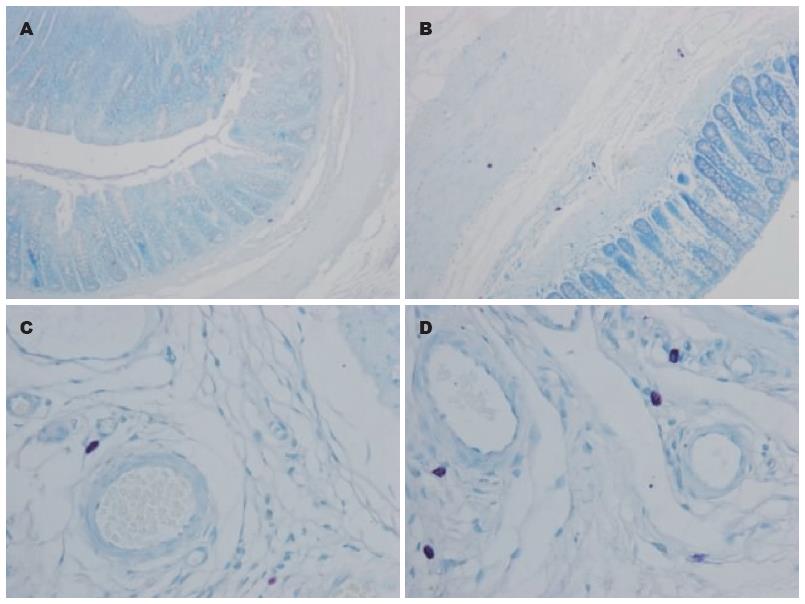
1.2.3 结肠黏膜炎症评估: (1)组织学检查. 内脏感觉功能测定完后, 处死大鼠, 取耻骨联合附近新鲜结肠组织, 其近端用4%甲醛固定, 石蜡包埋、切片, 行苏木素-伊红(HE)染色, 光镜下观察结肠黏膜组织学改变; (2)MPO活力测定. 取耻骨联合附近的新鲜结肠组织5 cm, 其远端用生理盐水简单冲洗, 剪成碎片, -80 ℃冻存, 48 h后取冻存结肠组织称重, 在4 ℃下制成匀浆, 按MPO试剂盒说明书测定灌肠后各周结肠组织MPO活力, 并换算成酶活性单位(MPO单位/g湿片). (3)肥大细胞计数. 结肠组织用4%甲醛固定, 石蜡包埋、切片后采用改良甲苯胺蓝染色法[8]计数肥大细胞, 普通光镜下每张切片随机选取3个低倍视野(×100)对黏膜下层肥大细胞进行计数, 取其平均值, 然后在高倍镜下(×400)观察肥大细胞形态.
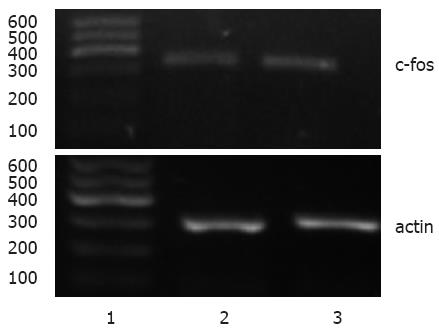
1.2.4 脊髓背根神经节c-fos mRNA的表达: 取大鼠背根神经节L5-S2节段, 匀浆, 加1 mL TRIzol试剂提取总RNA, 利用RT-PCR法测定c-fos mRNA的表达量, c-fos扩增条件: 94 ℃预变性3 min, 然后94 ℃ 20 s, 65 ℃ 30 s, 72 ℃ 1 min, 共33个循环, 72 ℃再延伸10 min终止反应. β-actin扩增条件: 94 ℃预变性5 min, 然后94 ℃ 45 s, 56 ℃ 45 s, 72 ℃ 45 s, 共30个循环, 72 ℃再延伸7 min终止反应. 产物行琼脂糖凝胶电泳, 密度扫描, 用其灰度值与对应的β-actin灰度值的比值进行比较.
统计学处理 计量资料用mean±SD表示, 以Friedman检验对不同压力的AWR评分进行相关性分析, 有统计学意义时采用单因素方差分析分别比较每个组灌肠前后各周AWR评分的差异, 方差齐时进一步采用最小显著差法(LSD)行两两比较, 方差不齐则采用Dunnett's T3进行两两比较; 相同时间相同CRD压力下的实验组与对照组的AWR评分、内脏感觉压力阈值和MPO活力、肥大细胞计数及两组间c-fos mRNA相对表达量比较均采用t检验, P<0.05为差异有统计学意义. 所有资料应用SPSS17.0统计软件分析.
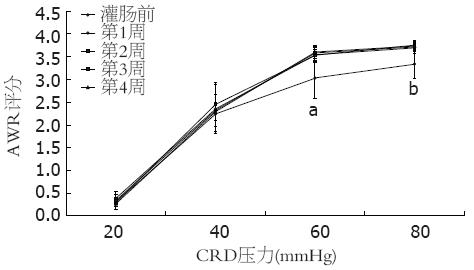
灌肠前3 d, AWR评分随着扩张压力的增大而增高(Friedman检验, χ2 = 53.82, P<0.01), 表明CRD压力与AWR评分间存在相关性, 灌肠前两组大鼠的AWR评分的差异无统计学意义(均P>0.05), 灌肠后, 在20, 40 mmHg的扩张压力下, 两组间AWR评分的差异无统计学意义(均P>0.05), 而在60, 80 mmHg的压力下, 实验组的AWR评分均比对照组高, 差异有统计学意义(均P<0.01, 表1). 实验组灌肠后第1, 2, 3, 4周在60, 80mmHg压力下AWR评分均比灌肠前高, 差异有统计学意义(60 mmHg: P = 0.044, 0.029, 0.045, 0.022, 均P<0.05; 80 mmHg: P = 0.048, 0.032, 0.017, 0.025, 均P<0.05), 而在20, 40 mmHg压力下与灌肠前相比差异无统计学意义(均P>0.05, 图1).
| 时间 | n | 20 mmHg | 40 mmHg | 60 mmHg | 80 mmHg |
| 灌肠前 | |||||
| 实验组 | 10 | 0.31±0.10 | 2.24±0.39 | 3.03±0.44 | 3.34±0.31 |
| 对照组 | 10 | 0.33±0.14 | 2.27±0.41 | 3.13±0.32 | 3.37±0.18 |
| 第1周 | |||||
| 实验组 | 10 | 0.39±0.14 | 2.35±0.53 | 3.54±0.17a | 3.70±0.13a |
| 对照组 | 10 | 0.28±0.10 | 2.18±0.34 | 3.31±0.23 | 3.48±0.12 |
| 第2周 | |||||
| 实验组 | 9 | 0.34±0.13 | 2.32±0.36 | 3.58±0.17a | 3.72±0.10a |
| 对照组 | 9 | 0.36±0.13 | 2.13±0.41 | 2.96±0.44 | 3.41±0.21 |
| 第3周 | |||||
| 实验组 | 8 | 0.30±0.08 | 2.45±0.48 | 3.53±0.14a | 3.76±0.09a |
| 对照组 | 8 | 0.26±0.13 | 1.99±0.52 | 3.07±0.30 | 3.46±0.23 |
| 第4周 | |||||
| 实验组 | 7 | 0.27±0.13 | 2.29±0.20 | 3.60±0.13a | 3.74±0.11a |
| 对照组 | 7 | 0.37±0.12 | 2.02±0.49 | 3.03±0.33 | 3.24±0.21 |
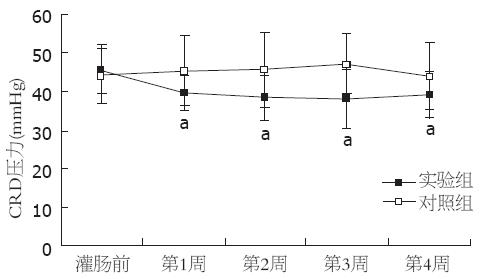
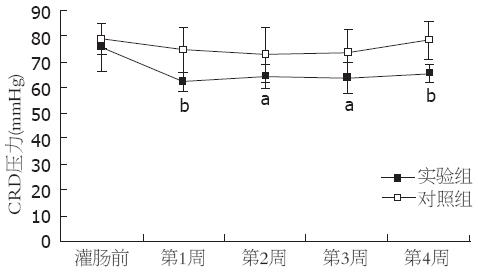
灌肠后第1, 2, 3, 4周, 实验组腹部抬起和骨盆抬起的压力阈值均低于对照组, 差异有统计学意义(腹部抬起: 37.60±3.78 vs 45.40±8.95, 38.00±5.66 vs 46.11±9.03, 37.25±6.78 vs 47.13±6.56, 39.43±4.89 vs 46.14±6.36, 均P<0.05; 骨盆抬起: 62.40±3.63 vs 74.60±8.64, 64.00±4.36 vs 72.89±9.85, 63.88±5.14 vs 73.13±7.70, 63.86±3.29 vs 76.71±5.56, 均P<0.05, 图2, 3).
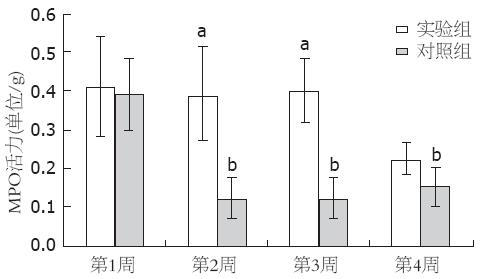
灌肠后第2, 3周MPO活性实验组均比对照组高, 差异有统计学意义(0.39±0.12 vs 0.12±0.05, 0.40±0.08 vs 0.12±0.05, n = 4, 均P<0.05), 而第1, 4周两组间MPO活性差异无统计学意义(0.40±0.13 vs 0.39±0.09, 0.22±0.04 vs 0.15±0.05, n = 4, 均P>0.05), 对照组第1周MPO活性高于第2, 3, 4周, 差异有统计学意义(0.39±0.09 vs 0.12±0.05, 0.12±0.05, 0.15±0.05, P<0.05, 图4).
灌肠后前2 wk, 实验组远端结肠组织可见黏膜上皮增生, 黏膜层可见少许炎性细胞浸润, 在后2 wk, 炎症逐渐消退, 未见明显充血及炎性细胞浸润(图5).
高倍镜下(×400), 肥大细胞主要散在分布于黏膜下层, 靠近血管周围, 经改良甲苯胺蓝染色肥大细胞颗粒呈紫红色, 细胞形态多样化, 可呈圆形、梭形或不规则形. 灌肠后1 wk, 实验组肥大细胞计数明显高于对照组, 差异有统计学意义(4.20±1.87 vs 1.10±0.74, P<0.05, 图6).
灌肠后1 wk, 实验组c-fos mRNA的相对表达量为0.74±0.04, 对照组相对表达量为0.68±0.02, 两组间差异有统计学意义(n = 4, P<0.05, 图7).
IBS是一种临床上常见的功能性肠病, 常伴有腹痛或腹部不适, 目前认为, 内脏高敏感的形成对IBS的病理生理学和症状的发生至关重要, 这种高敏感状态包括对伤害性刺激敏感性的增强和反应阈值的降低(痛觉过敏)和在正常生理状态下不引起痛觉的刺激诱发的疼痛(异常痛觉). 内脏高敏感的出现可能部分与支配胃肠道的初级传入神经纤维致敏有关, 部分可能也存在着中枢致敏, 其产生机制可能部分是由于支配胃肠道的初级传入纤维致敏所致[9]. 研究发现, 内脏高敏感性与肠道感染或炎症有着一定的关系[10]. 目前, 一般认为肥大细胞数量的异常改变以及介质的释放与IBS患者腹痛感觉密切相关[11], 肠黏膜中的肥大细胞主要位于黏膜血管、淋巴和神经附近, 是肠道主要的抗原感受器, 既具有免疫活性, 又能分泌多种介质[12], 在IBS的发病中可能承担着连接免疫机制和神经机制中间环节的作用.
DCA是一种非结合性次级胆汁酸, 是由甘氨胆酸和牛磺胆酸在肠道的厌氧菌发酵作用下产生, 他可以促进脂肪分解以利于小肠吸收. 然而高浓度的DCA是一种毒素, 他可以增加结肠黏膜的通透性, 诱导炎症产生[13]. 有研究发现, 胆盐吸收不良患者其肠道内胆汁酸浓度增高, 可引起炎症后IBS[14].
本研究参考Traub等[6]的方法采用DCA溶液灌肠诱导大鼠炎症后内脏痛觉过敏, 观察DCA溶液灌肠对大鼠结肠黏膜及感觉功能的影响. 本研究以结肠组织HE染色和MPO活性反应结肠炎症变化, 结果显示, DCA灌肠后前2 wk, HE染色高倍镜下可见结肠黏膜组织轻微的炎症改变, 到后2 wk炎症逐渐消退. MPO是与中性粒细胞脱颗粒相关的一种酶, MPO活性的测定被广泛应用于评价肠道的炎症程度, 是一种重要的炎症标志物. 本实验MPO活性测定显示DCA灌肠后前3 wk MPO活性增高, 到第4周又降至对照组水平. 这些表明DCA溶液灌肠诱导了结肠黏膜短暂轻微的炎症. 对照组生理盐水灌肠后, 第1周MPO活力高于第2, 3, 4周, 可能与灌肠针、生理盐水等异物刺激肠道导致轻微短暂炎症有关. 肠道炎症时肠黏膜免疫系统被激活, 各种炎症细胞增加, 主要有肥大细胞、淋巴细胞、内分泌细胞等, 他们活化后分泌出一系列炎症介质, 作用于肠道的神经末梢和内分泌运动感受器, 最终导致肠道分泌功能、运动功能及内脏感知的改变[15]. 肠道炎症可促使肥大细胞活化并通过释放各种炎症介质致敏外周传入神经, 肥大细胞可能在初始炎症消退后仍然维持过度反应性.
肠道炎症可促使肥大细胞活化, 并通过释放组胺、前列腺素、肝素、5-HT、白三烯等各种炎症介质, 致敏外周传入神经, 这些物质大多具致痛作用, 可能与IBS患者消化道对痛觉的敏感性增高有关. 肥大细胞可能在初始炎症消退后仍然维持过度反应性. 本实验结果显示, 灌肠后1 wk, 实验组肥大细胞计数明显高于对照组. Ohaskik等[16]发现向肥大细胞基因敲除大鼠肠道注射2, 4, 6-三硝基苯磺酸并不像正常大鼠导致内脏敏感性增高, 亦提示了肥大细胞在内脏高敏感性形成中起到关键作用. Rijnierse等[17]发现在IBS患者肠道肥大细胞大多分布在黏膜及黏膜下神经附近, 肠道黏膜低度炎症会刺激神经元释放各种神经肽类物质, 并作用于肥大细胞, 使肥大细胞形态发生改变, 同时肥大细胞释放的生物活性因子通过P物质(substance P, SP)、降钙素基因相关肽(calcitonin gene related protein, CGRP)等可能作用肠道神经, 改变内脏感觉. 在肠神经元上已发现存在肥大细胞源性化学物质(如组胺和5-HT)的受体, 而肥大细胞表面也有一些神经肽受体. 一些神经肽如SP、CGRP、血管活性肠肽(vasoactive intestinal polypeptide, VIP)和神经紧张素(neurotensin)等, 可调节肠黏膜内和结缔组织内肥大细胞的活性. 这些都提示肥大细胞可能在脑和肠道之间起桥梁作用, 黏膜中的肥大细胞可能构成了神经-免疫轴和脑-肠轴间的桥梁[18]肥大细胞活化后通过脱颗粒可释放胞内的大量生物活性因子, 如组胺、5-HT、血小板活化因子(platelet activating factor, PAF)、前列腺素(prostaglandin, PG)、白三烯(leukotriene, LT)以及细胞因子等[19], 他们均是伤害感受性分子, 可直接作用于邻近的伤害感受性神经纤维, 直接或间接改变初级传入神经元的感觉阈值. 这些研究提示肥大细胞的浸润和或活性的增加均在内脏高敏发生中起重要作用. 本实验中肥大细胞计数的改变可能是两组大鼠间AWR评分、压力阈值、c-fos mRNA表达差异的基础, 因此肥大细胞数目改变可能是炎症促使IBS症状产生的重要中间环节.
AWR评分及压力阈值的测定可以看出, 灌肠前, 实验组与对照组的AWR评分及压力阈值两组间无明显差异, 灌肠后4 wk内, 在20, 40 mmHg的CRD扩张压力下, 实验组与对照组的AWR评分无明显差异, 然而在60, 80 mmHg的伤害性压力刺激下, AWR评分实验组均比对照组高, 表明DCA灌肠可能增加了结肠组织对伤害性刺激的敏感性, 导致了内脏痛觉过敏. 另外, 灌肠后4 wk内, 实验组腹部抬起和骨盆抬起的压力阈值均比对照组低. 虽然炎症是短暂性的, 但是却出现了持续稳定的内脏痛觉过敏. 与其他模型类似, 向大鼠结肠内注入酵母聚糖[20]、醋酸[21]、芥子油[22]、三硝基苯磺酸[23]等炎性化学物质, 均可引起肠道的炎症变化, 增加对伤害性刺激的反应性, 并在炎症消退后较长时间内仍可持续存在, 进一步表明了IBS内脏高敏感性与既往的肠道炎症可能有一定的关系. 肠道炎症可引起多种炎性介质的释放, 如前列腺素、5-HT、缓激肽、神经生长因子等, 可直接作用于初级感觉神经传入纤维, 或间接有肥大细胞启动活化和致敏的级联效应, 使伤害性感受器产生继发性过敏, 并使"睡眠型"受体复活[24]. 神经生理学研究表明, 支配胃肠道的内脏初级传入神经纤维很多都属于沉默型或睡眠型纤维, 大约有50%以上的黏膜机械感受器属于此类型. 炎症可恢复其活性, 产生初级传入纤维致敏, 从而增加对伤害刺激的敏感性, 同时使内脏感觉阈值下降. 然而, 肠道炎症导致内脏高敏感的具体机制尚未完全阐明, 有待进一步研究.
激活的初级传入纤维反过来也可以刺激中枢致敏, 传导腹痛症状的感觉神经元胞体位于脊髓背根神经节, 脊髓背角作为脑-肠轴的"中继站"是内脏敏感性调节的关键部位. c-fos被认为是一种即刻早基因, 机体受到伤害性刺激后诱导表达的c-fos蛋白主要出现在与痛觉传导有关的神经元细胞核内, 机体受到外界伤害性刺激后, 诱导表达的c-fos蛋白主要出现在与痛觉传递有关的神经元细胞核内, 因此表达产物被认为是伤害性感受神经元兴奋的标志物[25,26], 研究表明, 受到伤害性刺激时脊髓背角c-fos的表达增强[27]. 孙刚等[28]研究发现, 脊髓背角5-HT、c-fos的异常表达可能参与便秘型IBS大鼠内脏敏感性异常的调节. 还有研究[29]显示腹泻型IBS大鼠脊髓c-fos阳性神经元明显升高. 这些研究表明脊髓c-fos阳性神经元可能在神经信号传入过程中起放大信号作用. 本实验研究显示, 灌肠后1 wk, 给予伤害性CRD扩张压力刺激, 实验组脊髓背根c-fos的mRNA表达量比对照组高, 表明DCA灌肠可能增加了结肠对伤害性机械刺激的敏感性, 这可能与肠道致敏大鼠脊髓背角痛觉神经元接受过多的来自肠神经系统上传的伤害性信号有关, 脊髓背角的c-fos阳性痛觉神经元和来自下行通路的5-HT能神经纤维参与内脏敏感性的调控, 其结构和功能的异常可能是内脏敏感性异常的物质基础之一, DCA诱导的痛觉过敏可能涉及到中枢致敏. 这种中枢致敏机制可能与肥大细胞相关, 肥大细胞是胃肠道最主要的内分泌细胞, 被激活后可释放5-HT至黏膜固有层, 5-HT的释放过多可影响正常肠道蠕动和分泌功能, 增加肠黏膜通透性, 且可导致脊髓以及更高级的中枢神经系统对肠道刺激的敏感性增加, 从而产生腹痛、腹泻等症状[30]. 然而DCA导致的内脏痛觉过敏的具体机制尚不明确, 可能结肠炎症和神经免疫也参与了其中.
总之, 4 mmol/L的DCA溶液持续灌肠3 d, 可诱导结肠一过性轻微的炎症, 出现了持续稳定的内脏痛觉过敏, 在炎症消退后仍可维持这种痛觉过敏状态. 模拟了炎症后内脏痛觉过敏现象, 可作为一个模型研究IBS的病理生理机制. 另外, 胆汁吸收不良时, 肠道内胆汁酸浓度升高, 这与IBS发生之间是否存在相关性也有待进一步探索.
肠易激综合征(IBS)是临床上常见的功能性疾病, 其病因尚未完全明了, 目前认为炎症与肠易激综合征的发生有一定关系, 内脏高敏感是肠易激综合征重要病理生理学基础.
黄培林, 教授, 东南大学; 杜顺达, 副主任医师, 北京协和医院肝外科; 王悦华, 副主任医师, 首都医科大学宣武医院普外科
胆盐吸收不良经细菌转变成脱氧胆酸后刺激结肠分泌, 可能与IBS的发生有一定关系, 其具体机制尚需进一步研究.
近年来, 有学者研究报道脱氧胆酸灌肠可建立炎症后内脏痛觉过敏模型, 胆盐吸收不良可引起各型炎症后肠易激综合征.
在研究炎症后内脏痛觉过敏的基础上, 进一步探讨脱氧胆酸溶液对内脏敏感性及脊髓背根神经节上c-fos mRNA表达的影响.
脱氧胆酸灌肠诱导了炎症后持续稳定的内脏高敏感状态, 为研究肠易激综合征提供了较好的动物模型, 胆盐吸引不良与肠易激综合征的相关性有待进一步深入研究.
该动物模型与检测指标的结合, 具有新颖性, 是有一定可读性的基础研究.
编辑:李薇 电编:何基才
| 2. | Manabe N, Tanaka T, Hata J, Kusunoki H, Haruma K. Pathophysiology underlying irritable bowel syndrome--from the viewpoint of dysfunction of autonomic nervous system activity. J Smooth Muscle Res. 2009;45:15-23. [PubMed] [DOI] |
| 3. | Parry S, Forgacs I. Intestinal infection and irritable bowel syndrome. Eur J Gastroenterol Hepatol. 2005;17:5-9. [PubMed] [DOI] |
| 4. | Bourdu S, Dapoigny M, Chapuy E, Artigue F, Vasson MP, Dechelotte P, Bommelaer G, Eschalier A, Ardid D. Rectal instillation of butyrate provides a novel clinically relevant model of noninflammatory colonic hypersensitivity in rats. Gastroenterology. 2005;128:1996-2008. [PubMed] [DOI] |
| 5. | Xu KD, Liang T, Wang K, Tian DA. Effect of pre-electroacupuncture on p38 and c-Fos expression in the spinal dorsal horn of rats suffering from visceral pain. Chin Med J (Engl). 2010;123:1176-1181. [PubMed] |
| 6. | Traub RJ, Tang B, Ji Y, Pandya S, Yfantis H, Sun Y. A rat model of chronic postinflammatory visceral pain induced by deoxycholic acid. Gastroenterology. 2008;135:2075-2083. [PubMed] [DOI] |
| 7. | Ness TJ, Gebhart GF. Colorectal distension as a noxiousvisceral stimulus: physiology and pharm acologic characterization of pseudaffective reflexs in the rat. Brain Res. 1988;450:153-169. [PubMed] [DOI] |
| 8. | 龚 志锦, 詹 镕洲. 病理组织制片和染色技术. 上海: 上海科学技术出版社 1994; 267-272. |
| 9. | Price DD, Zhou Q, Moshiree B, Robinson ME, Verne GN. Peripheral and central contributions to hyperalgesia in irritable bowel syndrome. J Pain. 2006;7:529-535. [PubMed] [DOI] |
| 10. | Verma-Gandhu M, Verdu EF, Bercik P, Blennerhassett PA, Al-Mutawaly N, Ghia JE, Collins SM. Visceral pain perception is determined by the duration of colitis and associated neuropeptide expression in the mouse. Gut. 2007;56:358-364. [PubMed] [DOI] |
| 11. | Guilarte M, Santos J, de Torres I, Alonso C, Vicario M, Ramos L, Martínez C, Casellas F, Saperas E, Malagelada JR. Diarrhoea-predominant IBS patients show mast cell activation and hyperplasia in the jejunum. Gut. 2007;56:203-209. [PubMed] [DOI] |
| 12. | Barbara G, Cremon C, Pallotti F, De Giorgio R, Stanghellini V, Corinaldesi R. Postinfectious irritable bowel syndrome. J Pediatr Gastroenterol Nutr. 2009;48 Suppl 2:S95-S97. [PubMed] [DOI] |
| 13. | Sun Y, Fihn BM, Jodal M, Sjövall H. Inhibition of nitric oxide synthesis potentiates the colonic permeability increase triggered by luminal bile acids. Acta Physiol Scand. 2004;180:167-175. [PubMed] [DOI] |
| 14. | Spiller RC. Postinfectious irritable bowel syndrome. Gastroenterology. 2003;124:1662-1671. [PubMed] [DOI] |
| 15. | Róka R, Ait-Belgnaoui A, Salvador-Cartier C, Garcia-Villar R, Fioramonti J, Eutamène H, Bueno L. Dexamethasone prevents visceral hyperalgesia but not colonic permeability increase induced by luminal protease-activated receptor-2 agonist in rats. Gut. 2007;56:1072-1078. [PubMed] [DOI] |
| 16. | Ohashi K, Sato Y, Kawai M, Kurebayashi Y. Abolishment of TNBS-induced visceral hypersensitivity in mast cell deficient rats. Life Sci. 2008;82:419-423. [PubMed] [DOI] |
| 17. | Rijnierse A, Nijkamp FP, Kraneveld AD. Mast cells and nerves tickle in the tummy: implications for inflammatory bowel disease and irritable bowel syndrome. Pharmacol Ther. 2007;116:207-235. [PubMed] [DOI] |
| 18. | Gui XY. Mast cells: a possible link between psychological stress, enteric infection, food allergy and gut hypersensitivity in the irritable bowel syndrome. J Gastroenterol Hepatol. 1998;13:980-989. [PubMed] [DOI] |
| 19. | Gué M, Del Rio-Lacheze C, Eutamene H, Théodorou V, Fioramonti J, Buéno L. Stress-induced visceral hypersensitivity to rectal distension in rats: role of CRF and mast cells. Neurogastroenterol Motil. 1997;9:271-279. [PubMed] [DOI] |
| 20. | Honoré P, Kamp EH, Rogers SD, Gebhart GF, Mantyh PW. Activation of lamina I spinal cord neurons that express the substance P receptor in visceral nociception and hyperalgesia. J Pain. 2002;3:3-11. [PubMed] [DOI] |
| 21. | Kang YM, Lamb K, Gebhart GF, Bielefeldt K. Experimentally induced ulcers and gastric sensory-motor function in rats. Am J Physiol Gastrointest Liver Physiol. 2005;288:G284-G291. [PubMed] [DOI] |
| 22. | Adam B, Liebregts T, Gschossmann JM, Krippner C, Scholl F, Ruwe M, Holtmann G. Severity of mucosal inflammation as a predictor for alterations of visceral sensory function in a rat model. Pain. 2006;123:179-186. [PubMed] [DOI] |
| 23. | Zhou Q, Price DD, Caudle RM, Verne GN. Visceral and somatic hypersensitivity in TNBS-induced colitis in rats. Dig Dis Sci. 2008;53:429-435. [PubMed] [DOI] |
| 24. | Collins SM, Piche T, Rampal P. The putative role of inflammation in the irritable bowel syndrome. Gut. 2001;49:743-745. [PubMed] [DOI] |
| 25. | Mönnikes H, Rüter J, König M, Grote C, Kobelt P, Klapp BF, Arnold R, Wiedenmann B, Tebbe JJ. Differential induction of c-fos expression in brain nuclei by noxious and non-noxious colonic distension: role of afferent C-fibers and 5-HT3 receptors. Brain Res. 2003;966:253-264. [PubMed] |
| 26. | Nakagawa T, Katsuya A, Tanimoto S, Yamamoto J, Yamauchi Y, Minami M, Satoh M. Differential patterns of c-fos mRNA expression in the amygdaloid nuclei induced by chemical somatic and visceral noxious stimuli in rats. Neurosci Lett. 2003;344:197-200. [PubMed] |
| 27. | Lee IO, Seo Y. The effects of intrathecal cyclooxygenase-1, cyclooxygenase-2, or nonselective inhibitors on pain behavior and spinal Fos-like immunoreactivity. Anesth Analg. 2008;106:972-977, table of contents. [PubMed] [DOI] |
| 30. | Wheatcroft J, Wakelin D, Smith A, Mahoney CR, Mawe G, Spiller R. Enterochromaffin cell hyperplasia and decreased serotonin transporter in a mouse model of postinfectious bowel dysfunction. Neurogastroenterol Motil. 2005;17:863-870. [PubMed] [DOI] |