修回日期: 2011-05-26
接受日期: 2011-06-08
在线出版日期: 2011-07-18
目的: 探讨Dikkopf-1(DKK1)对食管癌细胞周期、侵袭能力的影响.
方法: 采用免疫组织化学的方法检测DKK1在食管癌组织中的表达, 并通过免疫荧光对DKK1在细胞中的分布进行定位分析; 应用Western blot检测食管癌组织及其配对的正常食管组织和4株食管癌细胞系中DKK1蛋白表达水平. 通过构建过表达DKK1的真核表达载体, 将其转染到食管癌EC9706细胞中, 观察细胞周期和侵袭能力的改变.
结果: 免疫组织化学检测食管癌组织中DKK1阳性表达率为83.34%, 免疫荧光结果显示DKK1主要呈细颗粒状散在分布于细胞质中. Western blot检测表明DKK1在食管癌组织中的表达明显高于配对的正常食管组织; 在4株食管癌细胞系中均有不同程度的表达. 在食管癌细胞系EC9706中过表达DKK1, S期细胞所占比例明显升高(57.25% vs 45.87%, P<0.05), 在Boyden小室中穿透基底膜的细胞数目也明显增加(252±6.71 vs 99.18±3.02; 252±6.71 vs 112.33±3.21, 均P<0.01).
结论: DKK1在食管癌组织中呈高表达, 并且在4个食管癌细胞系中均有表达, 在EC9706细胞中过表达DKK1后能够促进细胞由G0/G1期向S期转变, 同时能够增加细胞的侵袭能力.
引文著录: 李书军, 和宇峥, 吕宝雷, 牛秀兰, 崔爱荣, 李永军, 张合林. DKK1在食管癌组织中的表达及其生物学功能. 世界华人消化杂志 2011; 19(20): 2116-2122
Revised: May 26, 2011
Accepted: June 8, 2011
Published online: July 18, 2011
AIM: To investigate the expression of dikkopf-1 (DKK1) in esophageal carcinoma tissue and four esophageal carcinoma cell lines and to explore the impact of DKK1 overexpression on cell cycle and invasion in EC9706 cell line.
METHODS: The expression of DKK1 in esophageal carcinoma tissues was detected by immunohistochemistry, and the distribution of DKK1 in esophageal carcinoma cell line TE13 was observed by immunofluorescence. Western blot was used to investigate the expression of DKK1 in esophageal carcinoma tissues and matched normal esophageal tissues, as well as in four esophageal carcinoma cell lines. A eukaryotic expression vector of DKK1 was constructed and transfected into EC9706 cells to evaluate the impact of DKK1 overexpression on cell cycle by flow cytometry and on cell invasion by Boyden chamber assay.
RESULTS: DKK1 was highly expressed in esophageal carcinoma tissues and mainly distributed in the cytoplasm of TE13 cells. The expression of DKK1 protein in carcinoma was obviously higher than that in matched normal esophageal tissue. Differential expression of DKK1 was observed in four esophageal carcinoma cell lines. Overexpression of DKK1 in EC9706 cells decreased the percentage of cells in G0/G1 phase and increased the percentage of cells in sphase and the number of cells penetrating through the membrane of Boyden chamber (252 ± 6.71 vs 99.18 ± 3.02; 252 ± 6.71 vs 112.33 ± 3.21, all P < 0.01).
CONCLUSION: DKK1 is overexpressed in esophageal carcinoma. Overexpression of DKK1 in EC9706 cells remarkably promoted cell invasion and progression from G1 phase to S phase.
- Citation: Li SJ, He YZ, Lv BL, Niu XL, Cui AR, Jun LY, Lin ZH. Expression and biological role of DKK1 in human esophageal cancer. Shijie Huaren Xiaohua Zazhi 2011; 19(20): 2116-2122
- URL: https://www.wjgnet.com/1009-3079/full/v19/i20/2116.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i20.2116
肝食管癌是发病率和死亡率较高的消化系恶性肿瘤之一, 尽管采用以手术为主的放疗、化疗等综合治疗已明显提高了患者的5年生存率, 食管癌转移仍是影响预后的主要因素, 研究肿瘤发生转移的分子机制成为当前的热点[1]. Dikkopf 1(DKK1)是Wnt/β-catenin信号通路中重要抑制因子, 在肿瘤进程中的作用已引起广泛关注, DKK1在不同的肿瘤中表达水平有很大的差异, 其作用机制尚未清楚[2-7]. 本研究在蛋白质水平对食管癌组织以及4株食管癌细胞株进行检测, 探讨其在食管癌转移过程中的作用.
食管癌及配对的正常食管组织来自河北医科大学第二医院胸外科2006-06/2008-06手术切除的138例食管癌患者. 人食管癌细胞株由天津市胸科医院张逊教授惠赠, 包括KYSE-150、KYSE-510、EC9706和TE13. DKK1表达质粒pCMV-Tag-2b由河北医科大学病理教研室张祥宏教授惠赠. 限制性内切酶BamHⅠ、EcoRⅠ, T4 DNA连接酶, Taq DNA聚合酶、蛋白Marker和碘化丙啶(PI)购自Promega公司; 质粒提取试剂盒、胶回收试剂盒购自Qiagen公司; RPMI-1640、新生小牛血清(newborn calf serum, NBS)及Lipofectmine2000购自Gibco公司; DKK1兔抗人单克隆抗体及兔抗人β-actin多克隆抗体购自Invitrogen公司; Boyden小室购自美国Millipore公司.
1.2.1 细胞培养: 人食管癌细胞用含100 mL/L NBS、100 mg/L链霉素、100 kU/L青霉素的RPMI-1640培养, 在37 ℃、50 mL/L CO2细胞培养箱中培养. 细胞进入对数生长期后, 用PBS清洗2次, 0.25%胰酶消化, 制备成2.5×108/L单细胞悬液, 接种到6孔板内培养.
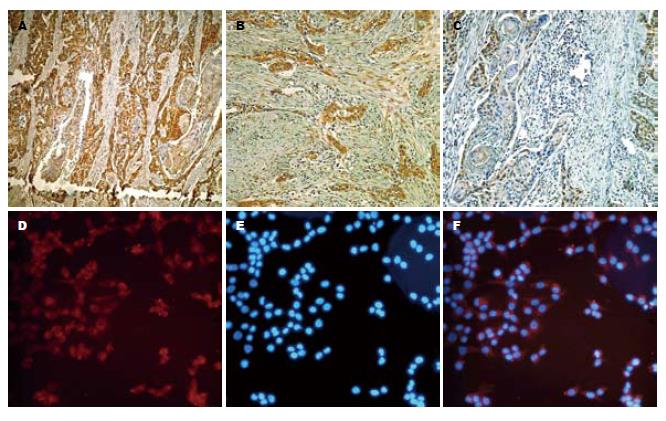
1.2.2 免疫组织化学和免疫荧光检测DKK1表达: 组织化学检测食管癌石蜡切片中DKK1的表达. 石蜡切片抗原热修复后, 按照说明书采用SP免疫组织化学法进行操作, 用PBS代替一抗作阴性对照, 已知阳性片作阳性对照. 染色结果由2名病理科医生采用双盲原则评定. 浅黄至棕黄色为阳性细胞[8].
在6孔板中水平置入载玻片进行细胞培养, 当细胞生长达40%-50%时取出载玻片, 4%多聚甲醛固定细胞, 用0.1% Triton X-100 PBS溶液浸透5 min, 然后加入含100 mL/L山羊血清的PBS室温封闭30 min. 用含有30% BSA的PBS 1:100稀释一抗, 室温下孵育60 min后用PBS洗5 min×3次, 罗丹明标记的二抗在室温下反应60 min进行染色, 再用PBS洗5 min×3次, 用DAPI对细胞核进行染色, 最后在激光共聚焦显微镜下进行观察.
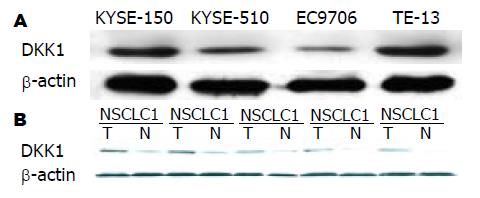
1.2.3 Western blot检测DKK1的表达: 分析4例患者的食管癌组织与配对的正常组织中DKK1表达. 收集进入对数生长期的人食管癌细胞, 向6孔板中加入RIPA在冰上进行裂解(300 μL/孔, 其中PMSF浓度为0.1%), 30 min后将其收集在1.5 mL EP管中, 4 ℃, 15 000 r/min离心15 min, 收集上清液用BCA法测定蛋白浓度. 组织蛋白提取时, 首先在液氮中研磨成粉末状, 再加入RIPA裂解, 其余步骤同细胞蛋白提取. 每个样品取50 μg蛋白进行10% SDS-PAGE胶电泳, 蛋白电转移到PVDF膜上; 5%脱脂奶粉4 ℃过夜封闭, 用DKK1的兔抗人单克隆一抗(1:500)室温下孵育2 h, 然后用过氧化物酶标记的羊抗兔二抗(1:5000稀释)室温下孵育30 min[7], 以β-actin为内参, 用Bandscan5.0软件分析蛋白条带总灰度值, 检测表达差异.
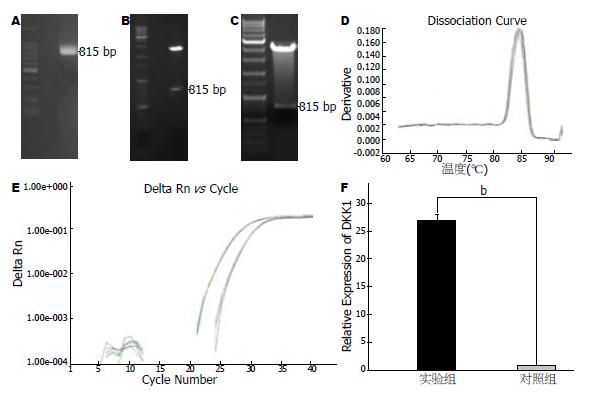
1.2.4 DKK1表达载体的构建: 根据DKK1在GeneBank中mRNA(NM: 012242.2)的序列, 设计PCR引物, Forward: 5'-TGGATCCATGATGGCTCTGGGCGCAGCGGGAG-3', Reverse: 5'-CGAATTCTTAGTGTCTCTGACAAGTGTGAAGCCTAGAAG-3', 在5'端分别引入酶切位点BamHⅠ和EcoRⅠ, PCR产物的大小为815 bp. 扩增的产物与pMD-18T载体连接, 构建的质粒进行BamHⅠ-EcoRⅠ双酶切鉴定, 插入正确的片段亚克隆到pCMV-Tag-2b载体上, 构建成DKK1表达载体pCMV-Tag-2b-DKK1, 再进行酶切鉴定和测序分析.
1.2.5 Real-time PCR检测DKK1的mRNA变化: 将构建的DKK1表达载体pCMV-Tag-2b-DKK1和空载体pCMV-Tag-2b分别转染食管癌细胞EC9706, 继续培养48 h后收集细胞, TRIzol法提取总RNA, 取1 μg总RNA用随机引物反转录为cDNA, Real-time PCR扩增DKK1基因, 引物序列: Forward 5'-CAACGCTATCAAGAACCTGC-3', Reverse: 5'-GATCTTGGACCAGAAGTGTC-3'; 内参GAPDH引物序列为: Forward: 5'-GGCATGGACTGTGGTCATGA-3', Reverse: 5'-TGGXGTGTGAACCACGAGAA-3'. 条件为: 95 ℃, 10 min预变性, 95 ℃变性5 s, 60 ℃退火34 s, 74 ℃荧光检测3 s, 重复40个循环. 70 ℃-95 ℃绘制熔解曲线, 使用SYBR Green检测荧光改变, 以2-ΔΔCt值比较两组之间差异, 并进行数据分析.
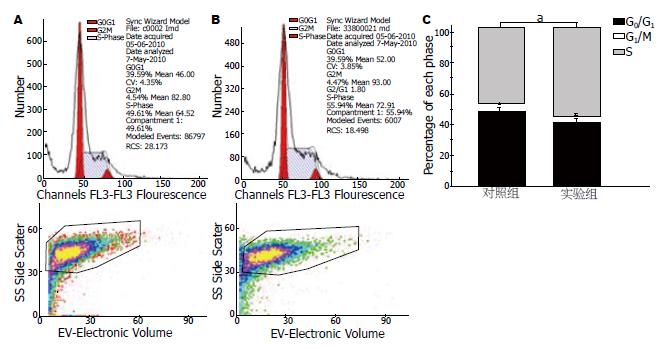
1.2.6 流式细胞术分析细胞周期: 将人食管癌细胞EC9706接种到6孔板中, 分为转染pCMV Tag-2b-DKK1(实验组)和pCMV-Tag-2b(对照组)两组, 每组设3个复孔. 细胞转染48 h后, 消化细胞制备成单细胞悬液, 4 ℃, 1 000 r/min×5 min离心后再悬浮2次, 400目滤网过滤细胞悬液, 离心后用750 mL/L乙醇1 mL固定细胞18 h, 之后用PBS重悬细胞, 4 ℃, 1 000 r/min×5 min离心后在悬浮2次, 200 μL RNase A(1 g/L)在37 ℃孵育30 min, 加入800 μL PI染色液混匀后4 ℃避光染色30 min. 在流式细胞仪上检测各个时相的细胞分布.
1.2.7 DKK1对食管癌细胞侵袭能力的影响: 人食管癌EC9706细胞接种到12孔板中, 细胞融合度为80%时进行转染, 分为转染pCMV-Tag-2b-DKK1(实验组)、pCMV-Tag-2b(对照组)和没有转染载体的空白组. 实验前用300 μL DMEM水化Boyden小室. 转染EC9706细胞18 h后用Opti-MEM重悬细胞, 调整浓度为3×108/L, 取300 μL单细胞悬液接种到上室内; 下室内为500 μL的含100 mL/L NBS的RPMI-1640培养基, 37 ℃, 50 mL/L CO2培养箱内培养48 h. 取出Boyden小室, 移走上室内的培养液, 用棉棒将上室内未穿膜的细胞轻轻刮掉, 置于0.1%结晶紫染色液中30 min; 取出小室, 用蒸馏水漂洗干净[9]; 镜下观察并统计各组穿膜细胞数并进行统计分析.
通过免疫组织化学分析了138例手术切除的食管癌标本中, DKK1强阳性表达88例(63.77%), 弱阳性表达27例(19.57%), 阴性表达23例(16.66%), DKK1在食管癌组织中的阳性表达率为83.34%(图1A-C). 免疫荧光检测食管癌细胞TE13中的DKK1的表达, 结果显示DKK1主要分布在细胞质中, 呈细颗粒状散在分布(图1D-F).
DKK1在食管癌组织中呈高表达, 在配对的远癌正常组织中呈低表达(图2A). 通过对4株食管癌细胞系中DKK1表达分析, 结果表明DKK1在细胞系中有不同程度的表达, 其中在TE13中表达最高, 而在EC9706细胞中的表达很低(图2B).
应用真核表达载体pCMV-Tag-2b构建了DKK1表达质粒pCMV-Tag-2b-DKK1, 经EcoRⅠ-BamH I双酶切鉴定和测序分析表明构建的重组质粒正确(图3A-C). 将构建成的过表达DKK1质粒转染食管癌细胞系EC9706后, Real-time PCR检测DKK1在EC9706细胞中的表达, 结果表明DKK1的表达能够增加27.15倍(图3D-E).
人食管癌细胞系在转染pCMV-Tag-2b-DKK1的EC9706细胞中S期细胞所占的比例明显升高(57.25% vs 45.87%), 而G0/G1期细胞所占的比例降低, 表明DKK1参与细胞周期的调控(图4).
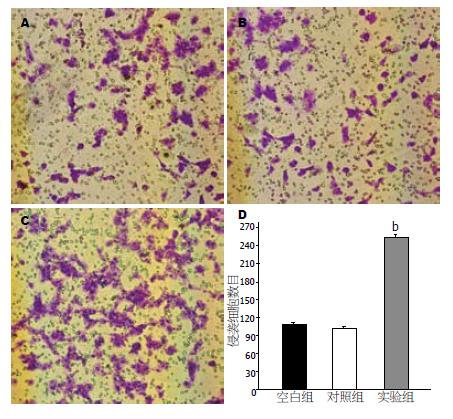
通过转染pCMV-Tag-2b-DKK1的EC9706细胞通过Boyden小室基底膜的细胞数(112.33±3.21)明显地高于转染对照组(99.18±3.02)和空白组的细胞数(252±6.71), 表明过表达DKK1的EC9706细胞侵袭能力有明显的增加(图5).
Wnt/β-catenin信号通路的异常在肿瘤的发生发展过程中具有重要的作用[10-14]. DKK1是一种分泌性糖蛋白, 能够与细胞膜上的Wnt受体LRP5和DKK1共受体Kremen1结合, 形成内吞小体, 从而阻断Wnt信号通路[15-18]. DKK1在不同的肿瘤中表达水平不一. 在胃肠道肿瘤、乳腺癌、胶质瘤中DKK1的表达降低或缺失[9,19,20], 而在肝癌、食管癌、黑色素瘤等肿瘤中DKK1的表达明显的升高[21,22], 这种差异性的表达在肿瘤中的意义尚不完全清楚.
Yamabuki等[23]分析食管鳞癌的基因表达谱发现, DKK1在癌组织中的表达水平明显高于癌旁组织, 且与预后相关, 可能成为临床上食管癌诊断及预后判断的标志物. Darlavoix等的研究表明DKK1在Barrett's食管中的过表达增加了转变为食管腺癌的风险. 本研究通过对食管癌组织和食管癌细胞系的研究结果显示: DKK1在多数食管癌组织中高表达(83.34%), 且在食管癌组织中的表达明显地高于配对的远癌正常食管组织; 免疫组织化学和Western blot检测的结果一致. 在4株食管癌细胞系中也有不同程度的表达, TE13中的表达最高, 而在EC9706细胞中的表达量最低; 免疫荧光检测DKK1在食管癌细胞中主要分布于细胞质, 呈细颗粒状散在分布, 符合DKK1是一分泌型蛋白的特点[24]. 这些结果为我们研究DKK1在肿瘤中的作用提供了线索.
在研究DKK1对食管癌细胞的生物学作用时, 我们选择EC9706细胞进行研究, 该细胞系中内源性DKK1的表达水平很低. 细胞周期分析的结果显示DKK1能够促进EC9706细胞由静止期向DNA合成期转变, 这可能是与DKK1能够促进细胞的增殖有关. 有关DKK1与细胞增殖、细胞周期的关系已有相关的报道[25,26], 具体的作用机制有待进一步深入的研究. Boyden小室实验结果表明: 过表达DKK1的EC9706细胞能够明显的增加穿过小室基底膜的细胞数, 因此, 我们认为DKK1能够提高食管癌细胞EC9706的侵袭能力, 在肿瘤发生转移的过程中具有促进作用. 本研究的结果与Kuang等[27]的研究结果相吻合, DKK1的过表达能够增加细胞的侵袭能力.
我们通过对DKK1在食管癌中的表达和功能水平上的研究, 证明其在食管癌发生发展过程中具有重要的作用, 具体在Wnt/β-catenin信号通路中的调控机制, 需要我们进一步深入探讨.
Dikkopf 1(DKK1)是Wnt/β-catenin信号通路中重要的抑制因子, 在肿瘤进程中的作用已引起广泛关注, DKK1在不同的肿瘤中表达水平有很大的差异, 其作用机制尚未清楚.
欧希龙, 副教授, 东南大学中大医院消化科
对于DKK1在不同肿瘤中的表达差异已有较多报道, 但对于在肿瘤中的具体作用机制及功能的研究报道较少, 尤其在食管癌中的报道较少.
Sikandar最新报道了DKK1对细胞周期和细胞凋亡的调控作用.
本文主要对DKK1在食管癌细胞中增殖、细胞周期和侵袭能力进行了探讨.
本研究针对DKK1在食管癌中的表达做出了分析, 并且在食管癌细胞株中进行了过表达后研究癌细胞增殖、细胞周期和侵袭能力的改变, 今后的研究中其将深入探讨作用机制, 有可能成为肿瘤生物治疗的靶点.
本文设计科学严谨, 数据可靠, 图像精美, 有较高的研究价值.
编辑:李薇 电编:张洋
| 1. | Kim T, Grobmyer SR, Smith R, Ben-David K, Ang D, Vogel SB, Hochwald SN. Esophageal cancer--the five year survivors. J Surg Oncol. 2011;103:179-183. [PubMed] [DOI] |
| 2. | Johansson TA, Westin G, Skogseid B. Identification of Achaete-scute complex-like 1 (ASCL1) target genes and evaluation of DKK1 and TPH1 expression in pancreatic endocrine tumours. BMC Cancer. 2009;9:321. [PubMed] [DOI] |
| 3. | Yu B, Yang X, Xu Y, Yao G, Shu H, Lin B, Hood L, Wang H, Yang S, Gu J. Elevated expression of DKK1 is associated with cytoplasmic/nuclear beta-catenin accumulation and poor prognosis in hepatocellular carcinomas. J Hepatol. 2009;50:948-957. [PubMed] [DOI] |
| 4. | Hirata H, Hinoda Y, Nakajima K, Kawamoto K, Kikuno N, Ueno K, Yamamura S, Zaman MS, Khatri G, Chen Y. Wnt antagonist DKK1 acts as a tumor suppressor gene that induces apoptosis and inhibits proliferation in human renal cell carcinoma. Int J Cancer. 2011;128:1793-1803. [PubMed] [DOI] |
| 5. | Lemaire O, Attal M, Bourin P, Laroche M. DKK1 correlates with response and predicts rapid relapse after autologous stem cell transplantation in multiple myeloma. Eur J Haematol. 2010;84:276-277. [PubMed] [DOI] |
| 6. | Li Y, Lu W, King TD, Liu CC, Bijur GN, Bu G. Dkk1 stabilizes Wnt co-receptor LRP6: implication for Wnt ligand-induced LRP6 down-regulation. PLoS One. 2010;5:e11014. [PubMed] [DOI] |
| 7. | Takahashi N, Fukushima T, Yorita K, Tanaka H, Chijiiwa K, Kataoka H. Dickkopf-1 is overexpressed in human pancreatic ductal adenocarcinoma cells and is involved in invasive growth. Int J Cancer. 2010;126:1611-1620. [PubMed] |
| 8. | Darlavoix T, Seelentag W, Yan P, Bachmann A, Bosman FT. Altered expression of CD44 and DKK1 in the progression of Barrett's esophagus to esophageal adenocarcinoma. Virchows Arch. 2009;454:629-637. [PubMed] [DOI] |
| 9. | Li S, Li Z, Guo F, Qin X, Liu B, Lei Z, Song Z, Sun L, Zhang HT, You J. miR-223 regulates migration and invasion by targeting Artemin in human esophageal carcinoma. J Biomed Sci. 2011;18:24. [PubMed] [DOI] |
| 10. | Bafico A, Liu G, Goldin L, Harris V, Aaronson SA. An autocrine mechanism for constitutive Wnt pathway activation in human cancer cells. Cancer Cell. 2004;6:497-506. [PubMed] [DOI] |
| 12. | Heider U, Kaiser M, Mieth M, Lamottke B, Rademacher J, Jakob C, Braendle E, Stover D, Sezer O. Serum concentrations of DKK-1 decrease in patients with multiple myeloma responding to anti-myeloma treatment. Eur J Haematol. 2009;82:31-38. [PubMed] [DOI] |
| 13. | Hoeppner LH, Secreto FJ, Westendorf JJ. Wnt signaling as a therapeutic target for bone diseases. Expert Opin Ther Targets. 2009;13:485-496. [PubMed] [DOI] |
| 14. | 彭 春伟, 燕 敏, 于 颖彦, 李 建芳, 计 骏, 蔡 劬, 刘 炳亚, 朱 正纲. Wnt信号通路靶基因GS mRNA及蛋白在胃癌中的表达. 世界华人消化杂志. 2009;17:1777-1781. [DOI] |
| 15. | Mao B, Wu W, Davidson G, Marhold J, Li M, Mechler BM, Delius H, Hoppe D, Stannek P, Walter C. Kremen proteins are Dickkopf receptors that regulate Wnt/beta-catenin signalling. Nature. 2002;417:664-667. [PubMed] [DOI] |
| 16. | Smadja DM, d'Audigier C, Weiswald LB, Badoual C, Dangles-Marie V, Mauge L, Evrard S, Laurendeau I, Lallemand F, Germain S. The Wnt antagonist Dickkopf-1 increases endothelial progenitor cell angiogenic potential. Arterioscler. Thromb Vasc Biol. 2010;30:2544-2552. [PubMed] [DOI] |
| 17. | Dun X, Jiang H, Zou J, Shi J, Zhou L, Zhu R, Hou J. Differential expression of DKK-1 binding receptors on stromal cells and myeloma cells results in their distinct response to secreted DKK-1 in myeloma. Mol Cancer. 2010;9:247. [PubMed] [DOI] |
| 18. | Zhou Y, Liu F, Xu Q, Wang X. Analysis of the expression profile of Dickkopf-1 gene in human glioma and the association with tumor malignancy. J Exp Clin Cancer Res. 2010;29:138. [PubMed] [DOI] |
| 19. | Maehata T, Taniguchi H, Yamamoto H, Nosho K, Adachi Y, Miyamoto N, Miyamoto C, Akutsu N, Yamaoka S, Itoh F. Transcriptional silencing of Dickkopf gene family by CpG island hypermethylation in human gastrointestinal cancer. World J Gastroenterol. 2008;14:2702-2714. [PubMed] [DOI] |
| 20. | Mikheev AM, Mikheeva SA, Maxwell JP, Rivo JV, Rostomily R, Swisshelm K, Zarbl H. Dickkopf-1 mediated tumor suppression in human breast carcinoma cells. Breast Cancer Res Treat. 2008;112:263-273. [PubMed] [DOI] |
| 21. | Qin X, Zhang H, Zhou X, Wang C, Zhang H, Zhang X, Ye L. Proliferation and migration mediated by Dkk-1/Wnt/beta-catenin cascade in a model of hepatocellular carcinoma cells. Transl Res. 2007;150:281-294. [PubMed] [DOI] |
| 22. | Sheng SL, Huang G, Yu B, Qin WX. Clinical significance and prognostic value of serum Dickkopf-1 concentrations in patients with lung cancer. Clin Chem. 2009;55:1656-1664. [PubMed] [DOI] |
| 23. | Yamabuki T, Takano A, Hayama S, Ishikawa N, Kato T, Miyamoto M, Ito T, Ito H, Miyagi Y, Nakayama H. Dikkopf-1 as a novel serologic and prognostic biomarker for lung and esophageal carcinomas. Cancer Res. 2007;67:2517-2525. [DOI] |
| 24. | Makino T, Yamasaki M, Takemasa I, Takeno A, Nakamura Y, Miyata H, Takiguchi S, Fujiwara Y, Matsuura N, Mori M. Dickkopf-1 expression as a marker for predicting clinical outcome in esophageal squamous cell carcinoma. Ann Surg Oncol. 2009;16:2058-2064. [PubMed] [DOI] |
| 25. | Sikandar S, Dizon D, Shen X, Li Z, Besterman J, Lipkin SM. The class I HDAC inhibitor MGCD0103 induces cell cycle arrest and apoptosis in colon cancer initiating cells by upregulating Dickkopf-1 and non-canonical Wnt signaling. Oncotarget. 2010;1:596-605. [PubMed] |
| 26. | Macdonald LJ, Sales KJ, Grant V, Brown P, Jabbour HN, Catalano RD. Prokineticin 1 induces Dickkopf 1 expression and regulates cell proliferation and decidualization in the human endometrium. Mol Hum Reprod. 2011; May 5. [Epub ahead of print]. [PubMed] |
| 27. | Kuang HB, Miao CL, Guo WX, Peng S, Cao YJ, Duan EK. Dickkopf-1 enhances migration of HEK293 cell by beta-catenin/E-cadherin degradation. Front Biosci. 2009;14:2212-2220. [PubMed] [DOI] |