修回日期: 2011-05-31
接受日期: 2011-06-14
在线出版日期: 2011-06-18
目的: 研究乙醛对肝星状细胞(HSC)细胞外基质和细胞因子分泌的影响及中药抗纤复方I号(KXI)的干预作用.
方法: 采用大鼠肝脏原位灌流消化法获得并原代及传代培养HSC, 大鼠灌以KXI制备药物血清, 以乙醛和药物血清作用于HSC, 通过RT-PCR测定细胞内α1(I)型胶原mRNA的表达, 以放射免疫法和ELISA法分别测定培养上清中透明质酸(HA)和转化生长因子-β1(TGF-β1)的含量.
结果: 100 μmol/L乙醛刺激HSC后, HSC中α1(I)型胶原mRNA的表达、上清中HA(ng/L)及TGF-β1(ng/L)的含量增加(1.193±0.0344 vs 0.988±0.0208; 1 243.22±58.13 vs 602.33±194.06; 2 734.43±787.12 vs 559.92±97.63, 均P<0.01). 而100 mL/L的药物血清则抑制α1(I)型胶原mRNA的表达、HA(ng/L)及TGF-β1(ng/L)的含量降低(0.973±0.0605 vs 1.193±0.0344; 1 032.667±77.65 vs 1 243.22±58.13; 759.62±205.34 vs 2 734.43±787.12, 均P<0.01).
结论: 乙醛能增加HSC中α1(I)型胶原的表达, 并促进HSC分泌HA及TGF-β1, 而KXI则起抑制作用.
引文著录: 林红, 黄玉红, 李异玲, 傅宝玉, 王炳元. 抗纤复方I号对乙醛刺激的肝星状细胞的细胞外基质及细胞因子分泌的干预作用. 世界华人消化杂志 2011; 19(17): 1826-1829
Revised: May 31, 2011
Accepted: June 14, 2011
Published online: June 18, 2011
AIM: To investigate the effect of KangXian FuFang I (KXI) on acetaldehyde-stimulated extracellular matrix synthesis and cytokine secretion in cultured hepatic stellate cells (HSCs).
METHODS: HSCs were isolated from rats and then primarily cultured and subcultured in vitro. Serum containing KXI was collected from normal rats intragastrically given the drug. HSCs were treated with acetaldehyde and the drug-containing serum. The contents of hyaluronic acid (HA) and transforming growth factor β1 (TGF-β1) in the media and expression of type I collagen α1 mRNA in stimulated HSCs were measured by radioimmunoassay, ELISA and reverse transcription polymerase chain reaction (RT-PCR), respectively.
RESULTS: After HSCs were stimulated with acetaldehyde (100 μmol/L), the expression level of type I collagen α1 mRNA (1.193 ± 0.0344 vs 0.988 ± 0.0208, P < 0.05) in HSCs and secreted levels of HA (1243.22 ng/L ± 58.13 ng/L vs 602.33 ng/L ± 194.06 ng/L, P < 0.05) and TGF-β1 (2734.43 ng/L ± 787.12 ng/L vs 559.92 ng/L ± 97.63 ng/L, P < 0.01) in the media significantly increased. Drug-containing serum (10%) significantly inhibited acetaldehyde-stimulated expression of type I collagen α1 mRNA (0.973 ± 0.0605 vs 1.193 ± 0.0344, P < 0.05) and secretion of HA (1032.667 ng/L ± 77.65 ng/L vs 1243.22 ng/L ± 58.13 ng/L, P < 0.05) and TGF-β1 (759.62 ng/L ± 205.34 ng/L vs 2734.43 ng/L ± 787.12 ng/L, P < 0.01).
CONCLUSION: KXI could inhibit acetaldehyde-stimulated secretion of HA and TGF-β1 and expression of type I collagen α1 mRNA in cultured HSCs.
- Citation: Lin H, Huang YH, Li YL, Fu BY, Wang BY. KangXian FuFang I inhibits acetaldehyde-stimulated extracellular matrix synthesis and cytokine secretion in cultured hepatic stellate cells. Shijie Huaren Xiaohua Zazhi 2011; 19(17): 1826-1829
- URL: https://www.wjgnet.com/1009-3079/full/v19/i17/1826.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i17.1826
酒精性肝病是由于长期大量饮酒所致, 包括酒精性脂肪肝、酒精性肝炎、肝纤维化和肝硬化. 肝纤维化是肝硬化的早期可逆阶段, 如不及时治疗则可能进展成为失代偿期肝硬化并出现各种终末期肝病并发症[1]. 肝纤维化的发展是细胞外基质(extracellular matrix, ECM)合成增加、降解减少的结果. 肝星状细胞(hepatic stellate cell HSC)的活化是肝纤维化发生的中心环节[2], 是分泌合成胶原的主要细胞. HSC激活受多种细胞因子的调控, 转化生长因子-β1(transforming growth factor β1, TGF-β1)为最强的促肝纤维化因子. 中药复方的多途径、多层次、多靶点的综合药理作用在抗肝纤维化治疗中显示出独特的优势. 本研究观察了中药抗纤复方I号(kangxian fufang I, KXI)对乙醛刺激的大鼠HSC分泌的ECM如α1(I)型胶原和透明质酸(hyaluronic acid, HA)以及TGF-β1的影响, 以期阐述KXI抗酒精性肝纤维化的部分作用机制.
KXI(主要由丹参、黄芪、红花、汉防己、葛根、桃仁、甘草等10味药物组成)浓缩口服制剂, 含2.7 g生药/mL. 按11 mL/kg给大鼠灌服中药制剂, 每天1次, 持续给药1 wk, 末次给药后1 h无菌条件下由下腔静脉取血, 取血清, 56 ℃灭活30 min, 分装-20 ℃冻存. 另选正常大鼠喂以等量生理盐水, 以同样方法制备正常血清作对照用. RT-PCR试剂盒购于大连宝生物工程有限公司.
1.2.1 HSC分离、培养及鉴定: 采用大鼠肝脏原位灌流消化的方法分离HSC[3]. 细胞得率约为1×107/肝, 经台盼蓝染色细胞存活率90%以上. 将细胞爬片用兔抗人Desmin抗体、SP法作免疫细胞化学染色以鉴定HSC, 胞质阳染者为HSC, 传代的HSC纯度>98%. 本次实验采用传2-4代HSC.
1.2.2 放免法测定HA含量: 以1×106/瓶浓度接种在培养瓶(25 cm2)中的传代的HSC长满单层后, 分为正常血清对照组、正常血清+乙醛组及药物血清+乙醛组. 正常血清及药物血清加入无血清DMEM培养液中, 制成浓度为10%的正常血清及药物血清孵育液, 乙醛组加入乙醛后使终浓度为100 μmol/L, 培养瓶均用封口膜封严, 培养24 h后收集培养上清, 严格按说明操作(HA放射免疫测定试剂盒购于为上海海军医学研究所). JC-1200放射免疫γ计数仪上直接测定HA含量(μg/L), 取均值.
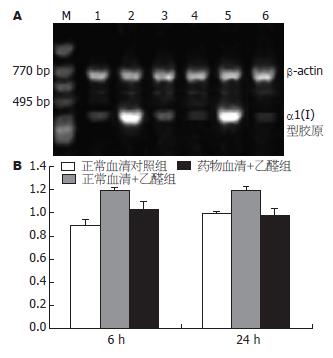
1.2.3 HSC α1(I)型胶原mRNA测定: HSC分为正常血清对照组、正常血清+乙醛组及药物血清+乙醛组, 按1.2.2方法处理后, 提取6 h和24 h的总RNA并逆转录成cDNA. 引物由北京奥科公司合成, 序列及扩增产物片段见表1. 总体积25 μL, 反应条件: 94 ℃ 3 min变性→94 ℃ 40 s→62 ℃ 1 min→72 ℃ 1 min, 共35个循环, 72 ℃ 7 min终止反应; PCR产物经2%琼脂糖凝胶电泳、摄片、密度扫描(1D Kodak成像分析系统), 然后用其表达量与对应的β-actin表达量进行比较.
| 引物名称 | 引物序列 | 大小 (bp) |
| α1(I)型 | F 5'-CCGTGGTGACAAGGGTGAGACAG-3' | 471 |
| 胶原 | R 5'-TCAGGGCTGCGGATGTTCTCA-3' | |
| β-actin | F 5'-GATTGCCTCAGGACATTTCTG-3' | 690 |
| R 5'-GATTGCTCAGGACATTTCTG-3' |
1.2.4 双抗夹心ABC-ELISA法检测培养上清中细胞因子TGF-β1的含量: 检测试剂盒由上海森雄科技实业有限公司提供. 严格按试剂盒说明书操作. 测定TGF-β1时需进行标本激活(因为TGF-β1是以无活性的形式分泌的)即将标本用样品稀释液稀释10倍, 总量500 μL, 加入20 μL 1 mol/L HCL, 2 ℃-8 ℃放置60 min后, 加入20 μL 1 mol/L NaOH即用. 计算结果时乘以稀释倍数(×10). 酶标仪检测A值.
统计学处理 采用SPSS10.0软件包进行统计学分析, 计量资料用mean±SD表示, 采用方差分析、LSD检验和t检验. P<0.05为差异有统计学意义.
乙醛浓度为100 μmol/L时, 刺激HSC 6 h α1(I)型胶原mRNA表达显著增加, 至24 h仍有较强的信号, 100 mL/L药物血清能明显抑制α1(I)型胶原mRNA表达(表2, 图1).
正常血清对照组HA分泌量为(602.334±194.062) ng/L, 正常血清+乙醛组为(1 243.225±58.126) ng/L(t = 4.73, P<0.01), 药物血清+乙醛组为(1 032.667±77.658) ng/L(t = 4.65, P<0.05).
100 μmol/L乙醛刺激HSC 24 h后, 培养上清中正常血清对照组TGF-β1含量(559.9±97.6) ng/L, 正常血清+乙醛组为(2734.4±787.1) ng/L(t = 4.83, P<0.01), 药物血清+乙醛组为(759.6±205.8) ng/L(t = 4.53, P<0.01).
ECM包括胶原、非胶原糖蛋白及蛋白多糖等, ECM本身并非单纯作为一种组织结构存在, 他具广泛的生理功能, 是对细胞、组织和器官的形态、生长、分化和代谢等结构功能有重要影响的生物大分子[4], 肝细胞的正常功能和HSC保持静息状态均有赖于Disse间隙的正常间质成分[5]. 胶原是ECM的主要成分, 肝脏以Ⅰ、Ⅲ型为主. Pinzani[6]提出酒精性肝纤维化的形成模式为细胞周围型纤维化, 由HSC产生纤维, 形成肝窦毛细血管化, 纤维形成并包绕肝细胞; HSC位于窦周Disse间隙, 研究表明在肝损伤过程中激活经表型转化而成为肌纤维母细胞(myofibroblast, MFB), 活化后的HSC的Ⅰ、Ⅲ、Ⅳ型前胶原mRNA表达明显增加; 层粘连蛋白(laminin, LN)、HA和纤维连接蛋白(fibronectin, FN)的mRNA表达也增加. HSC活化后ECM成分发生改变, 以Ⅰ型胶原为主. 实验表明随着酒精性肝纤维化的进展, 血清中含量最多的是蛋白多糖中的HA, 他与肝纤维化程度呈正相关[7]. 乙醛是乙醇的直接代谢产物, 而乙醛能通过多种途径造成肝脏的损伤. 本研究中, 用乙醛刺激体外传代培养的HSC, 能明显促进HSC分泌HA, α1(I)型胶原mRNA表达亦显著增高, KXI能显著抑制乙醛引起的HA的分泌及α1(I)型胶原mRNA表达, 说明KXI有抑制乙醛引起的HSC分泌某些主要ECM增加的作用.
TGF-β是目前已知的重要致肝纤维化的细胞因子之一[8], TGF-β1有旁分泌和自分泌两种来源, 刺激HSC产生Ⅰ型胶原蛋白及其他基质组分的能力最强[9]. 他既可促进ECM的合成, 又可抑制其降解, 在HSC激活过程中亦起重要作用[10], 因此在肝纤维化形成和发展中起着重要作用[11]. 动物活体实验表明, 敲除了smad3(TGF-β受体的下游转录因子)的大鼠没有发展为肝纤维化[12,13]. 有学者研究显示中药冬虫夏草的提取物虫草多糖脂质体, 鳖甲、莪术等合剂抗纤软肝冲剂及中药复方护肝片既能分别下调TGF-β1的基因转录[14]和抑制TGF-β1蛋白的表达[15], 又能在其基因转录、蛋白表达双水平同时起作用[16]. 酒精性肝纤维化中活化的库普弗细胞可分泌TGF-β, 使之以旁分泌的形式作用于HSC, 还可通过TNF-α诱导HSC自分泌TGF-β[17], 从而对其产生活化作用. 本研究发现乙醛能刺激体外培养的HSC分泌TGF-β1明显增加, 而KXI可抑制其作用.
目前, 抗氧化剂、TGF-β拮抗剂、信号转导抑制剂、干扰素等可抑制HSC活化的药物已应用于临床或处于试验阶段[18]. 此外, 可在多靶点抑制HSC活化的药物可能比单靶点药物更加有效, 已达到更好的抗肝纤维化疗效. 本实验提示乙醛能促进培养的HSC分泌α1(I)型胶原、HA等ECM及主要的致肝纤维化细胞因子TGF-β1, 中药KXI则起明显的抑制作用, 即可能从多方面抑制乙醛的致纤维化作用, 为进一步研究酒精性肝纤维化的发生机制及防治提供一定的实验依据.
近年来酒精性肝病发病率呈现不断上升的趋势. 酒精性肝纤维化是肝硬化的早期可逆阶段, 如不及时治疗则可能进展为失代偿期肝硬化并出现各种终末期肝病并发症. 肝纤维化的发展是细胞外基质合成增加、降解减少的结果. 肝星状细胞是分泌合成胶原的主要细胞. 转化生长因子-β1是最强的促肝纤维化因子. 中药复方的综合药理作用在抗肝纤维化治疗中显示出独特的优势.
曹鹏, 副研究员, 江苏省中医药研究院细胞与分子生物学实验室
酒精性肝纤维化的发病机制较复杂, 目前尚不清楚, 其治疗是研究纤维化分子治疗领域的重点、热点. 大多数化学药物仍处于动物实验或临床试验阶段, 但某些中药复方制剂在临床治疗肝纤维化方面已取得一定疗效, 复方中药的作用机制需进一步深入探讨.
本文通过体外培养肝星状细胞, 直接检测乙醛对肝星状细胞合成细胞外基质及分泌细胞因子的影响, 探讨乙醛促肝纤维化的机制, 并同时给予中药复方制剂干预, 是一系列研究的一部分.
抗纤复方I号在动物体内及体外多项实验中均证实其在多层次上有抗肝纤维化作用, 为临床应用其治疗肝纤维化提供有力的理论依据, 但仍需深入探讨其作用机制及安全性.
本研究设计合理, 思路清晰, 但是缺少深度,希望能进一步探索中药抗纤复方I号的干预机制.
编辑:李薇 电编:何基才
| 1. | Ismail MH, Pinzani M. Reversal of liver fibrosis. Saudi J Gastroenterol. 2009;15:72-79. [PubMed] [DOI] |
| 2. | Friedman SL. Molecular regulation of hepatic fibrosis, an integrated cellular response to tissue injury. J Biol Chem. 2000;275:2247-2250. [PubMed] [DOI] |
| 4. | Timpl R. Macromolecular organization of basement membranes. Curr Opin Cell Biol. 1996;8:618-624. [PubMed] [DOI] |
| 5. | Burt AD. Pathobiology of hepatic stellate cells. J Gastroenterol. 1999;34:299-304. [PubMed] [DOI] |
| 6. | Pinzani M. Liver fibrosis. Springer Semin Immunopathol. 1999;21:475-490. [PubMed] [DOI] |
| 8. | Gressner AM, Weiskirchen R, Breitkopf K, Dooley S. Roles of TGF-beta in hepatic fibrosis. Front Biosci. 2002;7:d793-d807. [PubMed] [DOI] |
| 9. | Inagaki Y, Okazaki I. Emerging insights into Transforming growth factor beta Smad signal in hepatic fibrogenesis. Gut. 2007;56:284-292. [PubMed] [DOI] |
| 10. | Dooley S, Delvoux B, Lahme B, Mangasser-Stephan K, Gressner AM. Modulation of transforming growth factor beta response and signaling during transdifferentiation of rat hepatic stellate cells to myofibroblasts. Hepatology. 2000;31:1094-1106. [PubMed] [DOI] |
| 11. | Akiyoshi S, Ishii M, Nemoto N, Kawabata M, Aburatani H, Miyazono K. Targets of transcriptional regulation by transforming growth factor-beta: expression profile analysis using oligonucleotide arrays. Jpn J Cancer Res. 2001;92:257-268. [PubMed] |
| 12. | Schnabl B, Kweon YO, Frederick JP, Wang XF, Rippe RA, Brenner DA. The role of Smad3 in mediating mouse hepatic stellate cell activation. Hepatology. 2001;34:89-100. [PubMed] [DOI] |
| 13. | Breitkopf K, Godoy P, Ciuclan L, Singer MV, Dooley S. TGF-beta/Smad signaling in the injured liver. Z Gastroenterol. 2006;44:57-66. [PubMed] [DOI] |
| 16. | Wu XL, Zeng WZ, Wang PL, Lei CT, Jiang MD, Chen XB, Zhang Y, Xu H, Wang Z. Effect of compound rhodiola sachalinensis A Bor on CCl4-induced liver fibrosis in rats and its probable molecular mechanisms. World J Gastroenterol. 2003;9:1559-1562. [PubMed] |
| 17. | Neuman MG. Cytokines--central factors in alcoholic liver disease. Alcohol Res Health. 2003;27:307-316. [PubMed] |
| 18. | Wu J, Zern MA. Hepatic stellate cells: a target for the treatment of liver fibrosis. J Gastroenterol. 2000;35:665-672. [PubMed] [DOI] |