修回日期: 2010-03-31
接受日期: 2010-04-07
在线出版日期: 2010-05-28
目的: 评价新型肝靶向一氧化氮释放药物NO-040527抗小鼠肝损伤的药效学及细胞毒性, 为进一步的临床前研究开发奠定基础.
方法: 通过腹腔注射四氯化碳、D-氨基半乳糖或对乙酰氨基酚, 制备肝损伤动物模型; 分别于造模前1 h和造模后12 h灌胃给予不同剂量的待测药物, 于第2次给药后24 h, 眼眶取血, 留取血清标本, 测定血清中的ALT, AST水平. 取对数生长期的HepG2细胞, 接种于96孔培养板, 长成单层, 加入不同浓度的待测药物. 继续培养24 h, 用MTT法, 测定细胞的存活率.
结果: 肝靶向药物NO-040527能够显著降低CCl4所致小鼠肝损伤的转氨酶升高(P<0.01), 降酶作用具有良好的剂量依赖性; 在相同剂量(55 mg/kg)下, NO-040527的降酶作用强于阳性对照药NCX-1000(P<0.05). 同样, 肝靶向药物NO-040527能够显著降低对乙酰氨基酚所引起的小鼠转氨酶升高(P<0.01), 各剂量组之间降酶作用无显著性差异, 在相同剂量(55 mg/kg)下, NO-040527的降酶作用与NCX-1000相当. NO-040527对D-氨基半乳糖所致小鼠肝损伤没有保护作用, 中低剂量组的小鼠血清ALT、AST值较模型组相比没有显著差异, 高剂量组转氨酶甚至略高于模型组. NO-040527在500 μmol/L浓度显示出细胞毒性, 细胞存活率为45.96%±29.46%(P = 0.058); 在1 000 μmol/L浓度具有显著的细胞毒性(P<0.005); 在50 μmol/L和100 μmol/L浓度时, NO-040527显示出促细胞生长的作用, 细胞存活率分别为137.67%±8.47%和152.65%±10.084%, 显著高于溶剂组(P<0.05).
结论: NO-040527能够显著降低CCl4和对乙酰氨基酚所引起的小鼠转氨酶升高, 但NO-040527和NCX-1000对D-氨基半乳糖所致小鼠肝损伤没有保护作用, 高剂量甚至加重转氨酶升高. NO-040527在高浓度显示出细胞毒性, 低浓度显示出促细胞生长的作用.
引文著录: 靳雪源, 王慧芬, 李宏武, 仲伯华, 赵平. 肝靶向一氧化氮释放药物对肝损伤的抑制作用及其细胞毒性的评价. 世界华人消化杂志 2010; 18(15): 1588-1593
Revised: March 31, 2010
Accepted: April 7, 2010
Published online: May 28, 2010
AIM: To evaluate the efficacy and cytotoxicity of NO-040527, a new liver-targeted nitric oxide-releasing drug, in the treatment of liver injury induced with carbon tetrachloride, acetaminophen or D-galactosamine in mice.
METHODS: Liver injury was induced in mice by intraperitoneal injection of carbon tetrachloride, acetaminophen or D-galactosamine. NO-040527 was orally administered to animals 1 h before and 12 h after the induction of liver injury. The animals were killed 24 h after drug delivery, and blood samples were taken to determine serum ALT and AST levels using an automatic biochemical analyzer. The cytotoxicity of the targeted conjugate was determined by methyl thiazol tetrazolium (MTT) assay.
RESULTS: NO-040527 could significantly inhibit carbon tetrachloride-induced elevation of ALT and AST in mice (both P < 0.01) in a dose-dependent manner. At the same dose (55 mg/kg), NO-040527 exhibited better efficacy than control drug NCX-1000 (P < 0.05) in lowering carbon tetrachloride-induced elevation of serum ALT and AST levels. Similarly, NO-040527 could also significantly inhibit acetaminophen-induced elevation of ALT and AST (both P < 0.01) though no dose-dependent effect was noted. At the same dose (55 mg/kg), NO-040527 exhibited similar efficacy to NCX-1000 in lowering acetaminophen-induced elevation of serum ALT and AST levels. NO-040527 showed no protective effects against liver injury induced with D-galactosamine. No significant differences were noted in serum ALT and AST levels between untreated mice with D-galactosamine-induced liver injury and those treated with medium- or low-dose NO-040527. However, the levels of serum ALT and AST in mice with D-galactosamine-induced liver injury treated with high-dose NO-040527 was higher than those in untreated ones. NO-040527 at a dose of 500 μmol/L began to show cytotoxicity (cell viability rate: 45.96% ± 29.46%; P = 0.058). Significant cytotoxicity was noted when the dose of NO-040527 rose to 1000 μmol/L (P < 0.005). NO-040527 at 50 and 100 μmol/L could accelerate cell growth (cell viability rate: 137.67% ± 8.47% and 152.65% ± 10.084%, respectively; both P < 0.05).
CONCLUSION: NO-040527 has good protective effects against carbon tetrachloride- or acetaminophen-induced liver injury in mice. NO-040527 is cytotoxic when used at high dose.
- Citation: Jin XY, Wang HF, Li HW, Zhong BH, Zhao P. Efficacy and cytotoxicity of a liver-targeted nitric oxide-releasing drug in the treatment of liver injury in mice. Shijie Huaren Xiaohua Zazhi 2010; 18(15): 1588-1593
- URL: https://www.wjgnet.com/1009-3079/full/v18/i15/1588.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i15.1588
肝硬化是威胁人类健康的重大疾病. 全球5亿多乙型肝炎和丙型肝炎患者中, 25%将发展成为肝硬化; 各种原因(酒精性、肥胖、糖尿病等)引起的脂肪肝的发展也会导致肝硬化[1-3]. 门静脉高压为肝硬化的主要并发症之一, 患者会出现食管和胃底静脉曲张破裂出血、腹水等症状, 是导致肝硬化患者死亡的重要原因. 目前临床尚没有理想的治疗肝硬化或门静脉高压的药物[4]. 一氧化氮释放药物可通过释放一氧化氮分子抑制肝脏炎症的发展及肝纤维化的形成、降低门静脉高压, 进而产生治疗肝硬化和门静脉高压的疗效. 但是目前临床用于治疗肝硬化的有机硝酸酯类的一氧化氮释放药物, 由于其体内分布的非特异性, 从而产生比较广泛的全身不良反应[5]. 通过肝靶向给药技术将化学治疗药物选择性的投放于肝脏, 能够减轻或避免其全身的不良反应[6-10]. 胆汁酸是内源性的肝细胞特异性的天然配基, 包括胆酸、熊去氧胆酸等. 胆汁酸具有高度的器官特异性和较高的转运能力. 以胆酸为靶向载体, 不但能够实现药物的肝靶向性, 减少不良反应, 而且能够提高药物的口服生物利用度; 作为内源性的天然配基, 胆酸具有较好的生物兼容性[11,12]. 肝靶向一氧化氮释放药物NCX-1000为硝酸酯与肝靶向载体熊去氧胆酸(ursodeoxycholic acid, UA)的偶联物, 能够通过胆酸的特异性转运机制, 将一氧化氮供体投放于肝脏中, 在肝内代谢释放出一氧化氮, 在发挥治疗作用的同时, 减少或避免一氧化氮的全身作用[13-15]. N-熊去氧胆酰-O-硝基-L-苏氨酸(NO-040527)为军事医学科学院毒物药物研究所研发的新型肝靶向一氧化氮释放药物. 本课题的研究目标就是对新型肝靶向一氧化氮释放药物N-熊去氧胆酰-O-硝基-L-苏氨酸(NO-040527)进行抗小鼠肝损伤的初步药效学评价及细胞毒性的实验研究, 为该药物的进一步的临床前研究开发奠定基础.
Baclb/c小鼠, 体质量20-25 g, 雌雄各半, 由中国人民解放军总医院动物中心提供. 四氯化碳, 分析纯, 由北京化工厂生产; D-氨基半乳糖, 分析纯, 由南京泽众化学试剂试剂公司提供; 对乙酰氨基酚由军事医学科学院毒物药物研究所提供. NCX-1000、NO-040527及熊去氧胆酸由军事医学科学院毒物药物研究所提供, 纯度≥98%; 与1%的羧甲基纤维素钠溶液一起研磨, 制成均一的悬浮液备用. 全自动生化测定仪(Olympus AU5400, 日本). HepG2细胞, 由中国人民解放军302医院传染病研究所病毒性肝炎研究室提供. DMEM细胞培养液由中国人民解放军302医院传染病研究所病毒性肝炎研究室提供. MTT, Sigma公司; 二甲亚砜, 分析纯, 博大泰克公司(BioDev). 酶联仪(Bio-RAD Model 550, Microplate Ready, 日本).
1.2.1 抗肝损伤实验: (1)抗CCl4所致小鼠肝损伤: 将小鼠随机分组, 每组10只, 雌雄各半. 通过灌胃给予不同剂量的待测药物或生理盐水, 1 h后, 按照10 mL/kg的剂量, 腹腔注射0.1%的CCl4橄榄油溶液, 制备肝损伤模型; 皮下注射生理盐水作为正常对照组. 造模后12 h, 再次灌胃给予不同剂量的待测药物. 第2次给药后24 h, 眼眶取血, 留取血清标本, 用全自动生化仪测定血清中的ALT, AST水平. (2)抗D-氨基半乳糖所致小鼠肝损伤: 将小鼠随机分组, 每组10只, 雌雄各半. 通过灌胃给予不同剂量的待测药物或生理盐水, 1 h后, 腹腔注射800 mg/kg的D-氨基半乳糖, 制备肝损伤模型; 皮下注射生理盐水作为正常对照组. 造模后12 h, 再次灌胃给予不同剂量的待测药物. 第2次给药后24 h, 眼眶取血, 留取血清标本, 用全自动生化仪测定血清中的ALT, AST水平. (3)抗对乙酰氨基酚所致小鼠肝损伤: 将小鼠随机分组, 每组10只, 雌雄各半. 通过灌胃给予不同剂量的待测药物或生理盐水, 2 h后, 腹腔注射200 mg/kg的对乙酰氨基酚, 制备肝损伤模型; 皮下注射生理盐水作为正常对照组. 造模后12 h, 再次灌胃给予不同剂量的待测药物. 第2次给药后24 h, 眼眶取血, 留取血清标本, 用全自动生化仪测定血清中的ALT, AST水平.
1.2.2 细胞毒实验: 取对数生长期的HepG2细胞, 以1×105/mL接种96孔培养板. 在长成单层的HepG2细胞的培养板中, 加入不同浓度的受试化合物溶液, 20 μL/孔, 3复孔, 使药物终浓度分别为10、50、100、500或1 000 μmol/L, 同时设阴性对照组和空白对照组, 37 ℃、50 mL/L CO2培养箱中继续培养24 h, 弃去旧培养液, 加入含MTT 0.5 g/L的培养液, 继续培养4 h后倾去培养液, 加入二甲基亚砜200 μL/孔, 震荡溶解10 min, 酶联仪测定490 nm处的吸光度(A)值, 与溶剂组的A值比较, 按下式计算得到细胞的存活率: 存活率(%) = A药物/A溶剂.
统计学处理 应用SPSS10.1软件包进行单因素多个均数比较的方差分析, 在作方差齐性检验后, 进行各组数据两两之间的均数比较.
实验期间正常组动物精力充沛, 活跃灵活, 饮食正常, 皮毛整洁, 无死亡, 模型组动物有不同程度的精神萎靡、活动迟钝、饮食减少、皮毛凌乱等表现. 给药组动物的精神、饮食等整体情况明显优于对照组, 但较正常组稍差. 与正常对照组比较, 生理盐水组的ALT、AST均明显高于正常对照组, 说明造模成功.
2.1.1 对CCl4所致小鼠肝损伤的抑制作用: NO-040527治疗三个剂量组的小鼠血清ALT、AST值以及NCX-1000组较模型组均显著降低(P<0.01), 说明各治疗组均有降低转氨酶的作用, 靶向一氧化氮释放药物能够同时降低ALT和AST; NO-040527降低转氨酶的作用与给药剂量成正相关, 具有良好的剂量依赖性(P<0.01); 在相同剂量(55 mg/kg)下, NO-040527的降酶作用强于NCX-1000(P<0.05). 而载体熊去氧胆酸在110 mg/kg对转氨酶没有降低作用(表1).
| 分组 | 剂量(mg/kg) | CCl4 | 对乙酰氨基酚 | D-氨基半乳糖 | |||
| ALT | AST | ALT | AST | ALT | AST | ||
| 正常对照 | 394±141 | 499±468 | 394±141 | 499±468 | 316±68 | 1 440±311 | |
| 生理盐水 | 4 492±5 607d | 4 060±1 335d | 3 276±3 980d | 3 875±2 489d | 1 269±751d | 2 691±649d | |
| NO-040527 | 27 | 1 740±2 399b | 2 572±2 719b | 1 487±1 361b | 2 077±909b | 1 062±710 | 2 948±1 630 |
| 55 | 861±496b | 1 220±1 065b | 1 261±1 297b | 1 901±763b | 1 296±1 029 | 3 773±1 805a | |
| 110 | 566±198b | 872±814b | 1 118±1 056b | 1 546±947b | 1 417±1 907 | 3 586±3 298a | |
| NX-1000 | 55 | 1 903±1 266b | 3 233±913b | 1 904±1 172b | 2 377±493b | 4 465±3 644a | 7 532±5 391a |
| UB | 110 | 4 977±6 364 | 3 731±1 791 | 3 297±1 641 | 3 769±2 240 | ND | ND |
2.1.2 对对乙酰氨基酚所致小鼠肝损伤的保护作用: NO-040527治疗三个剂量组的小鼠血清ALT、AST值以及NCX-1000组较模型组均显著降低(P<0.01), 说明各治疗组均有降低转氨酶的作用, 靶向一氧化氮释放药物能够同时降低ALT和AST. NO-040527药物各剂量组之间降低转氨酶的作用无显著差异, 在相同剂量(55 mg/kg)下, NO-040527的降酶作用与NCX-1000相当. 而载体熊去氧胆酸在110 mg/kg对转氨酶没有降低作用. 与CCl4所致小鼠肝损伤及对乙酰氨基酚所致小鼠肝损伤模型的结果不同, 肝靶向药物NO-040527对D-氨基半乳糖所致小鼠肝损伤没有保护作用(表1).
2.1.3 对D-氨基半乳糖所致小鼠肝损伤的作用: NO-040527治疗中低剂量组的小鼠血清ALT、AST值较模型组相比没有显著差异, 高剂量组转氨酶甚至略高于模型组; 在55 mg/kg剂量下, NCX-1000能够导致转氨酶显著的进一步升高(表1).
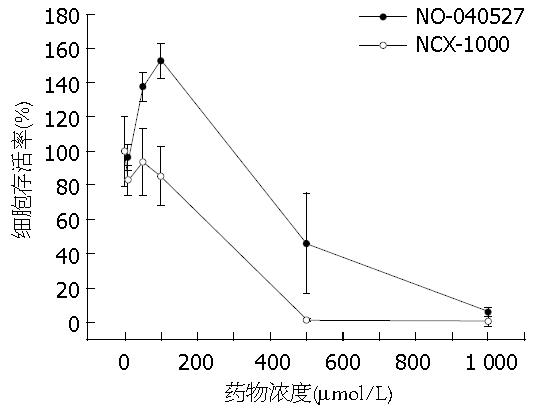
NO-040527的细胞毒性略低于NCX-1000. NO-040527在500 μmol/L浓度显示出细胞毒性, 细胞存活率为45.96%±29.46%, 但是由于数据波动较大, 与溶剂组相比, 差异不显著(P = 0.058); 在1 000 μmol/L浓度具有显著的细胞毒性, 细胞存活率(5.78%±2.47%)显著低于溶剂组(P<0.005); 在50和100 μmol/L浓度时, NO-040527还显示出促细胞生长的作用, 细胞存活率分别为137.67%±8.47%和152.65%±10.084%, 显著高于溶剂组(P<0.05). NCX-1000在500 μmol/L时即显示出明显的细胞毒性, 细胞存活率为1.06%±0.53%, 显著低于溶剂组(P<0.005, 图1).
门静脉高压为肝硬化的主要并发症之一, 患者会出现食管和胃底静脉曲张破裂出血、腹水等症状, 是导致肝硬化患者死亡的重要原因. 有研究发现[16,17], 肝血管紧张度的增加引起肝硬化门静脉的升高, 因此, 使用血管舒张剂不但能够通过增加肝脏血流量降低门静脉高压, 而且能够改善肝功[18]. 但是, 已有的血管舒张剂能够引起系统和脏器的血管舒张, 导致低血压, 从而加重肝硬化患者业已存在的水钠潴留, 腹水和肾功能障碍[19,20].
对NO与肝硬化关系的研究结果表明, 肝内NO释放的不足是增加肝硬化血管紧张度的主要因素之一[21,22]. 因此, 理想的治疗策略是给肝脏提供足够的NO, 而不增加循环中的NO, 因为肝硬化时循环中的NO已经过量. 肝靶向NO释放药物能够通过胆酸的特异性转运机制, 将NO供体投放于肝脏中, 在肝内代谢释放出NO, 在发挥治疗作用的同时, 减少或避免NO的全身作用. 因此, 肝靶向NO释放药物有可能成为肝硬化门静脉高压的理想的治疗药物[23].
N-熊去氧胆酰-O-硝基-L-苏氨酸(NO-040527)为军事医学科学院毒物药物研究所研发的新型肝靶向NO释放药物. 与NCX-1000相比, NO-040527分子中的一氧化氮释放成分苏氨酸的硝酸酯, 以酰胺键与熊去氧胆酸连接形成的偶合物, 保证了偶合物在血浆中的稳定性; 而进入靶细胞后, 硝酸酯与细胞中的巯基形成不稳定的S-亚硝基硫化物, 进一步分解释放出NO分子, 发挥药理作用. 间隔基为天然氨基酸, 具有良好的生物兼容性. 本课题对NO-040527进行了初步的实验研究, 考察了其对急性肝损伤的抑制作用, 为进一步的研究开发奠定了基础.
在抗肝损伤的评价方面, 我们选择致病机制不同的三种肝损伤模型. 四氯化碳所致肝损伤主要与其活性代谢产物三氯甲基自由基和氯自由基有关, 这些自由基可与细胞膜和细胞内的大分子发生共价结合, 使酶的功能失活, 细胞基质过氧化, 胞质钙浓度升高, 导致肝细胞损伤坏死, 胞质内氨基转移酶进入血液, 引起血中转氨酶浓度升高; D-氨基半乳糖所致肝损伤与其在肝内的代谢及随后对核酸合成的影响有关, 通过特异性消耗肝细胞内尿嘧啶核苷, 影响肝细胞核酸代谢; 对乙酰氨基酚通过代谢过程中产生的N-乙酰对苯醌亚胺产生肝脏毒性[24]. CCl4、D-氨基半乳糖及对乙酰氨基酚所致的动物肝损伤表现为血清转氨酶的升高; 动物中毒后血清转氨酶升高的水平与肝细胞损伤程度密切相关. 因此, 通过测定血中转氨酶的变化能够方便的评价药物的抗肝损伤作用.
根据测定结果, 我们首次发现肝靶向NO释放药物对致病机制不同的肝损伤可能具有不同的作用. NO-040527能够显著降低CCl4所致小鼠肝损伤的转氨酶升高, 降酶作用具有良好的剂量依赖性, 在相同剂量(55 mg/kg)下, NO-040527的降酶作用强于NCX-1000; 对于对乙酰氨基酚所致肝损伤, NO-040527也能显著降低转氨酶, 但是各剂量组之间无显著差异, 在相同剂量(55 mg/kg)下, NO-040527的降酶作用与NCX-1000相当; 对D-氨基半乳糖所致小鼠肝损伤, 靶向药物中低剂量组小鼠血清ALT、AST值较模型组相比没有显著差异, 高剂量组转氨酶甚至略高于模型组.
有研究表明, 在LPS联合氨基半乳糖所致急性肝损伤中, 动物体内NO生物合成机制被激活是其肝细胞损伤的重要机制之一. 在细胞因子(如TNF2α、内毒素等)的诱导下, 广泛存在于巨噬细胞、肝细胞、中性粒细胞和淋巴细胞等细胞中的诱导性一氧化氮合成酶(iNOS)激活, 产生NO, NO再通过多种途径对凋亡产生影响. 超过正常水平的低剂量NO能损伤线粒体造成DNA受损, 诱发细胞凋亡; 而大剂量NO则主要是直接损伤细胞膜和DNA, 导致细胞的大量坏死. NO、细胞凋亡及细胞坏死三者之间存在的密切关系: NO产生早期, 细胞损伤以凋亡为主. 随着NO产生量的增加, 细胞开始发生坏死, 并随时间的延长, 细胞损伤也逐步以坏死为主, 直至肝组织大片坏死, 肝功能衰竭而致动物死亡[25]. 肝靶向NO释放药物可能通过进一步释放NO, 加重氨基半乳糖所致的肝损伤.
一氧化氮在发挥有益的生理功能的同时, 也会产生细胞毒性等不良反应. 作用部位NO的浓度不同, 其作用不同甚至相反; 持续低浓度的NO具有肝保护作用, 而高浓度NO则通过产生细胞毒性, 诱导细胞凋亡造成肝损伤. 因此, 我们用MTT法测定了靶向药物对肝癌细胞的细胞毒性, 发现药物在不同浓度下对细胞有不同的作用. NO-040527在500 μmol/L浓度显示出细胞毒性, 细胞存活率为45.96±29.46%, 但是与溶剂组相比, 差异不显著(P = 0.058); 在1 000 μmol/L浓度具有显著的细胞毒性, 细胞存活率(5.78%±2.47%)显著低于溶剂组(P<0.005); 但是在50和100 μmol/L浓度时, NO-040527显示出促细胞生长的作用, 细胞存活率分别为137.67%±8.47%和152.65%±10.084%, 显著高于溶剂组(P<0.05). NCX-1000在500 μmol/L时即显示出明显的细胞毒性.
肝硬化是威胁人类健康的重大疾病, 门静脉高压为肝硬化的主要并发症之一, 是导致肝硬化患者死亡的重要原因. 一氧化氮释放药物可通过释放一氧化氮分子抑制肝脏炎症的发展及肝纤维化的形成、降低门静脉高压, 进而产生治疗肝硬化和门静脉高压的疗效.
黄园, 教授, 四川大学华西药学院药剂系.
通过肝靶向给药技术将化学治疗药物选择性的投放于肝脏, 能够减轻或避免其全身的不良反应. 胆汁酸是内源性的肝细胞特异性的天然配基, 具有较好的生物兼容性、高度的器官特异性和较高的转运能力. 以胆酸为靶向载体, 不但能够实现药物的肝靶向性, 减少不良反应, 而且能够提高口服生物利用度.
Fiorucci等报道了肝靶向一氧化氮释放药物NCX-1000为硝酸酯与肝靶向载体熊去氧胆酸的偶联物. 该偶合物能够通过胆酸的特异性转运机制, 将一氧化氮供体投放于肝脏中, 在肝内代谢释放出一氧化氮, 在发挥治疗作用的同时, 减少或避免一氧化氮的全身作用.
本文报道的肝靶向一氧化氮释放药物NO-040527将一氧化氮释放成分苏氨酸的硝酸酯, 以酰胺键与熊去氧胆酸连接形成偶合物, 保证了偶合物在血浆中的稳定性; 而进入靶细胞后, 硝酸酯与细胞中的巯基形成不稳定的S-亚硝基硫化物, 进一步分解释放出NO分子, 发挥药理作用. 间隔基为天然氨基酸, 具有良好的生物兼容性.
本课题对NO-040527进行了初步的实验研究, 考察了其对急性肝损伤的抑制作用, 为进一步的研发肝硬化治疗药物奠定了基础.
本研究选题有临床意义, 具有一定的参考价值.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Lubel JS, Angus PW. Modern management of portal hypertension. Intern Med J. 2005;35:45-49. [PubMed] [DOI] |
| 2. | Sass DA, Chang P, Chopra KB. Nonalcoholic fatty liver disease: a clinical review. Dig Dis Sci. 2005;50:171-180. [PubMed] [DOI] |
| 3. | Lefton HB, Rosa A, Cohen M. Diagnosis and epidemiology of cirrhosis. Med Clin North Am. 2009;93:787-99, vii. [PubMed] [DOI] |
| 6. | Levy GA, Adamson G, Phillips MJ, Scrocchi LA, Fung L, Biessels P, Ng NF, Ghanekar A, Rowe A, Ma MX. Targeted delivery of ribavirin improves outcome of murine viral fulminant hepatitis via enhanced anti-viral activity. Hepatology. 2006;43:581-591. [PubMed] [DOI] |
| 8. | Biessen EA, Valentijn AR, De Vrueh RL, Van De Bilt E, Sliedregt LA, Prince P, Bijsterbosch MK, Van Boom JH, Van Der Marel GA, Abrahams PJ. Novel hepatotrophic prodrugs of the antiviral nucleoside 9-(2-phosphonylmethoxyethyl)adenine with improved pharmacokinetics and antiviral activity. FASEB J. 2000;14:1784-1792. [PubMed] [DOI] |
| 9. | Bijsterbosch MK, Ying C, de Vrueh RL, de Clercq E, Biessen EA, Neyts J, van Berkel TJ. Carrier-mediated delivery improves the efficacy of 9-(2-phosphonylmethoxyethyl)adenine against hepatitis B virus. Mol Pharmacol. 2001;60:521-527. [PubMed] |
| 10. | Di Stefano G, Fiume L, Domenicali M, Busi C, Chieco P, Kratz F, Lanza M, Mattioli A, Pariali M, Bernardi M. Doxorubicin coupled to lactosaminated albumin: Effects on rats with liver fibrosis and cirrhosis. Dig Liver Dis. 2006;38:404-408. [PubMed] [DOI] |
| 11. | Trauner M, Boyer JL. Bile salt transporters: molecular characterization, function, and regulation. Physiol Rev. 2003;83:633-671. [PubMed] [DOI] |
| 13. | Fiorucci S, Antonelli E, Brancaleone V, Sanpaolo L, Orlandi S, Distrutti E, Acuto G, Clerici C, Baldoni M, Del Soldato P. NCX-1000, a nitric oxide-releasing derivative of ursodeoxycholic acid, ameliorates portal hypertension and lowers norepinephrine-induced intrahepatic resistance in the isolated and perfused rat liver. J Hepatol. 2003;39:932-939. [PubMed] [DOI] |
| 14. | Fiorucci S, Antonelli E, Distrutti E, Mencarelli A, Farneti S, Del Soldato P, Morelli A. Liver delivery of NO by NCX-1000 protects against acute liver failure and mitochondrial dysfunction induced by APAP in mice. Br J Pharmacol. 2004;143:33-42. [PubMed] [DOI] |
| 15. | Fiorucci S, Antonelli E, Tocchetti P, Morelli A. Treatment of portal hypertension with NCX-1000, a liver-specific NO donor. A review of its current status. Cardiovasc Drug Rev. 2004;22:135-146. [PubMed] [DOI] |
| 16. | Bosch J, García-Pagán JC, Feu F, Luca A, Fernández M, Pizcueta P, Rodés J. New approaches in the pharmacologic treatment of portal hypertension. J Hepatol. 1993;17 Suppl 2:S41-S45. [PubMed] [DOI] |
| 17. | Bosch J, Abraldes JG, Groszmann R. Current management of portal hypertension. J Hepatol. 2003;38 Suppl 1:S54-S68. [PubMed] [DOI] |
| 18. | Navasa M, Bosch J, Reichen J, Bru C, Mastai R, Zysset T, Silva G, Chesta J, Rodés J. Effects of verapamil on hepatic and systemic hemodynamics and liver function in patients with cirrhosis and portal hypertension. Hepatology. 1988;8:850-854. [PubMed] [DOI] |
| 19. | Wiest R, Groszmann RJ. The paradox of nitric oxide in cirrhosis and portal hypertension: too much, not enough. Hepatology. 2002;35:478-491. [PubMed] [DOI] |
| 20. | Salmerón JM, Ruiz del Arbol L, Ginès A, García-Pagán JC, Ginès P, Feu F, Claria J, Rivera F, Bosch J, Arroyo V. Renal effects of acute isosorbide-5-mononitrate administration in cirrhosis. Hepatology. 1993;17:800-806. [PubMed] |
| 21. | Gupta TK, Toruner M, Chung MK, Groszmann RJ. Endothelial dysfunction and decreased production of nitric oxide in the intrahepatic microcirculation of cirrhotic rats. Hepatology. 1998;28:926-931. [PubMed] [DOI] |
| 22. | Mittal MK, Gupta TK, Lee FY, Sieber CC, Groszmann RJ. Nitric oxide modulates hepatic vascular tone in normal rat liver. Am J Physiol. 1994;267:G416-G422. [PubMed] |
| 23. | Wiest R, Groszmann RJ. Nitric oxide and portal hypertension: its role in the regulation of intrahepatic and splanchnic vascular resistance. Semin Liver Dis. 1999;19:411-426. [PubMed] [DOI] |
| 24. | 黄 正明, 杨 新波. 抗肝炎中药现代研究与应用. 郑州: 郑州大学出版社 2006; 312-329. |
| 25. | Morikawa A, Kato Y, Sugiyama T, Koide N, Chakravortty D, Yoshida T, Yokochi T. Role of nitric oxide in lipopolysaccharide-induced hepatic injury in D-galactosamine-sensitized mice as an experimental endotoxic shock model. Infect Immun. 1999;67:1018-1024. [PubMed] |