修回日期: 2009-07-07
接受日期: 2009-07-13
在线出版日期: 2009-08-08
目的: 观察食管鳞癌组织、癌旁正常黏膜中环氧化酶-2(COX-2)及基质金属蛋白酶-9(MMP-9)的表达及其与微血管密度(MVD)的关系, 探讨COX-2和MMP-9对食管鳞癌血管生成的作用与意义.
方法: 应用SP法对90例食管鳞癌组织和34例癌旁正常黏膜的COX-2、MMP-9及CD34进行免疫组织化学染色, 检测癌组织、癌旁正常食管黏膜组织的COX-2与MMP-9表达及MVD, 并分析COX-2、MMP-9的表达与MVD之间, 以及他们与食管鳞癌临床病理特征之间的关系.
结果: 食管鳞癌组织中COX-2、MMP-9的阳性表达率和MVD分别为84.8%、82.2%和29.70±3.82, 显著高于癌旁正常黏膜的20.6%、14.7%和15.1±2.38. COX-2的表达与肿瘤的TNM分期、分化程度和淋巴结转移密切相关(P<0.01). MMP-9、MVD的表达与肿瘤的TNM分期和淋巴结转移密切相关(P<0.01); COX-2表达与MVD呈显著正相关(r = 0.607, P<0.01); COX-2与MMP-9的表达正相关(r = 0.740, P<0.01); MMP-9的表达与MVD值之间呈正相关(r = 0.718, P<0.01).
结论: COX-2与MMP-9异常表达在食管鳞癌的血管生成中起重要作用, COX-2、MMP-9及其诱导的血管生成与食管鳞癌的侵袭和转移密切相关.
引文著录: 产松苗, 欧希龙, 孙为豪, 陈国胜, 颜芳. COX-2和MMP-9在食管鳞癌组织中的表达及其与血管生成的关系. 世界华人消化杂志 2009; 17(22): 2259-2265
Revised: July 7, 2009
Accepted: July 13, 2009
Published online: August 8, 2009
AIM: To investigate the expression of COX-2 and MMP-9 in human esophageal squamous cell carcinoma and explore its correlation with angiogenesis.
METHODS: Ninety tumor specimens from patients with esophageal squamous cell carcinoma were obtained, and 34 corresponding paracancerous normal tissues were randomly selected as controls. Immunohistochemical staining was used for detecting the expression of COX-2 and MMP-9. Monoclonal antibody against CD34 was used for displaying vascular endothelial cells, and microvascular density (MVD) was determined by counting of CD34-positive vascular endothelial cells.
RESULTS: The positive expression rates of COX-2 and MMP-9 and MVD in esophageal squamous cell carcinoma were significantly higher than those in the normal esophageal mucosa (84.8% vs 20.6%, 82.2% vs 14.7% and 29.70 ± 3.82 vs 15.10 ± 2.38, respectively; all P < 0.01).The expression of COX-2 was closely related to UICC-AJCC TMN stage, cellular differentiation and lymph node metastasis (all P < 0.01), while the expression of MMP-9 and MVD was closely related to UICC-AJCC TMN stage and lymph node metastasis (both P < 0.01). COX-2 expression was positively correlated to MVD (r = 0.607, P < 0.01) and MMP-9 expression (r = 0.740, P < 0.01), while MMP-9 expression was also positively correlated to MVD (r = 0.718, P < 0.01).
CONCLUSION: Both COX-2 and MMP-9 play an important role in the angiogenesis of esophageal squamous cell carcinoma. The expression of COX-2 and MMP-9 and tumor neovascularization are closely related to tumor invasion and lymph node metastasis.
- Citation: Chan SM, Ou XL, Sun WH, Chen GS, Yan F. Expression of cyclooxygenase-2 and matrix metalloproteinase-9 in human esophageal squamous cell carcinoma and its correlation with angiogenesis. Shijie Huaren Xiaohua Zazhi 2009; 17(22): 2259-2265
- URL: https://www.wjgnet.com/1009-3079/full/v17/i22/2259.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i22.2259
环氧化酶(cyclooxygenase, COX)是花生四烯酸(arachidonic acid, AA)合成前列腺素(prostaglandins, PGs)过程中一个重要的限速酶, 其中的COX-2是一种诱导酶, 他合成的PGs与炎症、细胞增殖等病理生理作用有关, COX-2在多种肿瘤尤其是消化系肿瘤组织及相应的肿瘤细胞株中表达上调[1]. COX-2能诱导肿瘤血管生成, 增加肿瘤细胞的侵袭力, 促进肿瘤的远处转移和周围组织的侵袭. 基质金属蛋白酶家族(matrix metalloproteinases, MMPs)是一大类锌依赖性内肽酶家族, 实验资料表明MMPs在肿瘤的浸润和转移中起重要作用[2-3]. 基质金属蛋白酶-9(matrix metalloproteinase-9, MMP-9)是MMPs家族中相对分子质量最大的一个酶, 主要由巨噬细胞、毛细血管内皮细胞、中性粒细胞、恶性肿瘤细胞等分泌产生. MMP-9最主要的功能是降解细胞外基质中的Ⅳ、Ⅴ型胶原和明胶. 血管生成(angiogenesis)是指从已有的毛细血管或毛细血管后静脉发展而成的新生血管的过程. 恶性肿瘤的生长、浸润和转移必须依赖肿瘤血管生成, 微血管密度(microvascular density, MVD)是反映恶性肿瘤侵袭和转移等生物学行为的一个重要指标[4-5]. 以抗CD34抗体标记微血管内皮细胞计算MVD. 本研究采用免疫组织化学的方法, 检测食管鳞癌组织和癌旁正常黏膜中的COX-2、MMP-9和CD34表达并计数MVD, 旨在探讨COX-2、MMP-9表达与MVD间及其与食管鳞癌主要临床病理特征的关系.
2001-07/2005-07上海梅山医院和中大医院食管鳞癌新鲜手术切除及存档标本90例, 其中男76例, 女14例, 年龄40-75(中位年龄62)岁; 有淋巴结转移者53例, 无淋巴结转移37例; 肿瘤位于食管上段13例, 中下段77例. 根据组织学分类系统分溃疡型鳞癌57例, 覃伞型鳞癌18例, 髓质型鳞癌10例, 缩窄型鳞癌5例; 其中高分化鳞癌26例, 中分化鳞癌30例, 低分化鳞癌34例; 根据国际抗癌联盟(UICC)美国抗癌联合会(AJCC)的TNM分期标准[6]分为Ⅰ+Ⅱ期34例, Ⅲ+Ⅳ期56例; 所有病例均经HE染色证实为食管鳞癌, 且术前均未接受过非甾体类抗炎药治疗及放、化疗或其他抗肿瘤治疗. 所有标本均经40 g/L甲醛溶液固定24 h后取肿瘤中心部分制成蜡块连续切片, 另随机选择34例距肿瘤5 cm以上且经病理证实为正常食管黏膜的组织作为对照.
免疫组织化学染色采用链霉素-生物素过氧化物酶(SP)染色法, SP免疫组织化学试剂盒及一抗均购自北京中山生物技术有限公司. 具体操作步骤按SP免疫组织化学试剂盒说明书进行. 石蜡包埋的标本层厚4 μm连续切片, 常规脱蜡至水. 切片置10 mmol/L柠檬酸缓冲液(pH6.1)中, 微波加热(95℃, 10 min)修复抗原, 3 mL/L过氧化氢甲醇溶液室温孵育30 min阻断内源性过氧化物酶活性. 滴加一抗: 鼠抗人COX-2 mAb、鼠抗人MMP-9 mAb和鼠抗人CD34 mAb, 工作液浓度分别为1:180、1:40和1:80, 均为浓缩型产品. 4℃过夜孵育; PBS淋洗3次, 每次5 min, 滴加生物素化二抗, 37℃孵育60 min; PBS淋洗3次, 每次5 min, 滴加SP溶液, 37℃孵育20 min; PBS淋洗3次, 每次5 min, DAB显色. 细胞核用苏木素复染1 min, 中性树脂封片. 用已知阳性乳腺癌组织照片作阳性对照, 以PBS替代一抗作阴性对照. COX-2蛋白阳性染色为细胞质和细胞核中出现棕黄色颗粒, MMP-9蛋白阳性染色为细胞质出现棕黄色颗粒, 两者均根据阳性染色细胞百分率和阳性细胞着色强度进行半定量分析, 阳性细胞率以计数5个高倍视野为准, ≤4%为0分, 5%-29%为1分, 30%-59%为2分, ≥60%为3分. 基本未着色染色, 色强度与背景相似者为0分; 着色浅, 略高于背景色为1分; 中等着色, 明显高与背景色为2分; 强染, 着色深者为3分. 两项相加为4级: 0-1分为阴性(-), 2分为弱阳性(+), 3-4分为中等强度阳性(++), 5分以上为强阳性(+++). 阳性表达率以表达阳性的病例(包括弱阳性、中等阳性和强阳性之和)占总病例数的百分比表示. 按Weidner[7]推荐的方法, 在肿瘤区凡是染成棕黄色的单个内皮细胞或内皮细胞簇均作为一个血管计数, 每例首先在低倍镜下(×100)选择微血管密度最高的肿瘤区域即"热点"(hotspot), 然后在高倍光镜下(×400), 随机计数5个视野内微血管数, 再求其平均值为MVD. 计数时管腔直径<50 μm者判为微血管, 直径>50 μm或管壁含有肌层者不作为微血管计数, 另外单个染色细胞或成群无管腔的染色细胞也作为独立微血管计数.
统计学处理 MVD以mean±SD表示, 计数资料采用χ2检验; 计量资料采用t检验与方差分析; 等级相关采用Spearman等级相关分析. 所有数据均采用SPSS13.0统计软件进行分析, P<0.05表示差异有显著意义.
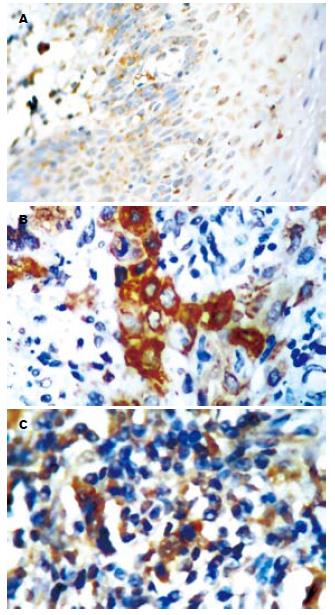
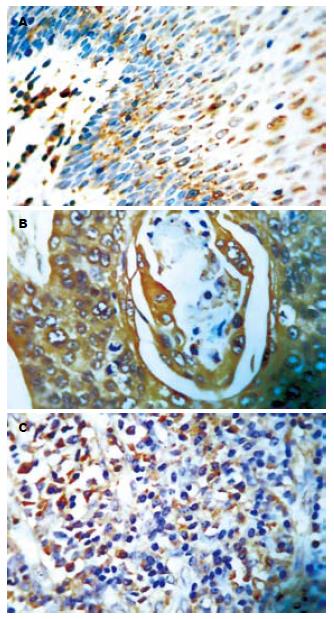
90例食管鳞癌组织中COX-2阳性表达76例, 其中(+)2例, (++)20例, (+++)54例, 阳性表达率为84.8%(76/90), 与正常上皮组20.6%(7/34)相比明显增加(且正常上皮组COX-2的表达均为弱阳性), 异常有统计学意义(P<0.01, 表1); 肿瘤组织中阳性染色主要见于肿瘤细胞的胞质中, 棕黄色颗粒状呈弥漫性分布于整个胞质或沿核膜周边呈线状分布, 癌周的粒细胞、纤维母细胞、淋巴细胞、血管内皮细胞可见少量表达, 浸润至淋巴结的癌细胞亦可见阳性染色(图1). COX-2表达与患者年龄、性别以及肿瘤组织学类型、肿瘤部位均无关(P>0.05), 而与肿瘤的TNM分期、分化程度和淋巴结转移呈正相关(P<0.01, 表2). TNM分期中Ⅲ+Ⅳ期及高中分化的食管鳞癌组织中COX-2表达率为92.9%, 显著高于Ⅰ+Ⅱ期和低分化的70.6%(P<0.01). 伴有淋巴结转移的食管鳞癌组织中COX-2表达率为94.3%, 显著高于无淋巴结转移的70.3%(P<0.01).
| 临床病理特征 | n | COX-2表达 | MMP-9表达 | MVD | P值 | ||||||
| 阳性(n) | 阴性(n) | 阳性率(%) | P值 | 阳性(n) | 阴性(n) | 阳性率(%) | P值 | ||||
| 年龄(岁) | |||||||||||
| <60 | 33 | 28 | 5 | 84.8 | 27 | 6 | 81.8 | 29.01±2.51 | |||
| ≥60 | 57 | 48 | 9 | 84.2 | 0.936 | 47 | 10 | 82.5 | 0.939 | 30.06±4.37 | 0.210 |
| 性别 | |||||||||||
| 男 | 76 | 66 | 10 | 86.8 | 62 | 14 | 81.6 | 29.68±3.84 | |||
| 女 | 14 | 10 | 4 | 71.4 | 0.144 | 12 | 2 | 85.7 | 0.710 | 29.67±3.78 | 0.996 |
| 肿瘤部位 | |||||||||||
| 上段 | 13 | 9 | 4 | 69.2 | 8 | 5 | 69.2 | 31.37±4.31 | |||
| 中下段 | 77 | 67 | 10 | 87.0 | 0.102 | 66 | 11 | 84.4 | 0.185 | 29.39±3.67 | 0.083 |
| TNM分期 | |||||||||||
| Ⅰ+Ⅱ | 34 | 24 | 10 | 70.6 | 23 | 11 | 67.6 | 26.74±2.06 | |||
| Ⅲ+Ⅳ | 56 | 52 | 4 | 92.9 | 0.005 | 51 | 5 | 91.1 | 0.005 | 31.46±3.52 | 0.000 |
| 组织学类型 | |||||||||||
| 溃疡型 | 57 | 48 | 9 | 84.2 | 47 | 10 | 82.5 | 29.44±4.10 | |||
| 覃伞型 | 18 | 16 | 2 | 88.9 | 15 | 3 | 83.3 | 29.50±3.83 | |||
| 髓质型 | 10 | 8 | 2 | 80.0 | 8 | 2 | 80.0 | 31.25±2.75 | |||
| 缩窄型 | 5 | 4 | 1 | 80.0 | 0.075 | 4 | 1 | 80.0 | 0.081 | 29.90±1.18 | 0.694 |
| 分化程度 | |||||||||||
| 低分化 | 34 | 24 | 10 | 70.6 | 30 | 4 | 88.2 | 29.28±2.93 | |||
| 高、中分化 | 56 | 52 | 4 | 92.9 | 0.005 | 44 | 12 | 78.6 | 0.245 | 29.92±4.27 | 0.447 |
| 淋巴结转移 | |||||||||||
| 无 | 37 | 26 | 11 | 70.3 | 25 | 12 | 67.5 | 26.76±2.01 | |||
| 有 | 53 | 50 | 3 | 94.3 | 0.002 | 49 | 4 | 92.5 | 0.002 | 31.72±3.43 | 0.000 |
90例食管鳞癌组中COX-2阳性表达74例, 其中(+)4例, (++)26例, (+++)44例, 阳性表达率为82.2%(74/90), 与正常上皮组14.7%(5/34)相比明显增加(且正常上皮组COX-2的表达均为弱阳性), 异常有统计学意义(P<0.01, 表1); 肿瘤组织中阳性染色主要见于癌周浸润的粒细胞、成纤维细胞、血管内皮细胞可见少量表达, 而在癌巢周边、侵袭性癌细胞中的MMP-9表达水平明显上调(图2). MMP-9表达与患者年龄、性别以及肿瘤组织学类型、分化程度、肿瘤部位均无关(P>0.05), 与肿瘤的TNM分期和淋巴结转移呈正相关(P<0.01, 表2). TNM分期中Ⅲ+Ⅳ期的食管鳞癌组织中MMP-9表达率为91.1%, 显著高于Ⅰ+Ⅱ期的67.6%(P<0.01). 伴有淋巴结转移的食管鳞癌组织中MMP-9表达率为92.5%, 显著高于无淋巴结转移的67.5%(P<0.01).
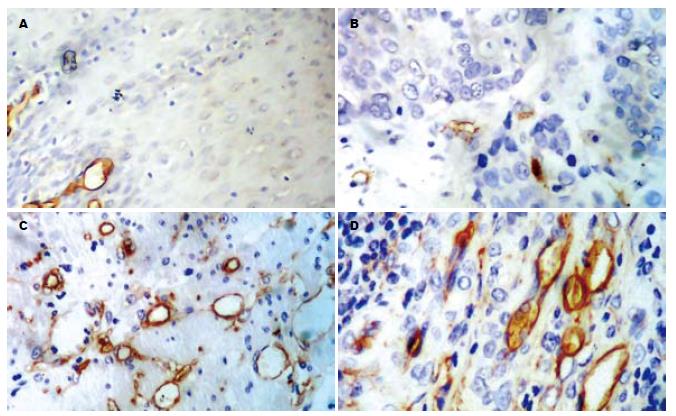
CD34免疫染色定位于大部分毛细微血管和单个内皮细胞. 癌区组织中微血管形态不规整, 分布不均, 肿瘤与周围组织交界的浸润缘血管最密集, 呈棕褐色、深染, 成簇状、逗点状、小管状或条索状、部分呈发芽状, 肌间血管也清晰可辨; 切缘区组织中微血管分布较少且均匀(图3). 癌组织MVD范围为23.0-38.0, 均数为29.70±3.82; 癌旁正常食管黏膜MVD值最高为24.0, 最低为8.0, 平均数为15.10±2.38. 食管鳞癌组织MVD值与癌旁正常食管黏膜相比, 差异有显著性(表1). MVD表达与患者年龄、性别以及肿瘤组织学类型、分化程度、肿瘤部位均无关(P>0.05), 与肿瘤的TNM分期和淋巴结转移呈正相关(P<0.01, 表2). TNM分期中Ⅲ+Ⅳ期的食管鳞癌组织中MVD值为31.46±3.52, 显著高于Ⅰ+Ⅱ期的26.74±2.06(P<0.01). 伴有淋巴结转移的食管鳞癌组织中MVD为31.72±3.43, 显著高于无淋巴结转移的26.76±2.01(P<0.01). COX-2表达(-)、(+)、(++)和(+++)食管鳞癌标本的MVD分别为24.68±0.87、26.45±0.64、29.45±2.95和31.18±3.43). 方差分析组间MVD差异有统计意义(F = 17.71, P<0.01). MMP-9表达(-)、(+)、(++)和(+++)食管鳞癌标本的MVD分别为24.88±1.00、26.20±0.68、29.69±3.26和31.73±3.08. 方差分析组间MVD差异有统计意义(F = 24.99, P<0.01). Spearman等级相关分析, COX-2表达与MVD呈显著正相关(r = 0.607, P<0.01); MMP-9的表达与MVD值之间呈正相关(r = 0.718, P<0.01); COX-2与MMP-9的表达正相关(r =0. 740, P<0.01, 表3).
| MMP-9表达 | COX-2表达 | 合计 | |||
| - | + | ++ | +++ | ||
| - | 8 | 1 | 5 | 2 | 16 |
| + | 1 | 1 | 1 | 1 | 4 |
| ++ | 3 | 0 | 7 | 16 | 26 |
| +++ | 2 | 0 | 7 | 35 | 44 |
| 合计 | 14 | 2 | 20 | 54 | 90 |
我们前期的多项研究证实, COX-2在多种肿瘤尤其是消化系肿瘤组织中表达上调[8]. COX-2表达在食管癌发生、发展中作用的机制是有: 抑制细胞凋亡, 诱导肿瘤血管生成, 增加肿瘤细胞的侵袭力, 免疫抑制作用, 诱导前致癌物的活性等途径. 在COX-2过度表达的肿瘤中各种PGs代谢产物增加, 其中以TXA2、PGE2尤为明显, 他们在COX-2促进肿瘤血管形成的过程中起到了重要的作用. 选择性COX-2抑制剂NS398对食管癌细胞增殖的抑制作用是通过PGE2机制实现的[9]. COX-2的过度表达直接上调使细胞外基质降解的MMP-9而降解细胞外基质, 促进肿瘤的侵袭和转移, 在肿瘤转移中发挥重要的作用[10-11]. 有研究显示, COX-2不仅在肿瘤细胞表达, 而且在肿瘤组织中的新生血管内皮细胞、基质的单核细胞、巨噬细胞及纤维母细胞内高表达, COX-2的表达水平与肿瘤组织中的MVD及血管内皮生长因子(vascular endothelial growth factor, VEGF) mRNA含量正相关, 运用COX-2选择性抑制剂可显著抑制实验动物肿瘤的血管生成, 提示促进血管生成有可能是COX-2促进肿瘤发生、发展的重要机制[12-13].
Zimmermann et al[14]报道, COX-2在食管鳞癌中阳性表达率为91%(156/172), 我们的研究提示其阳性表达率为84.8%; Ratnasinghe et al[15]应用免疫组织化学方法检测食管鳞癌和正常食管鳞状上皮中COX-2表达, 结果发现在高分化食管鳞癌中COX-2表达强阳性, 而低分化鳞癌COX-2表达阴性. 这与我们的实验结果相符. 我们还发现, COX-2表达与食管鳞癌的TNM分期以及淋巴结转移呈正相关, 另有学者还发现与肿瘤的浸润深度有关[16], 但这与Kuo et al的研究结果不一致, 他们认为COX-2表达水平与食管鳞癌的肿瘤分期以及远处转移呈负相关或无明显相关性[17-18].
研究表明[19], 在直肠癌、胰腺癌等多种实体肿瘤的癌细胞和细胞外基质中均有MMP-9的高表达, 其过度表达与肿瘤的远处转移及周围组织的侵袭密切相关. 我们也发现MMP-9表达与肿瘤的TNM分期和淋巴结转移呈正相关. 此外, MMP-9参与的基质降解和再塑形与肿瘤间质血管生成关系密切, 被认为是血管生成素(angiogenic)激活的"开关"之一[20]. 近年来的研究发现, COX-2可诱导MMP-9的产生. 在小鼠的动物模型中, 特异性COX-2抑制剂rofecoxib可使MMP-9的蛋白水平明显下降, 提示MMP-9有可能是COX-2促进肿瘤发生、发展的途径之一[21]. 本研究也表明在食管鳞癌中MMP-9的表达与COX-2呈正相关, 从而也证明COX-2可诱导MMP-9的产生这一观点.
许多学者对不同肿瘤进行研究, 发现肿瘤的MVD是一个独立的预后因素. 本研究发现, 有淋巴结转移的Ⅲ+Ⅳ期食管鳞癌, 其MVD值明显升高, 与文献[22]报道一致. 提示MVD与肿瘤的侵袭转移有相关性, MVD较高者, 肿瘤转移和潜在转移的可能性较大. 表明MVD在食管癌组织中也反映了肿瘤的生物学行为. 我们的研究发现, COX-2与MMP-9、MVD的高表达状态与食管鳞癌的生长、浸润和转移等恶性生物学行为密切相关. MMP-9随COX-2表达增强而增加, 提示COX-2可以诱导产生MMP-9; MVD随MMP-9表达增强而增加, MMP-9与MVD呈显著正相关, 提示MMP-9不仅通过降解细胞外基质和基底膜与肿瘤侵袭和转移, 还可以促进肿瘤血管生成而加速肿瘤的进展. 本研究证明, COX-2与MMP-9在促进食管鳞癌的侵袭、转移过程中, 血管生成起着重要的作用. 故COX-2与MMP-9、MVD可作为食管鳞癌的生物学行为的重要指标.
近年来研究表明, COX-2的高表达同食管鳞癌的预后及生存期成负相关[16,23-25], 而且特异性COX-2抑制剂如NS-398[26]、GSE[27]、Nimesulide[28]等在食管鳞癌的化学预防作用方面的研究逐渐增多并取得了一定的成果. 因此, 本研究也可为特异性COX-2抑制剂的治疗作用提供一些理论依据.
COX-2能诱导肿瘤血管生成, 增加肿瘤细胞的侵袭力, 促进肿瘤的远处转移和周围组织的侵袭. MMP-9最主要的功能是降解细胞外基质中的Ⅳ、Ⅴ型胶原和明胶. 恶性肿瘤的生长、浸润和转移必须依赖肿瘤血管生成, 微血管密度(MVD)是反映恶性肿瘤侵袭和转移等生物学行为的一个重要指标. 以抗CD34抗体标记微血管内皮细胞计算MVD. 本研究采用免疫组织化学的方法, 检测食管鳞癌组织和癌旁正常黏膜中的COX-2、MMP-9和CD34表达并计数MVD, 旨在探讨COX-2、MMP-9表达与MVD间及其与食管鳞癌主要临床病理特征的关系.
王健生, 教授, 西安交通大学医学院第一附属医院肿瘤外科
近年来, COX-2、MMP-9与肿瘤的关系日益受到人们的重视, 肿瘤的血管形成方面的研究也比较热门.
有研究显示, 运用COX-2选择性抑制剂可显著抑制实验动物肿瘤的血管生成, 提示促进血管生成有可能是COX-2促进肿瘤发生、发展的重要机制. 特异性COX-2抑制剂rofecoxib可使MMP-9的蛋白水平明显下降, 提示MMP-9有可能是COX-2促进肿瘤发生、发展的途径之一.
COX-2、MMP-9在食管鳞癌发生、发展及预后中的作用方面的研究较多, 本文旨在探讨COX-2、MMP-9表达与食管鳞癌主要临床病理特征和血管生成的关系.
COX-2、MMP-9异常表达及其诱导的血管生成在食管鳞癌的侵袭和淋巴结转移中起重要作用, 为特异性COX-2抑制剂在食管鳞癌预防和治疗中的作用提供理论依据.
本研究设计合理, 方法科学, 具有一定的临床指导意义.
编辑:李军亮 电编:何基才
| 1. | van Rees BP, Saukkonen K, Ristimäki A, Polkowski W, Tytgat GN, Drillenburg P, Offerhaus GJ. Cyclooxygenase-2 expression during carcinogenesis in the human stomach. J Pathol. 2002;196:171-179. [PubMed] [DOI] |
| 2. | Yoon SO, Park SJ, Yun CH, Chung AS. Roles of matrix metalloproteinases in tumor metastasis and angiogenesis. J Biochem Mol Biol. 2003;36:128-137. [PubMed] |
| 3. | Cui XN, Hou L, Liu JW, Ling MY. [Matrix metalloproteinases map of lymphogenous metastasis of hepatocarcinoma cell in mice]. Ai Zheng. 2002;21:1192-1196. [PubMed] |
| 4. | Weidner N. Tumoural vascularity as a prognostic factor in cancer patients: the evidence continues to grow. J Pathol. 1998;184:119-122. [PubMed] [DOI] |
| 5. | Folkman J. Angiogenesis research: from laboratory to clinic. Forum (Genova). 1999;9:59-62. [PubMed] |
| 6. | Sobin LH, Fleming ID. TNM Classification of Malignant Tumors, fifth edition (1997). Union Internationale Contre le Cancer and the American Joint Committee on Cancer. Cancer. 1997;80:1803-1804. [PubMed] [DOI] |
| 7. | Weidner N. Current pathologic methods for measuring intratumoral microvessel density within breast carcinoma and other solid tumors. Breast Cancer Res Treat. 1995;36:169-180. [PubMed] [DOI] |
| 9. | Deasy BM, O'Sullivan-Coyne G, O'Donovan TR, McKenna SL, O'Sullivan GC. Cyclooxygenase-2 inhibitors demonstrate anti-proliferative effects in oesophageal cancer cells by prostaglandin E(2)-independent mechanisms. Cancer Lett. 2007;256:246-258. [PubMed] [DOI] |
| 10. | Sun WH, Sun YL, Fang RN, Shao Y, Xu HC, Xue QP, Ding GX, Cheng YL. Expression of cyclooxygenase-2 and matrix metalloproteinase-9 in gastric carcinoma and its correlation with angiogenesis. Jpn J Clin Oncol. 2005;35:707-713. [PubMed] [DOI] |
| 11. | Dicken BJ, Graham K, Hamilton SM, Andrews S, Lai R, Listgarten J, Jhangri GS, Saunders LD, Damaraju S, Cass C. Lymphovascular invasion is associated with poor survival in gastric cancer: an application of gene-expression and tissue array techniques. Ann Surg. 2006;243:64-73. [PubMed] [DOI] |
| 12. | Masferrer JL, Leahy KM, Koki AT, Zweifel BS, Settle SL, Woerner BM, Edwards DA, Flickinger AG, Moore RJ, Seibert K. Antiangiogenic and antitumor activities of cyclooxygenase-2 inhibitors. Cancer Res. 2000;60:1306-1311. [PubMed] |
| 13. | Marrogi AJ, Travis WD, Welsh JA, Khan MA, Rahim H, Tazelaar H, Pairolero P, Trastek V, Jett J, Caporaso NE. Nitric oxide synthase, cyclooxygenase 2, and vascular endothelial growth factor in the angiogenesis of non-small cell lung carcinoma. Clin Cancer Res. 2000;6:4739-4744. [PubMed] |
| 14. | Zimmermann KC, Sarbia M, Weber AA, Borchard F, Gabbert HE, Schrör K. Cyclooxygenase-2 expression in human esophageal carcinoma. Cancer Res. 1999;59:198-204. [PubMed] |
| 15. | Ratnasinghe D, Tangrea J, Roth MJ, Dawsey S, Hu N, Anver M, Wang QH, Taylor PR. Expression of cyclooxygenase-2 in human squamous cell carcinoma of the esophagus; an immunohistochemical survey. Anticancer Res. 1999;19:171-174. [PubMed] |
| 16. | Hashimoto N, Inayama M, Fujishima M, Shiozaki H. Clinicopathologic significance of expression of cyclooxygenase-2 in human esophageal squamous cell carcinoma. Hepatogastroenterology. 2007;54:758-760. [PubMed] |
| 17. | Kuo KT, Chow KC, Wu YC, Lin CS, Wang HW, Li WY, Wang LS. Clinicopathologic significance of cyclooxygenase-2 overexpression in esophageal squamous cell carcinoma. Ann Thorac Surg. 2003;76:909-914. [PubMed] [DOI] |
| 18. | Kawabe A, Shimada Y, Uchida S, Maeda M, Sato F, Itami A, Imamura M. Expression of cyclooxygenase-2 is associated with carcinogenesis of the lower part of thoracic esophageal squamous cell carcinoma and p53 expression. Oncology. 2002;62:46-54. [PubMed] [DOI] |
| 19. | Matsuyama Y, Takao S, Aikou T. Comparison of matrix metalloproteinase expression between primary tumors with or without liver metastasis in pancreatic and colorectal carcinomas. J Surg Oncol. 2002;80:105-110. [PubMed] [DOI] |
| 20. | Bergers G, Brekken R, McMahon G, Vu TH, Itoh T, Tamaki K, Tanzawa K, Thorpe P, Itohara S, Werb Z. Matrix metalloproteinase-9 triggers the angiogenic switch during carcinogenesis. Nat Cell Biol. 2000;2:737-744. [PubMed] [DOI] |
| 21. | Yao M, Kargman S, Lam EC, Kelly CR, Zheng Y, Luk P, Kwong E, Evans JF, Wolfe MM. Inhibition of cyclooxygenase-2 by rofecoxib attenuates the growth and metastatic potential of colorectal carcinoma in mice. Cancer Res. 2003;63:586-592. [PubMed] |
| 22. | Suzuki T, Kuwabara Y, Iwata H, Mitani M, Shinoda N, Sato A, Mitsui A, Sugiura M, Kato J, Fujii Y. Role of matrix metalloproteinase-9 in in vitro invasion of esophageal carcinoma cells. J Surg Oncol. 2002;81:80-86. [PubMed] [DOI] |
| 23. | Huang WZ, Fu JH, Wang DK, Hu Y, Liu MZ, Yang H, Feng YF, Zheng B, Wang G, Luo KJ. Overexpression of cyclooxygenase-2 is associated with chemoradiotherapy resistance and prognosis in esophageal squamous cell carcinoma patients. Dis Esophagus. 2008;21:679-684. [PubMed] [DOI] |
| 24. | Takatori H, Natsugoe S, Okumura H, Matsumoto M, Uchikado Y, Setoyama T, Sasaki K, Tamotsu K, Owaki T, Ishigami S. Cyclooxygenase-2 expression is related to prognosis in patients with esophageal squamous cell carcinoma. Eur J Surg Oncol. 2008;34:397-402. [PubMed] [DOI] |
| 25. | Liu JF, Jamieson G, Wu TC, Zhang SW, Wang QZ, Drew P. Cyclooxygenase-2 expression in squamous cell carcinoma of the esophagus. Dis Esophagus. 2006;19:350-354. [PubMed] [DOI] |
| 26. | Liu JF, Zhu GJ, Jamieson GG, Wu TC, Zhu TN, Shan BE, Drew PA. NS-398 induces apoptosis in human esophageal cancer cells through inhibition of NF-kappaB downstream regulation of cyclooxygenase-2. Cancer Invest. 2009;27:17-23. [PubMed] [DOI] |
| 27. | Pak KC, Lam KY, Law S, Tang JC. The inhibitory effect of Gleditsia sinensis on cyclooxygenase-2 expression in human esophageal squamous cell carcinoma. Int J Mol Med. 2009;23:121-129. [PubMed] |
| 28. | Liu X, Li P, Zhang ST, You H, Jia JD, Yu ZL. COX-2 mRNA expression in esophageal squamous cell carcinoma (ESCC) and effect by NSAID. Dis Esophagus. 2008;21:9-14. [PubMed] |