修回日期: 2009-04-29
接受日期: 2009-05-05
在线出版日期: 2009-06-18
目的: 观察利血平对大鼠唾液蛋白分泌的影响.
方法: 实验大鼠随机分为2组, 实验组皮下注射利血平0.4 mg/(kg•d), 正常组皮下注射等量生理盐水. 10 d后, 抽取唾液检测酸刺激前后唾液淀粉酶活性(sAA)比值; HE染色检测腮腺形态学和透射电镜计数腮腺酶原颗粒; ELISA法检测血管活性肠肽(VIP)和环磷酸腺苷(cAMP)含量.
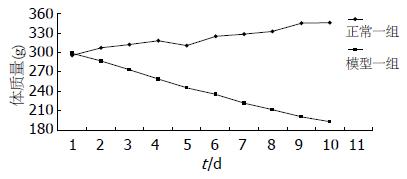
结果: 实验组较正常组摄食量明显减少, 体质量下降; sAA活性比值显著低于正常组(0.39±0.18 vs 0.80±0.21, P<0.01); HE染色未见2组腮腺有明显病理改变, 透射电镜发现实验组腮腺单位观察视野内酶原颗粒数量明显高于正常组(41.4±4.9 vs 34.6±5.2, P<0.01); 实验组血清VIP含量明显低于正常组(22.5±13.1 µg/L vs 38.5±14.1 µg/L, P<0.05), 2组腮腺VIP含量无明显差异; 实验组血清cAMP明显高于正常组(125.8±15.5 nmol/L vs 105.3±16.7 nmol/L, P<0.05); 2组腮腺cAMP水平无明显差异.
结论: 利血平导致大鼠消化代谢机能下降, 在酸刺激下大鼠的唾液蛋白分泌明显减少, 可能是通过降低血清VIP水平调节唾液蛋白分泌.
引文著录: 林传权, 陈玉龙, 李茹柳, 张海艇, 高小玲, 陈蔚文. 利血平对大鼠唾液蛋白分泌的影响. 世界华人消化杂志 2009; 17(17): 1702-1706
Revised: April 29, 2009
Accepted: May 5, 2009
Published online: June 18, 2009
AIM: To observe the effect of reserpine on the secretion of salivary protein in rats.
METHODS: All the rats were divided into experimental group and normal control group. Rats in the experimental group received subcutaneous injection of reserpine [0.4 mg/(kg•d)] while rats in the control group received the same volume of saline instead. After 10 days' treatment, salivary samples were collected from rats to detect the ratio of salivary amylase (sAA) before and after acid stimulation. Zymogen granules were counted under transmission electron microscopy. The content of vasoactive intestinal peptide (VIP) and cyclic adenosine monophosphate (cAMP) in the serum and parotid tissues were assayed using ELISA.
RESULTS: Food intake was significantly decreased and weight was reduced in the experimental group compared with the normal group. The ratio of sAA in the experimental group was significantly lower than the normal group (0.39 ± 0.18 vs 0.80 ± 0.21, P < 0.01). No difference in pathological changes was found between the two groups, and the number of zymongen granules under transmission electron microscopy was remarkably higher in experimental group than the normal group (41.4 ± 4.9 vs 34.6 ± 5.2, P < 0.01). The content of VIP in serum was lower in the experimental group than the normal group (22.5 ± 13.1 µg/L vs 38.5 ± 14.1 µg/L, P < 0.05). No difference was noted in content of VIP in parotid tissues between the two groups, and the serum cAMP was remarkably higher in the experimental group than in the normal group (125.8 ± 15.5 nmol/L vs 105.3 ± 16.7 nmol/L, P < 0.05) but no difference was found in the content of cAMP in parotid tissues between the two groups.
CONCLUSION: Reserpine decreases the digestive and metabolic function in rats; the secretion of salivary protein in rats is decreased significantly after the stimulation of acid, which regulates the secretion of salivary protein possibly though reducing the level of VIP in serum.
- Citation: Lin CQ, Chen YL, Li RL, Zhang HT, Gao XL, Chen WW. Effect of reserpine on the secretion of salivary protein in rats. Shijie Huaren Xiaohua Zazhi 2009; 17(17): 1702-1706
- URL: https://www.wjgnet.com/1009-3079/full/v17/i17/1702.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i17.1702
利血平通过耗竭周围交感神经末梢的肾上腺素, 心、脑及其他组织中的儿茶酚胺和5-羟色胺达到抗高血压、减慢心率和抑制中枢神经系统的作用. 他可使交感神经功能低下, 副交感神经功能相对亢进, 引起机体消化代谢功能低下. 唾液作为一种人体消化液, 具有消化食物的作用, 与机体消化代谢功能有着密切关系[1]. 口干是利血平临床常见不良反应之一, 其与唾液分泌有着密切关系. 研究报道[2-6]唾液分泌受内分泌、血液循环、神经等多种因素的调控, 其中自主神经调节起主要作用; 交感和副交感神经分别支配唾液腺, 释放神经递质, 都可一定程度调节唾液分泌[7]. 通过耗竭神经递质, 对自主神经起调节作用, 也可能调节唾液蛋白分泌, 本实验对此进行相关研究, 现报道如下.
♂SD大鼠, 广东省实验动物中心提供, SPF级, 合格证号: SCXK(粤)2003-0002, 粤监证字2008A020. 利血平注射液广东邦民制药有限公司出品, 批号050614. 9 g/L氯化钠注射液(生理盐水)西南药业股份有限公司出品, 批号06070067. D-木糖上海伯奥生物科技有限公司出品, 批号050107. 冰乙酸天津富宇精细化工有限公司出品, 批号060901. 对溴苯胺中国医药(集团)上海化学试剂公司出品, 批号20010814. 硫脲广州化学试剂厂出品, 批号20011003-2. 以上试剂均为分析纯. cAMP-ELISA和VIP-ELISA试剂盒由R&D公司提供, LOT: RT110371. UVmini-1420型岛津紫外可见分光光度计. 日本HITACHI公司H-600E-M型透射电镜.
1.2.1 分组, 给药及取材: 饲养大鼠质量至300±20 g, 随机分组, 每组10只. 实验组: 大鼠1-9 d皮下注射利血平0.4 mg/kg, 10 d停止注射; 正常组: 大鼠1-9 d皮下注射等体积生理盐水, 10 d停止注射. 2组大鼠11 d收集尿液检测D-木糖排泄率, 抽取唾液检测sAA活性, 眼眶静脉采血离心取血清检测血管活性肠肽(VIP)、环磷酸腺苷(cAMP)含量, 处死动物取一侧腮腺组织做病理切片HE染色和透射电镜观察酶原颗粒, 取另一侧腮腺组织检测VIP、cAMP含量.
1.2.2 对溴苯胺法测定大鼠尿D-木糖排泄率: 参照文献方法[8,9], 大鼠禁食不禁水12 h后, 每只灌胃30 g/L D-木糖溶液4 mL, 然后收集5 h尿液(期间禁食不禁水); 每例取0.5 mL尿液样本, 双蒸水稀释10倍后, 加入2%对溴苯胺溶液2.5 mL; 取浓度为1 g/L的D-木糖溶液, 依次倍比稀释制作标准曲线; 样本管和标准管置70 ℃恒温水浴箱10 min, 然后室温放置70 min, 以分光光度计在波长520 nm下检测. 木糖排泄率(%) = [(标准曲线所计算浓度×尿总量(mL)×尿液稀释倍数)/灌胃木糖(mL)]×100%.
1.2.3 大鼠唾液抽取: 大鼠腹腔注射戊巴比妥钠麻醉, 用抽吸管在唾液腺开口处收集唾液10 min作为酸刺激前唾液; 间隔10 min, 用10%冰乙酸在大鼠舌尖刺激30 s, 共3次, 每次间隔30 s, 期间收集唾液, 共计10 min.
1.2.4 碘比色法测定sAA活性: 参照文献方法改进[10], 将抽取的唾液注入试管, 并加入0.04%淀粉液1 mL, 37 ℃水浴3 min; 空白对照管加蒸馏水0.01 mL, 样品管加样品0.01 mL, 混匀, 37 ℃水浴7.5 min; 往各管中加入1 mL碘应用液; 在分光光度计波长660 nm下测量各管的A值. 淀粉酶活性单位: 淀粉酶单位/100 mL = [(对照管A值-测定管A值)/对照管A值]×1600. 酸刺激前后sAA活性比值 = 酸刺激后sAA活性单位/酸刺激前sAA活性单位.
1.2.5 腮腺组织病理切片: 处死动物迅速摘取一侧腮腺组织, 剪取少量组织作透射电镜检测, 余下组织保存于多聚甲醛液, HE染色光镜下进行病理组织学观察.
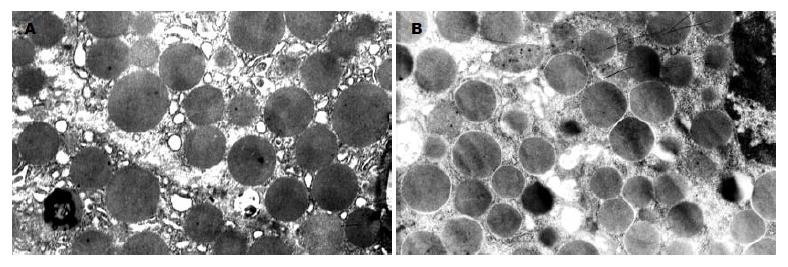
1.2.6 腮腺组织透射电镜观察酶原颗粒: 腮腺组织置于电镜保存液, 包埋切片, 观测酶原颗粒改变情况. 105放大倍数下, 随机选取8.8±7.0 cm2面积作为单位观察视野, 计算每个单位观察视野内酶原颗粒个数; 颗粒完全在视野内纳入计数, 若是与计数视野的四条边相互交叉重叠, 将与上边、左边交叉的酶原颗粒纳入计数, 而与下边、右边交叉的酶原颗粒不纳入计数. 每个组别观测3个样品, 每个样品随机选取5个部位拍摄相片, 再将各张相片计数所得酶原颗粒数量作为一个统计量, 比较两组酶原颗粒数量.
1.2.7 检测血清、腮腺组织VIP和cAMP: 眼眶静脉采血后离心(2000 r/min, 10 min)取血清, 4 ℃保存; 处死动物取一侧腮腺组织, 制备组织匀浆液取上清检测; 参照试剂盒的操作步骤以ELISA法检测样品.
统计学处理 结果用mean±SD表示, 统计软件SPSS11.0进行统计分析, 大鼠组间体质量、木糖排泄率、唾液sAA活性和酶原颗粒数量进行t检验, P<0.05认为有统计学意义.
造模前, 2组动物尿D-木糖排泄率无显著性差异(27.17%±10.73% vs 29.11%±17.17%, P>0.05); 造模后, 实验组尿D-木糖排泄率明显低于正常组(10.57%±4.88% vs 21.55%±8.44%, P<0.01).
11 d时, 正常组sAA活性比值明显高于实验组, 差异显著(0.80±0.21 vs 0.39±0.18, P<0.01).
11 d时, 实验组血清VIP含量明显低于正常组(22.5±13.1 µg/L vs 38.5±14.1 µg/L, P<0.05); 但腮腺组织VIP含量两组无明显差异(42.0±25.6 µg/L vs 64.8±27.0 µg/L, P>0.05); 2组大鼠组织VIP含量均明显高于本组血清VIP含量(P<0.05). 实验组血清cAMP含量明显高于正常组(125.8±15.5 nmol/L vs 105.3±16.7 nmol/L, P<0.05), 但在腮腺组织中, 两组无差异(113.4±26.6 nmol/L vs 110.2±16.0 nmol/L, P>0.05).
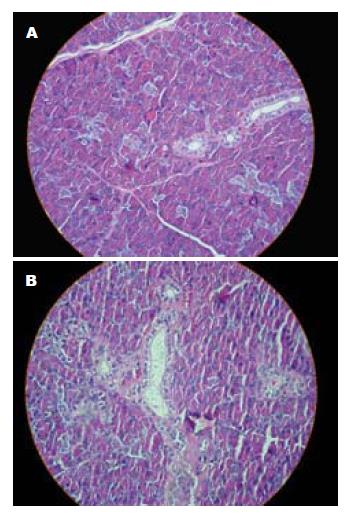
11 d时, 正常组和实验组腮腺组织病理切片光镜下观察无明显差异, 均未见明显病理改变. 腺体细胞无肿大, 间质未见充血水肿, 腺管周围及纤维间质中无淋巴细胞和浆细胞浸润, 腺泡未见萎缩、消失, 腺管上皮未见增生水肿, 管腔内未见坏死细胞和渗出物, 胞质内可见到分泌颗粒(图2).
实验组腮腺单位观察视野内酶原颗粒数量明显高于正常组, 2组比较差异显著(41.4±4.9 vs 34.6±5.2, P<0.01, 图3).
利血平属于外周交感神经阻滞药, 可以使体内儿茶酚胺类物质耗竭, 使交感神经功能低下, 副交感神经功能相对亢进, 引起机体消化代谢功能低下. 本实验室前期发现实验组动物给予利血平后出现食量显著减少、体质量明显下降, 作为反映机体吸收功能指标之一的尿D-木糖排泄率明显低于正常组[11-15]. 唾液作为一种人体消化液, 具有消化食物的作用, 与机体消化代谢功能有着密切关系. 有研究[2-6,16]表明唾液分泌受内分泌、血液循环、神经等多种因素的调控, 其中自主神经调节起主要作用. 而sAA是唾液蛋白的重要组成部分, 常用来作为反映唾液蛋白分泌的主要指标; 李常青[17]认为唾液淀粉酶活性比值反映的是副交感神经系统的功能状态, 唾液淀粉酶活性比值降低, 则提示副交感神经功能偏亢, 应激力低下. 口干是利血平临床上的常见不良反应之一, 说明利血平可能影响唾液分泌的状态, 并通过对自主神经的调节影响唾液蛋白分泌. 为此本研究对动物酸刺激前后唾液sAA活性比值进行检测, 发现实验组明显低于正常组, 说明利血平使动物的唾液蛋白分泌明显减少.
研究表明[18-21], VIP具有广泛的生物效应, 能够调节唾液腺的蛋白分泌, 刺激sAA分泌; 唾液蛋白分泌过程主要是腮腺细胞酶原颗粒胞吐的过程, VIP能减少腮腺贮存蛋白酶原颗粒密度, 刺激酶原颗粒释放[18,20,22-24]; 血清VIP在调节唾液分泌中发挥主要作用[25], 这说明VIP的含量与唾液蛋白分泌水平有密切关系, 可检测血清VIP含量来反映唾液蛋白的分泌. 本研究结果表明, 正常组腮腺单位观察面积酶原颗粒数量明显低于实验组; 正常组血清VIP含量明显高于实验组; 腮腺组织VIP含量实验组有下降趋势, 但是2组差异无统计学意义, 有待增加统计样本进一步比较; VIP作为一种胃肠肽激素, 其分布可能具有一定组织特异性, 腮腺组织的分布较多, 本研究出现腮腺组织VIP含量明显高于血清含量的结果. 以上研究结果提示利血平可影响血清VIP水平进而影响唾液蛋白分泌.
VIP调节唾液分泌机制由cAMP信号介导, 并促使细胞内cAMP水平升高[26-27]. 说明在VIP刺激下细胞内cAMP水平与唾液分泌关系较血清cAMP水平更密切. cAMP作为生物体细胞内重要的第2信使, 不仅参与调节体内多种生化代谢和生理功能, 而且在病理反应过程中也发挥介导作用, 其水平受机体内多种因素的影响. 本研究出现, 实验组血清cAMP水平明显高于正常组, 其升高机制较复杂, 可能受到其他组织的影响. 有实验发现, 利血平能降低脑组织内cAMP水平[28]. 本实验2组动物腮腺细胞内cAMP水平并未因VIP水平变化而发生明显改变, 可能由于在调节腮腺细胞分泌的胞内信号转导通路Ca2+、DAG/PKC、cAMP/PKA信号转导途径均有cAMP参与信号介导[25,29], 这些信号转导通路的改变也能影响细胞内cAMP水平; 细胞内cAMP能被磷酸二酯酶(phosphodiesterase, PDE)水解成5'-AMP而失活, 细胞内PDE的水平也可以影响细胞内cAMP水平.
本研究结果表明, 利血平能够使机体消化代谢功能低下, 对唾液蛋白分泌有调节作用, 其调节的途径可能是通过降低血清VIP水平来发挥作用的. 利血平对细胞内cAMP水平的影响及其与唾液蛋白分泌的关系, 有待今后进一步探讨.
利血平是临床上常用的抗高血压药物, 可引起机体消化代谢机能下降, 口干是不良反应之一; 唾液具有消化食物的作用, 与机体消化代谢功能有着密切关系. 然而利血平如何影响对唾液分泌的机制仍未能被完全揭示, 本文探讨利血平对唾液蛋白分泌的影响, 将进一步了解利血平不良反应的病理生理机制并为防治策略的制定提供参考.
冯志杰, 主任医师, 河北医科大学第二医院消化内科
目前, 国内外学者对于利血平不良反应的作用机制研究已获得突破性进展, 研究思路和作用靶点也较明确, 但是从VIP、cAMP对唾液蛋白分泌调节进行研究仍未见报道.
国外已有报道FHIT基因过表达能增加胰腺癌细胞系对外源性凋亡诱导剂的敏感性. 体内实验结果显示FHIT基因的转导能阻止肿瘤的生长, 延长模型小鼠的生存时间, 抑制暴露致癌环境下小鼠体内肿瘤的产生.
Groneberg et al报道VIP具有广泛的生物效应, 能够调节唾液腺的蛋白分泌, 刺激sAA分泌; Ekström et al报道唾液蛋白分泌过程主要是腮腺细胞酶原颗粒胞吐的过程, VIP能减少腮腺贮存蛋白酶原颗粒密度, 刺激酶原颗粒释放, 从而发挥调节唾液蛋白分泌的作用.
CCP的研究已经得到国家科技部"863"创新药物重大专项资助. 本文是有关药效学研究的部分内容. 经研究已明确, CCP在动物体外和体内均有杀伤肿瘤细胞的作用, 疗效高于卡铂, 副作用小, 有望进入正式的临床实验.
血管活性肠肽(VIP): 是非胆碱能非肾上腺素能(NANC)递质的主要成员, 也是重要的胃肠道激素, 广泛分布在消化系统, 调节胃肠运动和刺激胰液、肠液、唾液分泌. VIP能够调节唾液腺的蛋白分泌, VIP相关神经纤维在多种动物的唾液腺存在, VIP1和VIP2受体在唾液腺体细胞上表达.
本研究设计合理, 方法比较可靠, 图片清晰, 能够说明利血平应用后口干不良反应的发生机制, 学术价值较好.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Pedersen AM, Bardow A, Jensen SB, Nauntofte B. Saliva and gastrointestinal functions of taste, mastication, swallowing and digestion. Oral Dis. 2002;8:117-129. [PubMed] [DOI] |
| 4. | Porter SR, Scully C, Hegarty AM. An update of the etiology and management of xerostomia. O. ral Surg Oral Med Oral Pathol Oral Radiol Endod. 2004;97:28-46. [PubMed] [DOI] |
| 5. | Ford H, Johnson L, Purdie G, Feek C. Effects of hyperthyroidism and radioactive iodine given to ablate the thyroid on the composition of whole stimulated saliva. Clin Endocrinol (Oxf). 1997;46:189-193. [PubMed] [DOI] |
| 6. | Takai N, Yoshida Y, Shida T, Kondo E, Ueda Y, Kiyama H, Tohyama M. Expression of vasoactive intestinal polypeptide receptor mRNA and secretory regulation by vasoactive intestinal polypeptide in rat submandibular and sublingual salivary glands. Arch Oral Biol. 1997;42:197-204. [PubMed] [DOI] |
| 7. | Bradley RM, Fukami H, Suwabe T. Neurobiology of the gustatory-salivary reflex. Chem Senses. 2005;30 Suppl 1:i70-i71. [PubMed] [DOI] |
| 10. | 李 仪奎. 中药药理实验方法学. 第2版. 上海: 上海科学技术出版社 2006; 459. |
| 11. | 郭 文峰, 高 小玲, 李 茹柳, 陈 蔚文. 利血平致大鼠脾虚模型尿D-木糖排泄率与肠黏膜三磷酸腺苷水平的研究. 中国中西医结合消化杂志. 2008;16:211-214. |
| 12. | 羊 燕群, 郭 文峰, 李 茹柳, 陈 蔚文. 脾阳虚大鼠模型尿木糖、尿淀粉酶及整体状况变化的观察. 中国中医基础医学杂志. 2008;14:739-741. |
| 15. | 高 小玲, 郭 文峰, 李 茹柳, 陈 蔚文. 四君子汤对脾虚大鼠尿木糖排泄率及肠粘膜ATP的影响. 中国药学会应用药理专业委员会第三届学术会议、中国药理学会制药工业专业委员会第十三届学术会议暨2008生物医药学术论坛. 2008;203-208. |
| 16. | Lung MA. Autonomic nervous control of myoepithelial cells and secretion in submandibular gland of anaesthetized dogs. J Physiol. 2003;546:837-850. [PubMed] [DOI] |
| 18. | Ekstrom J. Gustatory-salivary reflexes induce non-adrenergic, non-cholinergic acinar degranulation in the rat parotid gland. Exp Physiol. 2001;86:475-480. [PubMed] [DOI] |
| 19. | Proctor GB, Carpenter GH. Regulation of salivary gland function by autonomic nerves. Auton Neurosci. 2007;133:3-18. [PubMed] [DOI] |
| 20. | Groneberg DA, Rabe KF, Fischer A. Novel concepts of neuropeptide-based drug therapy: vasoactive intestinal polypeptide and its receptors. Eur J Pharmacol. 2006;533:182-194. [PubMed] [DOI] |
| 21. | Ekstrom J, Asztely A, Tobin G. Parasympathetic non-adrenergic, non-cholinergic mechanisms in salivary glands and their role in reflex secretion. Eur J Morphol. 1998;36 Suppl:208-212. [PubMed] |
| 22. | Gorr SU, Venkatesh SG, Darling DS. Parotid secretory granules: crossroads of secretory pathways and protein storage. J Dent Res. 2005;84:500-509. [PubMed] [DOI] |
| 23. | Seino S, Shibasaki T. PKA-dependent and PKA-independent pathways for cAMP-regulated exocytosis. Physiol Rev. 2005;85:1303-1342. [PubMed] [DOI] |
| 24. | Ishikawa Y, Cho G, Yuan Z, Skowronski MT, Pan Y, Ishida H. Water channels and zymogen granules in salivary glands. J Pharmacol Sci. 2006;100:495-512. [PubMed] [DOI] |
| 25. | Sayardoust S, Ekstrom J. Nitric oxide-dependent in vitro secretion of amylase from innervated or chronically denervated parotid glands of the rat in response to isoprenaline and vasoactive intestinal peptide. Exp Physiol. 2003;88:381-387. [PubMed] [DOI] |
| 26. | Scott J, Baum BJ. Involvement of cyclic AMP and calcium in exocrine protein secretion induced by vasoactive intestinal polypeptide in rat parotid cells. Biochim Biophys Acta. 1985;847:255-262. [PubMed] [DOI] |
| 27. | Zawilska JB, Gendek-Kubiak H, Woldan-Tambor A, Wiktorowska-Owczarek A, Nowak JZ. Histamine-induced cyclic AMP formation in the chick hypothalamus: interaction with vasoactive intestinal peptide. Pharmacol Rep. 2005;57:188-194. [PubMed] |
| 28. | 黄 梅, 树 扬高, 陈 启贤. 利血平对马桑内酯致痫作用和癫痫小鼠脑内cAMP水平的影响. 四川大学学报(医学版). 1990;21:307-309. |