修回日期: 2007-12-18
接受日期: 2008-01-04
在线出版日期: 2008-01-18
目的: 研究VEGFR2胞外1-4片段(flk-1(n1-4))抑制肿瘤生长效应.
方法: 构建DNA疫苗SL3261-pcDNA3.1+/flk-1(n1-4), 经ig饲服BALB/c小鼠, 随机分为3组, 疫苗组, 载体对照组和NaHCO3对照组. 对小鼠进行基因免疫. ELISA检测小鼠血清中VEGF水平及特异性抗flk-1(n1-4)-IgG抗体. 流式细胞仪分析免疫小鼠淋巴细胞亚群. DNA疫苗免疫结肠癌荷瘤BALB/c小鼠, 测量免疫后荷瘤小鼠肿瘤大小, 检测肿瘤微血管密度.
结果: 免疫小鼠血清中VEGF水平明显降低, 并产生高水平的抗flk-1(n1-4)-IgG抗体.免疫后荷瘤小鼠CD4+ T、CD8+ T值维持较高水平, 小鼠结肠腺癌皮下肿瘤生长与载体和NaHCO3对照组相比明显受抑制, 疫苗组小鼠肿瘤质量、体积、平均微血管密度与载体和NaHCO3对照组相比明显降低(3.64±1.34 g vs 8.40±0.66 g, 8.26±0.44 g; 2.62±0.54 mm3vs 6.01±0.14 mm3, 5.92±0.25 mm3; 2.06±1.02 vs 6.93±2.34, 7.34±4.12; P<0.05). 疫苗组小鼠中位生存期较两对照组明显延长.
结论: flk-1(n1-4)能够抑制肿瘤血管内皮细胞生长, 达到抗大肠癌生长作用.
引文著录: 董坚, 陈明清, 杨军, 王熙才, 伍治平, 陈艳, 王志强, 李淼. 重组减毒沙门氏菌疫苗SL3261-pcDNA3.1+/flk-1(n1-4)抗小鼠大肠癌的生长. 世界华人消化杂志 2008; 16(2): 163-170
Revised: December 18, 2007
Accepted: January 4, 2008
Published online: January 18, 2008
AIM: To investigate the inhibitory effect of extracellular 1-4 segments of VEGFR2 on tumor growth.
METHODS: Oral DNA vaccine SL3261-pcDNA3.1+/flk-1(n1-4) was developed and BALB/c mice were immunized with vaccine encoding flk-1(n1-4) via gastrogavage. BALB/c mice receiving SL3261-pcDNA3.1+ or 10% NaHCO3 via gastrogavage were used as vector control and NaHCO3 group. Serum levels of VEGF and specific anti-flk-1(n1-4)-IgG antibody were measured by ELISA. The subset of lympholeukocytes was analyzed by flow cytometry. Mouse models of CT-26 adencarcinoma of colon were treated with SL3261-pcDNA3.1+/flk-1(n1-4) through gastrogavage. Tumor diameter and weight were measured, microvessel density (MVD) in the tumor tissue was detected by immunohistochemistry, and the survival time of mice was also investigated.
RESULTS: The serum level of VEGF in the vaccine group was significantly lower than that in the control group. All mice immunized with the DNA vaccine had a high level of anti-flk-1(n1-4)-IgG, and showed strong activities against flk-1(n1-4). After inoculation of CT-26 cells, the number of CD4+ T and CD8+ T cells was obviously greater in the vaccine group than in the control group. Tumor weight and diameter as well as MVD were significantly lower in the vaccine group than in the vector and NaHCO3 control groups (3.64 ± 1.34 g vs 8.40 ± 0.66 g, 8.26 ± 0.44 g; 2.62 ± 0.54 mm3vs 6.01 ± 0.14 mm3, 5.92 ± 0.25 mm3; 2.06 ± 1.02 vs 6.93 ± 2.34, 7.34 ± 4.12; P < 0.05). The survival time of mice was longer in the vaccine group than in the control group.
CONCLUSION: The extracellular 1-4 segments of VEGFR2 can inhibit the growth of tumor by suppressing the growth of its endothelial cells.
- Citation: Dong J, Chen MQ, Yang J, Wang XC, Wu ZP, Chen Y, Wang ZQ, Li M. Recombinant attenuated Salmonella typhimurium vaccine SL3261-pcDNA3.1+/flk-1(n1-4) inhibits growth of colorectal cancer in BALB/c mice. Shijie Huaren Xiaohua Zazhi 2008; 16(2): 163-170
- URL: https://www.wjgnet.com/1009-3079/full/v16/i2/163.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i2.163
VEGF/VEGFR2信号传导通路被证实在肿瘤血管生成过程中起关键性作用, 阻断该信号传导通路, 可达到抑制肿瘤生长和转移的目的[1-4].VEGFR2(血管内皮生长因子受体-2, flk-1)分子结构分为胞外段、跨膜段和胞内段, 其胞外段含7个免疫球蛋白样袢[5]. 研究证实, VEGFR2胞外段是与VEGF相结合的部位, VEGFR2胞外第1袢是与VEGF结合的必须部位, 第2-3袢是与VEGF紧密结合的主要部位, 受体通过第4个Ig样区形成同源二聚体的活性形式[6], 而第5-7袢与VEGF结合的关系不密切. 以VEGFR2信号通路作为靶点构建的DNA疫苗药物不仅具有较高的疗效, 而且疫苗制备容易, 成本低[7].
已有研究所证实, 重组减毒胞内菌尤其是减毒沙门氏菌可用于DNA疫苗载体运送和表达外源蛋白抗原, 并且效果显著[8]. 减毒沙门氏菌主要通过将DNA疫苗直接呈送给抗原递呈细胞(antigen presenting cell, APC), 激活机体的细胞免疫和体液免疫, 诱发免疫记忆, 发挥免疫效果[9]; 另外, 载体菌本身还可作为免疫佐剂, 加强免疫效果[10].
目前以VEGFR2进行抗肿瘤血管生成的研究主要集中在使用VEGFR2全长cDNA序列作为基因治疗靶标[11-13], 本实验室已完成VEGFR2胞外全长片段的重组减毒沙门氏菌疫苗SL3261-pcDNA3.1+/flk-1(n1-7)[14]的构建, 动物实验观察发现该疫苗有明显的抗肿瘤血管生成的效果. 但仍存在分子质量较大, 转录过程中碱基错配发生机率高, 不利于蛋白质的正确表达, 不容易插入真核表达载体, 还可能诱发其他非血管抑制的功能问题. 为了寻求能够与配体VEGF结合、同时分子质量又较小的可溶性flk-1功能域, 我们利用RT-PCR技术, 从BALB/c孕鼠胎盘中扩增出1248 bp的flk-1胞外第1-4袢基因片段, 插入真核表达质粒载体pcDNA3.1(+), 构建重组质粒pcDNA3.1+/flk-1(n1-4), 重组质粒转化减毒沙门氏菌SL3261, 制备成抗大肠癌血管生成DNA疫苗SL3261-pcDNA3.1+/flk-1(n1-4), 观察VEGFR2胞外1-4袢作为目的基因抗小鼠大肠癌血管生成效应. 该小片段目的基因已包含能与配体VEGF紧密结合的功能区域, 并具有分子质量较小, 转录过程中碱基错配发生机率小, 易于在真核细胞内进行蛋白的表达, 容易插入真核表达载体, 主要发挥抑制血管生成的作用, 同时具有与胞外全长片段相同的免疫原性等优点. 本文旨在研究VEGFR2胞外段1-4袢DNA序列作为基因疫苗抑制大肠癌皮下肿瘤生长的可行性.
SPF级BALB/c小鼠购自昆明医学院动物中心, ♀, 4-6周龄. 减毒沙门氏菌SL3261(芳香族氨基酸营养缺陷菌株)由英国帝国理工医学院S.J.Dunstan博士和山东大学医学院分子生物学实验室卞继峰副教授惠赠, pcDNA3.1(+)质粒, TRIzol Reagent以及lipofecmine 2000购自Invitrogen公司; COS-7细胞株以及CT-26细胞株分别购自GIBCO公司和ATCC公司. RT-PCR扩增VEGFR2胞外1-4袢上游引物为: 5'-CCGGTACCATGGAGAGCAAGGCGC-3', 下游引物为: 5'-GCTCTAGATTAAGAGACCATGTGGCTCTG-3', 由上海搏亚公司合成. CMV启动子上游引物为: 5'-CCCAGTACATGACCTTATGGG-3', 下游引物为: 5'-GGAGACTTGGAAATCCCCGT-3'[15], 由上海捷瑞生物公司合成. One Step RT-PCR Kit购自Qiagen公司; Immun-Blot TM PVDF膜及蛋白质分子质量标准购自Bio-RAD公司, 限制性内切酶XbaⅠ、KpnⅠ等购自大连宝生物公司; 小鼠VEGF细胞因子检测ELISA试剂盒购自晶美公司. OMEGA质粒小提试剂盒购自OMEGA公司, 山羊抗小鼠VEGFR2胞外段多克隆抗体, 辣根过氧化物酶标记的兔抗山羊IgG, 以及DAB试剂盒为R&D公司产品.通用基因组DNA快速提取试剂盒购自上海捷瑞生物公司.
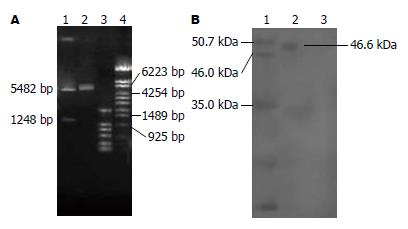
1.2.1 真核表达质粒pcDNA3.1+/flk-1(n1-4)的构建: 取BALB/c14 d孕鼠胎盘, 匀浆后用TRIzol提取总RNA, 总RNA经RT-PCR法扩增出一段1.2 kb的VEGFR2胞外片段, 将其定向插入pcDNA3.1(+)载体的限制性酶切位点XbaⅠ和KpnⅠ之间, 构建成重组质粒pcDNA3.1+/flk-1(n1-4).
1.2.2 真核表达质粒转染COS-7细胞及表达产物的检测: 接种5×104生长状态良好的COS-7细胞于24孔板的各孔, 在含有100 mL/L FBS的DMEM培养基中于37 ℃, 50 mL/L CO2培养箱培养过夜, 分别设立转染pcDNA3.1+/flk-1(n1-4)和空白对照两个组, 每个组设3个复孔. 将配好的转染混合物(100 μL OPTI-DMEM中加入5 μL脂质体, 2 μg待转质粒, 混匀; 室温放置15 min)逐滴加入待转细胞中, 轻轻混匀. 于37 ℃, 50 mL/L CO2培养箱培养5 h后每孔加入0.2 mL含100 mL/L血清DMEM培养基, 培养48 h后收集COS-7细胞, 裂解细胞后取上清用于Western blot检测.
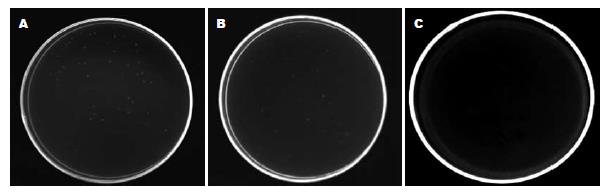
1.2.3 携带目的基因的重组减毒沙门氏菌的制备: 采用氯化钙法[16]将重组质粒pcDNA3.1+/flk-1(n1-4)导入感受态减毒沙门氏菌SL3261中, 分别设立转化pcDNA3.1+/flk-1(n1-4)、pcDNA3.1(+)和空白对照3个组. 将重组疫苗菌SL3261- pcDNA3.1+/flk-1(n1-4)接种于3 mL含有氨苄青霉素的LB液体培养基中振荡过夜, 次日取1 mL菌液加入50 mL含有氨苄青霉素的LB液体培养基中, 3 h后收集菌体, 用生理盐水清洗后, 用10% NaHCO3溶液悬浮, 调整细菌浓度为1×1012 cfu/L.
1.2.4 疫苗的免疫及肿瘤细胞的接种: 取30只BALB/c小鼠随机分为3组, 每组10只. 疫苗组: 灌胃饲服携带pcDNA3.1+/flk-1(n1-4)的减毒沙门氏菌0.1 mL每周1次, 共3次; 载体对照组: 灌胃饲服携带质粒pcDNA3.1(+)的减毒沙门氏菌0.1 mL, 每周一次, 共三次; NaHCO3对照组: 灌胃饲服10% NaHCO3 0.1 mL, 每周1次, 共3次. 常规培养CT-26小鼠结肠腺癌细胞, 在po免疫2 wk以后, 各组BALB/c小鼠右侧腋窝皮下接种1×106个CT-26小鼠结肠腺癌细胞. 另外取24只BALB/c小鼠随机分为3组, 每组8只, 分组及操作同上, 接种肿瘤细胞以后观察各组小鼠的生存时间, 监测小鼠体质量及肿瘤体积变化.
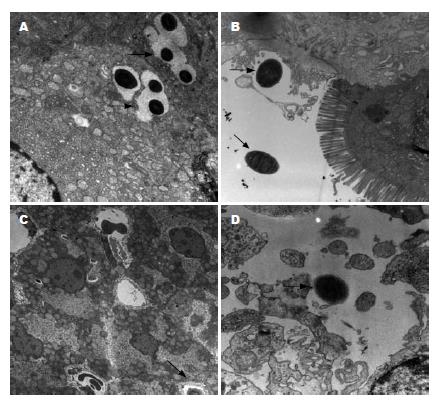
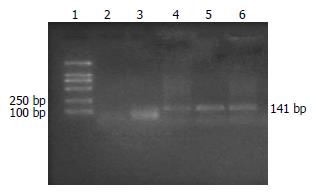
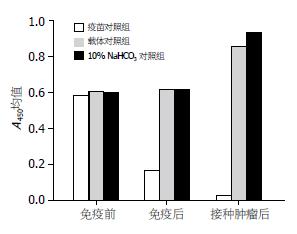
1.2.5 小鼠体内减毒沙门氏菌分布、体内VEGF水平和基因组中真核表达载体的检测: 最后一次免疫后2 wk在无菌条件下从各组小鼠随机挑选2只取出肝脏, 脾脏, 小肠以及大肠, 切成约1 mm×1 mm×1 mm大小, 固定后透射电镜下查找沙门氏菌, 剩余组织液氮冻存备用. 取出液氮冻存的免疫组小鼠的肝脏、脾脏、小肠、结肠, 分别提取基因组DNA进行PCR反应. 反应条件为: 94 ℃变性30 s, 55 ℃复性30 s, 72 ℃延长45 s, 一共进行30个循环, 72 ℃延长10 min[17]. 扩增片段于5 g/L琼脂糖凝胶电泳. 各组小鼠最后一次po免疫后2 wk、接种肿瘤2 wk后及处死前各采血一次, 离心收集上清液, 用抗小鼠VEGF单抗包被于酶标板, 加入生物素化抗小鼠VEGF抗体和辣根过氧化物酶标记的亲合素, 加入显色剂后于酶标仪测吸光度(A450)值显示小鼠血清VEGF水平.
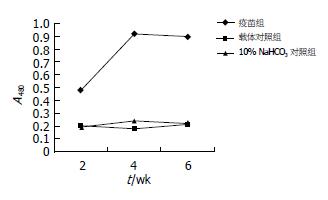
1.2.6 小鼠外周血中抗pcDNA3.1+/flk-1(n1-4)抗体的检测和淋巴细胞亚群分析: 在小鼠最后一次免疫后2 wk、接种肿瘤2 wk以后以及在处死以前各采血一次, 采用ELISA直接法, 以mVEGFR2多克隆抗体包被酶标板, 以HRP标记的羊抗小鼠IgG抗体作为第二抗体, 酶标仪测得吸光度(A480)值显示抗体水平. 每组小鼠最后一次po免疫后2 wk、接种肿瘤2 wk后及处死前各采血100 μL并抗凝处理, 流式细胞仪对各组小鼠的CD4+ T和CD8+ T计数.
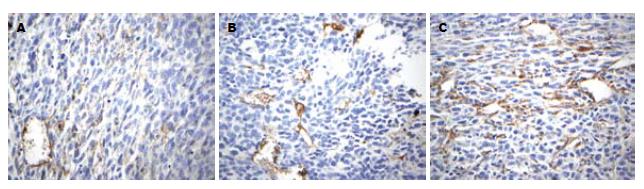
1.2.7 口服疫苗抑制小鼠皮下肿瘤的作用: 接种肿瘤后第32天, 10% NaHCO3对照组第一只小鼠出现死亡, 引颈处死所有小鼠, 取各组小鼠皮下肿瘤组织, 称质量, 测量肿瘤体积, 免疫组化测定微血管密度.微血管密度判定标准[18]: 每张切片在低倍镜(×100)下确定肿瘤内5个血管密集区, 再在高倍镜(×200)下计数每个密集区中一个视野的微血管数, 以5个区域微血管数的平均数作为微血管密度(microvessels density, MVD), 在高倍镜(×400)下拍照.
统计学处理 计量数据以mean±SD表示, 数据采用方差分析, 所有统计均由SPSS10.0统计软件处理完成.
成功地构建重组质粒pcDNA3.1+/flk-1(n1-4), 且目的基因flk-1(n1-4)在真核细胞COS-7细胞中得到表达(图1A-B); 重组质粒pcDNA3.1+/flk-1(n1-4)以及质粒pcDNA3.1(+)分别转化减毒沙门氏菌SL3261以后, 在含氨苄青霉素的LB固体培养基上均呈单菌落生长, 而阴性对照在含氨苄青霉素的LB固体培养基无菌落生长(图2).
透射电镜显示除10% NaHCO3对照组外, 疫苗组及载体对照组小鼠的肝、脾、小肠、结肠均可见重组沙门氏菌(图3).
结果显示除10% NaHCO3对照组外, 疫苗组及载体对照组小鼠的肝、脾、小肠、结肠组织中均可扩增出一个141 bp大小的片段, 与引物设计时所预计的扩增片段大小相符. 表示外源基因已整合到小鼠各组织器官中(图4).
流式细胞仪检测在接种疫苗前以及接种疫苗后, 疫苗组小鼠CD4+ T与两对照组无明显差别(P>0.05), 肿瘤细胞接种2 wk后疫苗组CD4+ T维持较高水平, 两对照组较疫苗组明显下降(P<0.05, 表1); 在接种疫苗前, 疫苗组CD8+ T与两对照组无明显差别, 在疫苗接种后以及肿瘤模型建立2 wk后CD8+ T在疫苗组明显比两对照组高(P<0.05, 表1).
| 分组 | 免疫前 | 免疫后 | 接种肿瘤后2 wk | |
| CD4+ T细胞 | 疫苗组 | 62.34±6.63 | 65.82±7.25 | 62.12±6.44 |
| 载体对照组 | 64.15±7.65 | 67.86±8.24 | 44.79±5.16a | |
| 10% NaHCO3对照组 | 62.78±6.54 | 65.89±7.94 | 43.76±6.12a | |
| CD8+ T细胞 | 疫苗组 | 10.16±0.84 | 15.64±1.46 | 11.92±2.60 |
| 载体对照组 | 9.78±0.59 | 9.58±1.24a | 7.54±2.97a | |
| 10% NaHCO3对照组 | 10.72±1.54 | 9.49±1.39a | 5.53±2.40a | |
| 血清VEGF×10-2(A450) | 疫苗组 | 58.24±6.42 | 18.88±8.07 | 2.66±1.91 |
| 载体对照组 | 60.45±6.20 | 62.44±6.43 | 85.65±10.36a | |
| 10% NaHCO3对照组 | 59.86±5.77 | 61.18±6.72 | 92.86±7.28a |
接种疫苗以及接种疫苗以前, 疫苗组小鼠血清VEGF水平与两对照组无明显差异, 在最后一次免疫后2 wk, 两对照组的血清VEGF水平开始出现升高, 而疫苗组血清VEGF水平出现下降, 在接种肿瘤2 wk后, 疫苗组VEGF水平较两对照组下降, 而两对照组的VEGF水平明显升高(表1, 图5).
SL3261-pcDNA3.1+/flk-1(n1-4)免疫组小鼠产生高水平的抗pcDNA3.1+/flk-1(n1-4)-IgG抗体, 且抗体水平持续增高; 而载体对照组以及10% NaHCO3对照组未产生抗pcDNA3.1+/flk-1(n1-4)-IgG抗体(图6).
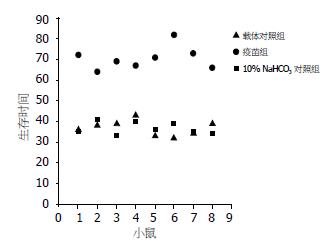
皮下动物模型显示, 疫苗组小鼠中位生存期为70.50±5.58 d, 载体对照组小鼠中位生存期为36.75±3.69 d, 10% NaHCO3对照组小鼠中位生存期为47.95±16.77 d, 疫苗组小鼠中位生存期较两对照组明显延长(P<0.05); 免疫后小鼠接种皮下肿瘤, 疫苗组小鼠生存时间较其余两对照组小鼠的生存时间明显延长, 疫苗组组小鼠在接种肿瘤后64 d才开始出现死亡, 其中荷瘤小鼠生存时间最长达82 d; 在两对照组中, 在接种肿瘤32 d后就有小鼠出现死亡, 最长生存时间为42 d(图7).
血管生成在实体瘤的生长和转移中起重要作用, 阻断肿瘤的血流供应可以有效地抑制肿瘤的生长. 肿瘤血管靶向基因治疗具有特异性强, 毒副作用小, 作用持久等诸多优点, 因而, 抗肿瘤血管形成也就成为肿瘤生物学治疗的理想靶点[19-21]. 目前, 已开发出如血管生长因子及其受体的中和抗体, 血管生成抑制因子及抗血管生成的化学药物等治疗手段[22-25]. 而VEGF与其受体VEGFR2的相互作用, 是调控肿瘤血管形成的关键. 因此, VEGF及其受体也就成为抗肿瘤血管治疗最直接的靶点[26]. 在目前已鉴定和克隆出的几种VEGF受体中, VEGFR2与VEGF具有较高亲和力, 仅存在于血管内皮细胞和一些肿瘤细胞中, 在正常情况下表达水平甚低. 许多肿瘤细胞分泌的VEGF与受体的胞外段结合后, 通过胞内段的信号传导, 可诱导内皮细胞增殖, 血管新生及肿瘤细胞的分裂、增殖[27-29]. 可溶性受体为VEGFR胞外不同大小的片段, 仅具有与配体结合的能力, 而无信号传导功能, 因此可竞争VEGF的功能受体, 阻止肿瘤血管的形成, 进而抑制肿瘤生长[30].
血管内皮细胞生长因子(VEGF)与其受体flk-1的相互作用, 在肿瘤周围血管形成过程中起到关键作用. 肿瘤细胞分泌大量的VEGF, 通过作用于内皮细胞上相应的跨膜受体, 引起内皮细胞的增殖和血管形成. 因此, 阻断VEGF与相应受体的结合, 在目前抗肿瘤血管形成的研究中倍受关注.
本研究选择VEGFR2胞外段1-4袢为研究对象, 将flk-1(n1-4)定向插入质粒pcDNA3.1(+)构建重组质粒pcDNA3.1+/flk-1(n1-4), 将重组质粒转染COS-7细胞, Western blot检测到重组质粒能够在COS-7细胞中表达相应蛋白质, 说明该目的基因片段能够在哺乳动物细胞中表达; 将重组质粒转化减毒沙门氏菌SL3261, 制备成口服DNA疫苗SL3261-pcDNA3.1+/flk-1(n1-4); 口服DNA疫苗灌胃饲服小鼠建立稳定免疫以后, 取小鼠肝脏、脾脏、小肠以及大肠标本在透射电镜下观察, 结果可见重组沙门氏菌再小鼠各主要消化器官内均有分布, 说明沙门氏菌已将DNA疫苗带入机体; 同时, 提取小鼠肝脏、脾脏、小肠以及大肠标本DNA, 经PCR特异性扩增DNA疫苗中的真核启动子CMV作为外源性目的基因整合入小鼠基因组的证据, 结果证实目的基因flk-1(n1-4)已整合到小鼠基因组中; 动物试验表明, 经疫苗免疫后荷瘤小鼠中位生存期较对照组明显延长; 显著抑制小鼠结肠腺癌的血管生成, 进而抑制肿瘤的生长; 免疫学指标检测发现此口服DNA疫苗的作用机制可能是通过激活细胞免疫以及体液免疫而起到抗肿瘤血管生成及抑制肿瘤侵袭作用. 以上结果表明本实验室制备的口服DNA疫苗具有抑制结肠腺癌生长的作用, VEGFR2胞外1-4袢可能与完整受体竞争性结合VEGF, 从而降低了血清VEGF水平, 肿瘤周围血管内皮细胞受VEGF分泌刺激受限, 并且完全阻断了完整VEGFR2胞内信号传导功能, 导致血管内皮细胞的分裂及增殖能力降低, 血管生成减少最终抑制肿瘤的生长[31]. 本研究结果为小片段克隆合成并制备成为更为安全的DNA疫苗提供了新的思路, 同时也为结肠腺癌的抗血管生成治疗策略提供了强有力的支持.
VEGF与其受体flk-1的相互作用, 在肿瘤周围血管形成过程中起到关键作用. 肿瘤细胞分泌大量的VEGF, 通过作用于内皮细胞上相应的跨膜受体, 引起内皮细胞的增殖和血管形成. 可溶性受体为VEGFR胞外不同大小的片段, 仅具有与其配体VEGF相结合的能力, 而无信号传导功能, 因此可竞争VEGF的功能受体, 阻止肿瘤血管的形成, 进而抑制肿瘤生长. 因此, 利用可溶性受体阻断VEGF与相应受体的结合, 在目前抗肿瘤血管形成的研究中倍受关注.
陈其奎, 教授, 中山大学附属第二医院消化内科
研究发现, 采用基因重组的方法可以诱导可溶性受体的产生, 由于可溶性受体(sVEGFR)仅具有与VEGF结合的能力, 而无信号传导功能. 因此可用sVEGFR竞争性结合VEGF, sVEGFR与VEGF结合后, 耗竭肿瘤细胞产生的VEGF, 从而抑制VEGF诱导的生物学活性, 阻断VEGF与VEGFR2的结合, 达到抑制肿瘤生长的目的. Niethammer et al将VEGFR2全长cDNA序列插入真核载体pcDNA3.1(+)构建重组质粒, 再将重组质粒转化减毒鼠沙门氏菌SL7207, 通过胃饲小鼠, 研究发现其对于实体瘤血管生成以及肿瘤生长有明显抑制作用.
本文将VEGFR2胞外1-4片段插入质粒pcDNA3.1(+), 转化减毒沙门氏菌SL3261后成功构建小鼠po基因工程疫苗SL3261-pcDNA3.1+/flk-1(n1-4), 结果发现该疫苗对于小鼠皮下肿瘤的生长有明显的抑制作用, 并能够显著延长荷瘤小鼠的生存时间. 本研究结果为po DNA疫苗抗小鼠结肠腺癌的研究提供了强有力的支持.
本文为小片段克隆合成并制备成为更为安全的DNA疫苗提供了新的思路, 同时为以后抗血管生成策略应用于肿瘤的临床治疗提供可靠的依据.
本文具有一定的科学性和方法学创新性, 有一定的理论价值和应用价值.
编辑:程剑侠 电编:吴鹏朕
| 1. | Witte L, Hicklin DJ, Zhu Z, Pytowski B, Kotanides H, Rockwell P, Böhlen P. Monoclonal antibodies targeting the VEGF receptor-2 (Flk1/KDR) as an anti-angiogenic therapeutic strategy. Cancer Metastasis Rev. 1998;17:155-161. [PubMed] |
| 2. | Yoshida S, Amano H, Hayashi I, Kitasato H, Kamata M, Inukai M, Yoshimura H, Majima M. COX-2/VEGF-dependent facilitation of tumor-associated angiogenesis and tumor growth in vivo. Lab Invest. 2003;83:1385-1394. [PubMed] |
| 3. | Verheul HM, Pinedo HM. The role of vascular endothelial growth factor (VEGF) in tumor angiogenesis and early clinical development of VEGF-receptor kinase inhibitors. Clin Breast Cancer. 2000;1 Suppl 1:S80-S84. [PubMed] |
| 4. | Werther K, Nielsen HJ. Significance of vascular endothelial growth factor--VEGF--in tumor angiogenesis. Therapeutic possibilities in solid tumors. Ugeskr Laeger. 2000;162:4916-4920. [PubMed] |
| 5. | Shinkai A, Ito M, Anazawa H, Yamaguchi S, Shitara K, Shibuya M. Mapping of the sites involved in ligand association and dissociation at the extracellular domain of the kinase insert domain-containing receptor for vascular endothelial growth factor. J Biol Chem. 1998;273:31283-31318. [PubMed] |
| 6. | Neufeld G, Cohen T, Gengrinovitch S, Poltorak Z. Vascular endothelial growth factor (VEGF) and its receptors. FASEB J. 1999;13:9-22. [PubMed] |
| 7. | Shoda LK, Kegerreis KA, Suarez CE, Mwangi W, Knowles DP, Brown WC. Immunostimulatory CpG-modified plasmid DNA enhances IL-12, TNF-alpha, and NO production by bovine macrophages. J Leukoc Biol. 2001;70:103-112. [PubMed] |
| 8. | Dietrich G, Spreng S, Gentschev I, Goebel W. Bacterial systems for the delivery of eukaryotic antigen expression vectors. Antisense Nucleic Acid Drug Dev. 2000;10:391-399. [PubMed] |
| 9. | Darji A, zur Lage S, Garbe AI, Chakraborty T, Weiss S. Oral delivery of DNA vaccines using attenuated Salmonella typhimurium as carrier. FEMS Immunol Med Microbiol. 2000;27:341-349. [PubMed] |
| 10. | Sirard JC, Niedergang F, Kraehenbuhl JP. Live attenuated Salmonella: a paradigm of mucosal vaccines. Immunol Rev. 1999;171:5-26. [PubMed] |
| 11. | Niethammer AG, Xiang R, Becker JC, Wodrich H, Pertl U, Karsten G, Eliceiri BP, Reisfeld RA. A DNA vaccine against VEGF receptor 2 prevents effective angiogenesis and inhibits tumor growth. Nat Med. 2002;8:1369-1375. [PubMed] |
| 12. | Lü F, Qin ZY, Yang WB, Qi YX, Li YM. A DNA vaccine against extracellular domains 1-3 of flk-1 and its immune preventive and therapeutic effects against H22 tumor cell in vivo. World J Gastroenterol. 2004;10:2039-2044. [PubMed] |
| 13. | Feng KK, Zhao HY, Qiu H, Chen J. Specific anti-glioma angiogenesis immune response induced by attenuated Salmonella typhimurium vaccine expressing vascular endothelial growth factor receptor-2. Ai Zheng. 2005;24:548-553. [PubMed] |
| 14. | 陈 明清, 杜 伟, 王 熙才, 伍 治平, 陈 艳, 王 志强, 许 岩. 口服DNA疫苗pcDNA3.1+/flk-1(n1-7)抗小鼠结肠癌肝转移. 中国癌症杂志. 2006;16:641-646. |
| 15. | During MJ, Symes CW, Lawlor PA, Lin J, Dunning J, Fitzsimons HL, Poulsen D, Leone P, Xu R, Dicker BL. An oral vaccine against NMDAR1 with efficacy in experimental stroke and epilepsy. Science. 2000;287:1453-1460. [PubMed] |
| 16. | Huebener N, Lange B, Lemmel C, Rammensee HG, Strandsby A, Wenkel J, Jikai J, Zeng Y, Gaedicke G, Lode HN. Vaccination with minigenes encoding for novel 'self' antigens are effective in DNA-vaccination against neuroblastoma. Cancer Lett. 2003;197:211-217. [PubMed] |
| 17. | 李 玉华, 陈 慧, 郭 坤元, 解 咏梅, 王 丰, 谢 匡诚, 黄 建生, 任 大明. 口服携带细胞因子基因的减毒沙门氏菌对小鼠肿瘤的预防作用. 科学通报. 2001;46:317-321. |
| 18. | Weidner N, Folkman J, Pozza F, Bevilacqua P, Allred EN, Moore DH, Meli S, Gasparini G. Tumor angiogenesis: a new significant and independent prognostic indicator in early-stage breast carcinoma. J Natl Cancer Inst. 1992;84:1875-1887. [PubMed] |
| 19. | Giordano FJ, Johnson RS. Angiogenesis: the role of the microenvironment in flipping the switch. Curr Opin Genet Dev. 2001;11:35-40. [PubMed] |
| 20. | Bergers G, Benjamin LE. Tumorigenesis and the angiogenic switch. Nat Rev Cancer. 2003;3:401-410. [PubMed] |
| 21. | Blagosklonny MV. Antiangiogenic therapy and tumor progression. Cancer Cell. 2004;5:13-17. [PubMed] |
| 22. | Witte L, Hicklin DJ, Zhu Z, Pytowski B, Kotanides H, Rockwell P, Bohlen P. Monoclonal antibodies targeting the VEGF receptor-2 (Flk1/KDR) as an anti-angiogenic therapeutic strategy. Cancer Metastasis Rev. 1998;155-161. [PubMed] |
| 23. | Hunt S. Technology evaluation: IMC-1C11, ImClone Systems. Curr Opin Mol Ther. 2001;3:418-424. [PubMed] |
| 24. | Gingrich DE, Reddy DR, Iqbal MA, Singh J, Aimone LD, Angeles TS, Albom M, Yang S, Ator MA, Meyer SL. A new class of potent vascular endothelial growth factor receptor tyrosine kinase inhibitors: structure-activity relationships for a series of 9-alkoxymethyl-12-(3-hydroxypropyl)indeno[2,1-a]pyrrolo[3,4-c]carbazole-5-ones and the identification of CEP-5214 and its dimethylglycine ester prodrug clinical candidate CEP-7055. J Med Chem. 2003;46:5375-5388. [PubMed] |
| 25. | Laird AD, Cherrington JM. Small molecule tyrosine kinase inhibitors: clinical development of anticancer agents. Expert Opin Investig Drugs. 2003;12:51-64. [PubMed] |
| 26. | Strawn LM, McMahon G, App H, Schreck R, Kuchler WR, Longhi MP, Hui TH, Tang C, Levitzki A, Gazit A. Flk-1 as a target for tumor growth inhibition. Cancer Res. 1996;56:3540-3545. [PubMed] |
| 27. | Li B, Fuh G, Meng G, Xin X, Gerritsen ME, Cunningham B, de Vos AM. Receptor-selective variants of human vascular endothelial growth factor. Generation and characterization. J Biol Chem. 2000;275:29823-29828. [PubMed] |
| 28. | Gille H, Kowalski J, Li B, LeCouter J, Moffat B, Zioncheck TF, Pelletier N, Ferrara N. Analysis of biological effects and signaling properties of Flt-1 (VEGFR-1) and KDR (VEGFR-2). A reassessment using novel receptor-specific vascular endothelial growth factor mutants. J Biol Chem. 2001;276:3222-3230. [PubMed] |
| 29. | Larrivee B, Karsan A. Signaling pathways induced by vascular endothelial growth factor (review). Int J Mol Med. 2000;5:447-456. [PubMed] |