修回日期: 2007-07-02
接受日期: 2007-07-28
在线出版日期: 2007-08-08
目的: 探讨四氯化碳(CCl4)诱发大鼠肝纤维化自发逆转过程中肝库普弗细胞与星状细胞的分布和意义.
方法: 500 mL/L CCl4腹腔注射8 wk诱发大鼠肝纤维化模型, 实验第8, 12周末检测血清生化指标, 观察肝组织的病理变化, 采用免疫组化SP法观察单核巨噬细胞抗原(ED1), α-平滑肌动蛋白(α-SMA)阳性表达的肝库普弗细胞(kupffer cell, KC)和肝星状细胞(hepatic stellate cells, HSC)的分布.
结果: 第8周末模型组大鼠与对照组比较, 血清ALT和AST活性(568.18±630.46 nkat/L vs 472.26±167.37 nkat/L, P<0.05; 5845.84±1353.27 nkat/L vs 1698.51±663.30 nkat/L, P<0.01), 肝/体质比(3.90±0.85 vs 2.56±0.24, P<0.001)及胶原纤维面密度(5.87±1.13 vs 0.52±0.30, P<0.001) 明显增高; 大量ED1和α-SMA阳性的KC和HSC主要分布在汇管区增生的纤维组织及纤维间隔内. 第12周末模型组与第8周比较大鼠血清ALT活性(1020.70±306.73 nkat/L vs 376.74±304.06 nkat/L, P<0.05)仍较高外, 胶原纤维面密度减少, 汇管区增生的纤维组织及纤维间隔内ED1阳性的KC减少, α-SMA阳性的HSC消失.
结论: 腹腔注射CCl4 8 wk后大鼠肝功能明显损伤,形成肝硬化, KCs激活和HSCs活化相关, 停止注射CCl4 4 wk后大鼠肝纤维化发生自发逆转.
引文著录: 金英姬, 金仁顺, 朴东明. 四氯化碳诱发大鼠肝纤维化自发逆转中库普弗细胞与星状细胞的分布. 世界华人消化杂志 2007; 15(22): 2453-2457
Revised: July 2, 2007
Accepted: July 28, 2007
Published online: August 8, 2007
AIM: To investigate the distribution and significance of kupffer cells (KCs) and hepatic stellate cells (HSCs) during spontaneous reversible carbon tetrachloride (CCl4)-induced liver fibrosis in rats.
METHODS: Rat liver fibrosis was induced by peritoneal injection of CCl4 (500 mL/L) for 8 weeks. Serum activity of alanine transaminase (ALT) and aspartate transaminase (AST), total protein (TP) content, ratio of liver/body weight, and area density of collagenous fiber were examined 8 and 12 weeks after injection. Meanwhile, the pathological changes in the liver were observed by light microscopy after Hematoxylin and eosin (HE) staining. The expression of ED1 and α-smooth muscle actin (α-SMA) was detected by immunohistochemical streptavdin-peroxidase-biotin (SP) method.
RESULTS: Compared with the control group, the levels of ALT (2568.18 ± 630.46 nkat/L vs 472.26 ± 167.37 nkat/L, P < 0.05) and AST (5845.84 ± 1353.27 nkat/L vs 1698.51 ± 663.30 nkat/L, P < 0.01), ratio of liver/body weight (3.900 ± 0.850 vs 2.560 ± 0.240, P < 0.001), and area of collagenous fiber (5.867 ± 1.127 vs 0.518 ± 0.2995, P < 0.001) were significantly increased 8 wk after injection of CCl4. Diffuse cirrhosis was observed in most rats, and ED1- and α-SMA-positive cells were prominently aggregated in the fibrotic tissue and septa. Compared with that at 8 wk, ALT (1020.70 ± 306.73 nkat/L vs 376.74 ± 304.06 nkat/L, P < 0.05) level was still higher 12 wk after injection, but the area of collagenous fiber had decreased, fibrous septa became thinner, discontinuous and understained, the number of ED1-positive cells was reduced, and α-SMA-positive cells had disappeared.
CONCLUSION: CCl4 induced obvious liver dysfunction and diffuse cirrhosis in rats, and KCs are closely associated with the activation of HSCs. Rat liver fibrosis is reversible 4 wk after stopping CCl4 injection.
- Citation: Jin YJ, Jin RS, Piao DM. Distribution of kupffer and hepatic stellate cells during spontaneous reversible carbon-tetrachloride-induced liver fibrosis in rats. Shijie Huaren Xiaohua Zazhi 2007; 15(22): 2453-2457
- URL: https://www.wjgnet.com/1009-3079/full/v15/i22/2453.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i22.2453
长期以来人们对肝纤维化、肝硬化能否发生逆转存在着争议, 著名的肝病学家Rogking对肝纤维化、肝硬化进行了深入的研究后提出了典型发展的肝纤维化、肝硬化可以逆转的结论[1]. 近年来随着肝纤维化研究的不断深入, 对其可逆性的认识也进一步提高, 肝纤维化可逆性的临床和动物实验研究日益增多. 本实验利用四氯化碳(CCl4)制备肝纤维化的动物模型, 观察其在自发逆转过程中ED-1和α-SMA的表达, 探讨CCl4诱发大鼠肝纤维化的可逆性.
SD♂大鼠(清洁级), 体质量160-180 g, 由延边大学医学院动物科提供; CCl4、直接红(direct red 80)购自Sigma公司(Aldrich Chemical Co, USA); 血清ALT, AST及TP(总蛋白)检测试剂购自Eiken Chemical公司(Tokyo, Japan); 免疫组化ED1 mAb购自Serotec公司(Oxford, England), α-SMA mAb购自Dako公司(Glostrup, Denmak).
1.2.1 动物模型制作: 实验1: 将16只动物随机分为2组, 正常组(n = 6): 橄榄油1 mL/kg, 2次/wk, ip共8 wk; 模型组(n = 10): 500 mL/L CCl4(橄榄油稀释)1 mL/kg, 2次/wk, ip共8 wk, 第8周末用乙醚麻醉大鼠, 心脏采血离心处理, 处死动物后立即取肝脏. 实验2: 正常组(n = 6): 橄榄油ip同实验1. 模型组(n = 10): 500 mL/L CCl4 ip同实验1, 第9周开始停止注射橄榄油和CCl4, 第12周末用乙醚麻醉大鼠, 心脏采血离心处理, 处死动物后立即取肝脏.
1.2.2 血清生化检测: 血清AST和ALT测定采用Reiman-Frankel氏方法, TP采用Biuret法, 严格按Kit说明书进行操作, 利用分光光度计(Ultraspec 4050, LKB, Switzerland)在490 nm测定光密度, 对照标准曲线得出结果.
1.2.3 病理学检查: 大鼠肝/体质比: 处死前测量动物的体质量, 采血后立即取肝脏称质量, 计算肝/体质量百分比. 病理学观察: 称质量后于肝左叶相同部位取2块组织, 经40 g/L中性甲醛固定, 常规石蜡包埋, 切片作HE染色观察肝组织病理变化, 直接红染色(1 g/L直接红picric acid饱和液)观察纤维组织的增生程度. 胶原纤维的定量分析: 直接红染色后的切片, 利用CMIAS真彩色病理图象分析系统(北京航空航天大学)进行胶原纤维的定量分析. 观察条件: 物镜4倍, 每张切片随机选2个视野, 图象采集、分割处理, 参数统计分析, 得出目标总面积/统计场总面积之比值. 免疫组织化学染色: 切片厚4-5 μm, 常规脱蜡至水, 采用SP法进行免疫组织化学染色, ED1工作浓度为1:100, α-SMA工作浓度为1:50.
统计学处理 数据均用mean±SD表示, 两样本均数的比较用t检验.
实验过程实验1模型组大鼠死亡3只, 实验2模型组死亡2只.
实验1模型组因大鼠肝细胞弥漫性脂肪变性, 肝脏体积增大, 与正常组比较肝/体质量比和胶原纤维面密度明显增高(P<0.001), 血清ALT和AST明显升高(P<0.05, P<0.01), TP含量下降, 但无统计学意义. 实验2模型组大鼠肝细胞脂肪变性消失, 肝/体质量比与正常组相似, 胶原纤维面密度虽然增高(P<0.05), 但与实验1中毒组比较明显下降, 血清生化指标除ALT(P<0.05)仍较高外, 其他指标与正常组相似(表1).
| 分组 | n | 肝/体质量比(%) | 面密度(%) | ALT(nkat/L) | AST(nkat/L) | TP(g/L) | |
| 实验1 | 正常组 | 6 | 2.56±0.24 | 0.52±0.30 472.26±167.37 | 1698.51±663.30 | 7.53±0.56 | |
| 模型组 | 10(3) | 3.90±0.85b | 5.87±1.13b | 2568.18±630.46a | 5845.84±1353.27b | 6.49±0.51 | |
| 实验2 | 正常组 | 6 | 2.58±0.21 | 0.65±0.34 | 376.74±304.06 | 2842.74±1205.07 | 7.21±1.19 |
| 模型组 | 10(2) | 2.68±0.66 | 3.58±0.69c | 1020.70±306.73c | 2890.24±434.25 | 6.34±0.42 |
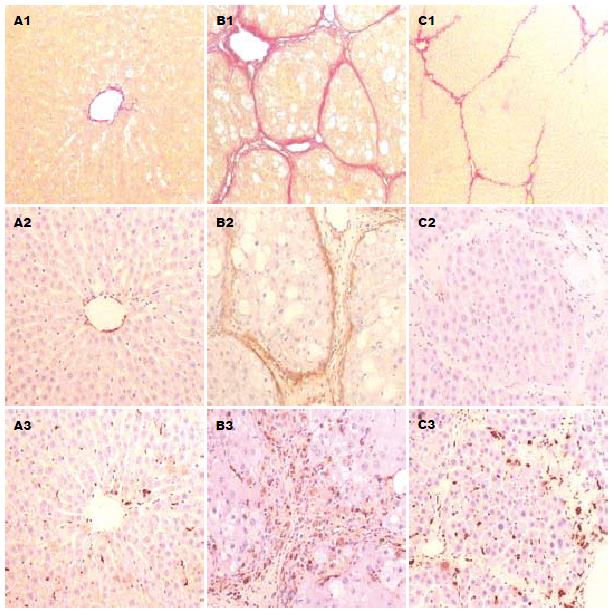
正常组肝小叶结构正常, 肝细胞无变性、坏死, 无纤维组织增生(图1-A1). 实验1模型组肝小叶结构破坏, 肝细胞明显肿胀, 胞质内可见弥漫性、大小不等的脂肪空泡, 可见点状、灶状坏死, 伴大量炎症细胞浸润; 汇管区大量纤维组织增生, 粗大的纤维间隔伸入肝组织内, 形成弥漫性、大小不等的假小叶(图1-B1). 实验2模型组肝小叶结构紊乱, 肝细胞脂肪变性消失, 偶见点状坏死, 炎症细胞明显减少; 汇管区纤维组织减少, 纤维间隔变细、不连续, 染色变淡, 与实验1模型组比较肝纤维化明显减轻(图1-C1).
正常组α-SMA在汇管区的各种血管壁上阳性表达, 肝小叶中央静脉壁有少量阳性表达, 肝实质内无阳性表达(图1-A2).实验1模型组α-SMA阳性表达的HSCs主要分布在汇管区增生的纤维组织及纤维间隔的边缘(图1-B2), 实验2模型组汇管区增生的纤维组织及纤维间隔内α-SMA阳性的HSC消失(图1-C2). 正常组ED1阳性表达的KC在汇管区、肝小叶中央静脉周围和肝实质内散在分布(图1-A3), 实验1模型组ED1阳性的KC细胞在汇管区增生的纤维组织及间隔内大量分布(图1-B3), 肝实质内较多散在分布, 实验2模型组ED1阳性的KC数量明显减少(图1-C3), 肝实质内少量散在分布.
肝纤维化及其终末期疾病肝硬化是主要的世界健康问题, 迄今为止晚期肝硬化治疗的唯一有效方法是肝脏移植[2]. 在过去的几十年围绕着肝纤维化、肝硬化能否发生逆转一直有争议. 近年来随着分子生物学技术的发展, 国内外对肝纤维化的发生机制进行了广泛、深入的研究, 逐步改变了肝纤维化不可逆转的观点, 提出了肝纤维化可逆转和从肝硬化恢复也是可能的结论[3]. CCl4是诱导大鼠肝纤维化模型的最经典和广泛应用的肝毒性物质, 该模型在肝纤维发生相关的组织学、生物化学、细胞和分子改变等方面具有最好的特性[4-5], CCl4 ip造模结果优于sc造模[6], sc造模结果优于人血白蛋白造模结果[7], 该模型在形态学及病理生理学的某些方面与人的慢性肝病肝纤维化进展为肝硬化相似.
一般认为早期肝硬化可能逆转, 而晚期肝硬化逆转的可能性不大[8]. 目前认为自发逆转现象在肝纤维化模型动物中具有较大的普遍性. Iredale et al[9]报道, 经ip CCl4(2次/wk) 4 wk可诱发大鼠肝纤维化, 停止毒剂注射后d 0, 3, 7, 28测定肝组织羟脯氨酸含量, 同时作肝组织学检查, 可见纤维间隔逐渐变细、不连续, d 28时几乎完全消退. 本实验在停止CCl4注射d 28后肝纤维化虽自发逆转, 但尚未完全消退, 主要是与造模时间长(8 wk), 肝纤维化程度重有关. 肝纤维化形成的中心通路是肝细胞损伤或坏死的刺激激活KC, KC活化后分泌多种细胞因子再激活HSC, HSC转化为成纤维样细胞或肌纤维细胞活化的HSC是ECM生成的主要细胞, 他可表达α-SMA和Desmin. Noyan et al[10]认为免疫组织化学α-SMA结果比Desmin提供更好的资料, 目前α-SMA抗体广泛用于肝纤维化的病理学研究中. 研究表明在肝脏受损伤而发生肝纤维化的过程中HSC的分裂和凋亡都增加, 在肝纤维化的进展过程中HSC的增生占优势, 而在恢复过程中其凋亡占优势. 最近的研究证实, 细胞外基质的降解导致了HSC的凋亡, 而不是HSC的凋亡引起细胞外基质的降解.
本组结果表明ip CCl4第8周末模型组大鼠肝功能明显受损伤, 血清ALT, AST活性明显升高, 肝/体质量比、胶原纤维面密度明显增加, 汇管区大量纤维组织增生, 较粗的纤维间隔伸入肝组织内, 形成大小不等的假小叶, 大部分动物形成弥漫性肝硬化. 免疫组化结果表明模型组大量KC及HSC主要分布在汇管区增生的纤维组织及纤维间隔内, 表明KC与活化HSC密切相关. 停止CCl4攻击4 wk后模型组大鼠肝功能除了血清ALT活性仍较高外其他生化指标和肝/体质比与正常组相似, 胶原纤维面密度较实验1模型组明显下降, 汇管区纤维组织减少, 纤维间隔变细、不连续、染色淡, 表明停止CCl4攻击4 wk后大鼠肝纤维化自发逆转. ED1 mAb可识别全部单核巨噬细胞系统的细胞, ED1阳性细胞包括几乎全部的肝KC, KC主要位于门脉血管和中央静脉周围. 实验研究已证实CCl4和猪血清诱发的大鼠肝纤维化中ED1阳性细胞显著增加, 主要位于增生的纤维间隔部位[11-13]. 本实验免疫组化结果表明, 第8周末模型组大量ED1和α-SMA阳性细胞主要在汇管区增生的纤维组织及纤维间隔内分布, 两种阳性细胞分布部位相同, 表明KC与HSC活化密切相关. 停止CCl4攻击4 wk后模型组增生的纤维组织及纤维间隔内ED阳性细胞数量明显减少, α-SMA阳性细胞消失, 表明消除诱发毒性物质CCl4后, 经过4 wk后已形成的大鼠肝纤维化发生自发逆转. 活化的α-SMA阳性HSC主要通过凋亡机制, 使其数量减少和消失是肝纤维化自发逆转的主要机制之一[14]. 肝纤维化的程度取决于HSC增生和活化, 因此抑制HSC活化是阻断肝纤维化的一种主要的途径[15]. 近年的研究表明停止注射CCl4后第7天TGF-β1水平明显下降, 其下降与逆转中HSC通过Fas依赖途径发生凋亡有关[16], 最近的研究表明Verapamil通过减少TGF-β1表达, 阻断HSC活化而延缓肝纤维化的形成[17].
肝纤维化形成的中心环节是肝细胞损伤或坏死后激活KC, KC活化后分泌多种细胞因子再激活HSC, HSC转化为成纤维样细胞或肌纤维细胞, 活化的HSC是生成ECM的主要细胞. 目前认为肝纤维化可发生逆转, 自发逆转现象在肝纤维化模型动物中具有较大的普遍性, 其中CCl4诱发大鼠肝纤维化的自发逆转的研究较多, 但其自发逆转的机制尚不清楚, 因此进一步深入研究肝纤维化的自发逆转对防治肝纤维化有重要意义.
一般认为早期肝硬化可能逆转, 而晚期肝硬化逆转的可能性不大, 目前认为自发逆转现象在肝纤维化模型中具有较大的普遍性.
利用ED-1 和 α-SMA抗体观察 CCl4诱发大鼠肝纤维化自发逆转过程中KC和HSC表达和分布的研究尚少. 本组结果表明ip CCl4 8 wk后模型组大鼠形成弥漫性肝硬化, KC s与激活和活化HSCs密切相关. 停止CCl 4 注射4 wk后模型组大鼠肝硬化自发逆转,ED阳性细胞数量明显减少, α-SMA阳性细胞消失.
本文采用四氯化碳诱发大鼠肝纤维化模型, 探讨了自发逆转过程中库普佛细胞与星状细胞的分布. 为进一步认识肝纤维化的可逆性提供了实验基础, 有一定的参考价值.
编辑:张焕兰 电编:郭海丽
| 3. | Elsharkawy AM, Oakley F, Mann DA. The role and regulation of hepatic stellate cell apoptosis in reversal of liver fibrosis. Apoptosis. 2005;10:927-939. [PubMed] |
| 4. | Tsukamoto H, Matsuoka M, French SW. Experimental models of hepatic fibrosis: a review. Semin Liver Dis. 1990;10:56-65. [PubMed] |
| 5. | Constandinou C, Henderson N, Iredale JP. Modeling liver fibrosis in rodents. Methods Mol Med. 2005;117:237-250. [PubMed] |
| 6. | 吕 鹏. 四氯化碳腹腔注射制备肝纤维化模型的实验研究. 胃肠病学和肝脏病学杂志. 2003;12:339-340. |
| 8. | Lee HS, Huang GT, Chen CH, Chiou LL, Lee CC, Yang PM, Chen DS, Sheu JC. Less reversal of liver fibrosis after prolonged carbon tetrachloride injection. Hepatogastroenterology. 2001;48:1312-1315. [PubMed] |
| 9. | Iredale JP, Benyon RC, Pickering J, McCullen M, Northrop M, Pawley S, Hovell C, Arthur MJ. Mechanisms of spontaneous resolution of rat liver fibrosis. Hepatic stellate cell apoptosis and reduced hepatic expression of metalloproteinase inhibitors. J Clin Invest. 1998;102:538-549. [PubMed] |
| 10. | Noyan S, Cavusoglu I, Minbay FZ. The effect of vitamin A on CCl4-induced hepatic injuries in rats: a histochemical, immunohistochemical and ultrastructural study. Acta Histochem. 2006;107:421-434. [PubMed] |
| 11. | Orfila C, Lepert JC, Alric L, Carrera G, Beraud M, Vinel JP, Pipy B. Expression of TNF-alpha and immunohistochemical distribution of hepatic macrophage surface markers in carbon tetrachloride-induced chronic liver injury in rats. Histochem J. 1999;31:677-685. [PubMed] |
| 12. | Armbrust T, Ramadori G. Functional characterization of two different Kupffer cell populations of normal rat liver. J Hepatol. 1996;25:518-528. [PubMed] |
| 13. | Bhunchet E, Eishi Y, Wake K. Contribution of immune response to the hepatic fibrosis induced by porcine serum. Hepatology. 1996;23:811-817. [PubMed] |
| 15. | Lee KS. Hepatic fibrogenesis. Korean J Gastroenterol. 2006;48:297-305. [PubMed] |
| 17. | Xu D, Wu Y, Liao ZX, Wang H. Protective effect of verapamil on multiple hepatotoxic factors-induced liver fibrosis in rats. Pharmacol Res. 2007;55:280-286. [PubMed] |