修回日期: 2007-05-01
接受日期: 2007-05-23
在线出版日期: 2007-07-08
目的: 探讨APC和p53基因突变在结直肠癌中的意义.
方法: 采用变性梯度凝胶电泳(DGGE), DNA测序法分析15例正常人和60例散发性结直肠癌标本的APC基因15外显子和p53基因第5, 7外显子的基因突变.
结果: 在结直肠癌组检出14例APC和16例p53基因突变, 测序证实其中13/14例APC发生在突变集中区域; 9/16例p53基因突变位于第5外显子, 7/16例p53基因突变位于第7外显子, 2例同时检出了APC基因和p53基因突变.
结论: DGGE是一种快速、简便、高效、灵敏的突变检测技术. 同时也证明APC基因突变和p53基因突变均参与了结直肠癌的发生、发展过程.
引文著录: 王艳, 李岩. 变性梯度凝胶电泳分析检测结直肠癌APC和p53基因突变. 世界华人消化杂志 2007; 15(19): 2162-2166
Revised: May 1, 2007
Accepted: May 23, 2007
Published online: July 8, 2007
AIM: To explore the effects of APC and p53 gene mutations in colorectal carcinoma.
METHODS: PCR-DGGE and direct DNA sequencing were used to identify mutations in exon 15 of the APC gene, and exons 5 and 7 of the p53 gene in 15 cases of normal colorectal mucosa and 60 cases of sporadic colorectal tumors.
RESULTS: Abnormal electrophoretic bands were found by DGGE. Fourteen cases of APC gene mutations and 16 cases of p53 gene mutations were detected. DNA sequencing showed that 13/14 cases took place in the APC-MCR region, 9/16 at exon 5, and 7/16 at exon 7. Two cases had both APC and p53 gene mutations.
CONCLUSION: DGGE was very sensitive for screening mutations of APC and p53 genes. DGGE combined with DNA sequencing could be used to define all colorectal cancer mutations. The APC and p53 genes were both involved in the formation stages of colorectal carcinoma.
- Citation: Wang Y, Li Y. Mutation analysis of APC and p53 genes in colorectal cancer by denaturing gradient gel electrophoresis. Shijie Huaren Xiaohua Zazhi 2007; 15(19): 2162-2166
- URL: https://www.wjgnet.com/1009-3079/full/v15/i19/2162.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i19.2162
大肠癌的发生是一个多基因、多阶段、多因素参与的过程, 其中抑癌基因的失活是一个重要的机制, "腺瘤→腺癌"模式普遍被认为是70%大肠癌的发展规律. 大肠癌的早期诊断和防治十分困难, 现代分子生物学的大量研究揭示大肠癌的发展过程中涉及到癌基因(K-ras等)的激活和抑癌基因(APC, p53, MCC, DCC等)的失活. APC基因的突变多发生于大肠癌的早期[1], p53基因是迄今发现与人类肿瘤相关性最高的基因,野生型P53蛋白是一种抑癌基因产物, 他的失活对肿瘤的形成有重要意义. 我们用DGGE技术分别检测APC基因MCR区段基因突变和p53基因第5, 7外显子的突变, 并进行DNA测序, 为大肠癌的早期诊断和治疗提供一个分子生物学指标.
15例正常肠黏膜组织取自中国医科大学第一临床学院消化内镜室; 60例大肠癌组织及癌旁5 cm以外正常黏膜组织取自中国医科大学第一临床学院外科手术切除标本, 均经病理证实为大肠癌. 切下后的新鲜标本立即用生理盐水冲洗后切成小块置液氮中保存. 应用Bio-Rad Power Pac3000型电泳仪、DGGE System电泳系统和Gel Doc1000图像分析系统, 甲酰胺、尿素(Bio-Rad公司); PE9600基因扩增仪(PE公司); 电泳所用主要试剂: 40% Acrylamide/Bis(38:2), 50×TAE, 尿素和去离子甲酰胺均由Bio-Rad公司提供. 制备60 g/L聚丙烯酰胺/TAE凝胶, 变性剂梯度范围20%-80%.
1.2.1 DNA提取: 用酚/氯仿法提取DNA为模板. 取冰冻组织约0.2 g捣碎, 加TE缓冲液(10 mmol/L Tris-HCl-EDTA, pH8.0)研至匀浆状后加入适量SDS, 100 g/L蛋白酶K 37℃消化过夜, 常规酚, 氯仿法抽提3次, 加入适量3 mol/L乙酸钠和冷乙醇沉淀出DNA纤维丝, 室温干燥后加入适量TE, 用紫外分光光度计测算DNA的浓度和纯度后置4℃中保存.
1.2.2 PCR引物: APC基因第15外显子1260-1593密码子区用4对引物扩增, 顺序见表1. p53基因第5, 7外显子的引物及用于DGGE的GC-clamp引物顺序如下[2]. 所有引物均由上海细胞生物学研究所合成; dNTP, DNA标准分子量Marker和琼脂糖, Promega公司; Taq DNA聚合酶, 华美生物工程公司.
| code | Lenth (bp) | seqence | |
| APC-A | 1260-1359 | 298 | F: CAGACTTATTGTGTAGAAGA |
| R: CTCCTGAAGAAAATTCAACA | |||
| APC-B | 1339-1436 | 295 | F: AGGGTTCTAGTTTATCTTCA |
| R: TCTGCTTGGTGGCATGGTTT | |||
| APC-C | 1417-1516 | 300 | F: GGCATTATAAGCCCCAGTGA |
| R: AAATGGCTCATCGAGGCTCA | |||
| APC-D | 1497-1593 | 291 | F: ACTCCAGATGGATTTTCTTG |
| R: GGCTGGCTTTTTTGCTTTAC | |||
| P53-E5 | 3038-3279 | 241 | F: TTCCTCTTCCTGCAGTACTC |
| R: CTGGGCAACCAGCCCTGTCGT | |||
| P53-E7 | 3991-4114 | 123 | F: TCTCCTAGGTTGGCTCTGACTG |
| R: GCAAGTGGCTCCTGACCTGGA | |||
| GC-Clamp: | CGCCCGCCGCGCCCCGCGCCCGTCCCGCCGCCCCCGCCCG | ||
| CCCCGCTCCCCGCCCCCCTCCCCGCCCCGCCCGTCGCCGCCCCG | |||
1.2.3 PCR扩增: 反应体系: PCR反应体系的基本组成为: 模板5 μL; 10×反应缓冲液(50 mmol/L KCl; 10 mmol/L Tris-HCl, pH9.0; 1 g/L Triton100) 5 μL; MgCl2(15 mmol/L) 5 μL, dNTPs(每种2 mmoL) 5 μL, 引物(20 μmol/L)各0.6 μL, Taq DNA聚合(5×106 U/L) 0.2 μL. APC基因循环参数: 94℃加热7 min. 反应程序如下: 94℃ 50 s; 52℃ 50 s和72℃ 50 s, 共35个循环, 然后72℃ 5 min为最后的延伸阶段. p53基因循环参数: 94℃加热5min. 反应程序如下: 94℃ 1 min; 62℃ 1 min和72℃ 1 min, 共35个循环, 然后72℃ 5 min为最后的延伸阶段.
1.2.4 变性梯度凝胶电泳(DGGE): 配制变性剂浓度分别为20%和80%的60 g/L聚丙稀酰胺凝胶溶液各15 mL(聚丙稀酰胺/TAE凝胶, 变性剂梯度范围为20%-80%), 100%变性剂即7 mol/L尿素和甲酰胺; 分别加入150 μL的过硫酸铵、15 μL的TEMED后混匀, 经凸轮手动灌制变性剂梯度方向与电泳方向相平行的垂直DGGE凝胶, 过夜凝固; 预热电泳槽中1×TAE缓冲液至60℃, 取20 μL的PCR产物及示踪迹的混合物上样, 150 V, 60℃, 6 h电泳, 电泳后的凝胶经0.4 mg/L溴化乙锭染色, 在紫外灯及凝胶成像以下观察与拍照[3].
1.2.5 DNA测序: 将在DGGE电泳中出现异常带型的样本用全自动遗传分析仪进行测序及突变分析. 按上述条件进行PCR反应后, 将50 μL PCR产物于15 g/L低熔点琼脂糖凝胶上回收, 用Promega公司生产的Wizard TM PCRPreps DNA Purificatiun System纯化后进行测序. 再应用DGGE中所用的未加GC-clamp的反向引物经PE公司生产的ABIPRISM310型全自动核酸序列分析仪进行测序及突变分析. 荧光素标记在ddNTPs上.
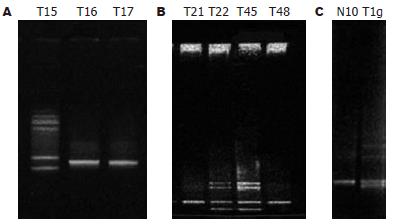
与正常条带数目和位置不同者为有突变者, 由于突变样本中混有正常组织, 大多数形成异源双链(图1).
将在DGGE电泳中出现异常带型的样本进行测序后, 发现几种位置的突变, 具体种类见表2.
| 序号 | 外显子 | 密码子 | 碱基突变类别 | |
| APC基因 | 1 | 15 | 1307 | 缺失AAAA |
| 2 | 15 | 1316 | C→T | |
| 3 | 15 | 1316 | 缺失C | |
| 4 | 15 | 1317 | A→G | |
| 5 | 15 | 1362 | 缺失G | |
| 6 | 15 | 1378 | G→C | |
| 7 | 15 | 1393 | G→A | |
| 8 | 15 | 1450 | T→G | |
| 9 | 15 | 1464 | T→G | |
| 10 | 15 | 1487 | C→T | |
| 11 | 15 | 1516 | A→G | |
| 12 | 15 | 1521 | C→A | |
| 13 | 15 | 1465 | 缺失AC | |
| P53基因 | 1 | 5 | 179 | CAT→TAT |
| 2 | 5 | 182 | TGC→TGTC | |
| 3 | 7 | 245 | GGC→AGC | |
| 4 | 7 | 248 | CGC→CAG | |
| 5 | 7 | 258 | GAA→GTGGAA |
大肠癌是常见的恶性肿瘤, 发病率高且呈上升趋势, 早期诊断和防治十分困难, 现代分子生物学的大量研究揭示大肠癌的发展过程中涉及到癌基因(K-ras等)的激活和抑癌基因(APC, p53, MCC, DCC等)的失活, 这些基因的改变遵循一定的顺序, 即在由"正常细胞-腺瘤-腺癌-癌转移"的演变过程中依次发生"APCK-ras-P53-DCC"的突变[4].
对家族性腺瘤息肉病基因(adenomatous polyposis coli, APC)的研究发现该基因在大多数大肠肿瘤中有突变或缺失, 与大肠癌的发生密切相关由于APC基因突变在大肠癌发生"腺瘤-腺癌"序列中早于K-ras和p53基因突变故被称为人大肠癌发生的"守门者"或"门卫"基因(gatekeeper). APC基因突变首先发现于有种系突变的腺瘤性息肉病患者, 后发现其在散发性大肠癌的发生中亦起重要作用, 这些突变常发生于大肠癌的早期阶段[5]. Miyaki et al[6]发现, 60%大肠肿瘤的APC基因突变发生于APC基因第15外显子5'端1286-1513 codon之间, 将此区域称为突变集中区域(mutation cluster region, MCR). 此结果与文献报道的检测结果相一致. 此突变率低于实际突变率, 因本研究未对1-14外显子进行检测. 过去的研究表明, APC突变多集中在5'端, 所以该区被称为"突变密集区"(mutation clusterregion). APC基因突变将导致其编码蛋白的改变, 使其不能正常地发挥生理功能, 导致细胞黏附、生长、分化、增殖、凋亡调控和细胞内信号传导等方面的重要改变, 使细胞发生癌变[7]. 引起肿瘤形成和细胞转化的P53蛋白是p53基因突变的产物, 是一种肿瘤促进因子, 他可以消除正常P53蛋白的功能, P53正常功能的丧失,最主要的方式是基因突变, 最常见的突变正对应P53基因进化保守区段, 即5-8外显子编码区. P53基因定位于17p13.1, 由10个外显子和11个内含子组成, 编码393个氨基酸蛋白, 分子量为53 kDa.
近年来研究表明, p53基因是肿瘤发生的晚期事件, 人们对p53基因与肿瘤转移与预后的关系进行了多方面的研究[8]. p53基因是迄今发现与人类肿瘤相关性最高的基因, 其主要的失活方式是基因突变, 最常见的基因突变正对应p53基因进化保守区域, 即5-8外显子编码区. 在肿瘤发展过程中, 长期高度生长促进环境中的P53突变的癌细胞比含野生型P53的癌细胞对生长刺激的敏感性降低, 因而对于术后大量释放出的生长因子的反应低于野生型P53细胞, 使含突变P53的残余癌细胞在术后增生繁殖速度远低于野生型P53的癌细胞. 这也就决定了后者的术后复发早于前者、术后生存期短于前者[9]. 常见的突变检测方法包括免疫组化、单链构象多钛性(SSCP)和DGGE等, 前两者最为普遍, DGGE就是一种根据DNA片段的熔解性质而使之分离的凝胶系统. 根据核酸的这些基本性质将凝胶设置在双重变性条件下: 温度50-60℃, 变性剂0%-100%. 当一双链DNA片段通过一变性剂浓度呈梯度增加的凝胶时, 当此片段迁移至某一点, 变性剂的浓度恰好相当于此段DNA的低熔点区的Tm值时, DNA就在此区开始熔解, 而在高熔点区仍为双链. 这种局部发生解链的DNA分子的迁移率发生改变, 从而达到分离效果. Tm值的改变是完全序列依赖性的, 即使只有一个碱基的替代即可引起Tm的升高或降低. 因此, DGGE法可以检测出DNA分子中的任何一个单碱基的突变, 包括转换和颠换. 尽管转换并未改变碱基组成, 但相邻碱基间的相互堆砌作用发生改变也会对Tm产生影响. 1983年Fischer和Lerman根据这个原理, 在双螺旋结构稳定性具有序列特异性的统计学理论的基础上建立了这种突变分析技术[10].
从最初建立到广泛应用的今天, DGGE方法已经有了很大的改进, 其技术改进主要体现在提高突变检出率和简化方法两方面. 由于一旦DNA由双链完全变性成单链, 这种序列依赖性凝胶迁移率变化就失去, 因此, 高熔点区的突变是检测不到的. 为了改进, 人们增加了一个高熔点区, 即GC夹(GC-clamp)和化学夹. GC夹就是在一侧引物的5'端加上一个30-40 bp的GC结构, 这样在PCR产物的一侧可产生一个高熔点区, 使相应的感兴趣的区域成为低熔点区而便于分析. 在实际工作中人们发现突变样本中混有正常组织时形成的异源双链可进一步确保突变的检出率. 于是又将变性梯度凝胶电泳的PCR过程加以改进, 增加了一个异源双链的形成过程. 因为异源双链含有一个错配碱基, 所以较同源双链先解链. 每种碱基替代对某一DNA片段熔解性质的影响是特异的, 所以结合同源双链和异源双链带, 使每个突变带型呈"指纹样", 从而可以与已知突变带型比较鉴定其性质. 如果带型相似, 可以将待测样品与已知突变样品混合进行电泳测定. DGGE技术的主要优点在于高突变检出率, 99%甚至100%. 他的独特之处在于突变带可从凝胶中直接分离而用于进一步的测序分析. 是一种快速、简便、高效、灵敏的突变检测技术. DGGE主要可应用于体内外致突变源作用之后的突变谱筛查、肿瘤组织突变筛查、候选基因的突变分析、新基因的分析、多态分析和标记筛查.
突变分析既可用于鉴定一个候选基因与疾病表型是否存在因果关系, 也可鉴定已知座位上新的等位基因突变, 用于诊断、群体遗传学及基因结构功能分. 从而疾病按涉及何种基因及基因损害的本质进行分类, 达到精确的分子诊断水平. 与其他检测方法相比较, DGGE技术的突变检测率更高, 我们就利用该项技术对散发性结直肠癌的APC及p53基因的突变情况进行检测, 从而进一步证实APC基因和p53基因突变在结直肠癌发生进程中的意义.
在由"正常细胞-腺瘤-腺癌-癌转移"的演变过程中依次发生"APC-K-ras-P53-DCC"的突变, 这一模式自从被提出后得到人们的认可, 也为从分子水平干预疾病的发生奠定了基础.
目前有不少研究将几种检测方法联合应用, 目的就是能减少遗漏, 但是同时也增加了检查的难度和成本, 找到一种既简单又实用, 既准确又经济的检测方法是下一步研究的方向. 本文课题组曾经应用PCR-SSCP方法检测大肠腺瘤、大肠癌的同样基因突变情况, 结合国外同类研究的结果, 突变检出率均不能达100%地检出实际突变情况.
基因突变检测已经被人们应用于很多疾病, 尤其是肿瘤的诊断研究, 针对大肠肿瘤的基因突变进程, 我们研究了腺瘤到腺癌的过程中的基因突变, 尤其是APC, P53基因. 基因突变的检测方法有多种, 关键在于能否最大限度地检测出组织的突变情况. 试图找出百分之百检测基因突变的技术.
本文采用DGGE电泳法检测大肠癌APC基因、p53基因突变, 是对以往该基因检测方法的改进. 文章有一定的科学性, 对于指导大肠癌的基础研究有一定的价值.
编辑:王晓瑜 电编:张敏
| 1. | Mulkens J, Poncin J, Arends JW, De Goeij AF. APC mutations in human colorectal adenomas: analysis of the mutation cluster region with temperature gradient gel electrophoresis and clinicopathological features. J Pathol. 1998;185:360-365. [PubMed] |
| 2. | De Benedetti L, Sciallero S, Gismondi V, James R, Bafico A, Biticchi R, Masetti E, Bonelli L, Heouaine A, Picasso M. Association of APC gene mutations and histological characteristics of colorectal adenomas. Cancer Res. 1994;54:3553-3556. [PubMed] |
| 4. | Groden J, Gelbert L, Thliveris A, Nelson L, Robertson M, Joslyn G, Samowitz W, Spirio L, Carlson M, Burt R. Mutational analysis of patients with adenomatous polyposis: identical inactivating mutations in unrelated individuals. Am J Hum Genet. 1993;52:263-272. [PubMed] |
| 5. | Cheadle JP, Krawczak M, Thomas MW, Hodges AK, Al-Tassan N, Fleming N, Sampson JR. Different combinations of biallelic APC mutation confer different growth advantages in colorectal tumours. Cancer Res. 2002;62:363-366. [PubMed] |
| 6. | Miyaki M, Konishi M, Kikuchi-Yanoshita R, Enomo-to M, Igari T, Tanaka K, Muraoka M, Takahashi H, Amada Y, Fukayama M. Characteris-tics of somatic mutation of the adenomatous polyposis coli gene in colorectal tumors. Cancer Res. 1994;54:3011-3020. [PubMed] |
| 7. | Cooper HS, Everley L, Chang WC, Pfeiffer G, Lee B, Murthy S, Clapper ML. The role of mutant Apc in the development of dysplasia and cancer in the mouse model of dextran sulfate sodium-induced colitis. Gastroenterology. 2001;121:1407-1416. [PubMed] |
| 9. | Saigusa N, Maruyama K, Sugimura H, Endoh Y, Baba S. The results of p53 immunostaining in colorectal adenomas, early cancers, advanced cancers and their hepatic metastasis. Gan To Kagaku Ryoho. 1996;23 Suppl 2:159-163. [PubMed] |
| 10. | Bolshakov S, Walker CM, Strom SS, Selvan MS, Clayman GL, El-Naggar A, Lippman SM, Kripke ML, Ananthaswamy HN. p53 mutations in human aggressive and nonaggressive basal and squamous cell carcinomas. Clin Cancer Res. 2003;9:228-234. [PubMed] |