修回日期: 2007-05-01
接受日期: 2007-05-11
在线出版日期: 2007-07-08
目的: 将TFPI-2基因转染胰腺癌细胞系Panc-1细胞, 研究其对胰腺癌细胞凋亡的影响.
方法: 将重组质粒pEGFP-C1-TFPI-2通过脂质体介导转染胰腺癌细胞系Panc-1细胞, G418筛选获得阳性细胞克隆后, 用逆转录-聚合酶链反应(RT-PCR)和免疫印迹(Western blot)技术分别检测转染细胞中TFPI-2 mRNA及相应蛋白的表达, 同时测定转染细胞的生长曲线和凋亡情况.
结果: 同转染空载体及未转染细胞相比, 转染成功的Panc-1细胞可以检测到TFPI-2 mRNA和相应蛋白的表达, 细胞生长受到抑制(n = 9, P = 0.02), DNA琼脂糖凝胶电泳显示凋亡细胞特有的"梯状"条带.
结论: 外源性TFPI-2基因能够抑制胰腺癌细胞生长增殖、诱导胰腺癌细胞凋亡.
引文著录: 汤志刚, 孙振阳, 胡何节, 许戈良, 陈炯, 李建生. TFPI-2基因体外诱导胰腺癌Panc-1细胞的凋亡. 世界华人消化杂志 2007; 15(19): 2093-2096
Revised: May 1, 2007
Accepted: May 11, 2007
Published online: July 8, 2007
AIM: To study the effect of the TFPI-2 gene on apoptosis of human pancreatic cancer cells.
METHODS: Recombinant pEGFP-C1-TFPI-2 was transfected into Panc-1 cells using liposomes. Positive cells were selected by G418. Expression of the TFPI-2 gene was determined by Reverse transcription-polymerase chain reaction(RT-PCR) and Western blotting. Cell growth and apoptosis were also studied.
RESULTS: Expression of TFPI-2 mRNA and protein was detected in Panc-1 cells transfected with pEGFP-C1-TFPI-2. Comparing Panc-1 cells transfected with vector and untransfected cells, the growth rate was lower and the apoptotic index of G418-resistant Panc-1 cells with the expression of TFPI-2 protein was faster(n = 9, P = 0.02).
CONCLUSION: The TFPI-2 gene can inhibit the growth of Panc-1 cells and cause cells to enter apoptosis.
- Citation: Tang ZG, Sun ZY, Hu HJ, Xu GL, Chen J, Li JS. Apoptosis of Panc-1 pancreatic cancer cells induced by the TFPI-2 gene in vitro. Shijie Huaren Xiaohua Zazhi 2007; 15(19): 2093-2096
- URL: https://www.wjgnet.com/1009-3079/full/v15/i19/2093.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i19.2093
细胞凋亡(apoptosis)又称细胞程序性死亡(PCD), 是由基因调控的细胞自主的有序性死亡. PCD异常可导致多种疾病如肿瘤的发生[1]. TFPI-2基因位于人染色体7q22, 与多种肿瘤的发生有关[2-6]. 我们将外源性TFPI-2基因转染到人胰腺癌细胞系Panc-1细胞, 观察其对胰腺癌细胞凋亡的影响, 探讨TFPI-2基因抑制肿瘤细胞增殖的机制.
人胰腺癌细胞系Panc-1购自中科院细胞库; TFPI-2基因真核表达载体pEGFP-C1-TFPI-2由本实验室构建; DMEM培养基购自Hyclone公司; RNA抽提试剂TRIzol Regent购自Gibco BRL公司; RT-PCR试剂盒购自Promega公司; DNA聚合酶pfu, dNTP 购自申能博彩公司; Lipofectamine2000转染试剂盒购自Invitrogen公司; 多克隆抗兔TFPI-2抗体、DBA显色试剂盒购自Santa Cruz公司; DNA抽提试剂盒购自Qiagen公司.
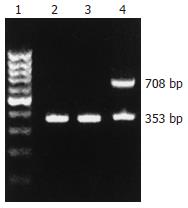
细胞培养及转染Panc-1细胞用含100 g/L胎牛血清的DMEM培养基在37℃, 50 mg/mLCO2的培养箱传代培养. 取对数生长期的细胞, 接种于12孔培养板, 每孔1×105, 培养24 h后, 用无血清的DMEM培养基洗涤两次以备转染. 采用Lipofectamine2000脂质体介导的基因转移技术将重组表达载体pEGFP-C1-TFPI-2转染到Panc-1细胞, G418筛选稳定表达TFPI-2的细胞株, 命名为Panc-1-TFPI-2. 转染空载体和未转染细胞为对照组, 分别命名为Panc-1-V和Panc-1-P. 人TFPI-2基因PCR扩增的上下游引物分别为: 5'CAGAATTCTATGGACCCCGCTCGCCCC3'和5'CAGTCGACTTAAAATTGCTTCTTCCG3', 扩增产物为708 bp. β-actin作为内参照, 上下游引物分别为5'GCTCGTCGTCGACAACGGCT3'和5'CAAACATGATCTGGGTCATCTTCTC3', 扩增产物为353 bp. 按照TRIzol说明书分别从3组细胞中提取总RNA, 紫外分光光度计检测其浓度和纯度. 采用两步法RT-PCR合成TFPI-2 DNA, 取扩增产物进行凝胶电泳, 紫外透视仪检测结果并摄像.
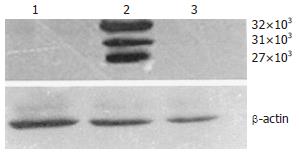
1.2.1 Western blot检测: 动分别提取3组细胞的细胞外基质(ECM)蛋白[7], 测定蛋白浓度, 制备120 g/L SDS-PAGE凝胶, 并进行蛋白质电泳, 电泳分离后, 恒压转移到PVDF膜上, 用含5 g/L脱脂牛奶的TBST缓冲液封闭, 4℃过夜. TBST1/200稀释抗TFPI-2多抗, 室温培育1.5 h, TBST洗5次, 再用HRP标记的抗鼠二抗培育1 h, 显色, 显影. β-actin作为内参.
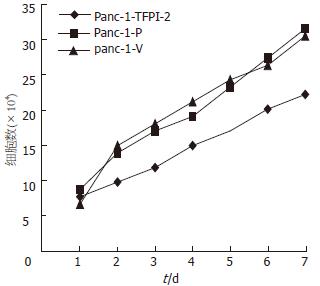
1.2.2 细胞生长曲线测定: 将3组细胞Panc-1-TFPI-2, Panc-1-V和Panc-1-P无血清培养24 h, 使细胞同步化. 取2×104细胞接种于24孔板, 每隔24 h消化3组细胞并计数, 取平均值. 共检测7 d, 以细胞数为纵坐标, 时间为横坐标绘制生长曲线.
1.2.3 DNA片段化实验: 分别收集3组细胞约1×107, 用PBS洗1次, 随后加入含蛋白酶K和RNase的细胞裂解液500 µL, 混匀后于50℃水浴5 h; 加酚:氯仿:异戊醇0.5 mL抽提; 离心后上清移至另一离心管, 加0.5 mL氯仿:异戊醇抽提; 离心后上清移至另一离心管, 然后加3 mol/L乙酸钠10 µL和预冷无水乙醇1 mL, 混匀后置液氮5 min, 沉淀DNA, 离心去上清, 经700 mL/L乙醇洗涤后置室温干燥10 min, 加TE缓冲液30 µL溶解DNA. 20 g/L琼脂糖凝胶电泳, EB染色观察, 凝胶图像分析仪拍摄照片[8].
TRIzol法提取总RNA, 采用RT-PCR检测3组细胞中TFPI-2基因的表达. 结果显示, Panc-1-TFPI-2组细胞有708 bp的扩增条带, 而Panc-1-V和Panc-1-P组细胞未见明显条带(图1). Panc-1-TFPI-2组细胞经Western blot证实有32 kDa, 31 kDa和27 kDa 3种分子质量的TFPI-2蛋白的表达, 而Panc-1-V和Panc-1-P组细胞无任何一种蛋白的表达(图2).
Panc-1-TFPI-2组细胞抽提DNA, 琼脂糖凝胶电泳, 出现"梯状"条带, 而Panc-1-V和Panc-1-P组细胞仅在电泳加样孔附近出现基因组条带, 未出现"梯状"条带, 说明转染细胞存在细胞凋亡现象(图4).
TFPI-2基因位于人染色体7q22, 其编码蛋白也称胎盘蛋白-5, 是新近发现的一种丝氨酸蛋白酶抑制物, 能降解多种丝氨酸蛋白[9-13]. 通过对神经胶质细胞瘤、绒毛癌、肺小细胞癌等肿瘤的研究, 发现TFPI-2具有抗肿瘤和抑制肿瘤血管生成等生物学功能[14-19]. 有实验证实将组织金属蛋白抑制物(tissue inhibitor of metalloproteinase, TIMP)转染细胞后可明显增加细胞的凋亡率[20-22], 而同只有胶原酶抑制作用TIMP相比, TFPI-2的蛋白酶抑制谱更广, 抑制能力更强, 有可能在诱导癌细胞凋亡中发挥重要作用. 细胞凋亡与多种基因改变有关, 在肿瘤的发生发展过程中起重要作用. 其发生受两条独立的信号转导途径的调节: 一条是通过Fas和TNF受体介导的级联反应的调节; 另一条是通过线粒体依赖的caspase级联反应的调节. 在这一过程中, 细胞色素C易位, Bax/Bcl-2蛋白比例发生改变, Bax蛋白对凋亡的执行来说是必需的, 其与Bcl-2蛋白比例的变化对该途径具有调节作用[23-26]. 另有研究表明抗凋亡基因XIAP在肿瘤发生过程中表达上调, 从而促进肿瘤的恶性生物学行为. Baker et al[27]研究证实, TFPI-2可以降解丝氨酸的蛋白产物以结合细胞调亡受体, 引导细胞程序性死亡. TFPI-2能够调节白介素8的表达, 在TNF诱导下, 白介素8通过核因子kappaB信号途径调控肿瘤细胞的凋亡. 此外, TFPI-2亦可通过caspase途径调控肿瘤细胞的凋亡, 在这一过程中, 凋亡蛋白BAX、细胞色素C及半胱天冬酶3的表达水平增高, 而XIAP(X-linked inhibitor of apoptosis)、抗凋亡蛋白Bcl-2的表达水平降低, 从而导致肿瘤细胞凋亡率增加[28-30].
胰腺癌是常见的恶性肿瘤, 近年来发病率逐年增加. 有关胰腺癌发病机制目前还不十分清楚. 随着分子生物学技术的发展, 与胰腺癌有关的凋亡基因不断被发现和克隆, 为胰腺癌发病机制的探讨、诊断和治疗提供了新靶点. 我们通过脂质体介导将外源性TFPI-2基因转染到胰腺癌细胞系Panc-1细胞, 经RT-PCR及Western blot方法证实TFPI-2基因mRNA和相应蛋白可以在转染细胞内稳定表达. 说明能成功的把TFPI-2基因转染到胰腺癌细胞Panc-1中, 建立稳定、高表达TFPI-2蛋白的胰腺癌细胞模型. 转染成功细胞生长曲线显示, 细胞生长速度减慢, 细胞生长受到抑制; 抽提DNA电泳呈典型的凋亡细胞特有的不连续"梯状"条带, 说明TFPI-2基因能诱导人胰腺癌细胞的凋亡, 从而起到抑癌作用, 其具体机制有待进一步研究. TFPI-2基因诱导细胞凋亡的研究尚少, 具有广阔的应用前景. 在后续的实验中, 我们将继续研究TFPI-2基因在胰腺癌实体瘤中的表达, 进一步探讨TFPI-2基因在胰腺癌细胞凋亡中的作用及其机制.
胰腺癌是消化道恶性程度最高的肿瘤之一, 其发病机制的研究成为近年来的热点. 组织因子途径抑制物2是新近发现的一种丝氨酸蛋白酶抑制剂, 在调控肿瘤细胞侵袭及转移、抑制肿瘤新生血管的形成及诱导肿瘤细胞凋亡中起重要作用. 近年来, 有关TFPI-2诱导肿瘤细胞凋亡的研究尚处于起步阶段, TFPI-2能否诱导胰腺癌细胞凋亡的实验研究国内外目前相关报道不多. 而且实验结果也不尽相同.
近年来研究发现, VEGF能够上调TFPI-2的表达, 进而降解丝氨酸的蛋白产物以结合细胞凋亡受体, 引导细胞程序性死亡, 这一过程中, 凋亡蛋白BAX、细胞色素C及半胱天冬酶3的表达水平增高, 而XIAP(X-linkedinhibitorofapoptosis)、抗凋亡蛋白Bcl-2的表达水平降低, 从而导致肿瘤细胞凋亡率增加, 发挥其抗肿瘤效应.
本研究证实TFPI-2能够在体外诱导胰腺癌细胞Panc-1的凋亡, 为进一步研究TFPI-2在胰腺癌细胞增殖中的作用奠定了基础.
TFPI-2能够诱导胰腺癌细胞的凋亡, 这为进一步研究其作用机制, 为研发新的抗肿瘤药物及其在抗癌领域的临床应用奠定了实验基础.
本文通过脂质体介导将外源性TFPI-2基因转染到胰腺癌细胞系Panc-1细胞, 用RT-PCR和Westernblot技术分别检测转染细胞中TFPI-2mRNA及相应蛋白的表达情况, 同时测定转染细胞的生长曲线和细胞凋亡情况, 说明TFPI-2基因能诱导人胰腺癌细胞的凋亡, 从而起到抑癌作用. 该试验选题符合该领域的研究热点, 设计科学、合理, 作者掌握了相关的实验基础理论和专门实验技术, 正确统计学方法, 结论可靠.
编辑:程剑侠 电编:张强
| 1. | LaCasse EC, Baird S, Korneluk RG, MacKenzie AE. The inhibitors of apoptosis (IAPs) and their emerging role in cancer. Oncogene. 1998;17:3247-3459. [PubMed] |
| 2. | Miyagi Y, Yasumitsu H, Eki T, Miyata S, Kkawa N, Hirahara F, Aoki I, Misugi K, Miyazaki K. Assignment of the human PP5/TFPI-2 gene to 7q22 by FISH and PCR-based human/rodent cell hybrid mapping panel analysis. Genomics. 1996;35:267-268. [PubMed] |
| 3. | Wong CM, Ng YL, Lee JM, Wong CC, Cheung OF, Chan CY, Tung EK, Ching YP, Ng IO. Tissue factor pathway inhibitor-2 as a frequently silenced tumor suppressor gene in hepatocellular carcinoma. Hepatology. 2007;45:1129-1138. [PubMed] |
| 4. | Steiner FA, Hong JA, Fischette MR, Beer DG, Guo ZS, Chen GA, Weiser TS, Kassis ES, Nguyen DM, Lee S. Sequential 5-Aza 2'-deoxycytidine/depsipeptide FK228 treatment induces tissue factor pathway inhibitor 2 (TFPI-2) expression in cancer cells. Oncogene. 2005;24:2386-2397. [PubMed] |
| 5. | Sato N, Parker AR, Fukushima N, Miyagi Y, Iacobuzio-Donahue CA, Eshleman JR, Goggins M. Epigenetic inactivation of TFPI-2 as a common mechanism associated with growth and invasion of pancreatic ductal adenocarcinoma. Oncogene. 2005;24:850-858. [PubMed] |
| 6. | Chand HS, Du X, Ma D, Inzunza HD, Kamei S, Foster D, Brodie S, Kisiel W. The effect of human tissue factor pathway inhibitor-2 on the growth and metastasis of fibrosarcoma tumors in athymic mice. Blood. 2004;103:1069-1077. [PubMed] |
| 7. | Neaud V, Hisaka T, Monvoisin A, Bedin C, Balabaud C, Foster DC, Desmouliere A, Kisiel W, Rosenbaum J. Paradoxical pro-invasive effect of the serine proteinase inhibitor tissue factor pathway inhibitor-2 on human hepatocellular carcinoma cells. J Biol Chem. 2000;275:35565-35569. [PubMed] |
| 8. | Herrmann M, Lorenz HM, Voll R, Grunke M, Woith W, Kalden JR. A rapid and simple method for the isolation of apoptotic DNA fragments. Nucleic Acids Res. 1994;22:5506-5507. [PubMed] |
| 9. | Kong D, Ma D, Bai H, Guo H, Cai X, Mo W, Tang Q, Song H. Expression and characterization of the first kunitz domain of human tissue factor pathway inhibitor-2. Biochem Biophys Res Commun. 2004;324:1179-1185. [PubMed] |
| 10. | Jin M, Udagawa K, Miyagi E, Nakazawa T, Hirahara F, Yasumitsu H, Miyazaki K, Nagashima Y, Aoki I, Miyagi Y. Expression of serine proteinase inhibitor PP5/TFPI-2/MSPI decreases the invasive potential of human choriocarcinoma cells in vitro and in vivo. Gynecol Oncol. 2001;83:325-333. [PubMed] |
| 11. | Siegling S, Thyzel E, Brinkmann T, Prohaska W, Glahn J, Gotting C, Kleesiek K. Genetic variations in the human TFPI-2 gene and its promoter region by denaturing high performance liquid chromatography. Thromb Res. 2004;113:341-343. [PubMed] |
| 12. | Hube F, Reverdiau P, Iochmann S, Gruel Y. Computer model of the interaction of human TFPI-2 Kunitz-type serine protease inhibitor with human plasmin. Thromb Res. 2003;111:197-198. [PubMed] |
| 13. | Wojtukiewicz MZ, Sierko E, Zimnoch L, Kozlowski L, Kisiel W. Immunohistochemical localization of tissue factor pathway inhibitor-2 in human tumor tissue. Thromb Haemost. 2003;90:140-146. [PubMed] |
| 14. | Rao CN, Lakka SS, Kin Y, Konduri SD, Fuller GN, Mohanam S, Rao JS. Expression of tissue factor pathway inhibitor 2 inversely correlates during the progression of human gliomas. Clin Cancer Res. 2001;7:570-576. [PubMed] |
| 15. | Rollin J, Iochmann S, Blechet C, Hube F, Regina S, Guyetant S, Lemarie E, Reverdiau P, Gruel Y. Expression and methylation status of tissue factor pathway inhibitor-2 gene in non-small-cell lung cancer. Br J Cancer. 2005;92:775-783. [PubMed] |
| 16. | Ivanciu L, Gerard RD, Tang H, Lupu F, Lupu C. Adenovirus-mediated expression of tissue factor pathway inhibitor-2 inhibits endothelial cell migration and angiogenesis. Arterioscler Thromb Vasc Biol. 2007;27:310-316. [PubMed] |
| 17. | Yanamandra N, Kondraganti S, Gondi CS, Gujrati M, Olivero WC, Dinh DH, Rao JS. Recombinant adeno-associated virus (rAAV) expressing TFPI-2 inhibits invasion, angiogenesis and tumor growth in a human glioblastoma cell line. Int J Cancer. 2005;115:998-1005. [PubMed] |
| 18. | Kondraganti S, Gondi CS, Gujrati M, McCutcheon I, Dinh DH, Rao JS, Olivero WC. Restoration of tissue factor pathway inhibitor inhibits invasion and tumor growth in vitro and in vivo in a malignant meningioma cell line. Int J Oncol. 2006;29:25-32. [PubMed] |
| 19. | Ruf W, Seftor EA, Petrovan RJ, Weiss RM, Gruman LM, Margaryan NV, Seftor RE, Miyagi Y, Hendrix MJ. Differential role of tissue factor pathway inhibitors 1 and 2 in melanoma vasculogenic mimicry. Cancer Res. 2003;63:5381-5389. [PubMed] |
| 20. | Bloomston M, Shafii A, Zervos EE, Rosemurgy AS. TIMP-1 overexpression in pancreatic cancer attenuates tumor growth, decreases implantation and metastasis, and inhibits angiogenesis. J Surg Res. 2002;102:39-44. [PubMed] |
| 21. | Che G, Chen J, Liu L, Wang Y, Li L, Qin Y, Zhou Q. Transfection of nm23-H1 increased expression of beta-Catenin, E-Cadherin and TIMP-1 and decreased the expression of MMP-2, CD44v6 and VEGF and inhibited the metastatic potential of human non-small cell lung cancer cell line L9981. Neoplasma. 2006;53:530-537. [PubMed] |
| 22. | Lin H, Chen X, Wang J, Yu Z. Inhibition of apoptosis in rat mesangial cells by tissue inhibitor of metalloproteinase-1. Kidney Int. 2002;62:60-69. [PubMed] |
| 23. | Tasiou A, Konduri SD, Yanamandra N, Dinh DH, Olivero WC, Gujrati M, Obeyesekere M, Rao JS. A novel role of tissue factor pathway inhibitor-2 in apoptosis of malignant human gliomas. Int J Oncol. 2001;19:591-597. [PubMed] |
| 24. | Eischen CM, Rehg JE, Korsmeyer SJ, Cleveland JL. Loss of Bax alters tumor spectrum and tumor numbers in ARF-deficient mice. Cancer Res. 2002;62:2184-2191. [PubMed] |
| 25. | Isenmann S, Engel S, Gillardon F, Bahr M. Bax antisense oligonucleotides reduce axotomy-induced retinal ganglion cell death in vivo by reduction of Bax protein expression. Cell Death Differ. 1999;6:673-682. [PubMed] |
| 26. | Thomadaki H, Talieri M, Scorilas A. Prognostic value of the apoptosis related genes BCL2 and BCL2L12 in breast cancer. Cancer Lett. 2007;247:48-55. [PubMed] |
| 27. | Baker AH, Edwards DR, Murphy G. Metalloproteinase inhibitors: biological actions and therapeutic opportunities. J Cell Sci. 2002;115:3719-3727. [PubMed] |
| 28. | George J, Gondi CS, Dinh DH, Gujrati M, Rao JS. Restoration of tissue factor pathway inhibitor-2 in a human glioblastoma cell line triggers caspase-mediated pathway and apoptosis. Clin Cancer Res. 2007;13:3507-3517. [PubMed] |
| 29. | Karikari CA, Roy I, Tryggestad E, Feldmann G, Pinilla C, Welsh K, Reed JC, Armour EP, Wong J, Herman J. Targeting the apoptotic machinery in pancreatic cancers using small-molecule antagonists of the X-linked inhibitor of apoptosis protein. Mol Cancer Ther. 2007;6:957-966. [PubMed] |
| 30. | Kondraganti S, Gondi CS, McCutcheon I, Dinh DH, Gujrati M, Rao JS, Olivero WC. RNAi-mediated downregulation of urokinase plasminogen activator and its receptor in human meningioma cells inhibits tumor invasion and growth. Int J Oncol. 2006;28:1353-1360. [PubMed] |