修回日期: 2006-08-17
接受日期: 2006-08-22
在线出版日期: 2006-12-08
目的: 探讨肝硬化患者外周血中单个核细胞(PBMC)表面Toll样受体4(Toll-like receptor 4, TLR4)、TLR2表达与肝硬化患者细菌感染的关系, 观察抗生素治疗对TLR4与TLR2表达的影响.
方法: 采用三色荧光染色法, 荧光素标记的抗TLR2/抗TLR4/抗CD14 mAb对42例肝硬化患者及正常人的血液单核细胞表面TLR2、TLR4及CD14分子进行免疫荧光染色, 应用流式细胞仪检测.
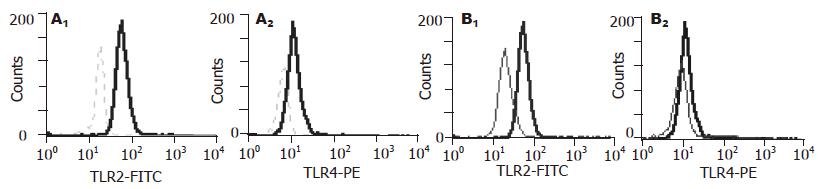
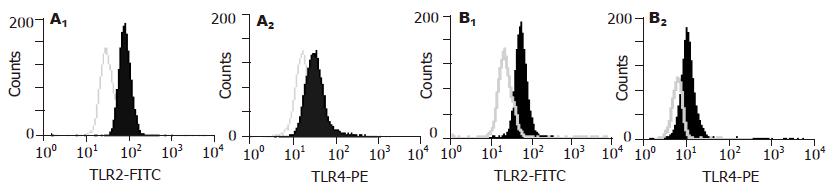
结果: 肝硬化腹水组TLR2和TLR4表达(n = 30, TLR2, 47.65±0.75; TLR4, 22.28±0.80)与正常对照组(n = 15, TLR2, 24.40±2.77; TLR4, 14.45±3.23)比较有显著性差异(P<0.05), 肝硬化腹水患者治疗前(n = 20, TLR2, 47.79±0.76; TLR4, 28.58±0.79)和治疗后(n = 20, TLR2, 17.22±2.48; TLR4, 12.37±0.35)比较有显著性差异(P<0.05); 肝硬化腹水患者与肝硬化无腹水患者组(n = 12, TLR2, 25.37±1.62; TLR4, 14.81±0.29)比较有显著性差异(P<0.05); 肝硬化无腹水患者组与正常对照组比较无显著性差异(P>0.05).
结论: 肝硬化腹水患者TLR4与TLR2的表达显著上调, 抗生素治疗后显著下调.
引文著录: 苟艳子, 连建奇, 聂青和, 庄严, 刘清泉, 邵彬. 肝硬化患者外周血单核细胞表面TLR4和TLR2表达的临床意义. 世界华人消化杂志 2006; 14(34): 3278-3283
Revised: August 17, 2006
Accepted: August 22, 2006
Published online: December 8, 2006
AIM: To explore the correlation of Toll-like receptor 4, Toll-like receptors 2 expression on the surface of peripheral blood mononuclear cells with bacterial infection in patients with liver cirrhosis, and observe the effect of antibiotics on PBMC expression of TLR4 and TLR2 in cirrhosis.
METHODS: Blood cells from a total of 42 patients (30 with ascites, 12 without ascites) with liver cirrhosis and 15 normal controls were stained with fluorescent labeling anti-TLR2/anti-TLR4/anti-CD14 monoclonal antibodies. Samples were collected and analyzed for three-color immunofluorescence by flow cytometry.
RESULTS: The expression of TLR4 and TLR2 were significantly higher in patients with ascites than those in the controls (TLR4: 22.28 ± 0.80 vs 14.45 ± 3.23, P < 0.05; TLR2: 47.65 ± 0.75 vs 24.40 ± 2.77, P < 0.05), and marked difference also existed before and after treatment (TLR4: 28.58 ± 0.79 vs 12.37 ± 0.35, P < 0.05; TLR2: 47.79 ± 0.76 vs 17.22 ± 2.48, P < 0.05). TLR4 and TLR2 expression were notably increased in patients with ascites as compared with those in ones without ascites (TLR2: 25.37 ± 1.62; TLR4: 14.81 ± 0.29) (P < 0.05), and they were not significantly different between patients without ascites and normal controls (P > 0.05).
CONCLUSION: PBMC expression of TLR4 and TLR2 are up-regulated in patients with liver cirrhosis, and they can be down-regulated by antibiotics treatment.
- Citation: Gou YZ, Lian JQ, Nie QH, Zhuang Y, Liu QQ, Shao B. Clinical significance of Toll-like receptor 4 and 2 expression on the surface of peripheral blood mononuclear cells in patients with liver cirrhosis. Shijie Huaren Xiaohua Zazhi 2006; 14(34): 3278-3283
- URL: https://www.wjgnet.com/1009-3079/full/v14/i34/3278.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i34.3278
肝硬化失代偿等重症肝病患者肠道内菌群紊乱产生的内毒素在肝内不能灭活而引起内毒素血症[1], 同时由于细菌移位致使自发性细菌性腹膜炎等并发症出现[2]. 因此感染成为肝硬化失代偿等重症肝病严重并发症和重要的致死原因之一[3], 迄今其预防和治疗效果不甚理想. 细菌移位(bacterial translocation, BT)的概念已从传统的有活性的肠道菌丛通过肠道屏障到达肠系膜淋巴结和肠腔外其他器官或部位, 延伸到细菌释放产物(如内毒素和细菌DNA)的移位[4]. BT在肝硬化并发感染和高动力循环状态的发生中起着重要作用, 而后者又是门脉高压、腹水以及肝肾综合症形成的关键因素[5]. 在肝硬化鼠模型中可观察到不是所有的过度生长的肠腔细菌移位至肠系膜淋巴结, 提示肝硬化细菌移位的机制除了肠腔细菌过度生长, 还可能包含其他的因素. 这些可能是肠黏膜屏障结构或功能的改变, 由于门脉高压可能引起血流停滞, 导致肠道细菌向血管或淋巴管的通透性增加. 在肝硬化鼠模型和肝硬化患者的肠道黏膜病理观察中可见肠道黏膜充血和水肿, 细胞间距变宽[6]. 另一方面, 在几个包含肝硬化的门脉高压的实验模型中, 肠腔黏膜氧化损伤可能是由于门脉高压引起的局部组织缺氧, 引起肠道黏膜屏障渗透性增加, 细菌顺利移位. 已有数据证明给予抗氧化剂治疗可阻止回肠和盲肠黏膜的损伤和肝硬化腹水鼠的细菌移位[7]. 为探讨肝硬化患者并发感染的特点及防治对策, 我们对本科42例肝硬化住院患者及15例正常对照作一研究, 应用流式细胞仪检测其PBMC中TLR4与TLR2的表达.
2005-11/2006-06第四军医大学唐都医院传染病科住院的肝硬化患者42例, 男35例, 女7例, 年龄29-70(平均42.5±2.8)岁. 其中乙型肝炎肝硬化30例, 丙型肝炎肝硬化和酒精性肝硬化各3例, 原因不明肝硬化6例. Child-Pugh A级12例, B级10例, C级20例. 将全部患者根据有无腹水分为肝硬化腹水组(n = 30)、肝硬化无腹水组(n = 12). 将全部患者随机分为3组: 对照组(n = 10)、治疗Ⅰ组(n = 10)及治疗Ⅱ组(n = 10), 3组患者入院时的主要临床症状、体征、实验室检查结果无显著性差异. 治疗Ⅰ组给予: 100 g/L葡萄糖注射液250 mL加清开灵注射液200 mg, 静脉滴注, qd. 治疗Ⅱ组给予氧氟沙星注射液100 mL静滴, bid; 50 g/L氯化钠注射液100 mL加注射用头孢哌酮钠3 g静滴, bid. 对照组给予100 g/L葡萄糖注射液250 mL加甘利欣注射液30 mL, 静脉滴注, qd. 100 g/L葡萄糖注射加复方丹参注射液l4 mL, 静脉滴注, qd. 肝硬化诊断由病史、临床表现、实验室和影像学检查证实, 所有病例均符合2000-09西安会议修订的《病毒性肝炎防治方案》中的诊断标准[8]. 研究对象57例其中肝硬化患者42例, 健康人15例, 抽取健康志愿者和肝硬化患者外周静脉血各2 mL, 置于无菌EDTA-K2抗凝管中, 4 ℃保存. 腹水标本肝硬化腹水患者入院后严格无菌操作条件下行腹腔穿刺术, 床边血培养瓶接10 mL送细菌培养; 肝硬化无腹水患者及肝硬化腹水患者作血细菌培养. 流式细胞仪, FACSCalibur型(美国BD公司); 低温高速离心机, Legend/RT型(德国科峻公司). 2 mL EDTA-K2真空抗凝管(美国BD公司); 试剂荧光素FITC、PE和PerCP-CY5.5标记的mAb, 外周全血细胞表面的染色使用下列mAb: anti-human TLR2 fluorescein isothiocyanate及其IgG2a阴性对照(eBioscience, San Diego, CA公司); anti-human TLR4 peridinin chlorophyll protein及其IgG2a同型对照、anti-human CD14 peridinin chlorophyll protein及非特异性的相匹配的同型对照; RBC裂解液(美国Becton Dickinson, San Diego, CA 公司).
治疗前后使用流式细胞仪检测肝硬化患者外周血单核细胞表面的TLR4, TLR2表达, 肝功能化验、腹部B超由我院化验室及B超诊断室完成检测. 首先处理标本, 对每份肝硬化患者血液取2只试管, 分别标记为A管、B管, 并用1个正常标本作对照. A管为FITC同型对照、PE同型对照和PerCP-cy5.5抗-CD14 mAb, B管为FITC-抗TLR2 mAb、PE-抗TLR4 mAb和PerCP-cy5.5- 抗CD14 mAb, 首先在B管分别加入anti- human TLR4 phycoerythrin荧光抗体30 mL, 抗凝全血100 mL, 振荡混匀, 在4 ℃下避光孵育30 min. 再在A管、B管加入红细胞裂解液2 mL, 混匀, 室温下避光裂解15 min. 300 g离心5 min, 弃上清后加入洗涤液2 mL, 300 g离心5 min, 移去上清, 再加入洗涤液2 mL 300 g离心5 min, 移去上清. 再在B管加入二抗4 mL, 在4 ℃下避光孵育30 min后加入洗涤液2 mL, 300 g离心5 min, 移去上清; 再在A管加入mouse anti-human fluorescein isothiocyanate Ig2a同型对照抗体, mouse anti- human phycoerythrin isothiocyanate Ig2a同型对照抗体各30 mL和anti-human CD14荧光抗体9 mL, 振荡混匀, 再在B管加入anti-human TLR2 fluorescein isothiocyanate抗体30 mL、anti-human CD14荧光抗体9 mL, 振荡混匀, 在4 ℃下避光孵育30 min后加入洗涤液2 mL, 300 g离心5 min, 移去上清, 再加入500 mL 固定液振荡混匀, 制成细胞悬液4 ℃避光保存备用[9]. 应用流式细胞仪检测外周血单核细胞表面TLR2, TLR4的表达水平, 以平均荧光强度的几何均数(GMF)表达其含量. 选择CellQuest软件, 设门取单核细胞群, CD14(PerCP-cy5.5)标记外周血单核细胞, CD14PerCP-cy5.5)与侧向光散射(SSC)设门圈出单核细胞, 每份样本获取10 000 个CD14+单核细胞,去除死亡细胞, 记录外周血单核细胞TLR2, TLR4的GMF, 作直方图比较[10]. 抽取腹水后立即在床边注入10 mL腹水于需氧血培养瓶中, 送检. 静脉采血10.0 mL注入需氧血培养瓶中, 送本院细菌室培养.
统计学处理 所有实验数据均由自动分析后获取, 应用SPSS13.0统计学软件分析, 计量资料参数采用均数±标准差表示, 采用两样本t检验. P<0.05为显著性标准. 治疗前后的显著性检验采用配对t检验, 以P<0.05为显著性标准.
肝硬化腹水患者TLR2和TLR4的GMF分别为47.65±0.75和22.28±0.8; 肝硬化无腹水患者TLR2和TLR4的GMF分别为25.37±1.62和14.81±0.29; 正常对照组TLR2和TLR4的GMF分别为24.40±2.77和14.45±3.23. 肝硬化腹水患者与正常对照组比较有显著性差异(P<0.05); 肝硬化腹水患者与肝硬化无腹水患者组比较有显著性差异; 肝硬化无腹水患者组与正常对照组比较无显著性差异(P>0.05, 图1). 治疗组1治疗前TLR2和TLR4的GMF分别为47.67±1.62和22.31±0.9; 治疗组1治疗7 d后TLR2和TLR4的GMF分别为17.69±2.48和12.97±0.35; 治疗组2治疗前TLR2和TLR4的GMF分别为47.63±0.75和22.26±0.80; 治疗组2治疗7 d后TLR2和TLR4的GMF分别为16.74±2.48和11.77±0.35; 治疗组1、治疗组2的TLR2, TLR4 的GMF表达水平下调明显优于对照组, 经统计学处理有显著性差异(P<0.05, 图2). 且随着治疗时间的延长下调更为明显(表1). 治疗组, 在改善症状, 消退黄疸, 降低转氨酶等方面明显优于对照组, 经统计学处理有显著性差异(P<0.05). 14例腹水细菌培养阳性者: 大肠埃希菌(G-菌)3例, 产酸克雷伯氏菌(G-菌)1例; 金葡菌(G+菌)3例, D群链球菌(G+菌)3例, 表皮葡萄球菌(G+菌)2例, 孔氏葡萄球菌(G+菌)孔氏亚种1例, 藤黄微球菌(G+菌)1例. 血细菌培养阳性者为大肠埃希菌(G-菌)1例; 腊样芽胞菌(G+菌)1例.
Toll样受体(Toll like receptor, TLR)属于模式识别受体(pattern recognition receptor, PRR), 在识别和抵御各种病原微生物及其产物中发挥重要作用. TLR识别病原微生物细胞壁上一类真核细胞所不具备的特殊结构, 这类结构对表达PRR的细胞有强烈的刺激作用, 称为病原相关分子模式(pathogen associated molecular patterns, PAMPs), 包括G-菌的脂多糖(LPS)、类脂A, G+菌的肽聚糖(PGN)、脂磷壁酸(LTA)、脂阿拉伯甘露聚糖(LAM), 分枝杆菌和疏密螺旋体的脂蛋白与脂肽, 酵母菌和支原体的某些成分等. TLR如同天然免疫的"眼睛", 监视与识别各种不同的PAMPs, 是机体抵抗感染性疾病的第一道屏障. 目前, 已克隆的人类的TLR成员有10个(即TLR1-10), 他们在天然免疫中发挥重要的抗感染免疫功能, 并与免疫耐受、特异性抗感染免疫, 以及一些疾病具有相关性. 近年来发现TLR4是一种功能性的细菌内毒素即LPS跨膜受体, TLR4是引起对LPS应答的主要受体. TLR2主要识别G+菌(如金葡菌)成份脂蛋白、脂多肽、真菌、酵母、分支杆菌、支原体脂肽等的信号转导及酵母细胞壁、肽聚糖(PGN)等, 也有报道TLR2的活化与某些致病菌的LPS有关, TLR2与配体结合并产生信号转导过程必需有其他TLR的参与, 如TLR6和TLR1. 总之, TLR2主要识别革兰阳性菌; TLR4主要识别革兰阴性细菌LPS成分, 是革兰阴性杆菌LPS的受体[11], LPS与TLR4结合可导致NF-κB激活[12], 并且可激活单核巨噬细胞产生炎性因子[13]. 近年认为, 机体针对细菌、病毒及其他病原生物等病原相关分子(pathogrn-associated molecular patterns, PPAMs)的入侵所产生的先天免疫及特异性免疫由模式识别受体(pattern recognition receptors, PRRs)启动. TLR介导的先天免疫不仅包括针对病菌的宿主防御反应, 而且包括免疫病变[14]. TLR是主要的PRRs, 模式识别受体的发现对了解许多有病原体感染的疾病的发病机制有着重要的意义并为将来研发各种免疫治疗提供新的靶位. 另外, 一项研究显示在活体内TLR发出信号通过干扰素抑制HBV病毒复制[15], G+菌的产物通过对TLR2的刺激, 促进TNF及可溶性TNF受体(soluble TNF receptor)增加, 与TLR2不同的是, TLR4已被确定在酒精导致的肝损伤鼠模型中起到重要作用, TLR4突变的这种鼠模型对LPS、炎症(inflammation)、TNF-α、脂肪变性(steatosis)呈低反应性, 其与野生型对照组相比坏死减少[16]. 人肝脏星状细胞里, TLR4通过细菌脂多糖介导炎症信号释放[17]. 在部分肝切除的小鼠模型中, TLR4的表达上调加重了内毒素诱导的肝衰竭[18]. 另一项研究结果提示, 在失血性休克后, 全身炎症应答起始及肝细胞的损伤过程中, TLR4进行信号传导必不可少[19].
在本研究中, 肝硬化腹水患者的外周血单核细胞中的TLR2, TLR4的表达较正常人显著上调(P<0.05). 抗生素治疗7 d后与治疗前比较TLR2, TLR4的表达显著下调(P<0.05); 且随着治疗时间的延长下调更为明显; 随着敏感抗生素的使用更为明显. 肝硬化腹水患者在使用了清开灵等清热解毒类中药后TLR2, TLR4的表达也显著下调(P<0.05); 清开灵等清热解毒类中药及抗生素对TLR2, TLR4的表达影响同样极其显著. 抗生素或清开灵治疗后肝硬化患者的一般状况显著改善, Child-Pugh评分降低. 在研究中, 不同病因所致的肝硬化TLR2, TLR4的表达上调无明显差异(P>0.05). 肝硬化腹水患者与肝硬化无腹水患者组比较有显著性差异(P<0.05), 肝硬化腹水患者与正常对照组比较有显著性差异(P<0.05); 肝硬化无腹水患者组与正常对照组比较无显著性差异(P>0.05).
肝硬化患者的并发症自发性细菌性腹膜炎发病机制是肠腔来源的细菌通过肠壁, 到达肠系膜淋巴结和其他器官. 如果机体局部免疫防御系统不能产生充分的反应, 自发性细菌性腹膜炎最终逐步发展, 产生腹水. 在临床和实验的初步研究中, 用口服抗生素抑制肠腔需氧的革兰氏阴性菌丛, 可以明显地降低肝硬化患者自发性细菌性腹膜炎的发生率和肠腔细菌过度生长的发生率, 降低肝硬化鼠的细菌移位、细菌性腹膜炎的发生率[20], 临床实践中, 肝硬化无腹水患者使用抗生素是否确实优于未使用者, 尚需进一步深入研究. 肝硬化患者的肠道细菌菌丛潜生体(cryptic growth cells, CGC)形成率和群集率可显著增高. 肝硬化患者的CGC有很强的繁殖能力、运动能力和抗生素耐受力,从而具有极强的侵袭力. 乳果糖及生态制剂较抗生素在调节细菌CGC形成和群集方面更理想[21]. 另外, 肝硬化患者中内毒素激活巨噬细胞被认为与血液循环中肿瘤坏死因子的增高有关[22], 近来的研究中观察到, 以未治疗或仅以抗生素治疗做对照组, 用抗生素和抗肿瘤坏死因子(anti-TNF-α)联合治疗并发细菌性腹膜炎的肝硬化鼠可降低死亡率[23].
有趣的是, 血清脂多糖结合蛋白(LPS-binding protein, LBP)水平增高的肝硬化患者显示明显的免疫激活, 通过口服氟哌酸可以改善免疫激活. 这种现象提示对于无感染的肝硬化患者, 具有致病力的肠道细菌产物可激活免疫系统[24]. 近来实验研究也估价了细菌移位在高动力循环状态的发病机制中的作用, 肝硬化腹水鼠与正常鼠比较对于血管收缩内脏血管呈现低反应性, 平均动脉血压也更低. 存在细菌移位的肝硬化鼠的这些异常情况中更显著. 一氧化氮与肿瘤坏死因子(TNF-α)的产生增加与血液动力学改变密切相关. 另外, 细菌移位与内毒素在肠系膜淋巴结和血液中的出现相伴随. 这些研究提示细菌或其产物的肠道移位, 如内毒素, 能使已改变的循环状态恶化. 支持这种假设的证据显示, 细菌DNA的存在诱导严重肝硬化患者腹水白细胞的进一步激活. 这导致培养中一氧化氮的过度产生, 一氧化氮水平与一氧化氮合酶的可诱导形式存在显著的直接相关[24]. 与本实验结果不同的是, Gustot et al [25]在酒精性脂肪肝鼠模型中发现, 抗生素的使用不影响鼠的TLR表达, 而本实验中抗生素及中药对TLR2, TLR4的表达影响均极其显著, 且在使用1 d后就可出现下调, 这可能因种属间差异所致. 本研究结果显示: 对有抗生素使用指征的肝硬化腹水患者, 及时应用抗生素的治疗组在改善症状、恢复肝功能等方面优于对照组(P<0.05), 对病情的恢复是有益的. 血培养、腹水培养的细菌包括革兰阴性细菌、革兰阳性细菌. 另外, 细菌培养及FCM检测结果显示肝硬化患者多为单一性的细菌感染, 两种以上的细菌感染少见. FCM研究结果同样提示肝硬化患者的感染包括革兰阳性细菌, 革兰阴性细菌. 近来在肝硬化无菌腹水(培养阴性且无中性白细胞)患者的血清和腹水检测到细菌DNA, 经自动化的核苷酸序列测定鉴定出DNA片断大部分来源于大肠杆菌. 这种细菌也是引起肝硬化患者自发性细菌性腹膜炎发生的最常见原因[26].
本实验中正常人对照组中剔除3例上感患者, 发现他们的TLR2和TLR4的GMF分别39.91±2.50; 37.12±9.22, 与正常人比较TLR2和TLR4的表达上调; 剔除乙型肝炎所致的肝癌患者1例, 其TLR2、TLR4的GMF为44.90, 2.19, 与正常人比较TLR2表达上调; 此结果提示TLR2和TLR4的表达与多种因素有关, 还需进一步研究. 在本实验中, 肝硬化腹水患者TLR2和TLR4的表达较正常人显著上调, 且肝硬化腹水患者在经过抗感染治疗后显著下调, 与TLR2, TLR4的表达分别与G+细菌及内毒素刺激有关的理论相符. 流式细胞术检测TLR2, TLR4的表达具有快速、敏感, 可相对定量的优势,对肝硬化细菌移位的检测有较强的预测性. 总之, 调控TLR4、TLR2的表达可能是肝硬化患者细菌感染防治的一种新策略, 甚至为新型疫苗和免疫调节剂的研发均可提供新的重要理论依据[27]. 肝硬化患者免疫功能明显降低, SBP等肝硬化失代偿期严重并发症经常发生[28]. 另外肝硬变并出血的治疗性临床实践中对急性出血的肝硬变患者预防性使用抗生素可减少细菌感染的机会[29].
总之, 针对肝硬化腹水, 可预防性应用抗生素, 为了避免耐药菌的产生, 应依据腹水培养和药敏试验结果, 从而提高临床疗效[30].
Toll样受体(TLR)是天然免疫中重要的模式识别分子, 均与抗感染有关, 近年来成为很多学科的研究热点. 在人单核细胞表面表达的TLR主要有TLR4、TLR2家族成员. TLR2主要参与抗革兰阳性菌免疫应答, TLR4主要参与抗革兰阴性菌的免疫应答. TLR4通过识别LPS与CD14复合物, 从而获取革兰阴性细菌感染的信息, 启动LPS信号途径, 因此TLR4又称作革兰阴性细菌感染的传感器. 肝硬化是一种严重威胁人类健康的疾病, 其并发症较多, 而SBP是常见而且危险较大的并发症. 探讨肝硬化患者外周血中单核细胞(PBMC)表面TLR2、TLR4表达与肝硬化患者细菌感染的关系有重要意义.
本文采用三色荧光染色法, 荧光素标记的抗TLR2/抗TLR4/抗CD14 mAb对肝硬化患者及正常人的血液单核细胞表面TLR2、TLR4及CD14分子进行免疫荧光染色, 应用流式细胞仪检测, 总结出肝硬化腹水患者较正常人及肝硬化无腹水患者TLR4与TLR2的表达显著上调, 即肝硬化腹水患者较肝硬化无腹水患者的感染更为严重.
本文对肝硬化患者细菌感染及单核细胞表面TLR2, TLR4的表达进行了研究, 对临床实践中控制感染有一定启示, 同时TLR有可能对预防感染及控制炎症反应起到一定作用.
肝硬化腹水患者较正常人TLR4与TLR2的表达显著上调, 抗生素治疗后显著下调. 肝硬化腹水患者的细菌感染包括革兰氏阳性及阴性细菌. 对有抗生素使用指征的肝硬化腹水患者, 及时使用抗生素可以得到肯定的疗效. 本文设计合理, 方法先进. 得出了有意义的结论.
电编:李琪 编辑:潘伯荣
| 6. | Such J, Guardiola JV, de Juan J, Casellas JA, Pascual S, Aparicio JR, Sola-Vera J, Perez-Mateo M. Ultrastructural characteristics of distal duodenum mucosa in patients with cirrhosis. Eur J Gastroenterol Hepatol. 2002;14:371-376. [PubMed] [DOI] |
| 7. | Chiva M, Guarner C, Peralta C, Llovet T, Gomez G, Soriano G, Balanzo J. Intestinal mucosal oxidative damage and bacterial translocation in cirrhotic rats. Eur J Gastroenterol Hepatol. 2003;15:145-150. [PubMed] [DOI] |
| 11. | Takeda K, Kaisho T, Akira S. Toll-like receptors. Annu Rev Immunol. 2003;21:335-376. [PubMed] [DOI] |
| 12. | Covert MW, Leung TH, Gaston JE, Baltimore D. Achieving stability of lipopolysaccharide-induced NF-kappaB activation. Science. 2005;309:1854-1857. [PubMed] [DOI] |
| 13. | Wiest R, Garcia-Tsao G. Bacterial translocation (BT) in cirrhosis. Hepatology. 2005;41:422-433. [PubMed] [DOI] |
| 14. | Takeda K, Akira S. Toll-like receptors in innate immunity. Int Immunol. 2005;17:1-14. [PubMed] [DOI] |
| 15. | Isogawa M, Robek MD, Furuichi Y, Chisari FV. Toll-like receptor signaling inhibits hepatitis B virus replication in vivo. J Virol. 2005;79:7269-7272. [PubMed] [DOI] |
| 16. | Iredale JP. Regulating hepatic inflammation: pathogen-associated molecular patterns take their toll. Hepatology. 2003;37:979-982. [PubMed] [DOI] |
| 17. | Paik YH, Schwabe RF, Bataller R, Russo MP, Jobin C, Brenner DA. Toll-like receptor 4 mediates inflammatory signaling by bacterial lipopolysaccharide in human hepatic stellate cells. Hepatology. 2003;37:1043-1055. [PubMed] [DOI] |
| 18. | Takayashiki T, Yoshidome H, Kimura F, Ohtsuka M, Shimizu Y, Kato A, Ito H, Shimizu H, Ambiru S, Togawa A. Increased expression of toll-like receptor 4 enhances endotoxin-induced hepatic failure in partially hepatectomized mice. J Hepatol. 2004;41:621-628. [PubMed] [DOI] |
| 19. | Prince JM, Levy RM, Yang R, Mollen KP, Fink MP, Vodovotz Y, Billiar TR. Toll-like receptor-4 signaling mediates hepatic injury and systemic inflammation in hemorrhagic shock. J Am Coll Surg. 2006;202:407-417. [PubMed] [DOI] |
| 20. | Llovet JM, Bartoli R, Planas R, Vinado B, Perez J, Cabre E, Arnal J, Ojanguren I, Ausina V, Gassull MA. Selective intestinal decontamination with norfloxacin reduces bacterial translocation in ascitic cirrhotic rats exposed to hemorrhagic shock. Hepatology. 1996;23:781-787. [PubMed] [DOI] |
| 22. | Albillos A, de la Hera A, Gonzalez M, Moya JL, Calleja JL, Monserrat J, Ruiz-del-Arbol L, Alvarez-Mon M. Increased lipopolysaccharide binding protein in cirrhotic patients with marked immune and hemodynamic derangement. Hepatology. 2003;37:208-217. [PubMed] [DOI] |
| 23. | Guarner C, Soriano G. Bacterial translocation and its consequences in patients with cirrhosis. Eur J Gastroenterol Hepatol. 2005;17:27-31. [PubMed] [DOI] |
| 24. | Frances R, Munoz C, Zapater P, Uceda F, Gascon I, Pascual S, Perez-Mateo M, Such J. Bacterial DNA activates cell mediated immune response and nitric oxide overproduction in peritoneal macrophages from patients with cirrhosis and ascites. Gut. 2004;53:860-864. [PubMed] [DOI] |
| 25. | Gustot T, Lemmers A, Moreno C, Nagy N, Quertinmont E, Nicaise C, Franchimont D, Louis H, Deviere J, Le Moine O. Differential liver sensitization to toll-like receptor pathways in mice with alcoholic fatty liver. Hepatology. 2006;43:989-1000. [PubMed] [DOI] |
| 26. | Such J, Frances R, Munoz C, Zapater P, Casellas JA, Cifuentes A, Rodriguez-Valera F, Pascual S, Sola-Vera J, Carnicer F. Detection and identification of bacterial DNA in patients with cirrhosis and culture-negative, nonneutrocytic ascites. Hepatology. 2002;36:135-141. [PubMed] [DOI] |
| 27. | Barton GM, Medzhitov R. Control of adaptive immune responses by Toll-like receptors. Curr Opin Immunol. 2002;14:380-383. [PubMed] [DOI] |