修回日期: 2006-09-08
接受日期: 2006-09-29
在线出版日期: 2006-11-28
目的: 探讨基质金属蛋白酶-7(MMP-7)蛋白和Fas蛋白在胃癌组织中的表达、相互关系及意义.
方法: 应用免疫组化方法检测了82例胃癌组织及30例周边正常胃黏膜中MMP-7和Fas的表达情况.
结果: 胃癌组织中MMP-7蛋白阳性率显著高于正常胃黏膜(73.2% vs 10%, P<0.001); 正常胃黏膜中Fas蛋白阳性率显著高于胃癌组织(39.1% vs 93.3%, P<0.001). MMP-7阳性表达率与淋巴结转移、TNM分期显著相关(P<0.001), 而与肿瘤细胞分化程度无显著性相关. Fas蛋白阳性表达率与肿瘤细胞分化程度显著相关(P<0.05), 而与淋巴结转移、TNM分期无显著性相关. 胃癌组织中MMP-7与Fas表达具有显著等级负相关(r = -0.597, P<0.001).
结论: MMP-7与Fas表达胃癌的生物学行为密切相关, 且两者之间的表达强度具有显著等级负相关.
引文著录: 胡端敏, 王少峰, 冯一中. MMP-7与Fas蛋白在胃癌组织中的表达及意义. 世界华人消化杂志 2006; 14(33): 3237-3240
Revised: September 8, 2006
Accepted: September 29, 2006
Published online: November 28, 2006
AIM: To investigate the expression of matrix metalloproteinase-7 (MMP-7) and Fas in gastric carcinoma as well as their relationships with clinical characteristics.
METHODS: The expression of MMP-7 and Fas proteins were examined with immunohistochemical technique in the specimens from 82 gastric carcinoma tissues and 30 surrounding normal tissues.
RESULTS: The positive rate of MMP-7 expression was significantly higher in gastric carcinoma than that in the normal tissues (73.2% vs 10%, P < 0.05), while the positive rate of Fas expression was marked lower in gastric carcinoma than that in the normal controls (39.1% vs 93.3%, P < 0.001). The expression of MMP-7 was correlated with lymph node metastasis and TMN staging (P < 0.001), but not with the differentiation of tumor cells (P > 0.05). The expression of Fas was correlated with the differentiation of tumor cells (P < 0.05), but was not correlated with lymph node metastasis and TMN staging (P > 0.05). There was a negative correlation between the expression of MMP-7 and Fas in gastric carcinoma (r = -0.597, P < 0.001).
CONCLUSION: The expression of MMP-7 and Fas are closely correlated with the biological behavior of gastric carcinoma. Meanwhile, a negative correlation exists between MMP-7 and Fas expression.
- Citation: Hu DM, Wang SF, Feng YZ. Expression of matrix metalloproteinase-7 and Fas and their significances in gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2006; 14(33): 3237-3240
- URL: https://www.wjgnet.com/1009-3079/full/v14/i33/3237.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i33.3237
胃癌的浸润和转移是多步骤的复杂过程, 其机制尚不清楚, 但基底膜和细胞外基质(extracellular matrix, ECM)的降解是其中的必要条件, 基质金属蛋白酶(matrix metalloproteinase, MMP)家族是一类依赖金属锌离子的蛋白水解酶家族, 能有效地降解细胞外基质, 在肿瘤的生长、转移过程中均起着重要作用, MMP-7是MMP家族中最小的成员, 可降解各种细胞外基质成分, 如层黏连蛋白、纤维连接蛋白、弹性蛋白、Ⅳ型胶原蛋白等[1]. 国内外许多研究者发现MMP-7的过度表达与胰腺癌[2]、结肠癌[3]等恶性肿瘤的转移相关, 但MMP-7的表达是否与细胞凋亡存在联系却很少有相关报道. 细胞凋亡即细胞程序化死亡是由基因或其他一些因素调控的活组织细胞自我消亡的过程, 这一过程的紊乱与许多疾病的发生、发展有关, 尤其与肿瘤的发生、发展关系密切, 在肿瘤发生的多阶段过程中, 细胞凋亡的抑制可能起着重要的作用, Fas是一种重要的细胞凋亡相关基因, Fas蛋白的异常表达作为可能的重要机制在食管癌[4]、结肠癌[5]、胆囊癌[6]等恶性肿瘤中已经得到证实. 为了研究胃癌发生过程中细胞凋亡和增殖异常的分子机制, 本研究应用免疫组化方法检测了正常胃黏膜及胃癌组织中MMP-7和Fas的表达, 并探讨其在胃癌发生、发展中的作用.
胃癌组织手术切除标本82例. 其中男44例, 女38例, 年龄32-82(平均59)岁. 术前未予放疗、化疗. 正常组织为同一手术中切取自距肿瘤边缘8 cm的正常胃壁组织30例. 标本经病理证实为腺癌, 其中低分化腺癌50例, 高、中分化腺癌32例. 病理分期采用国际抗癌联盟(UICC)1987年公布的胃癌TNM分期法. MMP-7及Fas多克隆抗体(兔抗)及链霉菌抗生物素蛋白-过氧化物酶免疫组化染色试剂盒均为武汉博士德生物工程有限公司产品.
免疫组织化学染色技术的具体操作步骤按照试剂盒要求进行. MMP-7及Fas的阳性细胞染色均定位于细胞膜和细胞质, 以细胞膜和细胞质中呈浅黄、棕黄、或更深的棕褐色的细小颗粒作为阳性细胞, 以PBS代替一抗作为阴性对照. 采用三个参数(即染色强度、阳性细胞数和两者记分的乘积)的半定量的计数方法. 着色强度记分标准: 无着色为0分, 浅黄色为1分, 棕黄色为2分, 棕褐色为3分. 光镜下随机观察8个高倍视野, 记录4个高倍视野中染色阳性细胞的百分率, 记分标准: 0%为0分, 1%-10%为1分, 11%-50%为2分, 51%-80%为3分, >80%为4分. 染色强度记分与阳性细胞数记分之积为最后得分: 0分为(-), 1-2分为(+), 3-4分为(++), >4分为(+++).
统计学处理 应用SPSS 11.0统计软件包进行统计分析, 组间采用卡方检验, 两指标间采用有序分组资料的等级相关检验, 取P<0.05为差异有统计学意义.
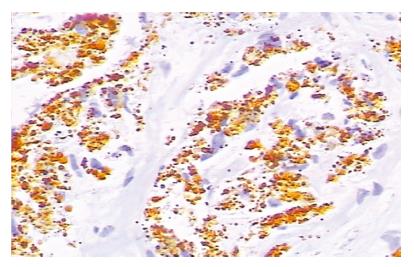
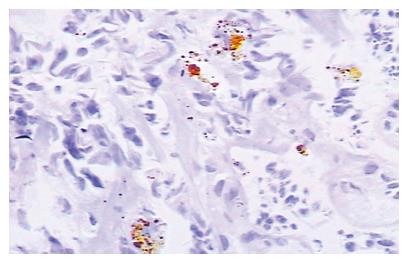
MMP-7在82例胃癌组织中表达为60例阳性,阳性率为73.2%. MMP-7在肿瘤细胞的胞膜及胞质中表达, 间质细胞中无表达, MMP-7的阳性染色分布异质性明显, 阳性染色的细胞常分布于深部浸润的癌巢, 尤其在浸润的前沿(图1), 这一现象在Ajisaka et al[7]的研究中也有相同的发现, 在30例正常对照的胃黏膜组织中有3例弱表达, 阳性率为10%, 经χ2检验显示胃癌组织中MMP-7阳性率显著高于正常胃黏膜组(P<0.001). Fas在82例胃癌组织中表达为32例阳性, 阳性率为39.1%, 阳性染色主要见于癌细胞的细胞质、胞膜及癌间质组织(图2), 在30例正常对照的胃黏膜组织中有28例表达阳性, 阳性率为93.3%, 阳性染色部位主要位于间质细胞, 经χ2检验显示, 正常胃黏膜组中Fas阳性率显著高于胃癌组织(P<0.001)(表1).
| MMP-7 | Fas | |||||
| (+) | (-) | P | (+) | (-) | P | |
| 性别 | ||||||
| 男 | 30 | 14 | 17 | 27 | ||
| 女 | 30 | 18 | 0.273 | 15 | 23 | 0.938 |
| 年龄 | ||||||
| <60 | 29 | 10 | 14 | 25 | ||
| ≥60 | 31 | 12 | 0.817 | 18 | 25 | 0.581 |
| 分组 | ||||||
| 正常组织 | 3 | 27 | 28 | 2 | ||
| 胃癌组织 | 60 | 22 | <0.001 | 32 | 50 | <0.001 |
| 病理分型 | ||||||
| 高、中分化型 | 23 | 9 | 20 | 12 | ||
| 低分化型 | 37 | 13 | 0.832 | 12 | 38 | <0.01 |
| TNM分期 | ||||||
| Ⅰ-Ⅱ期 | 16 | 15 | 14 | 17 | ||
| Ⅲ-Ⅳ期 | 44 | 7 | <0.001 | 18 | 33 | 0.375 |
| 淋巴结转移 | ||||||
| 有 | 51 | 9 | 22 | 38 | ||
| 无 | 9 | 13 | <0.001 | 10 | 12 | 0.472 |
MMP-7与Fas的阳性表达在各性别组和各年龄组之间无显著差异, MMP-7在TNM分期之间, 有淋巴结转移和无淋巴结转移胃癌组间表达有显著性差异(P<0.05), 而在高中分化胃癌组和低分化胃癌组间表达无显著性差异(P>0.05). Fas在高中分化胃癌组和低分化胃癌组间表达有显著性差异(P<0.05), 而表达在TNM分期之间, 有淋巴结转移和无淋巴结转移胃癌组间无显著性差异(P>0.05, 表1).
肿瘤转移的机制至今还未完全阐明, 一般认为过度增生的肿瘤细胞使细胞外基质降解和基底膜重塑, 肿瘤细胞进入血液或淋巴液转移到其他部位生长, 他是由许多因子共同参与的复杂过程, MMP家族已被证明可以降解基底膜和ECM, 与肿瘤的浸润和转移密切相关[8], MMP-7基因位于11q21-q22, 其cDNA长1094 bp, 是MMP家族中最小的一个[9], MMP-7基因主要在上皮来源的细胞中表达, 在胃肠道肿瘤细胞中为高表达, 在正常黏膜上皮中为弱表达或不表达, 他的高表达与癌细胞的浸润和转移特性相关[10]. 本实验MMP-7在73.2%胃癌组织中的表达增高, 同时发现MMP-7在TNM分期Ⅲ-Ⅳ期胃癌组阳性率明显高于TNM分期Ⅰ-Ⅱ期胃癌组(P<0.001), 表明MMP-7随胃癌的进展而表达增高, 这与Honda et al[11]的研究结果相似. 此外有淋巴结转移胃癌组中阳性率明显高于无淋巴结转移组(P<0.001), 这表明MMP-7表达与肿瘤的转移有关, 而肿瘤的转移与肿瘤患者的预后密切相关, 所以MMP-7的检测有可能成为评价胃癌恶性行为的生物学标记物, Kitoh et al[12]在他们的研究中也有相似的结论提出. 研究表明, 在胃癌的病理演化过程中, 不仅存在着细胞增殖的异常, 细胞凋亡的异常也起着重要的作用, Fas属Ⅰ型跨膜蛋白, 是肿瘤坏死因子(TNF)超家族成员, Fas与其天然配体(FasL)或相应膜抗体相结合, 通过激活Caspase家族, 完成细胞凋亡信号传递, 是细胞凋亡的主要途径之一[13]. 大量研究表明在肿瘤发生的多阶段过程中, 细胞凋亡的抑制可能起着重要的作用, Fas蛋白的异常表达作为可能的重要机制[14-15]. 本组肿瘤组织中Fas表达较正常组织减弱, 可能系肿瘤细胞逃避Fas系统介导的宿主免疫的普遍机制, 下调或抑制Fas表达, 导致机体内依赖Fas介导的CTL失去杀伤性识别作用, 避免了T淋巴细胞的攻击作用[16]. 本组胃癌Fas阳性表达与临床分期、淋巴结转移均无相关关系, 提示胃癌表达Fas的特性可能在细胞恶变时已形成, 不随细胞生长情况而改变[17]. 为了进一步探讨MMP-7是通过何种途径促进肿瘤的浸润、转移及其与Fas之间的相互关系, 本实验观察了82例胃癌组织中MMP-7及Fas蛋白的表达之间的关系, 经等级相关检验表明胃癌组织中MMP-7与Fas表达具有显著相关(rs = -0.597, P<0.001), 提示Fas下调可能促进MMP-7表达, 从而促使肿瘤细胞向周围组织间隙浸润同时通过淋巴管和血管向远处转移. 胃癌的发生、发展是一个多因素逐渐演变的复杂过程, MMP-7及Fas之间具体的作用机制有待进一步研究.
胃癌的发生和转移与MMP-7的过度表达相关, 同时Fas作为一种细胞凋亡基因也起着重要的作用, 但MMP-7的表达是否与细胞凋亡存在联系却很少有相关报道.
本研究显示MMP-7与Fas表达与胃癌的生物学行为密切相关, 且两者之间的表达强度具有显著等级负相关, 提示Fas下调可能促进MMP-7表达从而促使肿瘤细胞向周围组织间隙浸润同时通过淋巴管和血管向远处转移. 实验对照的设计合理可靠, 统计学处理方法的使用恰当, 结论较明确, 实验证据较充足.
电编:张敏 编辑:张焕兰
| 1. | Yamashita K, Azumano I, Mai M, Okada Y. Expression and tissue localization of matrix metalloproteinase 7 (matrilysin) in human gastric carcinomas. Implications for vessel invasion and metastasis. Int J Cancer. 1998;79:187-194. [PubMed] [DOI] |
| 2. | Li YJ, Wei ZM, Meng YX, Ji XR. Beta-catenin up-regulates the expression of cyclinD1, c-myc and MMP-7 in human pancreatic cancer: relationships with carcinogenesis and metastasis. World J Gastroenterol. 2005;11:2117-2123. [PubMed] [DOI] |
| 4. | Shibakita M, Tachibana M, Dhar DK, Kotoh T, Kinugasa S, Kubota H, Masunaga R, Nagasue N. Prognostic significance of Fas and Fas ligand expressions in human esophageal cancer. Clin Cancer Res. 1999;5:2464-2469. [PubMed] |
| 5. | Zhu Q, Liu JY, Xu HW, Yang CM, Zhang AZ, Cui Y, Wang HB. Mechanism of counterattack of colorectal cancer cell by Fas/Fas ligand system. World J Gastroenterol. 2005;11:6125-6129. [PubMed] [DOI] |
| 6. | Xu LN, Zou SQ, Wang JM. Action and mechanism of Fas and Fas ligand in immune escape of gallbladder carcinoma. World J Gastroenterol. 2005;11:3719-3723. [PubMed] [DOI] |
| 7. | Ajisaka H, Yonemura Y, Miwa K. Correlation of lymph node metastases and expression of matrix metalloproteinase-7 in patients with gastric cancer. Hepatogastroenterology. 2004;51:900-905. [PubMed] |
| 8. | Roeb E, Bosserhoff AK, Hamacher S, Jansen B, Dahmen J, Wagner S, Matern S. Enhanced migration of tissue inhibitor of metalloproteinase overexpressing hepatoma cells is attributed to gelatinases: relevance to intracellular signaling pathways. World J Gastroenterol. 2005;11:1096-1104. [PubMed] [DOI] |
| 9. | Knox JD, Boreham DR, Walker JA, Morrison DP, Matrisian LM, Nagle RB, Bowden GT. Mapping of the metalloproteinase gene matrilysin (MMP7) to human chromosome 11q21-->q22. Cytogenet Cell Genet. 1996;72:179-182. [PubMed] [DOI] |
| 10. | Yonemura Y, Endou Y, Fujita H, Fushida S, Bandou E, Taniguchi K, Miwa K, Sugiyama K, Sasaki T. Role of MMP-7 in the formation of peritoneal dissemination in gastric cancer. Gastric Cancer. 2000;3:63-70. [PubMed] [DOI] |
| 11. | Honda M, Mori M, Ueo H, Sugimachi K, Akiyoshi T. Matrix metalloproteinase-7 expression in gastric carcinoma. Gut. 1996;39:444-448. [PubMed] [DOI] |
| 12. | Kitoh T, Yanai H, Saitoh Y, Nakamura Y, Matsubara Y, Kitoh H, Yoshida T, Okita K. Increased expres-sion of matrix metalloproteinase-7 in invasive early gastric cancer. J Gastroenterol. 2004;39:434-440. [PubMed] [DOI] |
| 15. | Fukuzawa K, Takahashi K, Furuta K, Tagaya T, Ishikawa T, Wada K, Omoto Y, Koji T, Kakumu S. Expression of fas/fas ligand (fasL) and its involve-ment in infiltrating lymphocytes in hepatocellular carcinoma (HCC). J Gastroenterol. 2001;36:681-688. [PubMed] [DOI] |
| 16. | Compagni A, Christofori G. Recent advances in research on multistage tumorigenesis. Br J Cancer. 2000;83:1-5. [PubMed] |
| 17. | Zhao XH, Gu SZ, Tian HG, Quan P, Pan BR. Clinical significance of expression of apoptotic signal proteins in gastric carcinoma tissue. World J Gastroenterol. 2005;11:3846-3849. [PubMed] [DOI] |