修回日期: 2006-09-12
接受日期: 2006-09-30
在线出版日期: 2006-11-18
目的: 从肝海绵状血管瘤(CHL)超微结构探讨CHL组织起源, 以及组织结构与临床特征关系.
方法: 对8例CHL切除标本进行电镜观察. 1例按常规电镜样品制备, 7例用弹力纤维特异染色的丹宁酸块染后, 按常规电镜样品制备, 经LKB-V超薄切片, 用透射电镜H-600, JEOL-100SX和扫描电镜KYKY-2000进行观察.
结果: 血窦腔由单层内皮细胞覆盖, 血窦腔蜿蜒迂回, 呈迷宫状结构组成. 正常内皮细胞为扁平状, 细胞器减少, 有吞饮小泡和微丝, 细胞间有紧密连接和桥粒连接. 内皮细胞下有弹力纤维, 中膜层可见成纤维细胞和平滑肌细胞, 中、外膜层有丰富胶原纤维. 此与微动脉结构相似. CHL内皮细胞多肿胀, 核仁边移, 突向血窦腔成柱状. 随程度加重, 粗面内质网囊泡样改变, 直至内皮细胞由内膜层脱落, 坏死. 间质中大量胶原纤维增生, 分割弹力纤维, 并可由内皮细胞缺损处填充于血窦腔内, 发生纤维化. 瘤体中无正常肝细胞和肝窦结构. 由于瘤内无肝小叶, 所以瘤体无双重供血组织结构, CHL由动脉供血. 蜿蜒迂回、迷宫样血窦腔, 可以解释影像学特征(肝血管造影、CT增强). 内皮细胞退行性变化和间质中胶原纤维大量增生, 导致CHL纤维化, 并自行萎缩.
结论: CHL血窦腔结构类似微动脉, 起源于肝脏微动脉血管畸形病变. CHL一般不需手术治疗, 也不易自发破裂出血.
引文著录: 孙晓力, 李国威, 扬少毅, 刘清峰, 王志亮, 李宗芳. 肝海绵状血管瘤超微结构及其与临床特征的关系. 世界华人消化杂志 2006; 14(32): 3107-3110
Revised: September 12, 2006
Accepted: September 30, 2006
Published online: November 18, 2006
AIM: To explore the origin for cavernous hemangioma of the liver (CHL) from the angle of ultramicrostructure, and probe the relationship between CHL ultramicrostructure and the clinical characteristics.
METHODS: A total of 8 CHL samples were selected, 1 of which 1 was prepared using routine method, while the other 7 samples was firstly stained by scytodepsic acid before routine management. After the ultrathin sections were prepared by LKB-V ultramicrotome, transmission electron microscope H-600 and JEOL-100SX and scanning electron microscope KYKY-2000 were used to observe the changes of tissue ultrastructure.
RESULTS: In CHL samples, endothelial cell monolayer covered the inner wall of blood sinus which was circuitous and showed labyrinth-like structure. The normal endothelial cells were thin and flat with pinocytotic vesicle, microfilament and fewer cell organelles. There were tight and bridge corpuscle junction. Elastic fibers were located under the endothelial cells, while collagenoblasts and smooth muscle cells were observed in tunica media. Collagen fibers were rich in tunica media and theca externa. These structures were similar to those of arteriole. The endothelial cells of CHL tissues were swelled with nucleoli moving aside, and pillar-like blood sinus existed. Cystoid changes of rough endoplasmic reticulum lasted till the necrosis of endothelial cells occurred. A great amount of collagen fibers proliferated in interstitial substance, which divided the elastic fibers and filled the blood sinus cavity in the position of necrotic endothelial cells through fibrosis. There was no normal hepatic cells and sinus hepaticus in CHL tissues. There were no hepatic lobules in CHL, and double blood-supply system didn't exist.
CONCLUSION: CHL is caused by vascular malformation of liver arteriole, and the blood-supply of CHL is through artery. Circuitous and labyrinth-like structure of the blood sinus cavity can elucidate the characteristics of its imaging results, including hepatic angiography and computed tomography. Anaplasia of endothelial cells and proliferation of collagen fibers in interstitial substance leads to the fibrosis and analosis of CHL, which is the main mechanism of few natural disruptions in CHL.
- Citation: Sun XL, Li GW, Yang SY, Liu QF, Wang ZL, Li ZF. Ultramicrostructure of hepatic cavernous hemangioma and its correlation with clinical characteristics. Shijie Huaren Xiaohua Zazhi 2006; 14(32): 3107-3110
- URL: https://www.wjgnet.com/1009-3079/full/v14/i32/3107.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i32.3107
疾病发生、发展、变化过程, 都伴随组织结构和形态变化. 作者在前期提出了肝海绵状血管瘤(cavernous hemangioma of liver, CHL)是来自肝动脉末稍微动脉血管畸形病变论点[1-2]. 以及CHL具有不恶变, 不易自发破裂, 能自行纤维化萎缩生物学特征. 为进一步从超微结构进行认证和寻求解释依据, 我们对8例CHL切除瘤组织进行了超微结构研究.
CHL标本取自8例切除患者. 男3例, 女5例, 年龄30-50.9(平均38.2)岁. 切除剥脱瘤体最大直径8-15 cm.
切除瘤体组织样品当即切成1 mm3组织块, 迅速置入25 g/L戊二醛进行前固定2 h, 蒸溜水清洗后取出置入10 g/L OsO4进行后固定1 h. 其中7例用弹力纤维特异染色的丹宁酸进行块染[3], 然后按常规电镜样品制备. 另1例仅按常规电镜样品制备. 经LKB-V超薄切片, 用透射电镜H-600, JEOL-100SX和扫描电镜KYKY-2000进行观察.
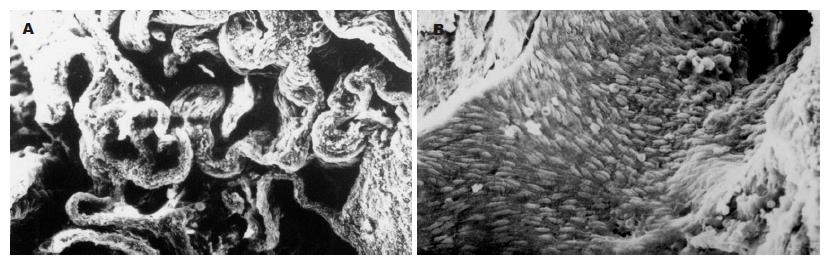
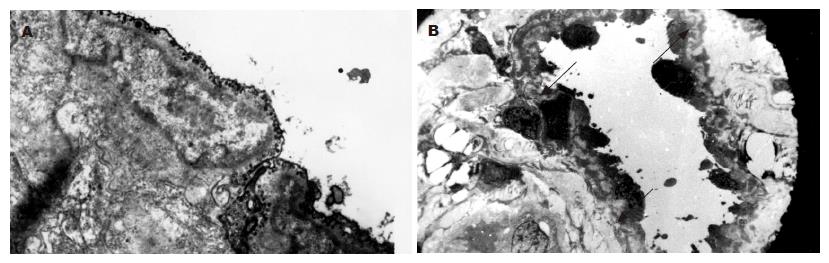
血窦腔内壁为单层内皮细胞, 正常内皮细胞为扁平状内皮细胞, 有丰富吞饮小泡, 可见少量微丝, 细胞间有紧密连接, 桥粒连接. 此为成熟内皮细胞(图2A). 此种内皮细胞的血窦腔宽, 血窦腔间隔壁薄, 内皮细胞下可见完整或较大段弹力纤维, 中膜层中可见到成纤维细胞和平滑肌细胞、中膜层薄, 外膜层有丰富胶原纤维(图2B). CHL这种结构与微动脉结构相似, 应视为肝动脉末梢微动脉性瘤样血管畸形病变. 电镜下末发现瘤体内有肝小叶结构.
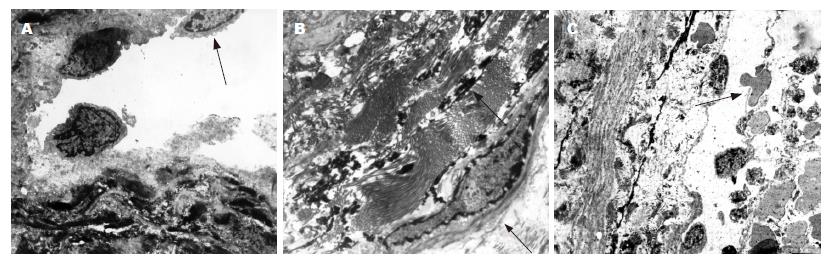
普遍现象是内皮细胞肿胀, 核仁边移, 由扁平状改变为柱状突入血窦腔, 随程度加重, 表现为内皮细胞由内膜层半剥离, 细胞器由减少到溶酶体、线粒体完全消失. 粗面内质网呈囊泡样改变, 直至内皮细胞完全脱落, 此为典型内皮细胞退化至坏死过程(图3A). 与此同时, 间质中大量胶原纤维增生, 将丹宁酸染色为电子密度极高的黑色之弹力纤维分割得支离破碎, 胶原纤维可占满血窦腔壁全层, 甚至由内皮细胞脱落处侵袭到血窦腔内, 并可完全填充血窦腔(图3B). 内皮细胞损害, 红细胞可大量渗透入间质中(图3C). 上述改变造成血窦腔逐渐狭窄致完全闭塞, 血窦壁逐渐增厚, 最后导致CHL纤维化及瘢痕形成. 纤维化改变过程, 经由中心部位开始发生(图4).
对8例CHL切除标本的电镜观察表明, 在血窦腔内皮细胞和间质结构没有发生明显退行性改变和胶原纤维大量增生破坏间质结构之前, 内膜可见扁平内皮细胞并含有丰富吞饮小泡, 少量微丝及细胞间连接, 内皮细胞下有完整弹力纤维, 中膜层可见少量平滑肌细胞, 或成纤维细胞, 中外膜关系不清晰, 其间有丰富胶原纤维. 上述结构与微动脉结构相似[4], 为非动脉性和非静脉毛细血管结构. 从组织学结构上证实CHL来源于肝动脉末梢微动脉的血管畸形病变. 进一步肯定了作者前期术中肝动脉支插管造影, 瘤体立即显影和临时阻断肝动脉条件下, 进行门静脉连续造影观察, 造影剂不能进入廇体; 再经门静脉注入亚甲兰、肝脏染色而瘤体色不变; 以及经肝静脉, 门静脉对切除标本铸型灌注后腐蚀观察瘤体脱落. 证实CHL瘤体完全由动脉供血, CHL来源于肝微动脉畸形病变的推论[1-2]. CHL瘤体中不含肝小叶, 也就不存在肝窦(窦状隙)结构, 也就不存在所谓廇体双重供血的组织学基础. 因此, CHL仅由肝动脉供血. 国外仅见Yamamoto et al[5]认为, CHL组织结构似肝动脉, 而与门静脉不同的报导.
CHL能自行纤维化萎缩[6-8]. 电镜观察到CHL病理改变均以内皮细胞退行性改变和间质中胶原纤维增生为特征. 内皮细胞肿胀, 核边移, 细胞变成柱状突向血窦腔内, 细胞器由减少到消失, 粗面内质网呈囊状小泡改变, 最后内皮细胞完全由内皮层脱落坏死. 间质中胶原纤维增生可致血窦壁内、中、外三层结构消失, 弹力纤维被分割. 胶原纤维由内皮细胞脱落处侵入血窦腔, 并可完全填充血窦腔, 导致CHL纤维化形成, 瘢痕化萎缩. 这是CHL为什么中年期以后逐渐纤维化, 萎缩的根据, 也是CHL原则上一般不用手术治疗的原因. 在临床上观察到只有极少数CHL由于某种因素刺激而增殖过快, 从而产生症状, 此种最多见于35岁以前的年轻人, 尤其反复怀孕和长期口服雌激素类避孕药的育龄妇女[9-11]. 绝大多数CHL在40岁以后发现, 多在查体或因其他疾病检查时发现. 此时发现, CHL已开始发生退化改变. CHL因为瘤体巨大而影响劳动和给生活带来不便者极为罕见, 且极少有CHL危及生命者.
CHL由迷宫状血窦腔组成, 瘤体越大其容积越大, 而入肝血流量并不加大, 肝动脉不增粗, 不迂曲, 此点与肝癌截然不同. 因此瘤体内血流量骤减, 压力锐降, 这一结构特征, 当对CHL行肝血管造影诊断, 表现出显影快而消退慢的"早出晚归"CHL特有的征象. CT增强扫描时, 造影剂在瘤内由周边向中心缓慢弥散, 瘤体密度显著高于周围肝实质, 可持续达5 min以上的原因. 正是由于瘤体血窦腔内血流极其缓慢, 可以造成瘤体内缺氧, 和代谢产物排出缓慢, 从而损害成熟内皮细胞, 造成内皮细胞肿胀, 细胞器逐渐消失, 粗面内质网囊泡样改变, 最后脱落坏死. 以及间质内胶元纤维大量增生, 并由内皮细胞缺损处填充于血窦腔内, CHL最终纤维化萎缩. 当瘤体内发生纤维化后, 造影剂不能进入血窦腔内, 在肝血管造影时, 纤维化萎缩区域出现造影剂缺损低密度区. 因此对CHL栓塞硬化治疗后, 栓塞区域不再显像, 或者对CHL血流血池动态核素显像时出现核素不被填充的缺损区(冷区域)[12]是判断疗效重要依据而不应单纯只以瘤体大小变化为准. CHL这一特征性结构, 血窦腔内压力低, 血流缓; 血窦腔壁形成无数间隔, 以及窦壁内丰富胶原纤维, 这是临床上难以见到自发破裂出血的原因. CHL血窦壁内皮细胞为成熟内皮细胞, 无增殖行为, 因此, 迄今为止尚末见到CHL恶变报导.
CHL为良性肿瘤, 发病率达7%. 绝大多数患者带瘤长期生存而无任何危害, 临床手术者中大多数手术依据不足. CHL破裂出血多发生于医源性损伤, 手术危险远大于疾病本身. CHL组织起源不明, 对其生物学特性缺乏了解和认识, 造成其治疗方法的混乱. 本文以前期研究为基础, 进一步明确CHL组织起源, 并对其不会自发破裂出血, 不恶变以及中年期后能自行纤维化萎缩的生物学行为的发生机制进行讨论, 将对今后CHL治疗原则产生影响.
研究CHL组织起源, 发生、发展机制和转归是难点. 外科治疗(含介入)指征和方法是热点. 针对内皮细胞消亡和胶原纤维增生两方面进行研究, 寻求生物学治疗是方向.
本文从超微结构研究进一步证实CHL来自肝内微动脉的血管畸形病变. 完全由动脉供血, 瘤内无肝窦状隙这一双重供血的组织学基础. 上述结果可能解释CHL在肝血管造影, 增强CT及肝血流血池动态显像诊断中出现的影像特征, 同时可以解释其不破裂, 不恶变并能自行纤维化萎缩的机制.
可以更科学的制定对CHL患者手术治疗的策略, 合理选择治疗方法, 丰富影像诊断学理论, 最大限度避免对CHL患者过度治疗和医源性损伤的发生.
本文采用电镜观察CHL的超微结构, 进一步证明其一般不需手术治疗, 也不易发生破裂出血的原因. 构思新颖, 有很强的说服力, 对临床治疗有很好的指导作用.
编辑:潘伯荣 电编:李琪
| 1. | Li GW, Zhao ZR, Li BS, Liu XG, Wang ZL, LIU QF. Source of blood supply of liver cavernous hemangioma and sclerosis and emboligation treatment. China Natl J New Gastroenterol. 1997;3:147-149. |
| 2. | Li GW, Chen QL, Jiang JT, Zhao ZR. The origin of blood supply for cavernous hemangioma of the liver. Hepatobiliary Pancreat Dis Int. 2003;2:367-370. [PubMed] |
| 3. | WHO电子显微镜诊断学研究研修センタ医学. 生物究のための电子显微镜学Ⅰ玉藤田企画出版株式会社第1版. 1987;42-44. |
| 4. | 钟 慈声. 细胞和组织的超微结构. 第1版, 北京: 人民卫生出版社 1984; 103-105. |
| 5. | Yamamoto K, Itoshima T, Ito T, Ukida M, Ogawa H, Kitadai M, Hattori S, Mizutani S, Nagashima H. Scanning electron microscopy of a liver cavernous hemangioma. Gastroenterol Jpn. 1983;18:15-20. [PubMed] |
| 6. | Kato M, Sugawara I, Okada A, Kuwata K, Satani M. Hemangioma of the liver. Diagnosis with combined use of laparoscopy and hepatic arteriography. Am J Surg. 1975;129:698-703. [PubMed] |
| 7. | Yamagata M, Kanematsu T, Matsumata T, Utsunomiya T, Ikeda Y, Sugimachi K. Management of haemangioma of the liver: comparison of results between surgery and observation. Br J Surg. 1991;78:1223-1225. [PubMed] |
| 8. | Pietrabissa A, Giulianotti P, Campatelli A, Di Candio G, Farina F, Signori S, Mosca F. Management and follow-up of 78 giant haemangiomas of the liver. Br J Surg. 1996;83:915-918. [PubMed] |
| 9. | Conter RL, Longmire WP Jr. Recurrent hepatic hemangiomas. Possible association with estrogen therapy. Ann Surg. 1988;207:115-119. [PubMed] |
| 10. | Trastek VF, van Heerden JA, Sheedy PF 2nd, Adson MA. Cavernous hemangiomas of the liver: resect or observe? Am J Surg. 1983;145:49-53. [PubMed] |
| 11. | Morley JE, Myers JB, Sack FS, Kalk F, Epstein EE, Lannon J. Enlargement of cavernous haemangioma associated with exogenous administration of oestrogens. S Afr Med J. 1974;48:695-697. [PubMed] |
| 12. | Jesic R, Radojkovic S, Tomic D, Krstic M, Jankovic G, Milinic N, Pavlovic A, Crnobaric M, Cvejic T, Aleksic T. Personal experience in embolization of liver hemangiomas. Srp Arh Celok Lek. 1998;126:349-354. [PubMed] |