修回日期: 2006-08-10
接受日期: 2006-09-28
在线出版日期: 2006-11-18
目的: 研究化学合成经修饰抗金属蛋白酶组织抑制剂-2(TIMP-2)小干扰RNA(siRNA)对CCl4诱导的大鼠肝纤维化的影响及其作用机制.
方法: SD大鼠42只随机平均分成7组:正常组、阴性对照组、假手术组、模型组, 治疗组(分3组, 分别用0.05、0.1、0.2 mg/kg siRNA尾静脉注射). 以400 mL/L CCl4(3 μL/g) sc诱导大鼠肝纤维化. 8 wk后所有动物取肝组织标本, 测门静脉血压(PVP)并经腹主动脉取血. 常规HE染色和Van Gieson(VG)胶原染色, 检测血清丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、透明质酸(HA)、层粘连蛋白(LN)、Ⅲ型前胶原(PCⅢ)、Ⅳ型胶原(CIV)和羟脯氨酸(Hyp). 应用荧光实时定量PCR法检测TIMP-2、Ⅰ型胶原纤维(COLⅠ)、Ⅲ型胶原纤维(COL Ⅲ)和α-平滑肌肌动蛋白(α-SMA) mRNA的表达. 应用Western blot或明胶酶谱法检测TIMP-2、α-SMA和MMP-2蛋白的表达.
结果: 各治疗组在应用抗TIMP-2 siRNA治疗后组织学病变减轻, PVP较模型组降低(2.2±0.1, 1.9±0.1, 1.6±0.1 kPa vs 2.7±0.1 kPa, P<0.05), 血清ALT和AST减少(2089.3±154.5, 1869.8±138.0, 1422.5±139.7 nkat/L vs 2717.2±193.8 nkat/L, P<0.05; 3634.1±242.7, 2739.4±141.3, 2286.6±145.5 nkat/L vs 4067.5±251.5 nkat/L, P<0.05), 反映肝纤维化指标的HA, LN, PCⅢ, CIV和Hyp均显著低于模型组(176.0±10.2, 160.6±9.3, 109.9±9.4 μg/L vs 206.3±17.0 μg/L, P<0.05; 93.1±8.2, 71.4±7.5, 55.9±7.3 μg/L vs 116.6±10.8 μg/L, P<0.05; 71.2±6.1, 64.1±5.1, 53.6±4.3 μg/L vs 91.2±8.9 μg/L, P<0.05; 64.3±5.4, 50.7±5.8, 41.6±4.4 μg/L vs 80.3±6.8 μg/L, P<0.05; 328.7±17.6, 279.7±16.3, 230.4±16.1 μg/g vs 380.7±20.6 μg/g, P<0.05). 各治疗组TIMP-2, COLⅠ, COL Ⅲ和α-SMA mRNA的表达较模型组明显减少(7.53±0.83, 5.04±0.75, 1.30±0.49 vs 23.23±2.14, P<0.05; 33.38±2.85, 22.80±2.48, 11.45±1.27 vs 43.18±3.32, P<0.05; 19.23±1.95, 13.21±1.35, 10.11±1.09 vs 25.90±2.23, P<0.05; 23.76±2.06, 15.33±1.25, 10.53±1.02 vs 34.85±3.16, P<0.05), 且TIMP-2, MMP-2和α-SMA蛋白的表达也相应减少(23.27±3.06, 14.13±1.86, 9.16±1.33 vs 44.83±5.45, P<0.05; 23.80±2.14, 15.58±1.52, 9.52±0.93 vs 39.90±3.23, P<0.05; 24.58±2.59, 19.29±2.31, 13.40±1.98 vs 57.19±7.07, P<0.05).
结论: 化学合成经修饰抗TIMP-2 siRNA能显著降低TIMP-2的表达, 促进细胞外基质的降解, 抑制肝星状细胞的活化.
引文著录: 胡迎宾, 李定国, 李光明, 孙超, 徐芹芳. 化学合成经修饰抗TIMP-2小干扰RNA对CCl4诱导肝纤维化动物模型的影响. 世界华人消化杂志 2006; 14(32): 3081-3087
Revised: August 10, 2006
Accepted: September 28, 2006
Published online: November 18, 2006
AIM: To probe the effects of chemically modified small interfering RNA (siRNA) targeting tissue inhibitor of metalloproteinase-2 (TIMP-2) on liver fibrosis as well as its possible mechanism in rats.
METHODS: A total of 42 male rats were randomly and averagely divided into 7 groups: a normal group, a negative control group, a sham-operated group, a model group and three siRNA-treated groups (treated with 0.05, 0.1, and 0.2 mg/kg siRNA via portal vain, respectively). Carbon tetrachloride (CCl4) was used to induce liver cirrhosis. All the rats were sacrificed at 8 wk to collect liver tissue specimens, and the portal vein pressure (PVP) was measured. The pathological changes of liver tissues were observed after HE and Van Gieson (VG) staining. The levels of alanine aminotransferase (ALT), aspartate aminotransferase (AST), hyaluronic acid (HA), laminin (LN), procolagen type Ⅲ (PCⅢ), collagen type Ⅳ (CIV) and hydroxyproline (Hyp) were measured. The mRNA expression of TIMP-2, collagen type I (COLI), collagen type Ⅲ (COLⅢ) and a-smooth muscle actin (a-SMA) were detected by quantitative real-time polymerase chain reaction (QRT-PCR). The protein expression of TIMP-2, a-SMA and MMP-2 were analyzed by Western blott or gelatin zymography.
RESULTS: In comparison with those in the model group, the pathological changes in the three siRNA-treated groups (treated with 0.05, 0.1, and 0.2 mg/kg siRNA, respectively) were markedly attenuated, and the levels of PVP (2.2 ± 0.1, 1.9 ± 0.1, 1.6 ± 0.1 kPa vs 2.7 ± 0.1 kPa, P < 0.05), ALT (2089.3 ± 154.5, 1869.8 ± 138.0, 1422.5 ± 139.7 nkat/L vs 2717.2 ± 193.8 nkat/L, P < 0.05), AST (3634.1 ± 242.7, 2739.4 ± 141.3, 2286.6 ± 145.5 nkat/L vs 4067.5 ± 251.5 nkat/L, P < 0.05), HA (176.0 ± 10.2, 160.6 ± 9.3, 109.9 ± 9.4 mg/L vs 206.3 ± 17.0 mg/L, P < 0.05), LN (93.1 ± 8.2, 71.4 ± 7.5, 55.9 ± 7.3 mg/L vs 116.6 ± 10.8 mg/L, P < 0.05), PCⅢ(71.2 ± 6.1, 64.1 ± 5.1, 53.6 ± 4.3 mg/L vs 91.2 ± 8.9 mg/L, P < 0.05), CIV (64.3 ± 5.4, 50.7 ± 5.8, 41.6 ± 4.4 mg/L vs 80.3 ± 6.8 mg/L, P < 0.05) and Hyp (328.7 ± 17.6, 279.7 ± 16.3, 230.4 ± 16.1 mg/g vs 380.7 ± 20.6 mg/g, P < 0.05) were significantly lowered. QRT-PCR showed that the mRNA expression of TIMP-2, COLI, COLⅢ and a-SMA in the three siRNA-treated groups were decreased significantly as compared with those in the model group (7.53 ± 0.83, 5.04 ± 0.75, 1.30 ± 0.49 vs 23.23 ± 2.14, P < 0.05; 33.38 ± 2.85, 22.80 ± 2.48, 11.45 ± 1.27 vs 43.18 ± 3.32, P < 0.05; 19.23 ± 1.95, 13.21 ± 1.35, 10.11 ± 1.09 vs 25.90 ± 2.23, P < 0.05; 23.76 ± 2.06, 15.33 ± 1.25, 10.53 ± 1.02 vs 34.85 ± 3.16, P < 0.05). Western blot or gelatin zymography showed that the protein expression of TIMP-2, MMP-2 and a-SMA in the three siRNA-treated groups were also decreased significantly as compared with those in the model group (23.27 ± 3.06, 14.13 ± 1.86, 9.16 ± 1.33 vs 44.83 ± 5.45, P < 0.05; 23.80 ± 2.14, 15.58 ± 1.52, 9.52 ± 0.93 vs 39.90 ± 3.23, P < 0.05; 24.58 ± 2.59, 19.29 ± 2.31, 13.40 ± 1.98 vs 57.19 ± 7.07, P < 0.05).
CONCLUSION: Chemically modified siRNA targeting TIMP-2 can down-regulate the expression of TIMP-2, decrease the contents of extracellular matrix, and inhibit the activation of hepatic stellate cells.
- Citation: Hu YB, Li DG, Li GM, Sun C, Xu QF. Effects of chemically modified small interfering RNA targeting tissue inhibitor of metalloproteinase-2 on carbon tetrachloride-induced liver fibrosis in rats. Shijie Huaren Xiaohua Zazhi 2006; 14(32): 3081-3087
- URL: https://www.wjgnet.com/1009-3079/full/v14/i32/3081.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i32.3081
金属蛋白酶组织抑制剂-2(tissue inhibitor of metalloproteinase-2, TIMP-2)是体内多种基质金属蛋白酶(matrix metalloproteinases, MMPs)的特异性抑制剂之一. 在肝纤维化时TIMP-2表达增加, 一方面他通过抑制MMPs的活性从而减少细胞外基质(extracellular matrix, ECM)的降解, 导致ECM的过度沉积[1]. 另一方面, TIMP-2能够通过膜型MMP-1(membrane type 1 matrix metalloproteinase, MT1-MMP)介导活化MMP-2, 降解基底膜, 促进炎症细胞的侵袭和肝星状细胞(hepatic stellate cell, HSC)的活化[2-3]. 因此抑制TIMP-2在肝纤维化中的表达, 将有可能阻断肝纤维化的进一步发展. 小干扰RNA(small interfering RNA, siRNA)是RNA干扰(RNA interference, RNAi)过程中的效应分子, 他能够高效特异性的沉默同源性靶mRNA的表达, 从而达到基因沉默的目的. 本研究采用化学合成经修饰抗TIMP-2 siRNA防治CCl4诱导的肝纤维化动物模型, 探讨其作用机制, 为siRNA应用于临床奠定实验基础.
♂SD大鼠42只, 体质量240-260 g, 由中国科学院上海实验动物中心提供. 化学合成经修饰抗TIMP-2 siRNA由美国Invitrogen Life Technologies公司设计合成. 抗TIMP-2 siRNA正义链: 5'-GCCAAGUUCUUUGCCUGCAUCAAGA-3'; 反义链: 5'-UCUUGAUGCAGGCAAAGAACUUGGC-3'. 抗TIMP-2 siRNA阴性对照(control siRNA)正义链: 5'- GCCUUGUUCCGUGUCUACACAAAGA-3'; 反义链: 5'-UCUUUGUGUAGACACGGAACAAGGC-3'. 转染试剂Lipofectamine 2000购自美国Invitrogen Life Technologies公司. 定量RT-PCR试剂盒(ExScript RT-PCR Kit)购自大连TaKaRa公司. RNA抽提试剂TRIzol由上海生工生物工程技术服务有限公司提供. 抗β-肌动蛋白(β-actin)抗体和抗TIMP-2抗体购自武汉博士德公司. 抗α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)购自美国Sigma公司. 辣根酶标记二抗购自美国Santa Cruz公司. SuperSignal West Pico化学发光底物购自美国Pierce Biotechnology公司. 透明质酸(hyaluronic acid, HA)、层黏连蛋白(laminin, LN)、Ⅲ型前胶原(procolagen type Ⅲ, PCⅢ)、Ⅳ型胶原(collagen type Ⅳ, CIV)放射免疫分析试剂盒购自上海海研医学生物技术有限公司. 羟脯氨酸(hydroxyproline, Hyp)试剂盒购自南京建成生物工程研究所.
将动物随机分为7组, 每组6只. siRNA阴性对照组, 假手术组和模型组分别给予0.1 mg/kg control siRNA经鼠尾静脉注射, sc橄榄油(3 μL/g)及sc 400 mL/L CCL4(3 μL/g), 每3天1次, 至第8周末. 治疗组分为3组, 分别予sc 400 mL/L CCL4(3 μL/g), 每3天1次, 2 wk后各治疗组分别同时给予0.05 mg/kg siRNA(治疗1组)、0.1 mg/kg siRNA(治疗2组)和0.2 mg/kg siRNA(治疗3组)以及相应剂量Lipofectamine 2000(10, 20, 40 μL)经鼠尾静脉注射, 每3天1次, 至第8周末. 所有动物经门静脉测压(portal vein pressure, PVP), 腹主动脉取血, 同时取肝组织右叶约10 g. 采用HE常规染色和标准Van Gieson(VG)胶原染色, 光镜下观察肝细胞变性、坏死、炎症细胞浸润及胶原沉积情况.
1.2.1 血清学和肝组织Hyp检查: 血清丙氨酸氨基转移酶(alanine aminotransferase, ALT)和天冬氨酸氨基转移酶(aspartate aminotransferase, AST)由美国Beckman LX20生化自动分析仪检测. HA, LN, PCIII, CIV和Hyp的检测分别按试剂盒说明书操作.
1.2.2 荧光实时定量PCR: 用TRIzol试剂盒提取肝组织总RNA, 紫外分光光度计测定RNA浓度. 按定量RT-PCR试剂盒说明书取1 μg总RNA逆转录合成cDNA, 然后以Sybr Green作为荧光标记物, 在LightCycler荧光实时定量PCR仪(Roche公司, 德国)上进行PCR反应. PCR引物: TIMP-2正义链, 5'- ACCCAGAAGAAGAGCCTAAACCA-3', 反义链, 5'- GTCCATCCAGAGGCACTCATC-3'; α-SMA正义链, 5'-CCGAGATCTCACCGACTACC-3', 反义链, 5'-TCCAGAGCGACATAGCACAG-3'; Ⅰ型胶原纤维(collagen type Ⅰ, COL Ⅰ)正义链, 5'-GAGGGCGAGTGCTGTCCTT-3', 反义链, 5'-GGTCCCTCGACTCCTATGACTTC-3'; Ⅲ型胶原纤维(collagen type Ⅲ, COL Ⅲ)正义链, 5'-TGAAGGAAATAGCAAATTCACTTACAC-3', 反义链, 5'-TCAAAGACTGTCTTGCTCCATTC-3'; 3'-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)正义链, 5'-GCATGGCCTTCCGTGTTCCTACC-3', 反义链, 5'-GCCGCCTGCTTCACCACCTTCT-3'. 反应条件如下: 预变性 95 ℃ 10 s; 30个循环中95 ℃ 5 s, 60 ℃ 20 s, 72 ℃ 5 s. 通过融解曲线分析和电泳确定目的条带, 使用正常SD大鼠肝组织制作外在标准曲线, 通过双标准曲线法进行相对定量, 即特异性基因表达量/管家基因表达量(GAPDH).
1.2.3 Western印迹检测TIMP-2和α-SMA的表达: 组织标本经裂解液提取蛋白后, 采用BCA法定量蛋白浓度. 蛋白变性后在100 g/L SDS-聚丙烯酰胺凝胶中电泳分离, 完毕后采用半干法将蛋白电转移到聚偏二氟乙烯(polyvinylidene difluoride, PVDF)膜上, 用50 g/L的脱脂奶粉封闭后, 先后加入特异性一抗和相对应的二抗, 最后经化学发光法在X片上显影并扫描结果条带, 测定光密度值. 采用特异性基因光密度/管家基因光密度(β-actin)相对定量.
1.2.4 明胶酶谱法检测MMP-2蛋白表达: 细胞上清液浓缩后, 在Novex Zymogram Gels胶中进行非变性电泳, 复性缓冲液室温轻摇30 min后倾去, 显色缓冲液平衡30 min, 然后显色缓冲液37 ℃过夜, 1 g/L考马斯亮蓝染色, 脱色, 拍照.
统计学处理 应用SAS 6.12软件包进行统计分析, 数据以mean±SD表示, 组间差异使用方差分析, 两两比较采用Student-Newman-Kewls法, 以P<0.05表示有统计学差异.
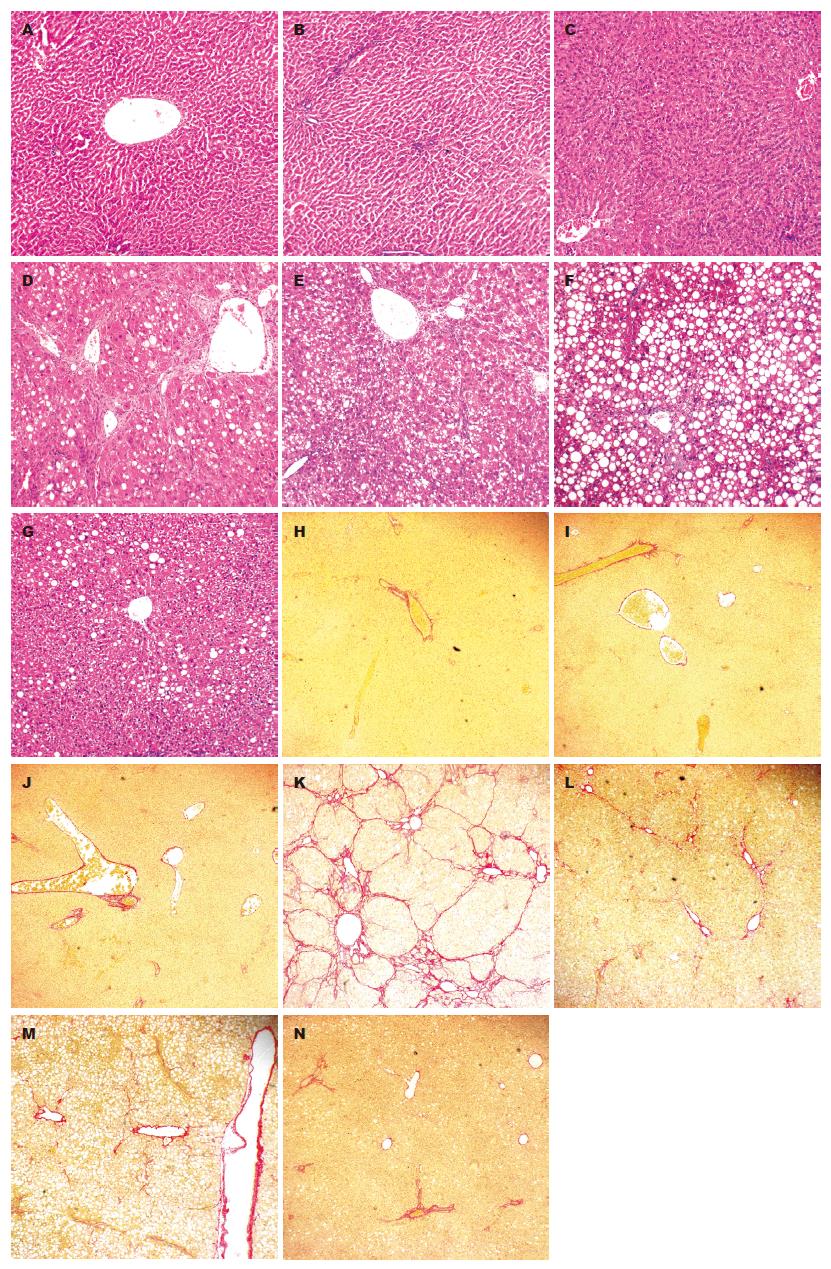
正常组, 阴性对照组和假手术组肝小叶形态无异常, 未见肝细胞变性、坏死及炎症细胞浸润, VG染色未见纤维间隔形成; 模型组肝小叶正常结构消失, 有大量炎症细胞浸润, 可见肝细胞变性、坏死, VG染色可见纤维间隔, 假小叶形成; 治疗1组肝小叶形态异常, 有炎症细胞浸润, 可见肝细胞脂滴变性, VG染色可见少量纤维组织; 治疗2组可见大量肝细胞脂肪变性, VG染色可见少量纤维组织; 治疗3组可见少量肝细胞脂肪变性, VG染色未见明显纤维组织(图1).
正常组、阴性对照组和假手术组3组之间PVP, ALT, AST均无统计学差异, 各治疗组PVP, ALT, AST, HA, LN, PCⅢ, CIV和Hyp均显著低于模型组(P<0.05, 表1), 且各治疗组之间的变化具有统计学差异(P<0.05).
| 分组 | PVP (kPa) | ALT (nkat/L) | AST (nkat/L) | HA (μg/L) | LN (μg/L) | PCIII (μg/L) | CIV (μg/L) | Hyp (μg/g) |
| 正常 | 1.1±0.1 | 425.1±96.5 | 575.1±94.7 | 70.1±7.2 | 30.3±4.4 | 41.9±5.2 | 11.0±2.3 | 191.3±15.2 |
| 阴性对照 | 1.2±0.1 | 480.7±109.8 | 683.5±118.3 | 75.8±4.5 | 34.4±5.4 | 39.4±5.0 | 10.7±2.9 | 191.5±16.4 |
| 假手术 | 1.2±0.1 | 530.7±129.3 | 736.3±103.5 | 79.4±5.1 | 35.6±4.9 | 44.9±4.1 | 11.9±2.5 | 196.3±15.4 |
| 模型 | 2.7±0.1a | 2717.2±193.8a | 4067.5±251.5a | 206.3±17.0a | 116.6±10.8a | 91.2±8.9a | 80.3±6.8a | 380.7±20.6a |
| 治疗1 | 2.2±0.1ac | 2089.3±154.5ac | 3634.1±242.7ac | 176.0±10.2ac | 93.1±8.2ac | 71.2±6.1ac | 64.3±5.4ac | 328.7±17.6ac |
| 治疗2 | 1.9±0.1ac | 1869.8±138.0ac | 2739.4±141.3ac | 160.6±9.3ac | 71.4±7.5ac | 64.1±5.1ac | 50.7±5.8ac | 279.7±16.3ac |
| 治疗3 | 1.6±0.1ac | 1422.5±139.7ac | 2286.6±145.5ac | 109.9±9.4ac | 55.9±7.3ac | 53.6±4.3ac | 41.6±4.4ac | 230.4±16.1ac |
模型组TIMP-2 mRNA的表达显著高于正常组(P<0.05, 表2), 各治疗组TIMP-2 mRNA的表达显著低于模型组(P<0.05, 表2), 且治疗3组TIMP-2 mRNA的表达与正常组比较无统计学差异; 模型组COLⅠ、COL III和α-SMA mRNA的表达显著高于正常组(P<0.05, 表2), 各治疗组COLⅠ、COL Ⅲ和α-SMA mRNA的表达显著低于模型组(P<0.05, 表2).
| 分组 | TIMP-2 | COL I | COL III | α-SMA |
| 正常 | 1.87±0.73 | 6.90±1.05 | 3.81±1.22 | 1.74±0.94 |
| 阴性对照 | 2.07±0.59 | 7.23±1.10 | 4.08±1.10 | 1.78±0.92 |
| 假手术 | 2.17±0.71 | 6.89±1.34 | 4.03±1.11 | 1.95±0.86 |
| 模型 | 23.23±2.14a | 43.18±3.32a | 25.90±2.23a | 34.85±3.16a |
| 治疗1 | 7.53±0.83ac | 33.38±2.85ac | 19.23±1.95ac | 23.76±2.06ac |
| 治疗2 | 5.04±0.75ac | 22.80±2.48ac | 13.21±1.35ac | 15.33±1.25ac |
| 治疗3 | 1.30±0.49c | 11.45±1.27ac | 10.11±1.09ac | 10.53±1.02ac |
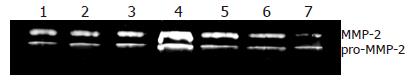
模型组TIMP-2蛋白的表达显著高于正常组(P<0.05, 表3), 各治疗组TIMP-2蛋白的表达显著低于模型组(P<0.05, 表3), 且治疗2组和治疗3组TIMP-2蛋白的表达接近正常组水平(图2); 模型组MMP-2蛋白的表达显著高于正常组(P<0.05, 表3), 各治疗组MMP-2蛋白的表达显著低于模型组(P<0.05, 表3), 且治疗3组MMP-2蛋白的表达显著低于正常组(P<0.05, 图3); 模型组α-SMA蛋白的表达显著高于正常组(P<0.05), 各治疗组α-SMA蛋白的表达显著低于模型组(P<0.05, 表3), 且治疗3组α-SMA蛋白的表达接近正常组(图4). 反义寡脱氧核苷酸、核酶和siRNA都是基因沉默的有效手段, 但是目前认为siRNA对基因表达的沉默效率高于反义寡脱氧核苷酸和核酶[4-5], 因此应用siRNA进行基因治疗将有更广阔的前景. 然而普通标准的siRNA也存在一些不足, 如脱靶效应, 非特异性效果以及不稳定性. 为了解决这些问题, 最近一些研究者采用化学合成经修饰siRNA的方法, 在活体内进行基因沉默, 取得了明显的治疗效果[6-7]. 本研究使用不同浓度的化学合成经修饰抗TIMP-2 siRNA进行实验性肝纤维化的防治, 证明能够有效抑制TIMP-2基因和蛋白的表达.
目前认为ECM合成与降解失衡是肝纤维化形成的根本原因, 而MMPs及其抑制剂TIMPs是调节ECM的关键酶[8-9], 因此肝纤维化的防治包括2个方面: 促进ECM的降解(如增加MMPs的表达)和抑制ECM的合成(如减少TIMPs的表达). 国内外研究已经证实增加一种MMPs的表达或者减少TIMP-1的表达能够减轻实验性肝纤维化的发生、发展[10-12]. 然而已知的MMPs有20余种, 增加一种MMPs的表达无法考虑各种MMPs之间的相互作用, 并且表达合成的MMPs酶原如何高效转化为有活性的MMPs也是一个值得考虑的问题. 虽然抑制TIMP-1的表达能够增加多种MMPs的活性, 但是TIMP-1无法像TIMP-2那样和MMP-2及MT1-MMP形成三联复合体, 而后者是MMP-2活化所必需的过程[2,13]. 因此, 抑制TIMP-2的表达将伴随MMP-2活化的减少, 这和我们在实验中发现应用抗TIMP-2 siRNA治疗后MMP-2蛋白的表达也随之减少相一致.
肝纤维化时以Ⅰ型和Ⅲ型胶原纤维增加为主, Ⅳ型胶原纤维、HA、LN、Hyp亦有所增加[14]. 在给予抗TIMP-2 siRNA干预6 wk后, 上述纤维化指标均明显降低, 表明抑制TIMP-2的表达能够显著减少ECM的沉积. 本研究还发现, 经抗TIMP-2 siRNA治疗后, 各治疗组的门静脉压力显著低于模型组, 说明减少ECM的沉积, 从而避免假小叶的形成, 有利于改善肝纤维化时血流动力学的异常变化. 目前研究认为, 肝星状细胞(hepatic stellate cell, HSC)的活化与肝纤维化的发生密切相关, 而α-SMA则是HSC活化的重要标志[15]. 我们应用抗TIMP-2 siRNA进行抗肝纤维化治疗, 能够降低α-SMA基因和蛋白的表达, 间接证明活化HSC的数量明显减少, 这可能和抑制MMP-2的活化作用有关[3]. 总之, 通过从调节ECM平衡这一肝纤维化发生的最终环节入手, 应用化学合成经修饰siRNA沉默TIMP-2的表达, 促进ECM的降解, 抑制HSC的活化, 将为肝纤维化的治疗提供新的有效方法.
随着RNA干扰机制在哺乳动物中的发现, 一些研究者逐渐开始应用小干扰RNA(siRNA)进行HBV、HIV、恶性肿瘤、神经元退行性变等多种疾病的基因治疗. 目前, 美国FDA已经批准siRNA进行Ⅲ期临床试验, 用于治疗湿性老年性黄斑变性(AMD)的患者. 2006年诺贝尔医学与生理学奖则授予了发现RNAi现象的两位美国科学家. 因此, siRNA在临床和科研工作中将有广泛的应用前景.
普通化学合成的siRNA存在一些不足, 例如脱靶效应, 非特异性效果以及不稳定性, 而化学合成经修饰siRNA将改善上述问题.
与其他TIMPs不同的是, TIMP-2可以活化MMP-2, 从而促进肝纤维化的发生、发展.
本研究证明应用化学合成经修饰siRNA沉默TIMP-2的表达, 促进ECM的降解, 抑制HSC的活化, 将为肝纤维化的治疗提供新的有效方法.
1小干扰RNA: 一种短片段双链RNA分子, 能够以同源互补序列的mRNA为靶目标降解特定的mRNA, 这个过程就是RNA干扰途径. 2膜型基质金属蛋白酶: 是基质金属蛋白酶家族中的一类分子, 他们通过跨膜结构域或与糖基化磷脂酰肌醇锚连而定位于细胞表面.
本文研究了抗金属蛋白酶组织抑制剂-2小干扰RNA对CCl4诱导的大鼠肝纤维化的影响及其作用机制. 该方法是对抗纤维化的有益探索, 实验内容中检测标志物比较全面, 检测手段先进, 方案设计细致, 有较高学术价值.
编辑:张焕兰 电编:李琪
| 1. | Arthur MJ. Fibrogenesis Ⅱ. Metalloproteinases and their inhibitors in liver fibrosis. Am J Physiol Gastrointest Liver Physiol. 2000;279:G245-G249. [PubMed] |
| 2. | Morgunova E, Tuuttila A, Bergmann U, Tryggvason K. Structural insight into the complex formation of latent matrix metalloproteinase 2 with tissue inhibitor of metalloproteinase 2. Proc Natl Acad Sci USA. 2002;99:7414-7419. [PubMed] |
| 3. | Theret N, Lehti K, Musso O, Clement B. MMP2 activation by collagen I and concanavalin A in cultured human hepatic stellate cells. Hepatology. 1999;30:462-468. [PubMed] |
| 4. | Beale G, Hollins AJ, Benboubetra M, Sohail M, Fox SP, Benter I, Akhtar S. Gene silencing nucleic acids designed by scanning arrays: anti-EGFR activity of siRNA, ribozyme and DNA enzymes targeting a single hybridization-accessible region using the same delivery system. J Drug Target. 2003;11:449-456. [PubMed] |
| 5. | Drew HR, Lewy D, Conaty J, Rand KN, Hendry P, Lockett T. RNA hairpin loops repress protein synthesis more strongly than hammerhead ribozymes. Eur J Biochem. 1999;266:260-273. [PubMed] |
| 6. | Karagiannis TC, El-Osta A. RNA interference and potential therapeutic applications of short interfering RNAs. Cancer Gene Ther. 2005;12:787-795. [PubMed] |
| 7. | Soutschek J, Akinc A, Bramlage B, Charisse K, Constien R, Donoghue M, Elbashir S, Geick A, Hadwiger P, Harborth J. Therapeutic silencing of an endogenous gene by systemic administration of modified siRNAs. Nature. 2004;432:173-178. [PubMed] |
| 10. | Iimuro Y, Nishio T, Morimoto T, Nitta T, Stefanovic B, Choi SK, Brenner DA, Yamaoka Y. Delivery of matrix metalloproteinase-1 attenuates established liver fibrosis in the rat. Gastroenterology. 2003;124:445-458. [PubMed] |
| 11. | Siller-Lopez F, Sandoval A, Salgado S, Salazar A, Bueno M, Garcia J, Vera J, Galvez J, Hernandez I, Ramos M. Treatment with human metalloproteinase-8 gene delivery ameliorates experimental rat liver cirrhosis. Gastroenterology. 2004;126:1122-33; discussion 949. [PubMed] |
| 12. | Jiang W, Wang JY, Yang CQ, Liu WB, Wang YQ, He BM. Effects of a plasmid expressing antisense tissue inhibitor of metalloproteinase-1 on liver fibrosis in rats. Chin Med J (Engl). 2005;118:192-197. [PubMed] |