修回日期: 2006-06-15
接受日期: 2006-06-24
在线出版日期: 2006-08-18
目的: 探讨DNA损伤修复基因hOGG1的遗传多态Ser326Cys与肝细胞癌(HCC)易感性的关系.
方法: 应用基因测序分型方法, 分析96例HCC患者和96例健康对照hOGG1的遗传多态及与HBV感染的交互作用.
结果: HCC病例组的Cys/Cys, Cys/Ser和Ser/Ser基因型分别为20.9%, 44.2%和34.9%. Ser/Cys杂合子个体的OR值为1.5, Cys/Cys纯合子个体的OR值为1.9, 明显高于Ser/Ser个体, 表现出剂量效应. HBV感染者发生HCC的相对风险度是非HBV感染者的9倍(OR = 9.2; 95%CI: 0.99-5.9). 对于HCC, hOGG1-Ser326Cys变异或HBV感染单一因素的OR值分别为5.5 (95%CI: 0.7-240.1)和10.9 (95%CI: 1.6-453.3), 但携带变异基因者如果感染HBV, OR值则高达27.8 (95%CI: 4.7-970.2).
结论: DNA修复基因hOGG1的Cys等位基因可能增加HCC的遗传易感性, 他与HBV协同在乙肝相关性HCC的发生中起着重要作用.
引文著录: 张昊, 郝冰涛, 贺福初. DNA损伤修复基因hOGG1的遗传多态与乙肝相关性HCC的风险. 世界华人消化杂志 2006; 14(23): 2311-2314
Revised: June 15, 2006
Accepted: June 24, 2006
Published online: August 18, 2006
AIM: To investigate the associations of suscep-tibility to hepatocellular carcinoma (HCC) with DNA repair gene hOGG1 Ser326Cys polymor-phism.
METHODS: The polymorphism of Ser326Cys in DNA damage repair gene hOGG1 was analyzed by sequencing and genotyping in 96 HCC patients and healthy controls.
RESULTS: The frequencies of Cys/Cys, Cys/Ser and Ser/Ser genotypes were 20.9%, 44.2% and 34.9%, respectively. The odd ratio (OR) of heterozygote Ser/Cys was 1.5, and that of homozygosity Cys/Cys was 1.9, which was significantly higher that of Ser/Ser, respectively. The relative risk of HCC in patients with hepatitis B virus (HBV) infection was over 9 times in patients without HBV infection (OR = 9.2; 95%CI: 0.99-5.9). Furthermore, the OR for the variant genotype and HBV infection was 5.5 (95%CI: 0.7-240.1) and 10.9 (95%CI: 1.6-453.3), respectively, while that was 27.8 (95%CI: 4.7-970.2) in patients with both variant genotype and HBV infection.
CONCLUSION: The allele Cys for hOGG1 gene may increase the genetic susceptibility of HCC, in which HBV infection plays a synergic role.
- Citation: Zhang H, Hao BT, He FC. Impact of DNA repair gene hOGG1 Ser326Cys polymorphism on the risk of hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2006; 14(23): 2311-2314
- URL: https://www.wjgnet.com/1009-3079/full/v14/i23/2311.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i23.2311
近年来, 肝细胞癌(hepatocellular carcinoma, HCC)的发病率居高不下, 已成为严重危害人民健康的恶性肿瘤之一. 乙型肝炎病毒(HBV)感染是公认的HCC的主要病因, 但HBV感染者中只有一小部分发展成HCC; 提示在相同的暴露条件下, 个人的易感性因素可能是促使发病的关键. 通过对HBV导致HCC的发病机制的研究发现, HBV基因组中的蛋白HBx是引起HCC的重要蛋白[1-2]. 最近发现, HBx可以与DNA损伤结合蛋白DDB1 (damaged DNA binding protein 1)作用, 从而降低细胞的核苷酸切除修复能力[3]. 在DNA损伤中8-羟基鸟嘌呤(8-hydroxyguanine)是一种高突变损伤, hOGG1是修复8-羟基鸟嘌呤的主要的DNA糖苷酶[4]. 有研究表明, 在hOGG1基因中存在着一个改变氨基酸编码序列的多态, 可以导致这个糖苷酶326位的Ser改变为Cys, 携带Ser的hOGG1修复能力是Cys变异体的7倍[5]. 既往研究表明, hOGG1的遗传多态在多个群体中与肺癌的遗传易感性关联[6]. 其与乙肝相关性HCC是否相关尚未见报道. 为此, 我们采用基因测序方法进行了病例-对照研究, 分析hOGG1的遗传多态与HBV感染交互作用对HCC风险的影响.
采用病例-对照研究, 包括96例HCC患者和96例正常对照, 病例和对照均为北方汉族群体, 来自河南省人民医院, 所有病例经临床资料和组织病理学检查确诊为HCC, 所有研究对象之间没有直系血缘关系(表1).
| 项目 | 病例组 | 对照组 |
| 男性(n) | 81 | 79 |
| 女性(n) | 15 | 17 |
| 年龄(yr) | 49.9±18 | 49.9±17.0 |
| 非HBV感染n(%) | 22(23.3) | 84(87.9) |
| HBV感染n(%) | 74(76.7) | 12(12.1) |
采用改良Miller法抽提研究对象外周血白细胞DNA, 应用Primer 3.0软件设计引物序列, 正向引物: 5'-CACACAGACTCCACCCTCCTA; 反向引物: 5'-CTGAACCGGGAGTTTCTCTG. 反应体系为25 μL, 含0.1 μg模板DNA, 0.4 μmol/L各引物, 0.1 μmol/L dNTP, 1.5 mmol/L MgCl2, 1.0 U Taq聚合酶以及1×反应缓冲液, 反应条件为: 95 ℃预变性2 min, 而后94 ℃ 30 s, 58 ℃ 30 s和72 ℃ 30 s, 进行28个循环, 最后72 ℃延伸9 min. 然后将PCR产物采用MultiScreen®-PCR plate (Millipore)进行纯化. 取纯化产物2 μL为模板, 用ABI PRIMERTM Big-Dye测序试剂盒, 进行PCR测序反应. 再在ABI 3700自动测序仪进行毛细管电泳序列测定. 在Unix服务器上运行PolyPhred软件, 获得每个个体的基因型, 并通过人工确定.
统计学处理 以比值比(odds ratio, OR)及其95%置信区间(confidence interval, CI)表示相对风险度. 所有的统计检验均为双侧概率检验. 所用统计软件为Statistic Analysis System第6版(SAS Insititute, Cary, NC, USA).
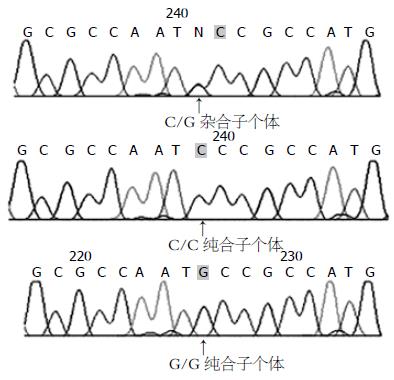
通过测序可以明确地获得病例和对照的hOGG1基因Ser326Cys的基因型(图1). C/C基因型对应蛋白编码序列Ser/Ser个体, G/G基因型对应蛋白编码序列Cys/Cys个体, C/G基因型对应蛋白编码序列Ser/Cys个体. 由于部分样本DNA降解, 导致测序不成功. 96个对照和96个病例测序结果, 可以明确得到的分型有89例对照、86例病例, 两组平均测序成功率为91%.
HCC病例组的Cys/Cys, Cys/Ser和Ser/Ser基因型分别为20.9%, 44.2%和34.9%. 基因型Cys/Cys和Cys/Ser与Ser/Ser相比在患者中的频率高于正常对照, 表现出剂量效应. 其中携带Cys/Cys基因型的个体患病风险增加约为2倍(OR = 1.9). 正常人群Cys等位基因频率为33.1%, HCC病例组为43.%, HCC患者要明显高于正常对照(表2).
| 项目 | HCC病例n(%) | 对照组n(%) | OR(95%CI) | |
| 等位基因 | Ser | 98(57.0) | 119(66.9) | 1.0(ref) |
| Cys | 74(43.0) | 59(33.1) | 1.5(0.99-2.35) | |
| 基因型 | Ser/Ser | 30(34.9) | 42(47.2) | 1.0(ref) |
| Cys/Ser | 38(44.2) | 35(39.3) | 1.5(0.79-2.93) | |
| Cys/Cys | 18(20.9) | 13(14.6) | 1.9(0.83-4.55) |
HCC组的HBV感染率显著高于对照组(76.7% vs 10.1%), HBV感染者发生HCC的相对风险度是非HBV感染者的9倍(OR = 9.2; 95%CI: 0.99-5.9). 我们以携带野生型而又未感染HBV者为参照, 分析变异基因型与HBV感染之间的交互作用对HCC风险的影响. 结果(表3)显示, 对于HCC, hOGG1-Ser326Cys变异或HBV感染单一因素的OR值分别为5.5 (95%CI: 0.7-240.1)和9.9 (95%CI: 1.6-453.3), 但携带变异基因者如果感染HBV, OR值则高达27.8 (95%CI: 4.7-970.2).
| 基因 | HBV | HCC病例 | 对照组 | OR(95%CI) |
| 否 | 无 | 1 | 16 | 1.0 |
| 是 | 无 | 5 | 22 | 5.5(95%CI: 0.7-240.1) |
| 否 | 有 | 2 | 8 | 9.9(95%CI: 1.6-453.3) |
| 是 | 有 | 38 | 4 | 27.8(95%CI: 4.7-970.2) |
HBV基因组中的蛋白HBx是引起HCC的重要蛋白, 该蛋白可与细胞中的多种癌症相关的蛋白包括P53, CREB, ATF2, RBP5等相互作用[1-2]. 最近人们发现, HBx可以与DDB1作用, 从而抑制该蛋白与DNA的结合[3]. DDB1是DNA修复系统中核苷酸切除修复(nucleotide excision repair, NER)途径的重要蛋白, 他可以结合到受损伤的DNA上, 引发核苷酸切除修复[7]. HBx蛋白与DDB1的结合可以降低细胞的核苷酸切除修复能力[3]. HBx还可以降低2个重要的NER蛋白XPB和XPD的表达. XPB和XPD是NER中的转录修复因子TFⅡH复合物的重要组成部分, 具有解旋酶的作用[7]. 这2个蛋白的突变可以导致一种严重的肿瘤易感性疾病-着色性干皮病[8-9]. 对HCC的EST分析也发现DNA修复相关基因DDB2, RAD51C, RAD23A, ERCC1和LIG1表达的下调[3,10,15]. 在过量表达DNA修复基因MGMT的转基因小鼠中也发现自发性HCC发病率降低[11], 而在患有活动性肝炎的HBV转基因小鼠体内可以检测到广泛的DNA氧化损伤[12]; 这些均提示HBV在肝细胞癌变过程中, 可能通过影响DNA损伤修复来起作用, DNA修复基因在HCC的发生过程中起着重要作用.
在生理或病理状态下, DNA氧化损伤广泛存在; 如果损伤得不到及时有效的修复, 细胞将发生基因突变和癌变[12], 因此, 由各种因素导致的DNA氧化损伤, 可能参与了HCC的发生和发展. 本文结果表明, hOGG1的Ser326Cys多态及与HBV感染交互作用与中国人HCC的风险显著相关.
hOGG1基因编码的蛋白产物具有DNA糖苷酶和AP裂解酶活性, 可以特异切除oh8Gua, 从而避免在DNA复制过程中导致的G:C→T:A颠换突变[13]. oh8Gua是氧化自由基攻击DNA形成的主要产物, 是一种重要的致癌性致突变性损伤[14]. 我们应用病例-对照分子流行病学方法, 通过基因测序分析发现, 等位基因Cys的基因频率在HCC患者高于正常对照, 基因型Cys/Cys和Cys/Ser与Ser/Ser相比较, 在患者中的频率都要高于对照, 表现出量效关系, 携带Cys/Cys基因型的个体患病风险较其他基因型(Cys/Ser和Ser/Ser)增加约2倍. 我们的结果从分子遗传学角度为DNA氧化损伤可能导致HCC提供了证据. hOGG1基因涉及oh8Gua切除修复, 该基因多态可引起个体对DNA氧化损伤修复能力的差异, 因此, 可能与HCC的遗传易感性有关. hOGG1基因Cys/Cys基因型增高HCC风险具有生物学上的关联性. 体外实验发现, Cys等位基因的修复能力比Ser等位基因低约7倍[5], 从机制上支持我们的结论. 目前认为, 肿瘤遗传易感性最根本的原因是各种损伤因素破坏了基因组的稳定性. hOGG1作为DNA修复基因, 可能在维持基因组稳定性方面发挥重要作用. 实验表明, hOGG1灭活后酵母菌基因组中G:C→T:A突变频率显著增加[5], 由于Cys等位基因编码的蛋白活性降低, 所以携带Cys/Cys基因型的个体修复oh8Gua的能力可能降低, 这样造成oh8Gua在基因组中存留而加快肿瘤相关G:C→T:A突变的积累, 使发生肿瘤的易感性增加. 在人类肺癌、食管癌以及其他一些肿瘤p53基因的G:C→T:A突变率较高[15], 而实验表明, oh8Gua是引起此类突变的重要原因[16]. 如果两者之间确实存在因果关系, 那么oh8Gua功能低下也可能易患其他肿瘤. 事实上, 已有研究报道Cys/Cys基因型个体罹患肺鳞癌的风险显著高于其他两种基因型[17]; hOGG1基因错义突变也与小细胞肺癌和食管癌的发生有关[18-19].
肝癌的发生与个体的易感性相关, 中国人肝癌的个体易感因素目前尚不清楚, 乙肝病毒感染是导致肝癌的重要原因, 二者的关系是本文想要探讨的问题.
多基因疾病已成为该领域研究的热点, 估计参与多基因疾病发病原理的基因可达3-20个, 这些基因的单核苷酸多态及其特定组合可能是造成疾病易感性最重要的原因. 对特定候选基因的单核苷酸多态与相关疾病的关联研究是该领 域研究的重点.
Radicella et al克隆了人hOGG1基因并发现其具有遗传多态性, 日本的研究发现, hOGG1基因多态增高肺癌易感性, 邢德印的研究表明, hOGG1基因多态与中国人食管癌易感性相关, 为本研究提供借鉴.
本文采用基因测序的方法, 对hOGG1基因多态与肝癌发生进行关联研究, 从基因水平研究肝癌的致病机制.
肝癌为我国高发的恶性肿瘤, 如果检测和确定肝癌易感性单核苷酸多态, 则为阐明我国人群肝癌的病因及基于遗传学背景的个体化治疗和临床试验奠定基础, 为肝癌的 预防、诊断、治疗和新药筛选创造条件.
单核苷酸多态: 指在基因组水平上由单个核苷酸的变异所引起的一种DNA序列多态性, 是人类基因组DNA序列中最常见的变异形式, 并有很高的信息含量.
DNA损伤修复基因的遗传多态性与肿瘤的发生, 是目前肿瘤流行病学研究的热点, 本文选择hOGG1的遗传多态Ser326Cys与肝细胞肝癌易感性的关系为研究对象, 比较新颖, 但是样本量少(国际上一般样本量达200-300), 有一定学术价值.
电编:张敏 编辑:潘伯荣
| 1. | Becker SA, Lee TH, Butel JS, Slagle BL. Hepatitis B virus X protein interferes with cellular DNA repair. J Virol. 1998;72:266-272. [PubMed] |
| 2. | Jia L, Wang XW, Harris CC. Hepatitis B virus X protein inhibits nucleotide excision repair. Int J Cancer. 1999;80:875-879. [PubMed] |
| 3. | Wakasugi M, Kawashima A, Morioka H, Linn S, Sancar A, Mori T, Nikaido O, Matsunaga T. DDB accumulates at DNA damage sites immediately after UV irradiation and directly stimulates nucleotide excision repair. J Biol Chem. 2002;277:1637-1640. [PubMed] |
| 4. | Khanna KK, Jackson SP. DNA double-strand breaks: signaling, repair and the cancer connection. Nat Genet. 2001;27:247-254. [PubMed] |
| 5. | Sugimura H, Kohno T, Wakai K, Nagura K, Genka K, Igarashi H, Morris BJ, Baba S, Ohno Y, Gao C. hOGG1 Ser326Cys polymorphism and lung cancer susceptibility. Cancer Epidemiol Biomarkers Prev. 1999;8:669-674. [PubMed] |
| 6. | Inoue M, Osaki T, Noguchi M, Hirohashi S, Yasumoto K, Kasai H. Lung cancer patients have increased 8-hydroxydeoxyguanosine levels in peripheral lung tissue DNA. Jpn J Cancer Res. 1998;89:691-695. [PubMed] |
| 7. | de Boer J, Hoeijmakers JH. Nucleotide excision repair and human syndromes. Carcinogenesis. 2000;21:453-460. [PubMed] |
| 8. | Butkiewicz D, Rusin M, Harris CC, Chorazy M. Identification of four single nucleotide polymorphisms in DNA repair genes: XPA and XPB (ERCC3) in Polish population. Hum Mutat. 2000;15:577-578. [PubMed] |
| 9. | Coin F, Marinoni JC, Rodolfo C, Fribourg S, Pedrini AM, Egly JM. Mutations in the XPD helicase gene result in XP and TTD phenotypes, preventing interaction between XPD and the p44 subunit of TFIIH. Nat Genet. 1998;20:184-188. [PubMed] |
| 10. | Davies AA, Masson JY, McIlwraith MJ, Stasiak AZ, Stasiak A, Venkitaraman AR, West SC. Role of BRCA2 in control of the RAD51 recombination and DNA repair protein. Mol Cell. 2001;7:273-282. [PubMed] |
| 11. | Sakumi K, Shiraishi A, Shimizu S, Tsuzuki T, Ishikawa T, Sekiguchi M. Methylnitrosourea-induced tumorigenesis in MGMT gene knockout mice. Cancer Res. 1997;57:2415-2418. [PubMed] |
| 12. | Marnett LJ. Oxyradicals and DNA damage. Carcinogenesis. 2000;21:361-370. [PubMed] |
| 13. | Kohno T, Shinmura K, Tosaka M, Tani M, Kim SR, Sugimura H, Nohmi T, Kasai H, Yokota J. Genetic polymorphisms and alternative splicing of the hOGG1 gene, that is involved in the repair of 8-hydroxyguanine in damaged DNA. Oncogene. 1998;16:3219-3225. [PubMed] |
| 14. | Floyd RA. The role of 8-hydroxyguanine in carcinogenesis. Carcinogenesis. 1990;11:1447-1450. [PubMed] |
| 15. | Greenblatt MS, Bennett WP, Hollstein M, Harris CC. Mutations in the p53 tumor suppressor gene: clues to cancer etiology and molecular pathogenesis. Cancer Res. 1994;54:4855-4878. [PubMed] |
| 16. | Hussain SP, Aguilar F, Cerutti P. Mutagenesis of codon 248 of the human p53 tumor suppressor gene by N-ethyl-N-nitrosourea. Oncogene. 1994;9:13-18. [PubMed] |
| 17. | Shen MR, Jones IM, Mohrenweiser H. Nonconser-vative amino acid substitution variants exist at polymorphic frequency in DNA repair genes in healthy humans. Cancer Res. 1998;58:604-608. [PubMed] |
| 18. | Ishida T, Takashima R, Fukayama M, Hamada C, Hippo Y, Fujii T, Moriyama S, Matsuba C, Nakahori Y, Morita H. New DNA polymorphisms of human MMH/OGG1 gene: prevalence of one polymor-phism among lung-adenocarcinoma patients in Japanese. Int J Cancer. 1999;80:18-21. [PubMed] |
| 19. | Xing DY, Tan W, Song N, Lin DX. Ser326Cys polymorphism in hOGG1 gene and risk of esopha-geal cancer in a Chinese population. Int J Cancer. 2001;95:140-143. [PubMed] |