修回日期: 2006-06-01
接受日期: 2006-06-08
在线出版日期: 2006-08-08
目的: 研究Cyclin E的表达失调对人类结肠癌细胞系DLD1染色体稳定性的影响.
方法: 建立四环素调控的Cyclin E稳定表达的细胞系DLD1tTA-Cyclin E, Western blot 检测Cyclin E表达. Cyclin E持续稳定表达 1, 3, 5, 7和14 d后, 对细胞进行DAPI染色, 在荧光显微镜下计数CIN细胞的百分比.
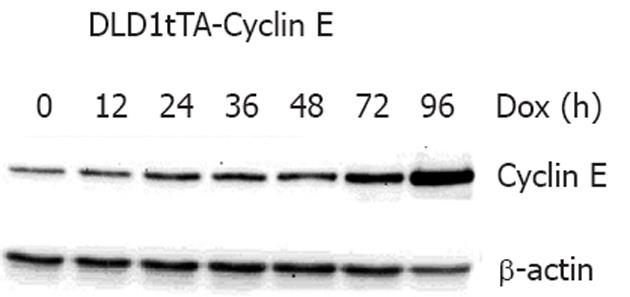
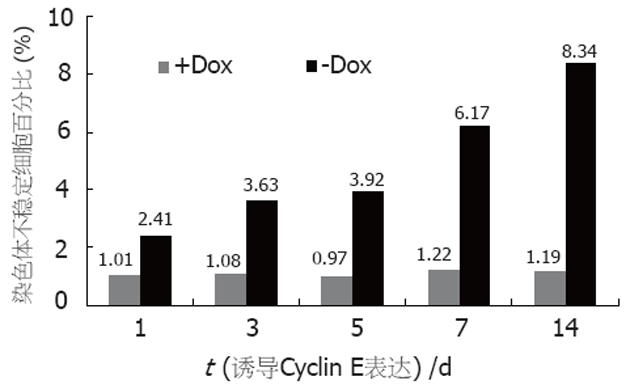
结果: Western blot显示, Cyclin E表达在96 h后达最高峰. Cyclin E表达关闭的DLD1细胞中, CIN细胞的百分比波动在0.97%-1.22%之间(t = 3.81, P>0.01); 而Cyclin E持续表达1, 3, 5, 7和14 d后的DLD1细胞中, CIN细胞的百分比分别为2.41%, 3.63%, 3.92%, 6.17%和8.34%(t = 4.77, P<0.01).
结论: Cyclin E的表达失调可导致DLD1结肠癌细胞非整倍体数染色体的形成, 也是造成结肠癌CIN的重要因素.
引文著录: 陈剑英, 黄文广, 陶凯雄, 王国斌. Cyclin E表达失调导致人类结肠癌染色体不稳定. 世界华人消化杂志 2006; 14(22): 2164-2168
Revised: June 1, 2006
Accepted: June 8, 2006
Published online: August 8, 2006
AIM: To study the influence of stably inducible expression of Cyclin E on the chromosomal instability in human colon cancer cell line DLD1.
METHODS: Tetracycline-responsive gene-inducible cell line DLD1tTA-cyclin E was generated. Western blot was used to examine the induction of Cyclin E expression upon removal of doxycycline. 4'-6-Diamidino-2-phenylindole (DAPI) staining was performed to detect the percentage of cells with chromosomal instability 1, 3, 5, 7 and 14 d after the induction of Cyclin E expression.
RESULTS: Western blot showed that the peak of Cyclin E expression appeared 96 h after induction. The percentage of cells with chromosomal instability in tet-off DLD1tTA-Cyclin E cells ranged from 0.97% to 1.22% (t = 3.81, P > 0.01). However, the percentages of cells with chromosomal instability were 2.41%, 3.63%, 3.92%, 6.17% and 8.34%, respectively, 1, 3, 5, 7 and 14 d after the induction of Cyclin E expression (t = 4.77, P < 0.01).
CONCLUSION: Deregulation of cyclin E can induce the formation of aneuploidy in human colon cancer cell line DLD1, and it also plays an important role in the pathway of chromosomal instability.
- Citation: Chen JY, Huang WG, Tao KX, Wang GB. Deregulation of Cyclin E induces chromosomal instability in human colon cancer. Shijie Huaren Xiaohua Zazhi 2006; 14(22): 2164-2168
- URL: https://www.wjgnet.com/1009-3079/full/v14/i22/2164.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i22.2164
结直肠癌是全球第三大癌症, 也是导致死亡的第四大恶性疾病. WHO统计, 结直肠癌每年新增病例约945 000人, 死亡病例约49 200人, 其5年总体生存率在发达国家可超过60%, 但在不发达国家仍低于40%[1-2]. 虽然结肠癌的发病率在逐年增加, 但其早期诊断仍主要依赖结肠镜检查的普及和遗传突变筛查的开展[3-5]. 由于大部分实体肿瘤的发病都与遗传不稳定(genetic instability)有关, 而导致这些遗传不稳定的基因各不相同[6-7], 因此, 深入研究人类结直肠癌发病的分子机制并提高患者术后药物治疗的敏感性具有重大的临床意义和社会价值[8-9].
DLD1tTA细胞系培养于含100 mL/L胎牛血清的McCoy'5A(Gibco公司)培养基中. 细胞转染使用Lipofectamine 2000试剂盒(Invitrogen公司). 将野生型Cyclin E cDNA克隆到pBI载体中四环素反应启动子下游的多克隆位点处, 产生四环素诱导Cyclin E表达的载体pBI-cyclin E.
建立四环素调控的稳定表达cyclin E的细胞系DLD1tTA-Cyclin E: 稳定表达四环素反应元件tTA(tetracycline-controlled transactivator, 四环素控制的反式作用元件)的人类结肠癌细胞系DLD1tTA(Tet-Off)购自BD公司, 稳定细胞克隆的筛选标记为500 mg/L G418(Invitrogen公司). 野生型Cyclin E的表达载体pBI-cyclin E和含hygromycin B(Invitrogen公司)筛选标记的表达载体pTK-Hyg按10∶1的比例共转染DLD1tTA细胞系, 转染24 h后, 用250 mg/L hygromycin B, 500 mg/L G418和0.5 mg/L doxycycline(Sigma公司)筛选2-3 wk, 其间保持细胞密度在10%-25%左右, 每隔2-3 d更换培养基和筛选抗生素.
1.2.1 Western blot: 培养细胞用预冷的PBS溶液漂洗2次, Laemmli缓冲液(62.5 mmol/L Tris-HCl (pH 6.8), 100 mL/L甘油, 10 g/L SDS, 50 g/L 2-巯基乙醇, 0.25 g/L溴酚蓝)裂解细胞, 蛋白质定量后每份样品取40 μg总蛋白于100 g/L SDS-PAGE凝胶中分离, 转移到PVDF膜上进行免疫杂交. 一抗为小鼠Cyclin E和兔β-Actin多克隆抗体, 二抗为相应的HRP标记的抗鼠和抗兔IgG抗体, ECL发光显影(Santa Cruz公司).
1.2.2 细胞核DAPI染色: 待染色的细胞培养于特殊载玻片上, 细胞完全贴壁后, PBS溶液漂洗细胞3次, 40 g/L甲醛在室温下固定细胞5-20 min, PBS溶液洗去固定液, DAPI(4', 6-diamidino-2-phenylindole hydrochloride)染液于37℃避光染色30 min后, PBS溶液漂洗细胞3次, 用含DAPCO(1, 4-diazabicyclo-2(2, 2, 2) octane)的盖玻片覆盖细胞, 在荧光显微镜下观察染成蓝色的正常和异常的细胞核形态.
1.2.3 CIN细胞计数: 将稳定诱导Cyclin E表达的细胞系DLD1tTA-Cyclin E(Tet-Off)接种于10个10 cm细胞培养皿中, 其中5个培养皿持续使用0.5 mg/L四环素以关闭Cyclin E的表达, 另外5个培养皿在细胞贴壁后充分洗脱四环素以开放Cyclin E的表达. 分别于1, 3, 5, 7和14 d后平行收集Cyclin E表达前后的细胞进行DAPI染色, 在63倍油镜下, 随机连续计数2000个细胞, 计算其中CIN细胞的百分比, 每组细胞按双盲法计数3次, 计算微核(micronuclei)产生的平均百分比.
统计学处理 用SPSS 10.0统计软件进行数据的处理, 组间比较采用t检验.
将hygromycin B和G418耐受细胞克隆种植于7-8个10 cm细胞培养皿中, 用HBSS液充分漂洗3-5次, 以充分洗脱四环素再分别于0, 12, 24, 36, 48, 72和96 h后收集细胞总蛋白, 用Western blot检测耐受细胞克隆中Cyclin E的稳定诱导表达. 结果显示, 自洗脱四环素后12 h开始, Cyclin E的表达逐渐增加, 在96 h时达到最高峰. β-actin蛋白作为加样对照(图1).
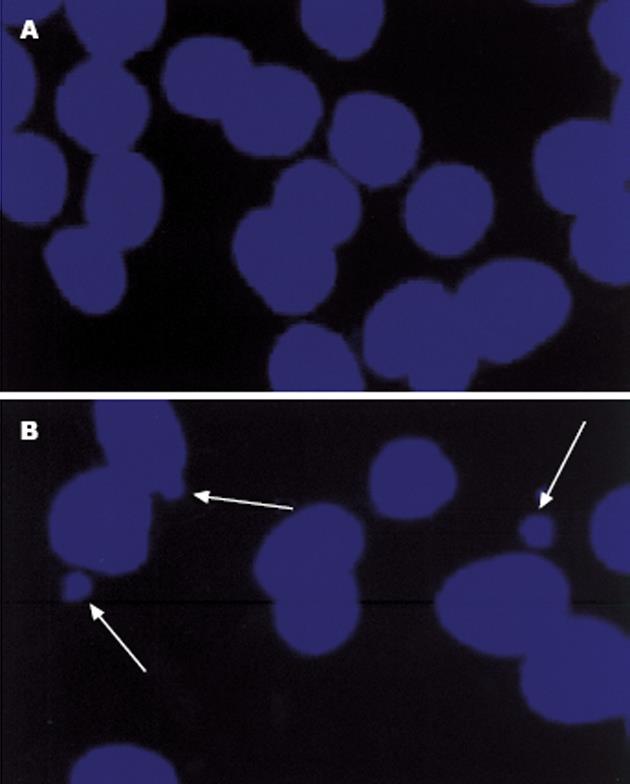
CIN的细胞核是指在细胞不正常分裂后产生的游离于原细胞核外周的直径不超过原细胞核1/3的圆形的、含染色体的细胞核部分, 又称为微核[10-13]. 用DAPI染色可以使细胞核内染色体在荧光显微镜下发出蓝色荧光, 因而可以显示细胞核的形态(图2). 图中显示了CIN的细胞中游离于原细胞核之外的染色体成分(箭头所指).
四环素关闭Cyclin E表达的DLD1细胞中, CIN细胞的百分比波动在0.97%-1.22%之间(P>0.01); 而洗脱四环素诱导Cyclin E表达1, 3, 5, 7和14 d后, CIN细胞的百分比分别为2.41%, 3.63%, 3.92%, 6.17%和8.34%, 即Cyclin E的过表达增加了CIN的细胞百分比, 并随着细胞的有丝分裂的累积, 这些CIN的细胞总数和百分数也将增加更明显. 统计学分析组间差异有显著性(P<0.01, 图3).
多年来, 研究者认为癌症的主要特征是遗传不稳定, 而这种遗传不稳定表现在2个不同水平: 一是表现在核苷酸水平的遗传不稳定, 即出现一些核苷酸的碱基替换、缺失和插入[14-15]; 二是表现在染色体水平的遗传不稳定, 即出现整个染色体或染色体的大部分缺失和/或获得, 这也是绝大部分实体肿瘤的特征[16-17]. 发生在调节细胞生长、分化、代谢和血管生成的关键基因(如癌基因和抑癌基因)的遗传不稳定, 将改变这些基因的表达和转录, 促使细胞具有选择生长的优势, 因而诱发肿瘤的生成和进展[18-19].
人类结直肠癌也具有遗传不稳定的基本特征[20]. 研究发现, 大约15%的结直肠癌表现为核苷酸水平的遗传不稳定, 即因错配修复基因hMLH1和/或hMSH2的失活导致的错配修复缺陷(mismatch repair deficiency, MMR). MMR功能失活使细胞基因组易感于突变, 特别是那些简单重复序列, 又称为微卫星不稳定(microsatellite instability, MIN或MSI)[21-22]. 具有MIN的结直肠癌细胞在核苷酸水平的突变率高于正常细胞的100-1000倍, 尽管如此, MIN结直肠癌细胞的染色体数目仍是二倍体(diploidy)或接近二倍体. 然而, 85%的结直肠癌和其他大部分的实体肿瘤并不表现为MIN, 而表现为异常的染色体数目, 即非整倍体的染色体数目(aneuploidy), 体外培养这些细胞的单细胞克隆时发现, 这些细胞的染色体丢失和/或获得的机率极高, 并导致细胞与细胞之间染色体核型的巨大差异, 这种类型的遗传不稳定被称为CIN(chromosomal instability, CIN)[23-25]. 与MIN不同的是, CIN结直肠癌细胞通常不存在核苷酸水平的遗传不稳定, 因此, 理论上认为MIN和CIN不可能在结直肠癌中同时存在, 他们是导致结直肠癌发生的2个独立机制, 而CIN是大多数散发型实体肿瘤发生的优势机制[26]. 目前的研究认为, CIN不是指染色体的部分或全部丢失和/或获得的状态或肿瘤细胞中非整倍体的染色体数目, 而是指染色体的部分或全部丢失和/或获得的机率. 研究显示, CIN细胞在每次细胞分裂时, 每条染色体有1%的机率出现CIN, 而MIN细胞的机率极低甚至检测不到. 同时CIN的存在促使细胞迅速获得导致肿瘤形成的关键遗传改变, 如肿瘤抑制基因的杂合性丢失(loss of heterozygosity, LOH)和/或癌基因的有效扩增[27]. 在酵母细胞的研究中已经发现, 有100多种基因的突变可以导致CIN, 这些基因主要涉及染色体代谢、纺锤体形成、细胞周期调节和有丝分裂控制有关, 但在人类肿瘤细胞只有少数基因如hBUB1, BRCA1和hMAD2被证实与CIN有关[28].
人类Cyclin E蛋白是1991年后发现的与细胞周期密切相关的蛋白, 他的表达在细胞周期不同时相差异很大, 在G1晚期和临近S期表达达到高峰, 当细胞进入分裂期后, Cyclin E蛋白被迅速降解, 因此Cyclin E的关键功能是调节细胞周期从G1期进入S期, 即DNA合成期[29]. 实验证实, Cyclin E的表达异常与多种恶性肿瘤的形成相关, 在这些恶性肿瘤中Cyclin E基因明显扩增并使Cyclin E蛋白在细胞周期的各个时相都高表达[30-31]; 在转基因鼠的乳腺组织中过表达Cyclin E可明显导致相关组织的增生和肿瘤形成[32].
本实验研究Cyclin E蛋白的过表达是否导致结肠癌细胞CIN的发生. DLD1细胞系是具有二倍体染色体数目的、染色体稳定的人类结肠癌细胞系, 我们用四环素控制的稳定诱导Cyclin E表达的系统, 在DLD1细胞中稳定过表达Cyclin E蛋白2 wk, 结果发现Cyclin E蛋白的稳定过表达可以导致DLD1细胞异常染色体的出现(即微核的形成), 并且随着表达时间的延长, 发生CIN细胞的百分比明显增加. 由于这种CIN细胞必然存在调节细胞生长和分化关键基因的缺失或功能改变, 因而可以促使细胞的恶性转化. 我们认为Cyclin E可以导致结肠癌细胞的CIN, 并维持这些CIN的细胞克隆能够随着细胞分裂周期的增加而增加. 由于Cyclin E是控制细胞周期从G1期向S期转移的关键蛋白, 在多种人类肿瘤中发现有Cyclin E的高表达, 因此一些研究认为, Cyclin E是与细胞恶性增生相关的癌基因. 但是, 在人类结直肠癌中, 没有发现Cyclin E基因拷贝数的增加, 也只有约30%的患者存在Cyclin E蛋白的表达或活性增加, 但Cyclin E蛋白表达的增加与患者的肿瘤分级和预后无关. 我们推论Cyclin E虽然不能评估结直肠癌的预后, 但他可能是结直肠癌发生早期事件中的重要因素, 他是人类结直肠癌CIN形成的关键基因之一[33].
人类结直肠癌是常见的恶性肿瘤, 其发病率在逐年增加. 研究显示85%的结直肠癌存在异常的染色体数目, 即非整倍体的染色体数目(aneuploidy), 而对形成这种染色体不稳定(CIN)的分子机制尚不清楚. 在人类仅有数种相关的癌基因和/或抑癌基因被证实与CIN相关.
本研究初步发现 细胞周期调控蛋白cyclin E的表达失调与人类结直肠癌CIN相关, 这对深入研究人类结直肠癌发病的分子机制并提高患者术后药物治疗的敏感性具有重要的临床意义和社会价值.
电编:李琪 编辑:潘伯荣
| 1. | Kashida H, Kudo SE. Early colorectal cancer: concept, diagnosis, and management. Int J Clin Oncol. 2006;11:1-8. [PubMed] [DOI] |
| 2. | Wang WS, Chen PM, Su Y. Colorectal carcinoma: from tumorigenesis to treatment. Cell Mol Life Sci. 2006;63:663-671. [PubMed] [DOI] |
| 3. | Hung KE, Chung DC. Colorectal cancer screening: today and tomorrow. South Med J. 2006;99:240-246; quiz 247-249. [PubMed] [DOI] |
| 4. | Kiesslich R, Hoffman A, Neurath MF. Colonoscopy, tumors, and inflammatory bowel disease - new diagnostic methods. Endoscopy. 2006;38:5-10. [PubMed] [DOI] |
| 5. | Harford WV. Colorectal cancer screening and surveillance. Surg Oncol Clin N Am. 2006;15:1-20. [PubMed] [DOI] |
| 6. | Jeter JM, Kohlmann W, Gruber SB. Genetics of colorectal cancer. Oncology (Williston Park). 2006;20:269-276; discussion 285-286, 288-289. [PubMed] |
| 7. | Vanhoefer U. Molecular mechanisms and targeting of colorectal cancer. Semin Oncol. 2005;32:7-10. [PubMed] [DOI] |
| 8. | Anthony T. Colorectal cancer follow-up in 2005. Surg Oncol Clin N Am. 2006;15:175-193. [PubMed] [DOI] |
| 9. | Kehoe J, Khatri VP. Staging and prognosis of colon cancer. Surg Oncol Clin N Am. 2006;15:129-146. [PubMed] [DOI] |
| 10. | Norppa H. Cytogenetic biomarkers and genetic polymorphisms. Toxicol Lett. 2004;149:309-334. [PubMed] [DOI] |
| 11. | Hagmar L, Stromberg U, Tinnerberg H, Mikoczy Z. Epidemiological evaluation of cytogenetic biomarkers as potential surrogate end-points for cancer. IARC Sci Publ. 2004;207-215. [PubMed] |
| 12. | Neri M, Fucic A, Knudsen LE, Lando C, Merlo F, Bonassi S. Micronuclei frequency in children exposed to environmental mutagens: a review. Mutat Res. 2003;544:243-254. [PubMed] [DOI] |
| 13. | Hall EJ, Hei TK. Genomic instability and bystander effects induced by high-LET radiation. Oncogene. 2003;22:7034-7042. [PubMed] [DOI] |
| 14. | Pihan GA, Doxsey SJ. The mitotic machinery as a source of genetic instability in cancer. Semin Cancer Biol. 1999;9:289-302. [PubMed] [DOI] |
| 16. | Rajagopalan H, Nowak MA, Vogelstein B, Lengauer C. The significance of unstable chromosomes in colorectal cancer. Nat Rev Cancer. 2003;3:695-701. [PubMed] [DOI] |
| 17. | Gagos S, Irminger-Finger I. Chromosome instability in neoplasia: chaotic roots to continuous growth. Int J Biochem Cell Biol. 2005;37:1014-1033. [PubMed] [DOI] |
| 18. | Kops GJ, Weaver BA, Cleveland DW. On the road to cancer: aneuploidy and the mitotic checkpoint. Nat Rev Cancer. 2005;5:773-785. [PubMed] [DOI] |
| 19. | Bharadwaj R, Yu H. The spindle checkpoint, aneuploidy, and cancer. Oncogene. 2004;23:2016-2027. [PubMed] [DOI] |
| 20. | Lengauer C, Kinzler KW, Vogelstein B. Genetic instability in colorectal cancers. Nature. 1997;386:623-627. [PubMed] [DOI] |
| 21. | Soreide K, Janssen EA, Soiland H, Korner H, Baak JP. Microsatellite instability in colorectal cancer. Br J Surg. 2006;93:395-406. [PubMed] [DOI] |
| 22. | Oda S, Maehara Y, Ikeda Y, Oki E, Egashira A, Okamura Y, Takahashi I, Kakeji Y, Sumiyoshi Y, Miyashita K. Two modes of microsatellite instability in human cancer: differential connection of defective DNA mismatch repair to dinucleotide repeat instability. Nucleic Acids Res. 2005;33:1628-1636. [PubMed] [DOI] |
| 23. | Duesberg P, Rausch C, Rasnick D, Hehlmann R. Genetic instability of cancer cells is proportional to their degree of aneuploidy. Proc Natl Acad Sci USA. 1998;95:13692-13697. [PubMed] [DOI] |
| 24. | Rajagopalan H, Lengauer C. CIN-ful cancers. Cancer Chemother Pharmacol. 2004;54 Suppl 1:S65-S68. [PubMed] [DOI] |
| 26. | Dunican DS, McWilliam P, Tighe O, Parle-McDermott A, Croke DT. Gene expression differences between the microsatellite instability (MIN) and chromosomal instability (CIN) phenotypes in colorectal cancer revealed by high-density cDNA array hybridization. Oncogene. 2002;21:3253-3257. [PubMed] [DOI] |
| 27. | Rajagopalan H, Jallepalli PV, Rago C, Velculescu VE, Kinzler KW, Vogelstein B, Lengauer C. Inactivation of hCDC4 can cause chromosomal instability. Nature. 2004;428:77-81. [PubMed] [DOI] |
| 28. | Burds AA, Lutum AS, Sorger PK. Generating chromosome instability through the simultaneous deletion of Mad2 and p53. Proc Natl Acad Sci USA. 2005;102:11296-11301. [PubMed] [DOI] |
| 29. | Hwang HC, Clurman BE. Cyclin E in normal and neoplastic cell cycles. Oncogene. 2005;24:2776-2786. [PubMed] [DOI] |
| 30. | Hubalek MM, Widschwendter A, Erdel M, Gschwendtner A, Fiegl HM, Muller HM, Goebel G, Mueller-Holzner E, Marth C, Spruck CH. Cyclin E dysregulation and chromosomal instability in endometrial cancer. Oncogene. 2004;23:4187-4192. [PubMed] [DOI] |
| 31. | Lindahl T, Landberg G, Ahlgren J, Nordgren H, Norberg T, Klaar S, Holmberg L, Bergh J. Overexpression of cyclin E protein is associated with specific mutation types in the p53 gene and poor survival in human breast cancer. Carcinogenesis. 2004;25:375-380. [PubMed] [DOI] |
| 32. | Loeb KR, Kostner H, Firpo E, Norwood T, D Tsuchiya K, Clurman BE, Roberts JM. A mouse model for cyclin E-dependent genetic instability and tumorigenesis. Cancer Cell. 2005;8:35-47. [PubMed] [DOI] |
| 33. | Simone C, Resta N, Bagella L, Giordano A, Guanti G. Cyclin E and chromosome instability in colorectal cancer cell lines. Mol Pathol. 2002;55:200-203. [PubMed] [DOI] |