修回日期: 2006-06-10
接受日期: 2006-06-14
在线出版日期: 2006-08-08
目的: 观察双侧基底内侧杏仁核(BMA)内注射胃动素对大鼠胃运动的影响, 并探讨胃动素作用的神经传导通路化测定等方法探讨胃动素作用的神经传导通路.
方法: 选用成年♂Wistar大鼠40只, 进行实验1: 双侧BMA注射胃动素(MT, 1 mg/侧)或生理盐水(NS, 0.5 mL/侧), 通过胃内球囊-压力换能器-二道生理记录仪观察胃内压(IGP)和胃运动频率(GMF)的改变(n = 14); 实验2: 膈下迷走神经切断后重复实验1(n = 12); 实验3: BMA注射MT或NS后60 min, 采用免疫荧光法观察下丘脑室旁核(PVN)c-Fos蛋白表达(n = 7); 实验4: 放射免疫法测定正常大鼠各脑区胃动素含量(n = 7).
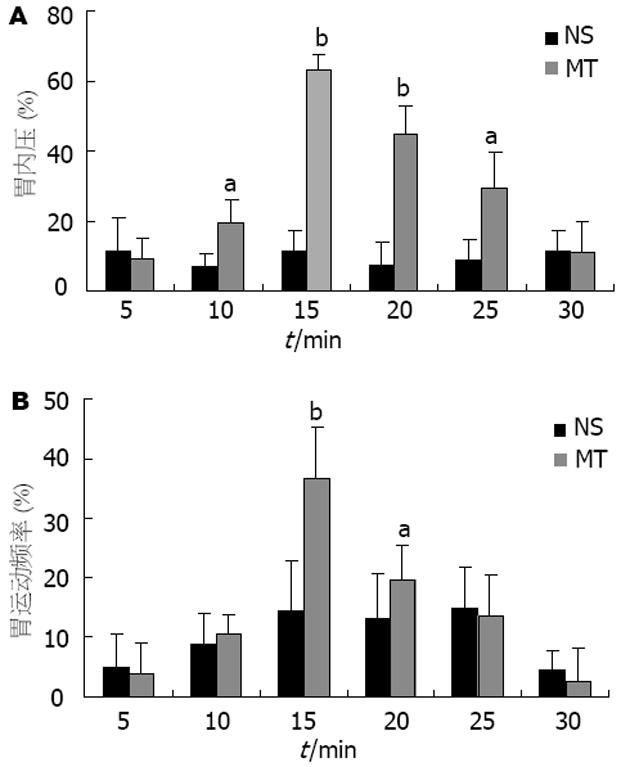
结果: 双侧BMA注射胃动素后, 大鼠胃运动明显加强, 给药10, 15, 20, 25 min后, IGP变化百分率分别为 19.7%±6.5%(P = 0.023), 62.9%±4.7%(P<0.01), 45.1%±7.9%(P<0.01), 29.3%±10.3%(P = 0.029). GMF在给药后15和20 min明显增加, 其变化百分率分别为36.7%±8.5%(P<0.01)和19.5%±6.0%(P = 0.015). 双侧BMA注射NS后IGP和GMF均未见明显改变. 大鼠行膈下迷走神经切断后重复实验1, 可观察到胃动素促进胃运动的效应完全被阻断(P>0.05). 双侧BMA注射MT后, PVN内c-Fos阳性细胞数较NS对照组明显增多(53.4±8.9 vs 22.5±5.2, P<0.01), c-Fos蛋白表达增强. 正常大鼠下丘脑胃动素含量较高(74.3±19.6 mg/kg), 其他脑区内胃动素含量为7.8±2.2→17.3±6.6 mg/kg.
结论: 基底内侧杏仁核外源性胃动素可加强大鼠胃运动, 该效应可能通过杏仁核-下丘脑和脑干-迷走神经通路来完成.
引文著录: 韩晓华, 徐珞, 陶尚敏. 杏仁核外源性胃动素对大鼠胃运动的调节作用及机制. 世界华人消化杂志 2006; 14(22): 2159-2163
Revised: June 10, 2006
Accepted: June 14, 2006
Published online: August 8, 2006
AIM: To investigate the effect of motilin microinjection into bilateral basomedial amygdaloid nucleus (BMA) on the gastric motility in rats, and explore its underlying mechanism.
METHODS: Forty male Wistar rats were used for four sets of experiments (Exp). Exp 1: Animals received bilateral injections of motilin (MT, 1 mg/side) or normal saline (NS, 0.5 mL/side) into BMA, and both intragastric pressure (IGP) and gastric motility frequency (GMF) were recorded to estimate the gastric motility (n = 14). Exp 2: Pretreatment of vagotomy was carried out in 12 rats, and then MT or NS was injected into BMA as in Exp1. Exp3: Sixty minutes after MT or NS injection into BMA, c-Fos protein expression was detected in the paraventricular nucleus (PVA, n = 7). Exp 4: Motilin contents were measured in five brain areas (hypothalamus, midbrain, pons, medulla, and pituitary gland), using radioimmunoassay (RIA) method (n = 7).
RESULTS: Exogenous motilin in BMA enhanced the gastric motility in rats, and this action lasted about 15 min. At the 10th, 15th, 20th, 25th min after motilin injection, the changes of IGP percentage were 19.7% ± 6.5%(P = 0.023), 62.9% ± 4.7% (P < 0.01), 45.1% ± 7.9% (P < 0.01), 29.3% ± 10.3% (P = 0.029). The changes of GMF percentage at the 15th, 20th min were 36.7% ± 8.5% (P < 0.01) and 19.5% ± 6.0% (P = 0.015), respectively. No obvious changes in both IGP and GMF were observed in normal saline controls. Pretreatment of subdiaphragmal vagotomy abolished the enhanced gastric motility induced by motilin injection. Motilin injection into bilateral BMA induced increased numbers of c-Fos positive cells in PVN, as compared with the saline control (53.4 ± 8.9 vs 22.5 ± 5.2, P < 0.01). Among the five tested brain areas, the highest motilin level was found in the hypothalamus area (74.3 ± 19.6 mg/kg). The motilin contents in the other four areas ranged from 7.8 ± 2.2 mg/kg to 17.3 ± 6.6 mg/kg.
CONCLUSION: Exogenous motilin in BMA can enhance the gastric motility in rats, which might rely on the amygdala-hypothalamus and brain stem-vagus pathway.
- Citation: Han XH, Xu L, Tao SM. Effect of exogenous motilin in amygdaloid nucleus on gastric motility and its underlying mechanism in rats. Shijie Huaren Xiaohua Zazhi 2006; 14(22): 2159-2163
- URL: https://www.wjgnet.com/1009-3079/full/v14/i22/2159.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i22.2159
胃动素(MT)是由胃肠黏膜分泌的含22个氨基酸的多肽, 在外周可促进胃肠平滑肌收缩, 消化间期呈周期性释放, 诱发胃肠道移行性复合运动Ⅲ相的出现[1-2]. 除消化道外, MT免疫阳性细胞及其受体还存在于垂体、下丘脑、大脑皮层、小脑及松果体中[3-5]. 现已证实, 外源性胃动素在海马、下丘脑和延髓均明显促进大鼠胃运动[6-9]. 因此, MT也是参与胃肠运动调节的脑-肠肽之一. 杏仁核是边缘系统中重要的皮层下核团, 不仅参与情绪反应、学习记忆、生殖行为等复杂行为的整合, 对心血管、胃肠道和呼吸等内脏活动也具有明显的调节作用[10-11]. 采用放射自显影技术及免疫组化方法均发现, 杏仁核内存在大量的胃动素免疫阳性细胞及其受体[4,12]. 根据以往研究, 我们观察了基底内侧杏仁核(BMA)注射MT对大鼠胃运动的影响, 并采用膈下迷走神经切断、免疫组化等方法对胃动素的作用机制作进一步探讨.
选用健康♂Wistar大鼠40只, 体质量200-250 g, 由青岛市药检所提供. MT和抗MT兔血清为美国Sigma公司产品; c-Fos多克隆抗体为美国Chemicon international公司产品; 异硫氰酸荧光素(FITC)交联的山羊抗兔IgG系美国Jackson ImmunoResearch公司产品; MT放射免疫试剂盒由上海第二军医大学提供. SN-3型脑立体定位仪系日本成茂科学仪器研究所产品; 3066-23型台式生理记录仪为成都精密仪器厂产品; 激光共聚焦显微镜系日本Olympus公司产品; Leica-1401型冰冻切片机系德国Leica公司产品.
实验前所有大鼠禁食16 h, 随机分组进行实验. 实验1: 双侧BMA注射MT, (1 μg/侧, n = 7)或生理盐水(NS, 0.5 μL/侧, n = 7), 通过胃内球囊-压力换能器-二道生理记录仪观察胃内压(IGP)和胃运动频率(GMF)的改变; 实验2: 膈下迷走神经切断后重复实验1(n = 12); 实验3: BMA注射胃动素(n = 4)或生理盐水(n = 3)60 min后, 采用免疫荧光法观察下丘脑室旁核(PVN)c-Fos蛋白表达; 实验4: 放射免疫法测定正常大鼠各脑区(下丘脑、中脑、脑桥、延髓、垂体)胃动素含量(n = 7)
1.2.1 核团微量注射及胃运动观察: 大鼠用200 g/L乌拉坦(1 g/kg, ip)麻醉后作头部正中切口, 参照Paxinos-Watson大鼠脑图谱[13]将自制不锈钢套管插入双侧BMA(前囱后2.8 mm, 旁开4.5 mm, Â骨表面下9.0 mm), 以502胶和牙脱水固定套管. 用微量注射器向双侧BMA注射MT(1 μg/侧)或NS(0.5 μL/侧), 1 min内匀速注入. 实验结束后, 经心脏以生理盐水及甲醛灌流脑部, 快速断头取脑. 40 g/L福尔马林内浸泡2 d后作50 μm系列冠状切片, 观察脑片套管轨迹, 定位不准确者弃去. 头部手术后作上腹部正中切口, 沿胃大弯上部作长1 cm切口, 置水囊于胃窦部, 荷包缝合, 囊内注水3 mL维持基础压力. 水囊与压力换能器相连, 信号输入二道生理记录仪记录IGP和GMF变化[14]. 取给药前单位时间(以每5 min作为一个时段)IGP或GMF作为基础值, 给药后单位时间的IGP或GMF作为效应值, 计算各自的变化百分率, 即单位时间内IGP或GMF变化百分率(%) = [(效应值-基础值)/基础值]×100%. 另外12只大鼠行膈下迷走神经切断术[15], 在靠近胃贲门部的食管周围分离膈下迷走神经的腹侧支和背侧支, 结扎剪断, 术后30 min分别向双侧BMA注射MT(1 μg/侧)或NS (0.5 μL/侧), 观察胃运动变化.
1.2.2 PVN c-Fos表达: 双侧BMA分别注射MT (1 μg/侧)或NS (0.5 μL /侧)后60 min, 以生理盐水和40 g/L多聚甲醛经心脏灌注固定, 断头取脑, 后固定2 h, 梯度蔗糖浸泡过夜, 待组织块沉底后行脑冠状连续冰冻切片, 片厚为20 μm. 脑片在含有40 mL/L正常羊血清. 5 mL/L Triton X-100的0.1 mol/L PBS溶液中孵育2 h, 将兔抗c-Fos多克隆抗体(1∶200) 滴加到切片上, 4℃孵育40 h, 用0.01 mol/L PBS 漂洗3次, 每次5 min, 加入二抗羊抗兔FITC-IgG (1∶500), 避光孵育2 h后以0.01 mol/L PBS冲洗, 甘油/PBS封片剂封片, 激光共聚焦显微镜下观察c-Fos免疫阳性细胞(绿色荧光). 各组脑片均在同一水平每隔3张取1, 每组均取6张, 每张切片在阳性细胞最密集处取4个互不重叠的高倍视野(×400)计数, 取平均值作为该切片的阳性细胞数[16].
1.2.3 脑内胃动素的放射免疫测定: 脑区内胃动素的提取和放免检测按说明书进行操作. 首先配制胃动素标准液(将胃动素标准品用PBS缓冲液稀释成每100 μL分别含胃动素2.5, 5, 10, 20, 40, 80, 160, 320, 640, 1280 pg. 胃动素抗血清用PBS稀释至1∶8000. 正常大鼠迅速断头取脑, 将脑和垂体置于煮沸的生理盐水中分别煮5 min和3 min, 吸干分离脑区并称重, 加0.5 mol/L盐酸1.0 mL制成匀浆, 室温下静置100 min. 然后加1 mol/L氢氧化钠1 mL中和, 4000 r/min离心20 min, 取上清液测定. 测定程序: 各管加125I-胃动素100 μL, 抗MT血清100 μL. 样品管加100 μL(下丘脑)或300 μL(其他脑区)上清液, 标准管加胃动素标准品100 μL, 最后以磷酸缓冲液补足至总反应体积500 μL; 4℃冰箱内孵育24 h; 各管加1∶3羊抗兔血清100 μL, 继续孵育24 h, 4000 r/min离心20 min, 弃上清液. 测沉淀物的cpm, 根据同批测定管的MT标准曲线, 求每克组织中胃动素含量.
统计学处理 数据均用均数±标准差(mean±SD)表示. 两样本均数的比较用t检验, P<0.05为差异有统计学意义.
双侧BMA注射MT 10 min后, 可观察到大鼠胃运动明显加强, 持续约15 min逐渐恢复. 给药后10, 15, 20, 25 min, IGP变化百分率分别为19.7%±6.5%(P = 0.023), 62.9%±4.7%(P<0.01), 45.1%±7.9%(P<0.01), 29.3%±10.3%(P = 0.029, 图1A); GMF在给药后15 min和20 min明显增加, 其变化百分率为36.7%±8.5%(P<0.01)和19.5%±6.0%(P = 0.015, 图1B). 双侧BMA注射NS后, IGP和GMF均未见明显改变(图1A-B).
大鼠行膈下迷走神经切断后重复2.1, 可观察到MT的效应完全被阻断, 给药前后单位时间内IGP和GMF的变化百分率无明显差异(图2A-B).
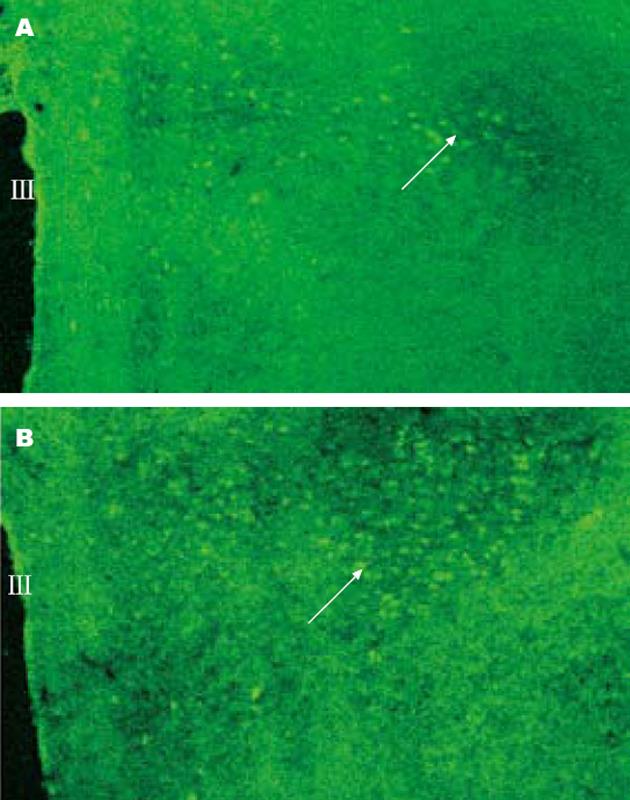
c-Fos蛋白免疫反应物质呈黄绿色颗粒, 存在于PVN神经元核中. 双侧BMA注射MT后, 可见PVN内c-Fos阳性细胞数较生理盐水对照组明显增多(53.4±8.9 vs 22.5±5.2, P<0.01), c-Fos蛋白表达增强(图3A-B).
正常大鼠各脑区内MT含量有很大差异, 其中以下丘脑MT含量最高(74.3±19.6 mg/kg), 中脑、脑桥、延髓及垂体含量分别为8.7±2.3, 7.8±2.2, 17.3±6.6, 11.4±1.3 mg/kg.
近年来的研究表明, MT是体内调节胃肠运动的最重要的脑-肠肽之一, 其中枢作用部位包括下丘脑(外侧区、腹内侧核、室旁核)、海马、延髓迷走背核复合体等[6-9]. 脑内MT免疫阳性细胞及其受体分布非常广泛, 包括垂体、下丘脑、大脑皮层、小脑及松果体等处[3-5]. MT在大鼠脑内的分布和其他神经肽不同, 以小脑的MT浓度最高, 在下丘脑内侧基底部和正中隆起有中等浓度的MT分布[4]. 我们利用放射免疫法对各脑区MT含量进行测定, 发现下丘脑含量明显高于低位脑干, 该结果同以往的研究相吻合.
杏仁核是边缘系统中重要的皮层下核团, 由多个解剖和功能不同的核团组成, 主要分为皮质内侧核群与基底外侧核群, 以及前杏仁区、皮质移行区2个大过渡区. 杏仁核与脑干、丘脑、下丘脑及皮层感觉区等存在广泛的纤维联系[10,17-18], 使杏仁核涉及机体许多重要生理功能的调节机制, 包括对摄食行为[19-20]和胃肠运动的调节[11-12]. 运用放射性自显影及免疫组化等方法证明, 杏仁核也有丰富的MT免疫反应阳性细胞及其受体分布[4,12], 因此, 杏仁核很可能是MT调控胃肠运动的中枢部位之一. 我们向双侧BMA注射外源性胃动素后, 大鼠胃运动明显加强, 验证了以上的假说.
PVN是下丘脑的一个异质性核团, 既具有神经内分泌功能, 又参与对植物神经活动的调控, 是神经体液调节的关键性部位[21-23]. PVN接受来自海马、隔核、蓝斑及孤束核发出的内脏传入纤维, 发出的纤维至下丘脑的大部分核团, 上行纤维至隔核及杏仁核; 下行纤维至孤束核、疑核等[21,23], 因此他常被认为是内脏信息的重要转换站. 我们通过观察胃动素注射后PVN c-Fos蛋白的表达, 以及膈下迷走神经切断对胃动素效应的影响, 进一步探讨了胃动素作用可能的神经传导通路.
c-Fos原癌基因是即早基因家族中的一员,可被多种刺激诱导而快速表达, 其表达产物c-Fos蛋白被迅速转运到胞核内, 与Jun蛋白结合形成Fos-Jun异二聚复合体, 发挥对靶基因的调控作用[24-26]. 检测神经细胞核内c-Fos蛋白表达可以从单细胞水平上观察神经元的活动情况, 从而得以追踪生理或药理刺激发挥作用的神经传导通路[26]. 我们发现, 杏仁核注射MT后可诱导PVN c-Fos蛋白的表达增强, 提示杏仁核和下丘脑室旁核之间具有密切的功能联系. Wu et al[16]的研究发现, 侧脑室注射MT后, PVN及视上核c-Fos表达增加, 但下丘脑其他区域及海马等c-Fos表达无明显变化. 该实验结果提示PVN可能是中枢胃动素调节胃肠运动的重要中继站之一. 各级脑中枢对胃运动的调节是通过交感神经和迷走神经传出纤维实现的. 支配胃的交感神经对胃运动一般起抑制作用. 迷走神经节前纤维起源于迷走背核, 到达胃肌间的神经节换元后, 其节后纤维支配胃平滑肌, 大部分节后纤维末释放乙酰胆碱, 通过M受体加强胃运动[15]. 我们切断膈下迷走神经后再向杏仁核注射MT, MT的效应完全被阻断, 表明该效应需要迷走神经的参与.
总之, 杏仁核外源性MT可促进大鼠的胃运动. MT作用的可能机制是: 外源性MT首先与杏仁核中MT受体结合, 通过受体后的信号传导激活下丘脑及低位脑干, 最后经过迷走神经将神经冲动传至胃平滑肌, 调节大鼠胃运动
胃动素对胃肠运动的调控是目前研究的热点之一,其外周促进胃肠运动的作用已经有大量报道. 近年来, 本实验室运用电生理、免疫组织化学等多种方法对胃动素的中枢作用做了系列研究. 杏仁核是参与胃肠道等内脏活动整合的重要的皮层下核团, 该部位存在大量的胃动素免疫阳性细胞及其受体, 提示杏仁核外源性胃动素可能参与对胃肠运动的调节.
目前胃动素的中枢作用机制仍有很多尚未阐明的问题. 例如其中枢作用的部位, 核团间的相互关系, 信号传导通路等. 另外, 由于胃肠动力障碍是临床上最常见的疾病之一,胃动素拟似剂的研究具有巨大的应用价值, 是目前胃动素研究领域的热点.
本文主要对杏仁核内胃动素调节胃运动的神经传导通路进行研究.除常用的胃运动记录及迷走神经切断外, 还采用c-Fos免疫组化方法在细胞水平进行研究.
本研究将为胃动素及其拟似剂对胃肠动力障碍性疾病的治疗提供有价值的实验依据.
本文提出的胃动素通过杏仁核-下丘脑-脑干迷走神经通路调节胃运动的结论具有一定的创新性.
电编:李琪 编辑:潘伯荣
| 1. | Tack J. Georges Brohee Prize 1994. Motilin and the enteric nervous system in the control of interdigestive and postprandial gastric motility. Acta Gastroenterol Belg. 1995;58:21-30. [PubMed] |
| 2. | Galligan JJ, Vanner S. Basic and clinical pharmacology of new motility promoting agents. Neurogastroenterol Motil. 2005;17:643-653. [PubMed] [DOI] |
| 3. | Jacobowitz DM, O'Donohue TL, Chey WY, Chang TM. Mapping of motilin-immunoreactive neurons of the rat brain. Peptides. 1981;2:479-487. [PubMed] [DOI] |
| 4. | Depoortere I, Van Assche G, Peeters TL. Distribution and subcellular localization of motilin binding sites in the rabbit brain. Brain Res. 1997;777:103-109. [PubMed] |
| 5. | Depoortere I. Motilin and motilin receptors: characterization and functional significance. Verh K Acad Geneeskd Belg. 2001;63:511-529. [PubMed] |
| 9. | Guan Y, Tang M, Jiang Z, Peeters TL. Excitatory effects of motilin in the hippocampus on gastric motility in rats. Brain Res. 2003;984:33-41. [DOI] |
| 10. | 李 涛, 李 铨德. 杏仁核簇功能性解剖的研究现状. 立体定位和功能性神经外科杂志. 2002;15:180-183. |
| 11. | Lyubashina OA. Possible mechanisms of involvement of the amygdaloid complex in the control of gastric motor function. Neurosci Behav Physiol. 2004;34:379-388. [PubMed] [DOI] |
| 13. | Paxinos G and Watson C. The rat brain in stereotaxic coordinates. London: Academic Press 1982; . |
| 16. | Wu M, Tang M, Adriaensen D, Depoortere I, Peeters TL, Timmermans JP. Central, but not peripheral application of motilin increases c-Fos expression in hypothalamic nuclei in the rat brain. Histochem Cell Biol. 2005;123:139-145. [PubMed] [DOI] |
| 17. | Moreno N, Gonzalez A. The common organization of the amygdaloid complex in tetrapods: new concepts based on developmental, hodological and neurochemical data in anuran amphibians. Prog Neurobiol. 2006;78:61-90. [PubMed] [DOI] |
| 18. | Akmaev IG, Kalimullina LB, Sharipova LA. The central nucleus of the amygdaloid body of the brain: cytoarchitectonics, neuronal organization, connections. Neurosci Behav Physiol. 2004;34:603-610. [PubMed] [DOI] |
| 19. | Grundmann SJ, Pankey EA, Cook MM, Wood AL, Rollins BL, King BM. Combination unilateral amygdaloid and ventromedial hypothalamic lesions: evidence for a feeding pathway. Am J Physiol Regul Integr Comp Physiol. 2005;288:R702-R707. [PubMed] [DOI] |
| 20. | Fekete E, Vigh J, Bagi EE, Lenard L. Gastrin-releasing peptide microinjected into the amygdala inhibits feeding. Brain Res. 2002;955:55-63. [PubMed] [DOI] |
| 21. | Coote JH. A role for the paraventricular nucleus of the hypothalamus in the autonomic control of heart and kidney. Exp Physiol. 2005;90:169-173. [PubMed] [DOI] |
| 22. | Spinazzi R, Andreis PG, Rossi GP, Nussdorfer GG. Orexins in the regulation of the hypothalamic-pituitary-adrenal axis. Pharmacol Rev. 2006;58:46-57. [PubMed] [DOI] |
| 25. | Wagner EF, Eferl R. Fos/AP-1 proteins in bone and the immune system. Immunol Rev. 2005;208:126-140. [PubMed] [DOI] |
| 26. | Herrera DG, Robertson HA. Activation of c-fos in the brain. Prog Neurobiol. 1996;50:83-107. [PubMed] [DOI] |