修回日期: 2006-03-01
接受日期: 2006-03-18
在线出版日期: 2006-04-28
目的: 探讨乳凝集素调节肠相关淋巴组织淋巴细胞分泌表达细胞因子的作用.
方法: 应用基因重组技术从MCF-7乳腺癌细胞中提取总RNA, 通过逆转录PCR方法得到目的基因(乳凝集素)片段, 利用酶切, 连接等技术, 将目的基因构建至PET28载体内, 转化入DH5α细胞后, 鉴定阳性质粒; 将含有目的基因的阳性质粒转化入表达细胞BL-21, IPTG诱导表达目的蛋白乳凝集素, 应用特异性镍鏊合的亲和层析柱得到纯化的目的蛋白. 利用H3-Tdr法明确乳凝集素剂量与人类肠上皮内淋巴细胞株EEI-10细胞增殖之间的关系. 给予适当剂量乳凝集素作用于EEI-10细胞后, 利用ELISA方法检测EEI-10分泌IL-2, IL-4及IFN-γ浓度, 应用RT-PCR方法检测IL-2, IL-4及IFN-γ mRNA表达.
结果: 酶切阳性的质粒经测序证实与基因文库一致. 所得纯化的目的蛋白进行SDS-PAGE电泳和特异性抗体鉴定, 明确为目的蛋白乳凝集素. 利用H3-Tdr法检测乳凝集素剂量与细胞增殖之间的关系, 结果显示乳凝集素作用剂量为250 mg/L时淋巴细胞增殖显著. 给予乳凝集素处理后细胞培养上清中IL-2(P = 0.0394)和IFN-γ(P = 0.0082)的含量高于未处理细胞组, 而IL-4没有显著的增高; 同时处理后IL-2 mRNA表达量升高, IL-4 mRNA表达量无显著性改变, IFN-γ mRNA表达量明显增高并高于PHA刺激组.
结论: 乳凝集素具有上调EEI-10细胞分泌和表达IL-2和IFN-γ的作用.
引文著录: 何振娟, 裴新红, 朱建幸, 杨凌云, 吴圣楣. 乳凝集素调节EEI-10细胞IL-2, IL-4及IFN-γ的分泌表达. 世界华人消化杂志 2006; 14(12): 1151-1155
Revised: March 1, 2006
Accepted: March 18, 2006
Published online: April 28, 2006
AIM: To define the function that lactadherin adjusts lymphocytes of gut-associated lymphoid tissue (GALT) cytokines secretion and expression.
METHODS: We extracted mRNA from human mammary cancer MCF-7 cells, and amplified the target gene from cDNA. The lactadherin was cloned into PET28 vector by digestion, ligation then transformation into DH5α cells to check positive clones. The cDNA encoding the desired polypeptide was transformed into BL-21 cells. The expression of recombinant protein was induced by isopropyl-β-D-thiogalactopyranoside (IPTG). The protein was purified with a nickel column. We detected the proliferation of EEI-10 cells after treated by different concentration of lactadherin using H3-Tdr assay. Then we checked the secretion of IL-2, IL-4 and IFN-g in treated EEI-10 cells using enzyme-linked immunosorbent assay (ELISA) and the cytokines mRNA expression using reverse transcription polymerase chain reaction (RT-PCR).
RESULTS: Lactadherin protein was successfully obtained and confirmed by SDS-PAGE electrophoresis and specific antibody verification. When treated with 250 mg/L lactadherin, EEI-10 cells showed a significant increase in proliferation. The levels of IL-2 and IFN-γ secretion enhanced significantly in the cells with lactadherin functional peptide in comparison with those in the untreated cells (P = 0.0394, P = 0.0082, respectively), but IL-4 secretion had no marked change. The expression of IL-2 and IFN-γ mRNA, especially IFN-γ mRNA, were also higher in the lactadherin-treated cells than those in the untreated cells.
CONCLUSION: Lactadherin can up-regulated the secretion and expression of IL-2 and IFN-γ in EEI-10 cells.
- Citation: He ZJ, Pei XH, Zhu JX, Yang LY, Wu SM. Lactadherin adjusts secretion and expression of interleukin-2, interleukin-4 and interferon-γ in EEI-10 cells. Shijie Huaren Xiaohua Zazhi 2006; 14(12): 1151-1155
- URL: https://www.wjgnet.com/1009-3079/full/v14/i12/1151.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i12.1151
近年来研究发现, 母乳喂养儿的腹泻病发病率较人工喂养儿低, 同时母乳喂养儿在轮状病毒感染后腹泻症状轻于人工喂养儿[1-5]. 乳凝集素(lactadherin)是母乳中与轮状病毒交联最强和抗病毒特异性最高的成分[6-12], 但其对淋巴细胞所产生的作用和随后引发的肠道保护性作用的确切机制目前尚不清楚. 我们通过构建重组乳凝集素作用于人类肠上皮内淋巴细胞株, 检测其细胞因子的表达及分泌, 为进一步深入研究乳凝集素的功能奠定基础.
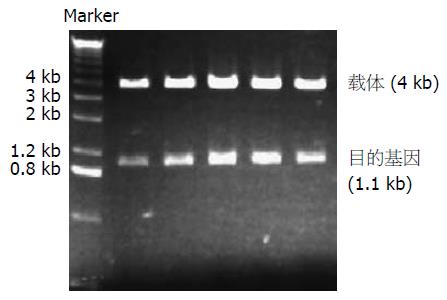
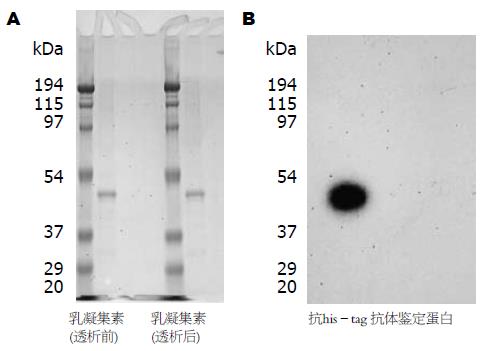
从MCF-7乳腺癌细胞中提取总RNA, 通过逆转录PCR方法得到目的基因(乳凝聚素)片段, 上游引物: 5'-GCGCCATGGGCCTGGATATCTGTTCCAAAAACCCCTGC-3'; 下游引物: 5'-GCGCTCGAGACAGCCCAGCAGCTCCAGGC-3'. 100 ng PCR与50 ng pET-28a(+)载体酶切产物, 经T4连接酶16 ℃连接过夜. 3 μL连接产物转化入50 μL DH5α最高效率转化细胞内, 利用酶切(图1)及DNA序列分析鉴定质粒构建成功. 将构建质粒转化入BL-21细胞中, 挑取单克隆培养于LB培养基中, 加入IPTG(isopropyl β-σ-thiogalactopyranoside)诱导表达4-12 h, 离心7500 r/min, 20 min收集细菌, 利用等渗缓冲液混悬细菌, 并用超声方法破碎细胞, 加入蛋白酶抑制剂(protease inhibitor cocktail set Ⅲ), 保护目的蛋白. 低温超速离心超声后混悬液18000 r/min, 20 min, 取上清与特异性镍螯合的亲和层析柱(Ni-chelating colum)结合, 通过梯度的结合缓冲液(20 mmol/L imidazole, 500 mmol/L NaCl, 20 mmol/L Tris-HCl), 洗柱1次, 冲洗缓冲液(60 mmol/L imidazole, 500 mmol/L NaCl, 20 mmol/L Tris-HCl), 洗柱1次, 洗脱液(200 mmol/L imidazole, 500 mmol/L NaCl, 20 mmol/L Tris-HCl)洗脱, 得到终产物乳凝集素. SDS-PAGE凝胶电泳检测纯化的乳凝集素(图2A), 利用迷你蛋白转膜系统将蛋白转至尼龙膜, 与特异性单克隆抗体(anti-his-tag)反应, Western blot方法鉴定目的蛋白(图2B).
人类肠上皮内淋巴细胞株EEI-10, 培养于完全培养基中, 含有DMEM, 100 mL/L胎牛血清(FBS), 50 kU/L青霉素和50 kU/L链霉素, 10 g/L谷氨酸, 10 g/L丙酮酸钠, 10 g/L HEPES, 37 ℃ 50 mL/L CO2孵育箱中培养. 以每孔2×105(0.2 mL)个EEI-10细胞的密度将细胞种于96孔板, 加入过滤除菌纯化的重组乳凝集素, 分别给予0, 0.01, 0.025, 0.05, 0.1, 0.25, 0.5, 1 g/L, 每一剂量重复3孔, 培养72 h, H3-Tdr测细胞增殖. 得到乳凝集素的有效作用剂量后, 每孔2×105(0.2 mL)个EEI-10细胞种于96孔板, 试验分为PHA(phythohaemagglutinin)1 mg/L作为阳性对照组, 有效剂量乳凝聚素组及空白对照组, 每组重复3孔, 培养条件同上. 培养72 h, 收集细胞及上清分别冻存于-80 ℃及-20 ℃冰箱待用. ELISA方法检测细胞培养上清中细胞因子浓度. 96孔板由羊抗人IL-2, IL-4, IFN-γ mAb 8 mg/L包被过夜, 50 g/L BSA封闭. 加入待测样品继续孵育1 h, 室温. 1×PBS包括1 g/L TWEEN 20洗3次, 加入8 mg/L兔抗人IL-2, IL-4, IFN-γ抗体孵育1 h, 加入辣根过氧化物酶标记的羊-抗兔IgG1抗体80 μg/L. 洗板并加入四甲基联苯胺(3, 3', 5, 5'-tetramethylbenzidine, TMB)100 μL反应15 min, 1 mol/L硫酸终止反应. 检测各孔A450. 冻存细胞, 经Hanks平衡盐溶液洗3次, 1000 r/min, 5 min. 由酚-氯仿抽提总RNA(Chomczynski et al, 1987). RNA由紫外分光光度计260 nm定量, 并进行甲醛凝胶胶体电泳检测RNA的质量. cDNA合成用总RNA 5 μg进行反转录, 总体积为20 μL, 包括1 mmol/L dNTP, 10 mmol/L DTT(dithiothreitol), 50 mmol/L Tris-HCl(pH8.3), 75 mmol/L KCl, 3 mmol/L MgCl2, 1 ng六聚体(hexamer), 50 U核酸酶抑制剂(RNAguard), 200 U逆转录酶. 反应条件为42 ℃, 90 min. PCR反应体系为100 μL, 包括稀释的cDNA 1-10 μL, 10×PCR缓冲液[200 mmol/L Tris-HCl pH8.55, 160 mmol/L(NH4)2SO4, 25 mmol/L MgCl2和1.5 g/L BSA]10 μL, 每条引物浓度为10-5 mmol/L, 3.47 mmol/L dNTPs 1 μL, Taq DNA聚合酶1 μL, 反应条件为95 ℃ 5 min后进入35个循环, 循环条件为95 ℃ 1 min, 61 ℃ 1 min, 72 ℃ 2 min. 最终72 ℃延长10 min. β-actin作为阳性对照用于定量每个样本所加入的cDNA为等量. 各反应设阴性对照, 即未加入IL-2, IL-5及IFN-γ的引物组. 引物: β-actin: 上游引物5'-GACTTCGAGCAAGAGATGGCCAC-3'; 下游引物5'-CAATGCCAGGGTACATGGTGGTG-3' (201 bp). IL-2: 上游引物5'-TGGAGCAGCTGTTGATGGACCTAC-3'; 下游引物5'-AGATGATGCTTTGACAGAAGGCTATC-3'(455 bp). IL-4: 上游引物5'-GAGCCATATCCACGGATGCGACAA-3'; 下游引物5'-CATGGTGGCTCAGTACTACGAGTA-3'(350 bp). IFN-γ: 上游引物5'-CTTCTTCAGCAACAGCAAGGCGAAAA-3'; 下游引物5'-CCCCCAGATACAACCCCGCAATCA-3'(381 bp).
统计学处理 各组间比较采用方差分析检验. 统计学数据通过应用美国STATISTICA 6.0软件获得.
将所构建的质粒进行酶切鉴定阳性质粒(图1); 阳性的重组质粒进行DNA测序分析, 测序的结果与基因文库一致. 乳凝集素表达后, 将所得纯化的目的蛋白进行SDS-PAGE电泳, 部分胶进行染色观察条带, 其分子质量大小位于目的蛋白区域(图2A); 特异性抗体鉴定明确为目的蛋白乳凝集素(图2B).
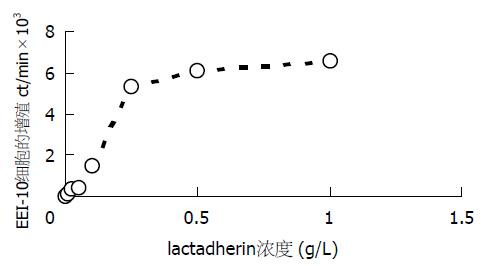
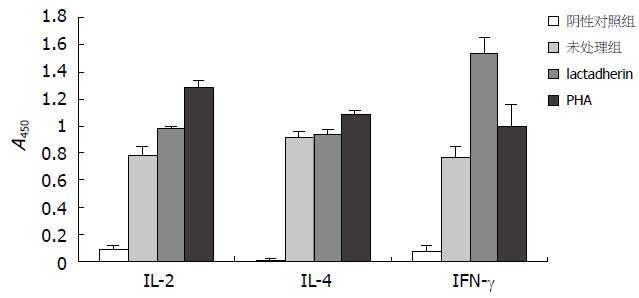
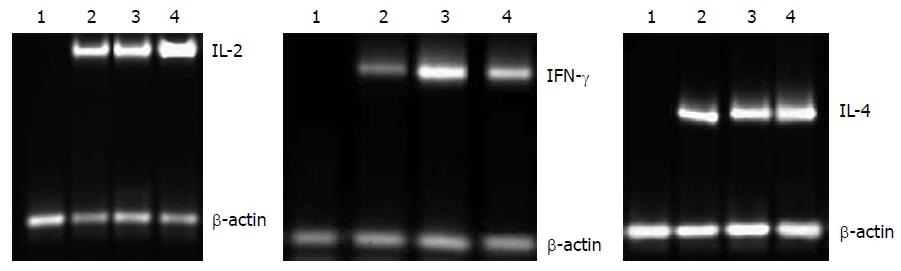
给予不同浓度乳凝集素刺激肠上皮淋巴细胞增殖, 利用H3-Tdr法检测剂量与细胞增殖之间的关系, 结果显示乳凝集素作用剂量为250 mg/L时淋巴细胞增殖显著, 根据母乳中乳凝集素的含量93±10 mg/L确定250 mg/L为刺激增殖最适剂量(图3). ELISA方法检测细胞因子浓度的结果显示肠上皮内淋巴细胞EEI-10经乳凝集素及PHA刺激后, 能够改变细胞因子的分泌情况, 其中培养上清中IL-2(aP<0.05 = 0.0394)和IFN-γ(bP<0.01 = 0.0082)的含量高于未处理细胞组; IFN-γ的含量高于PHA处理组(aP<0.05 = 0.047), 而IL-4没有显著的增高(图4). RT-PCR方法检测乳凝集素刺激EEI-10细胞株IL-2、IL-4及IFN-γ表达. 以未加入细胞因子引物组为阴性对照. 与未经乳凝集素及PHA处理组相比, 乳凝集素处理后IL-2表达量升高, IL-4表达量无显著性改变, IFN-γ表达量明显增高, 并高于PHA刺激组. 提示经乳凝集素的有效作用剂量处理, 能够刺激EEI-10细胞增殖, 促进肠上皮内淋巴细胞IL-2、IFN-γ细胞因子的表达(图5).
胃肠道不仅仅是消化营养物质的器官, 而且也是一个重要的免疫器官. 在与不计其数的食物蛋白、多肽和微生物相互作用中, 胃肠道免疫系统承担着选择细胞生长所需营养及对微生物等刺激产生良性应答的任务[12-13]. 乳凝集素是一种N端糖基化的具有免疫源性的糖蛋白, 由346个氨基酸组成, 含有表皮生长因子(EGF)样结构的Arg-Gly-Asp(RGD)N端, 能与aVb3整合素交联[6,14]. 因此其作为外源性抗原势必引起胃肠道免疫系统一系列的免疫应答反应, 其中肠上皮内淋巴细胞位于肠腔上皮细胞之间, 经食物和微生物抗原刺激后, 可增殖并在肠上皮层形成活性T淋巴细胞集落, 从而激发其他淋巴组织产生进一步反应. 对乳凝集素的研究始于1990年代末, 研究发现, 母乳中脂肪球膜蛋白(MFGM)能够降低轮状病毒感染性腹泻病的发病率或减轻腹泻时的症状, 其中乳凝集素起到了突出的作用[11-12,14-15], 但具体的作用机制仍不明确. 一些研究证实母乳喂养儿较人工喂养儿轮状病毒感染后症状明显轻, 因此我们推测乳凝集素是否有可能通过调节肠相关淋巴组织功能达到抗病毒作用.
我们利用重组技术获得乳凝集素, 通过给予肠上皮内淋巴细胞株EEI-10不同剂量的乳凝集素后检测淋巴细胞增殖情况, 结果显示, 在一定范围内随着乳凝集素剂量的增加, EEI-10细胞数逐渐增殖, 表明该物质能够作用于免疫细胞发挥促淋巴细胞细胞增殖的作用. 实验显示当乳凝集素作用剂量为250 mg/L时淋巴细胞增殖显著. 利用ELISA及RT-PCR等实验方法检测乳凝集素作用引起的IL-2、IL-4及IFN-γ分泌及表达的情况, 并以具有确切结果的PHA作为阳性对照, 结果显示乳凝集素处理组细胞培养上清中IL-2和IFN-γ的含量显著高于未经处理组, 其中IFN-γ的含量显著高于PHA处理组, 而IL-4的含量在处理前后无明显改变. 同时RT-PCR实验结果也证实IL-2和IFN-γ的表达量增加, 而IL-4的表达量无显著变化. IL-2是使T细胞激活并进入细胞分裂的关键成分, 而T细胞的活化又制约着整个特异性免疫应答, 此外IL-2还刺激NK细胞的生长和增强他们的杀伤功能并激发B细胞生长及抗体产生[16-20]. IFN-γ可激活单核巨噬细胞, 使之杀伤被吞噬的微生物, 还可促进T细胞分化, 诱导和增加MHC分子表达, 产生增强免疫应答等作用[20-26]. 本研究在体外实验中初步证实乳凝集素具有上调肠上皮内淋巴细胞分泌表达上述细胞因子的作用. 推测可能乳凝集素作用于肠上皮内淋巴细胞后能够促进这些细胞因子的分泌表达, 这些细胞因子一方面可能促进肠上皮内淋巴细胞的增殖, 进一步的作用是促进含有这些细胞因子受体的肠上皮细胞的增殖及成熟. 已知乳凝集素在胃的任何pH值下均有活性并且其结构不被蛋白酶等破坏, 保证了乳凝集素以完整的结构和功能到达肠道, 发挥其调节肠相关淋巴组织功能及抗轮状病毒感染的作用. 因此推测乳凝集素作用于肠相关淋巴组织可能是通过刺激肠上皮内淋巴细胞活化, 分泌表达IL-2及IFN-γ等细胞因子, 从而促进肠上皮内淋巴细胞的分化、迁徙等. 但乳凝集素在体内是如何发挥作用, 其活化肠上皮内淋巴细胞的通路仍不明确, 课题组对乳凝集素的进一步研究仍在进行中, 本实验为探讨乳凝集素的免疫作用提供了理论前提.
轮状病毒感染性腹泻在婴儿十分常见. 研究发现母乳中脂肪球膜蛋白能够降低轮状病毒感染性腹泻病的发病率或减轻腹泻时的症状, 其中乳凝集素起到了突出的作用, 但具体的作用机制仍不明确. 我们通过利用基因重组技术获得乳凝集素后, 首先从研究其调节淋巴细胞分泌表达细胞因子的作用方面, 探索其抗病毒作用机制.
本文科学性较强、有一定的创新性和有一定的临床价值和指导意义.
编辑:潘伯荣 电编:张敏
| 1. | Sharma R, Garrison RD, Tepas JJ 3rd, Mollitt DL, Pieper P, Hudak ML, Bradshaw JA, Stevens G, Premachandra BR. Rotavirus-associated necrotizing enterocolitis: an insight into a potentially preven-table disease? J Pediatr Surg. 2004;39:453-457. [PubMed] |
| 2. | Sharma R, Hudak ML, Premachandra BR, Stevens G, Monteiro CB, Bradshaw JA, Kaunitz AM, Hollister RA. Clinical manifestations of rotavirus infection in the neonatal intensive care unit. Pediatr Infect Dis J. 2002;21:1099-1105. [PubMed] |
| 3. | Newburg DS, Peterson JA, Ruiz-Palacios GM, Matson DO, Morrow AL, Shults J, Guerrero ML, Chaturvedi P, Newburg SO, Scallan CD. Role of human-milk lactadherin in protection against symptomatic rotavirus infection. Lancet. 1998;351:1160-1164. [PubMed] |
| 4. | Lodha A, de Silva N, Petric M, Moore AM. Human torovirus: a new virus associated with neonatal necrotizing enterocolitis. Acta Paediatr. 2005;94:1085-1088. [PubMed] |
| 5. | Sharma R, Tepas JJ 3rd, Hudak ML, Pieper P, Teng RJ, Raja S, Sharma M. Neonatal gut injury and infection rate: impact of surgical debridement on outcome. Pediatr Surg Int. 2005;21:977-982. [PubMed] |
| 6. | Peterson JA, Scallan CD, Ceriani RL, Hamosh M. Structural and functional aspects of three major glycoproteins of the human milk fat globule mem-brane. Adv Exp Med Biol. 2001;501:179-187. [PubMed] |
| 7. | Cavaletto M, Giuffrida MG, Giunta C, Vellano C, Fabris C, Bertino E, Godovac-Zimmermann J, Conti A. Multiple forms of lactadherin (breast antigen BA46) and butyrophilin are secreted into human milk as major components of milk fat globule mem-brane. J Dairy Res. 1999;66:295-301. [PubMed] |
| 8. | Ye A, Singh H, Taylor MW, Anema SG. Interactions of fat globule surface proteins during concentration of whole milk in a pilot-scale multiple-effect evapo-rator. J Dairy Res. 2004;71:471-479. [PubMed] |
| 9. | Schroten H, Bosch M, Nobis-Bosch R, Koehler H, Hanisch FG, Plogmann R. Anti-infectious properties of the human milk fat globule membrane. Adv Exp Med Biol. 2001;501:189-192. [PubMed] |
| 10. | Chen HY, Allen JC. Human milk antibacterial factors: the effect of temperature on defense sys-tems. Adv Exp Med Biol. 2001;501:341-348. [PubMed] |
| 11. | Kvistgaard AS, Pallesen LT, Arias CF, Lopez S, Petersen TE, Heegaard CW, Rasmussen JT. Inhibito-ry effects of human and bovine milk constituents on rotavirus infections. J Dairy Sci. 2004;87:4088-4096. [PubMed] |
| 12. | Black ME, Armstrong D. Human-milk lactadherin in protection against rotavirus. Lancet. 1998;351:1815-1816. [PubMed] |
| 13. | Van Assche G, Rutgeerts P. Physiological basis for novel drug therapies used to treat the inflammatory bowel diseases. I. Immunology and therapeutic potential of antiadhesion molecule therapy in infla-mmatory bowel disease. Am J Physiol Gastrointest Liver Physiol. 2005;288:G169-G174. [PubMed] |
| 14. | Andersen MH, Graversen H, Fedosov SN, Petersen TE, Rasmussen JT. Functional analyses of two cellular binding domains of bovine lactadherin. Biochemistry. 2000;39:6200-6206. [PubMed] |
| 15. | Newburg DS. Human milk glycoconjugates that inhibit pathogens. Curr Med Chem. 1999;6:117-127. [PubMed] |
| 16. | Vinderola CG, Duarte J, Thangavel D, Perdigon G, Farnworth E, Matar C. Immunomodulating capa-city of kefir. J Dairy Res. 2005;72:195-202. [PubMed] |
| 17. | Vinderola G, Perdigon G, Duarte J, Thangavel D, Farnworth E, Matar C. Effects of kefir fractions on innate immunity. Immunobiology. 2006;211:149-156. [PubMed] |
| 18. | Thoreux K, Schmucker DL. Kefir milk enhances intestinal immunity in young but not old rats. J Nutr. 2001;131:807-812. [PubMed] |
| 19. | Vinderola CG, Medici M, Perdigon G. Relationship between interaction sites in the gut, hydrophobicity, mucosal immunomodulating capacities and cell wall protein profiles in indigenous and exogenous bacteria. J Appl Microbiol. 2004;96:230-243. [PubMed] |
| 20. | Yang H, Antony PA, Wildhaber BE, Teitelbaum DH. Intestinal intraepithelial lymphocyte gamma delta-T cell-derived keratinocyte growth factor mo-dulates epithelial growth in the mouse. J Immunol. 2004;172:4151-4158. [PubMed] |
| 21. | Wildhaber BE, Yang H, Spencer AU, Drongowski RA, Teitelbaum DH. Lack of enteral nutrition-effects on the intestinal immune system. J Surg Res. 2005;123:8-16. [PubMed] |
| 22. | Perdigon G, Maldonado Galdeano C, Valdez JC, Medici M. Interaction of lactic acid bacteria with the gut immune system. Eur J Clin Nutr. 2002;56:S21-S26. [PubMed] |
| 23. | Yang H, Kiristioglu I, Fan Y, Forbush B, Bishop DK, Antony PA, Zhou H, Teitelbaum DH. Interferon-gamma expression by intraepithelial lymphocytes results in a loss of epithelial barrier function in a mouse model of total parenteral nutrition. Ann Surg. 2002;236:226-234. [PubMed] |
| 24. | Yang H, Fan Y, Teitelbaum DH. Intraepithelial lymphocyte-derived interferon-gamma evokes enterocyte apoptosis with parenteral nutrition in mice. Am J Physiol Gastrointest Liver Physiol. 2003;284:G629-G637. [PubMed] |
| 25. | Shibahara T, Miyazaki K, Sato D, Matsui H, Yanaka A, Nakahara A, Tanaka N. Alteration of intestinal epithelial function by intraepithelial lymphocyte homing. J Gastroenterol. 2005;40:878-886. [PubMed] |