修回日期: 2004-08-15
接受日期: 2004-08-25
在线出版日期: 2005-03-15
目的: 肝癌的侵袭与转移是导致其不良预后的重要因素, 目前临床缺乏针对肝癌侵袭与转移的有效治疗措施. 本研究通过人肝癌细胞培养, 研究大蒜素对体外人肝癌细胞侵袭能力的影响, 并在基因水平上探讨其机制.
方法: 将人肝BEL-7402细胞传代, 取进入指数生长期的细胞随机分为阿霉素组Human (5 mg/L)、大蒜素低、中、高剂量组(25、50、100 mg/L), 另设空白对照. 处理后每30 min观察一次细胞转移相关超微结构, 8 h后用流式细胞术检测肿瘤侵袭转移抑制基因nm23-H1和P21ras表达水平. 数据用SAS 8.2软件进行χ2检验.
结果: 与阿霉素组相比, 大蒜素处理后超微结构除凋亡表现外, 大多数贴壁细胞胞质回缩, 细胞之间的连接减少, 空隙加大, 细胞之间界限变清晰, 表面的丝状微绒毛也明显减少. 流式细胞检测显示, nm23-H1表达的荧光强度空白对照组为19.19, 5 mg/L阿霉素组为119.76, 25 mg/L大蒜素组为84.28, 50 mg/L大蒜素组为92.64, 100 mg/L大蒜素组为138.08, nm23-H1表达与大蒜素呈明显剂量效应关系, 大蒜素高剂量组比阿霉素组显著增强(138.08 vs 119.76, P<0.05). 而P21ras表达的荧光强度在空白对照组、阿霉素组和低、中、高剂量组分别为2.65%、3.56%、1.55%、3.22%、3.44%, 都表现为阴性低表达, 各组间没有明显差别.
结论: 大蒜素可以抑制体外肝癌细胞的侵袭能力, 其机制可能与大蒜素特异性影响BEL-7402细胞表面的微绒毛和上调肿瘤侵袭与转移抑制基因nm23-H1的表达有关.
引文著录: 钟宁, 马亚兵, 高海青, 张志勉, 程梅, 由倍安, 伊永亮, 刘新春. 大蒜素抑制体外人肝癌细胞的侵袭能力. 世界华人消化杂志 2005; 13(6): 743-747
Revised: August 15, 2004
Accepted: August 25, 2004
Published online: March 15, 2005
AIM: To investigate the influence of allicin on the ultramicromorphology of hepatocellular carcinoma cells, and to explore the genetic mechanism by which allicin inhibits the invasion and metastasis of hepatocellular carcinoma.
METHODS: Human hepatocellular carcinoma BEL-7402 cells were cultured in the presence of adriamycin (5 mg/L), or allicin at low, medium and high concentrations(25, 50, and 100 mg/L, respectively). Metastasis-related ultramicroscopic structures were examined 0.5 hour after drug treatment. Tumor invasion and metastasis inhibitory genes nm23-H1 and P21ras were assayed by flow cytometry 8 hours following treatment. The data were analyzed by χ2 test with SAS 8.2 software.
RESULTS: The growth of BEL-7402 cells was inhibited and apoptosis was induced following allicin treatment. Most of these adherent cells shrinked, with the junctions reduced, the intercellular space widened, and the cell surface microvilli decreased. Although cells treated with adriamycin also showed typical apoptosis morphology, there was no remarkable reduction of the microvilli on cell surface, and the cross junctions of microvilli among cells exhibited no changes either. The fluorescent intensities of the expression of nm23-H1 were l9.19 in negative control group, 119.76 in 5 mg/L adriamycin group, 84.8 in 25 mg/L allicin group, 92.64 50 mg/L allicin group, and 138.08 in 100 mg/L allicin group, respectively. Dose-effect relationship was clearly showed for allicin in the induction of nm23-H1 expression. The fluorescent intensity of 100 mg/L allicin group was remarkably stronger than that of 5 mg/L adriamycin group (138.08 vs 119.76, P<0.05). Negative or low expression of P21ras was observed in all groups, with no difference among them.
CONCLUSION: Allicin can inhibit the invasion of hepatocellular carcinoma cells, which may be caused by its influence on the motor system of hepatocellular carcinoma cells and its upregulation nm23-H1 gene expression.
- Citation: Zhong N, Ma YB, Gao HQ, Zhang ZM, Cheng M, You BA, Yi YL, Liu XC. Allicin inhibits invasion of human hepatocellular carcinoma cells in vitro. Shijie Huaren Xiaohua Zazhi 2005; 13(6): 743-747
- URL: https://www.wjgnet.com/1009-3079/full/v13/i6/743.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i6.743
原发性肝的预后仍然很差, 其主要原因在于其侵袭和转移. 一方面, 由于肝癌早期临床症状缺乏特异性, 很多患者发现时己到晚期, 出现了肝内或肝外的转移, 丧失了手术时机; 另一方面, 肝癌根治性切除后的5 a复发率高达61.5%, 是影响于术疗效的重要因素. 因此肝癌侵袭与转移的防治研究成为肝癌研究的热点和难点, 寻找新型特异性肝癌细胞侵袭和转移抑制剂, 具有重要意义和广阔前景. 大蒜素(Allicin)为百合科植物大蒜鳞茎中提取的二烯丙基三硫醚[(CH2=CHCH2)2S3], 油状物, 沸点: 87-88℃/0.1 mm, Mr 178.20, 现已人工合成. 他能够抑制端粒酶活性[1-3], 可通过激活caspases-3, -8和-9诱导肿瘤细胞凋亡[4], 并通过增强免疫力而发挥抗肿瘤作用[5], 且具有肝脏保护作用[6-7]. 大蒜素能明显抑制EGF刺激人肝细胞EGFR和VEGF mRNA表达, 通过上调Fas系统表达诱导人肝癌细胞凋亡, 能特异性影响BEL-7402细胞表面的微绒毛, 并能提高恶性肿瘤患者红细胞、淋巴细胞免疫功能[8-9], 因此, 有望应用于肿瘤治疗[10-12]. 我们采用超微形态学、流式细胞术等方法研究大蒜素对肝癌侵袭能力的影响, 分析nm23-H1表达与肝癌细胞体外侵袭力的关系, 为认识大蒜素抗肝癌侵袭转移的分子机制提供有价值的实验依据.
大蒜素, 纯度>99.9%, 连云港天晴制药公司生产. 吐温80, Sigma公司. 取大蒜素1 g, 吐温80 2 g和生理盐水100 mL, 混合制成10 g/L大蒜素乳剂, 4℃冰箱保存, 使用时按照要求的浓度以RPMI 1640培养液稀释. 空白对照组用RPMI l640培养液、生理盐水和吐温80混合成20 g/L溶液. 阿霉素, 批号OE2061-03, Pharmacia & Upjohn公司, 以生理盐水稀释成10 g/L, -80℃冰箱保存, 使用时稀释至0.5 g/L工作浓度, 4℃冰箱保存.鼠抗人nm23-H1 mAb, 检测时加异硫氢酸荧光素(FITC)标记羊抗鼠二抗, 抗P21ras荧光mAb为藻红蛋白(PE)标记的鼠抗人抗体. 所有抗体均为Pharmingen产品. 人肝癌细胞株BEL-7402, 购自山东省医学科学院免疫室. 以RPMI l640培养基(Gibico公司)和100 mL/L小牛血清(杭州四季青公司), 在37℃, 50 mL/L CO2条件下培养, 将处于指数生长期且长满培养瓶底壁的细胞用2.5 g/L胰蛋白酶消化, 至细胞从铺展开的多边形稍缩为圆形时, 倒掉消化液, 用含血清的培养液终止消化, 并制成细胞悬液, 分装于多个培养瓶, 补足培养液, 置培养箱培养. 将培养良好, 进入指数牛长期的细胞分组后进行实验. 需染色时, 可将干净无菌的盖玻片事先放入培养瓶或培养板上, 再按上述方法传代, 细胞可以生长于盖玻片上.
1.2.1 倒置相差显微镜观察BEL-7402细胞形态: BEL-7402细胞传代后随机分为5组, 显微镜下观察细胞形态至完全贴壁, 待细胞进入指数生长期后, 分别置换含以下药物的培养液, 阿霉素5 mg/L, 人蒜素25、50、100 mg/L, 另外设空白对照组. 药物处理后每隔30 min观察细胞生长状况.
1.2.2 BEL-7402细胞超微结构观察: 将上述5组BEL-7402细胞经药物处理12 h后分别用2.5 g/L胰蛋白酶消化, 3 000 r/min离心, PBS清洗, 收集于EP管中, 用25 g/L戊二醛固定, 10 g/L锇酸后固定, 脱水, 618包埋剂包埋, 超薄切片机切片后用醋酸铀及柠檬酸铅染色, JSM-1200EX型透射电镜(日本JEOL公司)观察. 分别取生长于盖玻片上的5组BEL-7402细胞, 经25 g/L戊二醛固定, OTO法处理, 梯度酒精脱水, 临界点干燥后真空喷镀, JSM-T300扫描电镜(日本JEOL公司)观察.
1.2.3 流式细胞术检测nm23-HI和P21ras的表达: 正常传代BEL-7402细胞, 待细胞进入指数生长期后, 置换含以下药物的培养液: 阿霉素5 mg/L和人蒜素(25、50、100 mg/L), 处理8 h后取上述4组和阴性对照组细胞, 2.5 g/L胰蛋白酶消化, PBS(pH7.4)洗涤3次, 加入700 mL/L冷乙醇2 mL, 4℃固定过夜, 同法洗2次, 500目铜网过滤, 加入相应荧光抗体, 以IgGl-FITC作为免疫阴性对照, 室温避光20 min. 上机后收集2万个细胞, 荧光强度以对数放大, 光散射数据存软舷, 测试完后在Macintosh 650计算机上, 以CellQuest Plot软件(BD公司提供)分析数据.
统计学处理 资料数据进行χ2检验, 统计计算由SAS8.2统计软件完成.
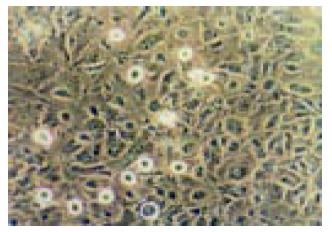
药物处理前BEL-7402细胞形态呈不规则的多角形或圆形, 轮廓清晰, 直径在24 μm, 核呈圆形或椭圆形, 可见多核和巨大核细胞, 核仁不规则. 药物处理30 min后, 阿霉素组细胞末见明显的形态学变化, 与空白对照组无显著差异; 大蒜素组在细胞问连接变化, 大多数细胞之间的连接减少, 胞质退缩, 细胞边缘不规则, 同时细胞内部颗粒增多, 各剂量组间无显著差异. 处理3 h后, 阿霉素组绝大多数细胞无明显的形态学变化, 只有少数细胞出现细胞皱缩, 折光度上升, 形态不规则, 严重者从瓶壁脱落; 大蒜素组细胞问连接的变化更加明显, 也可见脱落死亡细胞. 处理8 h后, 阿霉素组和大蒜素组均有大量的细胞死亡, 其中有细胞碎片, 也有凋亡形态细胞出现, 尤以在100 mg/L大蒜素组最为明显(图1).
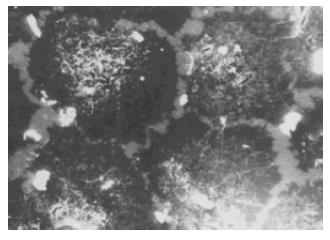
2.2.1 透射电镜: 药物处理前BEL-7402细胞形态为圆形或椭圆形, 表而有很多微绒毛凸起, 细胞浆内有人量细胞器, 多数细胞内可以发现丰富的微管和微丝结构, 线粒体形态规则, 粗面内质网丰富, 部分呈恶性肿瘤典型的指纹状改变. 细胞核质比值大, 核染色质丰富, 分布均匀, 染色较浅, 核仁多为2个以上, 核分裂相多见. 阿霉素组细胞经处理后, 有部分细胞出现微绒毛消失, 细胞核形态缩小, 染色质染色加深, 向边缘聚集等现象. 大蒜素处理后, 大多数细胞表面的微绒毛明显减少, 部分完全消失, 表面呈网形或椭圆形, 细胞浆内部的微管和微丝结构减少、消失, 大多数线粒体变化不明显, 少数出现线粒体肿胀、变性, 有些细胞内出现大量空泡; 细胞核体积缩小, 核仁消失, 染色质染色加深, 向边缘聚集, 有些细胞坏死后, 出现细胞碎片.
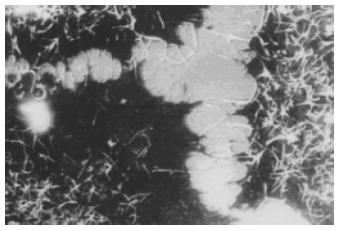
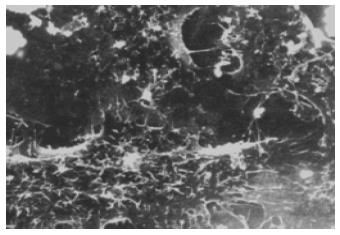
2.2.2 扫描电镜: 药物处理前BEL-7402细胞牛长在玻片上, 呈多角形或者椭圆形, 细胞表面有较多微绒毛, 呈丝状突起, 细胞之问连接紧密, 丝状微绒毛互相交叉, 细胞之间的界限不易区分. 阿霉素组细胞出现典型的凋亡改变, 但是大部分正常贴壁细胞表面丝状微绒毛未见明显减少, 细胞之间微绒毛的交义连接也没有明显减少. 大蒜素处理后, 除凋亡表现外, 大多数贴壁细胞胞质回缩, 细胞之间的迩接减少, 窄隙加大, 界限清晰, 细胞表而的丝状微绒毛也明显减少, 与阿霉素组存在显著差异. 还有一部分细胞体积明显缩小, 细胞从玻片表而脱落, 表面微绒毛减少或者脱落殆尽, 出现典型凋亡小体(图2-4).
流式细胞检测显示, nrn23-H1表达的荧光强度空白对照19.19, 5 mg/L阿霉素组119.76, 25 mg/L大蒜素组84.28, 50 mg/L大蒜素组92.64, 100 mg/L大蒜素组138.08. 而P21ras在对照组(2.65%)、阿霉素组(3.56%)和大蒜素组(1.55%、3.22%、3.44%)都表现为阴性低表达, 各组间没有明显差别(P>0.05).
肿瘤侵袭、转移是目前研究的一个热点问题[13]. 由于肝癌严重威胁人类健康, 近年来对肝癌侵袭、转移分子机制的研究日趋深入[14-20]. 目前已分离出多种能抑制肿瘤侵袭与转移的候选基因, 研究最多和被认为最有前途的是nm23基因. 许多研究表明, nm23基因表达水平与乳腺癌、结肠直肠癌、肝癌、肺癌、黑色素瘤、喉鳞状细胞癌、鼻咽癌、甲状腺癌等肿瘤侵袭转移呈显著负相关[21-30], 且nm23基因低表达患者的生存期短、预后不良. nm23基因的低表达已经在多种具有高转移潜能的肿瘤中被证实, 乳腺癌、胃癌、肝癌、结肠癌、直肠癌、肺癌、甲状腺癌、前列腺癌、喉癌等均发现m23基因及其产物的低表达, 与疾病的进展及转移能力呈明显负相关. 人nm23基因分为nm23-H1和m23-H2两个亚型, 其中nm23-H1与肿瘤侵袭转移更为密切. 将nm23-H1基因转染肝癌细胞可使其转移能力明显降低[31]. 他影响细胞的运动、黏附等特性, 调节肿瘤细胞侵袭转移能力. 作为一种重要的肿瘤转移抑制基因, nm23基因与肝癌关系的研究报道较多, 但目前关于nm23H1基因与肝癌细胞体内外侵袭力关系的研究, 国内外报道甚少.
我们从超微形态学观察人肝癌细胞BEL-7402的形态. 扫描电镜的结果可以清晰的看出BEL-7402细胞表面有大量丝状微绒毛, 而且无论在细胞培养阶段还是在移植瘤内部, 细胞之间的微绒毛都互相交织、紧密相连, 他们在细胞的侵袭和转移中发挥重要作用. 在我们对比分析大蒜素和阿霉素对细胞超微结构的影响时发现, 虽然二者都可以导致培养人肝癌细胞的凋亡, 大剂量时可以引进细胞坏死, 但是大蒜素在比较小的剂量下就可以引起细胞表面微绒毛的变化, 突出表现为肝癌细胞表面微绒毛的消失, 细胞内部微丝、微管等影响细胞运动功能的细胞器减少, 而阿霉素在相同的条件下, 虽然可以导致相同程度的细胞死亡, 但是对细胞表面微绒毛的影响较小, 二者区别显著. 这提示大蒜素对肝癌细胞的侵袭能力可能具有特异性的抑制作用, 在抗肝癌侵袭方面有临床应用价值. 在国内外现有关大蒜素对肿瘤细胞形态学影响的研究报道中, 大多数都发现大蒜素可以导致肿瘤细胞表面微绒毛减少或消失, 但都未在这方面与传统的化疗药物对比分析, 因此往往将这种形态学表现归于大蒜素对肿瘤细胞的杀伤作用. 但我们的结果显示, 似乎大蒜素还可能存在某些独特的作用机制, 可以对肿瘤细胞的运动系统产生独特的影响, 在这方面还需要今后更深入的探讨.
我们的研究结果显示, 大蒜素可以有效提高BEL-7402细胞nm23-H1的表达水平且呈剂量依赖性, 即随着剂量的提高, nm23-H1的表达水平也相应升高, 提示大蒜素在基因水平上调节肿瘤细胞侵袭和转移能力. 那么, 大蒜素对nm23-H1表达的影响与其对肝癌细胞微绒毛的影响有无联系呢?检索文献发现, nm23基因的表达可能抑制肿瘤细胞的运动功能. 细胞运动是肿瘤细胞转移克隆化的前提, nm23基因产物引起的细胞运动能力下降, 可能是抑制肿瘤转移的基础.
编辑: 张海宁 电编: 潘伯荣
| 1. | Sun L, Wang X. Effects of allicin on both telomerase activity and apoptosis in gastric cancer SGC-7901 cells. World J Gastroenterol. 2003;9:1930-1934. [PubMed] |
| 4. | Oommen S, Anto RJ, Srinivas G, Karunagaran D. Allicin (from garlic) induces caspase-mediated apoptosis in cancer cells. Eur J Pharmacol. 2004;485:97-103. [PubMed] |
| 5. | Patya M, Zahalka MA, Vanichkin A, Rabinkov A, Miron T, Mirelman D, Wilchek M, Lander HM, Novogrodsky A. Allicin stimulates lymphocytes and elicits an antitumor effect: a possible role of p21ras. Int Immunol. 2004;16:275-281. [PubMed] |
| 6. | Vimal V, Devaki T. Hepatoprotective effect of allicin on tissue defense system in galactosamine/endotoxin challenged rats. J Ethnopharmacol. 2004;90:151-154. [PubMed] |
| 8. | 张 志勉, 高 海青, 王 德斌, 时 庆. 大蒜素对恶性肿瘤患者淋巴细胞免疫功能的影响. 山东大学学报(医学版). 2002;40:245-249. |
| 9. | 张 志勉, 高 海青, 魏 瑗. 大蒜素对肿瘤患者细胞免疫功能的影响. 山东大学学报(医学版). 2003;41:148-150. |
| 10. | Dorai T, Aggarwal BB. Role of chemopreventive agents in cancer therapy. Cancer Lett. 2004;215:129-140. [PubMed] |
| 11. | Aggarwal BB, Takada Y, Oommen OV. From chemoprevention to chemotherapy: common targets and common goals. Expert Opin Investig Drugs. 2004;13:1327-1338. [PubMed] |
| 12. | Miron T, Mironchik M, Mirelman D, Wilchek M, Rabinkov A. Inhibition of tumor growth by a novel approach: in situ allicin generation using targeted alliinase delivery. Mol Cancer Ther. 2003;2:1295-1301. [PubMed] |
| 13. | Xiong B, Yuan HY, Hu MB, Zhang F, Wei ZZ, Gong LL, Yang GL. Transforming growth factor-beta1 in invasion and metastasis in colorectal cancer. World J Gastroenterol. 2002;8:674-678. [PubMed] |
| 14. | 李 大强, 王 智彪, 白 晋, 赵 颉, 胡 凯, 王 媛, 杜 永洪. 小鼠囊胚与不同侵袭转移潜能肝癌细胞系共培养模型的建立及生物学行为观察. 中国病理生理杂志. 2004;20:32-37. |
| 17. | 汪 思应, 江 岩, 郑 红, 余 科科, 许 望翔, 杨 晓明, 李 俊. 全反式维甲酸抑制Ets-1介导的肝癌7402细胞离散和侵袭及其分子机制. 中国药理学通报. 2003;19:689-693. |
| 21. | Sikorska B, Danilewicz M, Wagrowska-Danilewicz M. Prognostic significance of CD44v6 and nm23 protein immunoexpression in laryngeal squamous cell carcinoma. Pol J Pathol. 2002;53:17-24. [PubMed] |
| 22. | Terasaki-Fukuzawa Y, Kijima H, Suto A, Takeshita T, Iezumi K, Sato S, Yoshida H, Sato T, Shimbori M, Shiina Y. Decreased nm23 expression, but not Ki-67 labeling index, is significantly correlated with lymph node metastasis of breast invasive ductal carcinoma. Int J Mol Med. 2002;9:25-29. [PubMed] |
| 23. | Ohta S, Lai EW, Pang AL, Brouwers FM, Chan WY, Eisenhofer G, de Krijger R, Ksinantova L, Breza J, Blazicek P. Downregulation of metastasis suppressor genes in malignant pheochromocytoma. Int J Cancer. 2005;114:139-143. [PubMed] |
| 24. | Krishnakumar S, Lakshmi A, Shanmugam MP, Vanitha K, Biswas J. Nm23 expression in retinoblastoma. Ocul Immunol Inflamm. 2004;12:127-135. [PubMed] |
| 25. | Zhao H, Jhanwar-Uniyal M, Datta PK, Yemul S, Ho L, Khitrov G, Kupershmidt I, Pasinetti GM, Ray T, Athwal RS. Expression profile of genes associated with antimetastatic gene: nm23-mediated metastasis inhibition in breast carcinoma cells. Int J Cancer. 2004;109:65-70. [PubMed] |
| 26. | Chen JQ, Zhan WH, He YL, Peng JS, Wang JP, Cai SR, Ma JP. Expression of heparanase gene, CD44v6, MMP-7 and nm23 protein and their relationship with the invasion and metastasis of gastric carcinomas. World J Gastroenterol. 2004;10:776-782. [PubMed] |
| 27. | Bertucci F, Salas S, Eysteries S, Nasser V, Finetti P, Ginestier C, Charafe-Jauffret E, Loriod B, Bachelart L, Montfort J. Gene expression profiling of colon cancer by DNA microarrays and correlation with histoclinical parameters. Oncogene. 2004;23:1377-1391. [PubMed] |
| 28. | Wang LS, Chow KC, Wu YC, Lin TY, Li WY. Inverse expression of dihydrodiol dehydrogenase and glutathione-S-transferase in patients with esophageal squamous cell carcinoma. Int J Cancer. 2004;111:246-251. [PubMed] |
| 29. | Wang LS, Chow KC, Lien YC, Kuo KT, Li WY. Prognostic significance of nm23-H1 expression in esophageal squamous cell carcinoma. Eur J Cardiothorac Surg. 2004;26:419-424. [PubMed] |
| 30. | Nanashima A, Yano H, Yamaguchi H, Tanaka K, Shibasaki S, Sumida Y, Sawai T, Shindou H, Nakagoe T. Immunohistochemical analysis of tumor biological factors in hepatocellular carcinoma: relationship to clinicopathological factors and prognosis after hepatic resection. J Gastroenterol. 2004;39:148-154. [PubMed] |
| 31. | Liu F, Zhang Y, Zhang XY, Chen HL. Transfection of the nm23-H1 gene into human hepatocarcinoma cell line inhibits the expression of sialyl Lewis X, alpha1, 3 fucosyltransferase VII, and metastatic potential. J Cancer Res Clin Oncol. 2002;128:189-196. [PubMed] |