修回日期: 2005-01-15
接受日期: 2005-01-26
在线出版日期: 2005-03-15
目的: 检测HBV感染后外周血及感染肝组织内CD4+T和CD8+T细胞的数量及功能, 以及肝组织内TNF-α及TGF-β2表达, 探讨HBV对人体T细胞免疫的影响及其可能机制.
方法: 用流式细胞仪检测HBV感染者36例和正常人20例外周血中T细胞亚群的数量. 用免疫组化法HBV感染肝组织50例中CD4, CD8, CD25和TNF-α, TGF-β2 的表达, 并作相应比较.
结果: HBV感染组外周血, CD4+和CD4+/CD8+比值明显低于对照组(P<0.05); CD8+细胞升高, 明显高于对照组(P<0.05). 肝组织内浸润的淋巴细胞主要聚集在汇管区和小叶坏死区, 免疫组化结果显示HBV感染组肝组织内的 CD8+和CD4+细胞数量多于非HBV感染组(P<0.01). HBV感染组肝组织内CD25+细胞数量减少, 但统计学上无显著意义. HBV感染组肝组织TNF-α表达明显增强, 与非HBV感染组相比有显著差异(P<0.05); 而TGF-β2在HBV感染组肝组织的表达与非HBV感染组相比无显著差异. TGF-β2及TNF-α在肝硬化、癌旁肝硬化、肝细胞癌中均较强表达, 且与慢性乙肝组和正常对照组比较有非常显著差异(P<0.01).
结论: HBV感染者外周血和肝内的T细胞亚群紊乱, 活性下降, 功能受损. TNF-α表达与HBV感染和免疫损伤密切相关, 而HBV对TGF-β2的影响微弱.
引文著录: 杨炼, 管小琴, 肖明. HBV感染对人T细胞免疫及细胞因子TNF-α、GF-β2的影响. 世界华人消化杂志 2005; 13(6): 729-733
Revised: January 15, 2005
Accepted: January 26, 2005
Published online: March 15, 2005
AIM: To study the influence of hepatitis B virus(HBV) infection on cellular immunity via examining the T cell subsets in peripheral blood and the hepatic tissues and the expression of cytokines in the liver.
METHODS: CD4+ T cells and CD8+ T cells in peripheral blood was enumerated by flow cytometry (FCM) in 36 patients with hepatitis B and 20 healthy controls. The expression of CD4, CD8, CD25, TNF-α and TGF-β2 were determined by streptavidin-peroxidase (SP) immunohistochemistry in 50 cases HBV-infected liver tissues.
RESULTS: The quantity of CD4+ T cells and the ratio of CD4+/CD8+ in peripheral blood of patients were significantly lower than controls (P<0.05). The quantity of CD8+ T cells was considerably higher than controls (P<0.05). T cells mostly accumulated in the lobule and the portal tract. More CD8+ cells than CD4+ cells were observed. The quantities of CD4+ and CD8+ cells in the liver tissues of HBV positive group were significantly different from the negative group(P<0.05). CD25+ cells were reduced in the infected livers, but without significant difference. The expression of TNF-α in the liver tissues of HBV positive group were significantly different from the liver tissues of HBV negative group(P<0.05). In contrast, the expression of TGF-β2 was not significantly different between the two groups. TGF-β2 and TNF-α expression in liver cirrhosis, hepatocellular carcinoma and paratumor cirrhosis were significantly different from that in control group(P<0.01).
CONCLUSION: Aberrant T cell subsets and reduced T cell activity exist in patients with HBV infection. TNF-α, but not TGF-β2, may be related to HBV infection and liver injury.
- Citation: Yang L, Guan XQ, Xiao M. Effects of HBV infection on T cell immunity and hepatic expression of TNF-α and TGF-β2. Shijie Huaren Xiaohua Zazhi 2005; 13(6): 729-733
- URL: https://www.wjgnet.com/1009-3079/full/v13/i6/729.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i6.729
HBV的免疫清除, 对促进肝功能恢复、防止和减少肝硬化和肝癌的发生有着最根本的意义. HBV的免疫清除依赖于HBV特异性T细胞反应的激活. 感染早期HBV特异性T细胞反应强度和质量可以影响感染的最终结局[1-2]. 在肝组织损伤之前, 外周血HBV特异性CD4+细胞和CD8+细胞大量浸润在肝内[3]. HBV可导致PBMC功能失常, 同时淋巴细胞在肝内聚集, 免疫功能反而下降[4].
血液中CD4+ /CD8+比值是降低的, 但并不能准确地反映出机体的免疫功能状态[5-7]. 我们从外周血及肝脏组织内两方面着手, 检测了HBV感染者外周血T淋巴细胞CD4+、CD8+亚群的数量, 并结合临床生化指标分析比较; 采用免疫组化法, 检测HBV感染者肝组织内淋巴细胞CD4, CD8, CD25的表达, 同时检测TNF-α和TGF-β2的表达, 以了解肝组织内T细胞的免疫功能变化及与细胞因子的相关关系, 从两方面探讨HBV感染对机体T细胞免疫功能的影响及其可能机制.
根据血清病原学检查, 获得HBV感染者36例, 均不伴严重肝功能异常. 男24例, 女12例, 平均年龄31岁. 正常对照组20名, 男12名, 女8名, 平均年龄33.1岁. 两组间性别、年龄无差异. 所有血液标本均经肝素抗凝处理后, 进行流式细胞仪检测T细胞亚群情况.
手术切除标本存档蜡块及肝穿组织64例及其血清病原学资料, 包括慢性乙型肝炎(CHB)10例, 肝硬化(LC)37例, 肝细胞癌(HCC)17例, 其中癌旁肝硬化(PC)14例. 以免疫组化方法检测HBsAg和HBcAg. 肝组织内HBsAg和/或HBcAg阳性者为HBV感染组50例; 而肝组织HBsAg和(或)HBcAg及血清病原学检查均阴性者为非HBV感染组(HBV阴性组)10例, 余4例因缺乏血清资料或与组织学检查不符而删去. 在细胞因子免疫组化检测中, 另加入9例正常肝组织作为正常对照组.
流式细胞术采用美国BD公司的simulpest IMK试剂盒. 免疫组化用鼠HBsAgmAb、兔HBcAg多克隆抗体及S-P试剂盒均购自福州迈新公司; 鼠CD25、CD4及CD8mAb购自美国NEoMARKERS 公司, TGF-β2 mAb购自福州迈新公司, TNF-αmAb购自北京中山公司.
免疫组化详细步骤按试剂说明书要求进行. 血液中CD3+, CD4+, CD8+, CD16+56+, CD4+/CD8+系列直接采用流式细胞仪自动读数; 肝组织内CD4+, CD8+, CD25+细胞采用淋巴细胞计数, 选择10个有淋巴细胞浸润的视野, 计数100个淋巴细胞中的阳性淋巴细胞数, 取其平均值. 肝组织内的TNF-α, TGF-β2根据细胞显色程度及阳性比例来评分. 无着色为0分; 黄色为1分; 棕黄色为2分; 棕色为3分, 着色范围<1/3为1分; 1/3-2/3为2分; = 2/3为3分. 二者相乘所得数字≤2为+; 2-5为++; ≥5为+++.
统计学处理 流式细胞检测的全部数据采用微机输入SPSS数据库后, 进行成组设计资料样本均数比较t检验和直线相关分析. 免疫组化结果输入SPSS数据库后, 进行χ2检验及t检验.
正常对照组血清病原学检查及肝功能检查均正常. HBV感染组外周血T细胞亚群测定值中, CD4细胞和CD4/CD8比值低于对照组, 统计学有显著意义(P<0.05); CD8细胞高于对照组, 统计学有显著意义(P<0.05, 表1). CD16+56+与CD3+、CD4+/CD8+负相关; CD8+与CD3+正相关而与CD4+/CD8+负相关; CD4+与CD3+、CD4+/CD8+正相关(表2). CD8+与丙氨酸氨基转移酶(ALT, R = 0.391, P = 0.03<0.05 )、门冬氨酸氨基转移酶(AST, R = 0.368, P = 0.042<0.05)呈正相关.
| CD3% | CD4/CD8 | CD4% | CD8% | CD3/CD16+56+% | |
| CD3% | 1.000 | ||||
| CD4/CD8% | -0.152(0.414) | 1.000 | |||
| CD4% | 0.428(0.016) | 0.781(0.000) | 1.000 | ||
| CD8% | 0.620(0.000) | -0.738(0.000) | -0.233(0.208) | 1.000 | |
| CD3/CD16+56% | -0.898(0.000) | 0.042(0.823) | -0.527(0.002) | -0.493(0.005) | 1.000 |
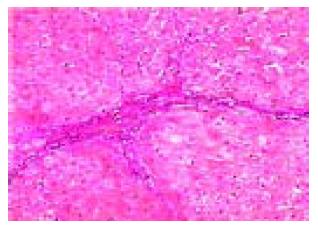
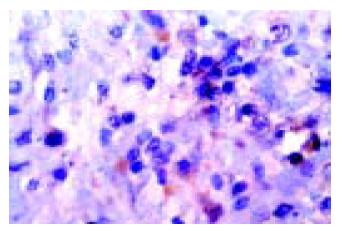
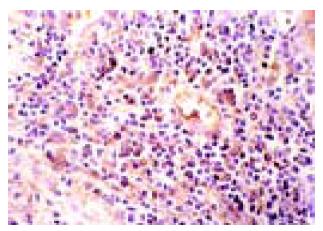
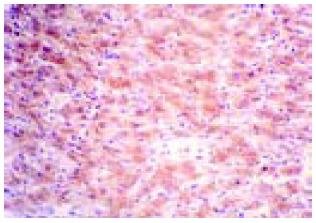
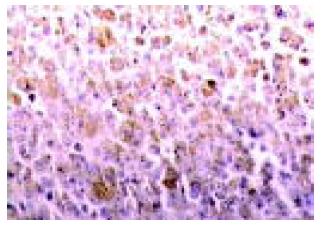
光镜可见肝细胞或肝癌细胞变性、坏死等病变及不同程度的肝细胞坏死灶和汇管区炎症细胞浸润(图1). 免疫组化结果显示慢性肝炎及肝硬化组织中CD8主要表达在坏死灶和汇管区, CD4+T细胞多见于汇管区, 也有个别枯氏细胞、内皮细胞及肝细胞表达CD4. 肝癌组织中炎性细胞浸润灶较少, 炎细胞表达CD4和CD8, 且以CD8为主(图2, 图3, 图4). 总的来说, CD4+细胞数量少与 CD8+细胞数量. CD25主要在具有活性的T细胞胞膜上表达, 在肝细胞坏死区和汇管区的淋巴细胞及在肝细胞、内皮细胞等可见CD25的表达. 在HBV感染组CD8+淋巴细胞平均为9.42每百个淋巴细胞, CD4+T细胞为3.55每百个淋巴细胞, 非HBV感染组则分别为1.79和0.97, 二者相比有非常显著差异(P<0.01). 而CD25+在HBV阳性组有减少的趋势, 但在统计学上与HBV阴性组比较无显著差异(9.82, 8.15, P>0.05), TGF-β2和TNF-α在9例正常肝组织中不表达, 但在慢性肝病、肝硬化、癌旁肝硬化和肝细胞癌组织中均有表达, 且在肝癌组的阳性率最高. TNF-α主要表达在淋巴细胞和肝细胞; TGF-β2表达部位主要位于肝细胞胞质, 淋巴细胞未见明显表达(图5, 6). 经卡方检验, TGF-β2在HBV阳性与HBV阴性两组的表达无显著差异(P>0.05), 而TNF-α在HBV阳性与HBV阴性两组的表达有显著差异(P<0.05, 表3). 经卡方检验, 各组的TGF-β2和TNF-α的表达总的来说有显著差异且二者之间存在正相关关系. 其中慢性乙肝组与肝硬化、癌旁肝硬化和肝癌组间TGF-β2 的表达有非常显著差异(P<0.01); 慢性乙肝组与肝硬化和肝癌组间 TNF-α的表达有非常显著差异(P<0.01), 肝硬化与癌旁肝硬化间TNF-α的表达有显著差异(P<0.05).
T细胞免疫在HBV感染中对病毒的清除、控制和肝组织病理损伤起主要作用, 并对疾病的转归有重要影响. CD4+T/CD8+T比值可以在一定程度上反映机体细胞免疫调节功能. 我们发现, 在HBV感染者外周血出现CD4+细胞数量下降, CD8+细胞数量升高导致CD4+T/CD8+T比值下降并同时伴随转氨酶升高, 肝功能下降, 并且CD8+数量与ALT, AST呈正相关. 此结果与已有的研究结果相符合[8-9]. 我们发现聚集在肝组织内的CD8+细胞绝对数量多于CD4+细胞数倍, 与国外研究资料结果相同[10-12], 但国外实验发现在肝坏死区聚集的T淋巴细胞多为CD8+细胞, 而汇管区聚集的T淋巴细胞则以CD4+居多. 这点与本结果不同, 无论在汇管区还是在坏死的小叶区, 浸润的淋巴细胞均以CD8+细胞占优势. CD25是低亲和性膜白介素2受体(mIL-2R)的α链, 主要分布于活化T淋巴细胞表面, 是活化T细胞标志[13-14]. 金秀国et al[15]的结果显示各肝病患者CD25+T细胞含量均明显低于正常对照组. 说明肝病患者T细胞活性明显低下, 这也可能是导致慢性肝病患者对病毒产生耐受, 使病毒难以消除、病情迁延不愈的一个重要因素. 本实验结果显示肝组织内HBV标志阴性组的CD25+细胞为9.8个每百个淋巴细胞, 而HBV标志阳性组的CD25+细胞为8.14个每百个淋巴细胞, 但可以看出HBV标志阳性组的CD25+细胞数量有减少的趋势, 但统计学上来说没有显著意义, 可能还需扩大样本量, 尤其是HBV标志阴性组的样本量.
慢性肝病中转化生长因子(TGF-β)是一种多功能的调节因子. 哺乳动物主要表达TGF-β1, TGF-β2, TGF-β3三种亚型. 潘志刚et al[16]发现TGF-β2高表达与肝癌复发和门脉癌栓正相关. 这可能与TGF-β2的免疫抑制功能有关. 国外有研究使用带反义TGF-β2基因的基因疫苗治疗小鼠肝癌, 并取得一定效果, 证实降低TGF-β2的表达可增加肿瘤细胞的免疫原性[17]. 我们发现TGF-β2在肝癌细胞、胆管细胞和间质细胞中强烈表达, 且在肝癌组中的强阳性率为41.2%, 在所有组中阳性率最高, 提示TGF-β2在肝癌形成和发展过程中起重要作用. TGF-β2表达在肝癌细胞和间质细胞提示TGF-β2通过自分泌和旁分泌作用于肿瘤[18]. 有学者发现TGF-β2的表达与正常组织相比增加3倍, 主要表达在窦周细胞[19]. 我们发现TGF-β2在肝硬化中的阳性率为29.7%, 与癌旁肝硬化(28.6%)相近, 明显强于正常组(0%)和肝纤维化不明显的慢性肝炎组(0%), 提示TGF-β2参与了肝的纤维化, 并在其发生发展过程中起重要作用. TNF-α与TGF-β2一样被认为是在肝纤维化及肝癌发生过程中比较重要的细胞因子[20]. Orfila在99年就发现四氯化碳造成鼠肝脏纤维化过程中, TNF-α的阳性表达增强[21]. 最近有学者在TNF-α对鼠肝癌细胞的研究中发现TNF-α能损害肝细胞的DNA, 可能在肝细胞向肝癌细胞转变的早期阶段起一定作用[22-23]. 提示了TNF-α与肝癌的发生有关. 与国内外研究资料相同, 本组资料显示TNF-α阳性表达程度较弱, 没有TGF-β2强烈, 主要表达在窦内皮细胞, 单核细胞和肝细胞. 根据本实验结果, TNF-α在肝癌中的阳性率最高, 为52.9%, 其次是肝硬化组为45.9%, 这两组的阳性率明显高于正常组和慢性肝炎组, 提示TNF-α同样参与了肝纤维化过程, 并且在肝癌的形成和发展过程中也起一定作用, 其参与程度可能不如TGF-β2. 同时本研究还发现TNF-α和TGF-β2的表达呈正相关, 提示其二者之间还可能存在协同作用. 近年来普遍认为TNF-α与HBsAg, HBcAg和HBV DNA等的关系密切. 本组资料显示TNF-α的阳性表达与HBV感染密切相关, 在慢性肝病患者中, HBV阴性组的TNF-α阳性率为20%, 而HBV阳性组TNF-α阳性率为59%, 二者之间存在显著差异, 可以认为TNF-α的阳性表达增强与HBV感染有关. TGF-β2与HBV的关系笔者未见相关报道, 从本研究结果来看HBV阴性组的TGF-β2阳性率为30%, 而HBV阳性组TGF-β2阳性率为38.6%, 二者之间没有显著差异. 可以认为TGF-β与HBV感染不存在相关关系, 而只在肝纤维化及肝癌形成过程中发挥作用.
近年来, 我国的HIV的感染率不断上升, 并有不少患者同时合并HBV感染. 由于CD4+细胞是HIV攻击的主要靶细胞, 可使外周血CD4+细胞数目显著减少和功能严重受损, CD4+和CD8+细胞比值下降; 而由本实验可看出HBV感染者本就可导致CD4+细胞数目减少, T细胞功能下降, HBV感染者可能易受HIV感染易使病情恶化. 我国HBV感染者众多, 因其所存在的T细胞紊乱可能为HIV的感染提供有利条件, 因此有必要对此保持关注.
编辑: 张海宁 电编: 潘伯荣
| 1. | Ferrari C, Penna A, Bertoletti A, Gavalli A, Missale G, Lamonaca V, Boni C, Valli A, Bertoni R, Vrbani S. Antiviral cell-mediated immune responses during hepatitis B and hepatitis C virus infections. Recent Results Cancer Res. 1998;154:330-336. [PubMed] |
| 2. | Vgas GN. Immunobiology of persistent blood-borne viral infections. Dev Biol. 2000;102:9-17. [PubMed] |
| 3. | Guo J T, Zhou H, Liu C, Aldrich C, Saputelli J, Whitaker T, Barrasa MI, Mason WS, Seeger C. Apoptosis and regeneration of hepaocytes during recovery from transient hepadnavirus infections. J Virol. 2000;74:1495-1505. [PubMed] |
| 5. | Maini MK, Boni C, Lee CK, Larrubia JR, Reignat S, Ogg GS, King AS, Herberg J, Gilson R, Alisa A. The role of virus-specific CD8+ cells in liver damage and viral control during persistent hepatitis B virus infection. J Exp Med. 2000;191:1269-1280. [PubMed] |
| 6. | Sobao Y, Tomiyama H, Sugi K, Tokunaga M, Veno T, Saito S, Fujiyama S, Moyimto M, Tanaka K, Takiguchi M. The role of hepatitis B virus specific memory CD8 T cells in the control of viral replication. J Hepatal. 2002;36:105-115. [PubMed] |
| 7. | Bertoletti A, Maini M, Williams R. Role of hepatitis B virus specific cytoxic T cells in liver damage and viral control. Antiviral Res. 2003;60:61-66. [PubMed] |
| 8. | 杨 婉凤, 金 树根, 汤 小青, 彭 志云, 杨 协珍, 董 慧芳, 陈 建杰. 肝脏患者外周血CD4+、CD8+和CD16+56+细胞亚群变化. 世界肿瘤杂志. 2002;1:119-122. |
| 10. | Mosnier JF, Pham BN, Walker F, Dubois S, Degos F, Erlinger S, Degott C. Relationship between composition of lymphoid cell infiltrates in the liver and replication status in chronic hepatitis B: an immunohistochemical study. Am J Clin Pathol. 1996;106:625-633. [PubMed] |
| 11. | Aoyama K, Takashi K, Kyouichi I, Sasaki H. Immunohistochemical investigation of hepatitis B virus associated antigens HLA antigens and lymphocyte subsets in type B chronic hepatitis. Gastroenterol Jpn. 1990;25:41-53. [PubMed] |
| 12. | Senaldi G, Portmann B, Mowat AP, Mieli-Vergani G, Vergani D. Immunohistochemical features of the portal tract mononuclear cell infiltrate in chronic aggressive hepatitis. Arch Dis Child. 1992;67:1447-1453. [PubMed] |
| 17. | Maggard M, Meng L, Ke B, Allen R, Devgan L, Imagawa DK. Antisense TGF-beta2 immunotherapy for hepatocellular carcinoma: treatment in a rat tumor model. Ann Surg Oncol. 2001;8:32-37. [PubMed] |
| 18. | Abou-Shady M, Baer HU, Friess H, Berberat H, Gold LI, Korc M, Buchler MW. Transforming growth factor betas and their signaling receptors in human hepatocellular carcinoma. Am J Surg. 1999;177:209-215. [PubMed] |
| 19. | Baer HU, Friess H, Abou-Shady M, Berberat P, Zimmermann A, Gold LI, Kore M, Buchlet MW. Transforming growth factor betas and their receptors in human liver cirrhosis. Eur J Gastroenterol Hepatol. 1998;10:1031-1039. [PubMed] |
| 21. | Orfila C, Lepert JC, Alric L, Garrera Gberaud M, Vinel JP, Pipy B. Expression of TNF-alpha and immunohistochemical distribution of hepatic macrophage surface markers in carbon tetrachloride-induced chronic liver injury in rats. Histochem J. 1999;31:677-685. [PubMed] |
| 22. | Wheelhouse NM, Chan YS, Gillies SE, Caldwell SE, Caldwell H, Ross JA, Harrison DJ, Prost S. TNF-alpha induced DNA damage in primary murine hepatocytes. Int J Mol Med. 2003;12:889-894. [PubMed] |
| 23. | Iocca HA, Isom HC. Tumor necrosis factor-alpha acts as a complete mitopgen for primary rat hepatocytes. Am J Pathol. 2003;163:465-476. [PubMed] |