修回日期: 2005-01-28
接受日期: 2005-02-02
在线出版日期: 2005-03-15
目的: 观察caspase-3, Bcl-XL及Cox-2在胃癌和癌旁组织中的表达, 并探讨三者与胃癌生物学行为及与临床病理行为的关系.
方法: 中国医科大学第二临床学院2000/2003年存档的胃癌及癌旁组织石蜡切片标本54例, 采用免疫组织化学方法观察caspase-3, Bcl-XL及Cox-2在胃癌和癌旁组织中的表达, 采用SPSS11.5分析软件进行统计学处理, 应用χ2检验分析caspase-3, Bcl-XL, Cox-2表达与临床病理行为的关系, 同时分析三者表达的相关性.
结果: 胃癌组织中caspase-3, Bcl-XL, Cox-2表达的阳性率分别为22.2%, 53.7%, 62.9%. caspase-3表达在不同组织学分级、淋巴结转移组与非转移组、TNM分期间有显著差异(P=0.022, P=0.010, P=0.007). Bcl-XL表达在不同组织学分级、Laurren分型、淋巴结转移组与非转移组、TNM分期间有显著差异(P=0.033, P=0.005, P=0.016, P=0.009). Cox-2表达在不同组织学分级、淋巴结转移组与非转移组间、在不同TNM分期间有显著差异(P=0.013, P=0.019, P=0.008). caspase-3和Bcl-XL表达呈负相关(r=-0.308, P=0.024), Bcl-XL和Cox-2表达呈正相关(r=0.442, P=0.001), caspase-3与Cox-2表达无明显相关性(r=-0.051, P=0.713).
结论: 人胃癌组织caspase-3表达较低, 而Bcl-XL及Cox-2表达较高. 人胃癌组织caspase-3, Bcl-XL, Cox-2表达与胃癌组织学分级、Laurren分型、淋巴结转移、TNM分期密切相关, 对判断胃癌预后可能具有重要价值. 人胃癌组织caspase-3与Bcl-XL表达呈负相关, 而Bcl-XL与Cox-2表达呈正相关.
引文著录: 赵滢, 张天彪, 王强. 胃癌组织caspase-3, Bcl-XL和Cox-2表达与临床病理行为的关系. 世界华人消化杂志 2005; 13(6): 711-715
Revised: January 28, 2005
Accepted: February 2, 2005
Published online: March 15, 2005
AIM: To analyze the expression of caspase-3, Bcl-XL and Cox-2 gastric cancer tissues, and to evaluate the clinicopathological relevance of these three factors.
METHODS: The immunohistochemistry was used to detect the expression of caspase-3, Bcl-XL and Cox-2 in 54 specimens of gastric cancer tissues and paracancer tissues. SPSS11.5 was used for statistical analysis. The relationship between the clinicopathology and the expression of caspase-3, Bcl-XL and Cox-2 in the specimens, and the correlation among the three factors were analyzed by χ2 test.
RESULTS: Positive cytoplasmic immunoreactivity was detected in a proportion of 22.2% for caspase-3, 53.7% for Bcl-XL, and 62.9% for Cox-2 in the gastric cancer tissues respectively. There was a significant correlation between the expression of caspase-3 and Bcl-XL (r = -0.308, P = 0.024), as well as that between Bcl-XL and Cox-2 (r = 0.442, P = 0.001). No significant correlation was found between the expression of caspase-3 and Cox-2 (r = -0.051, P = 0.713). The difference of the expression of caspase 3 among specimens in different histological types, status of regional lymph nodes and TNM stages was significant (P = 0.022, 0.010, 0.007). Similar immunoreactivity was found with Bcl-XL and Cox-2. There was statistical difference in the expression of Bcl-XL among samples with different histological types, Laurren classification, status of regional lymph nodes and TNM stages (P = 0.033, 0.005, 0.016, 0.009). The difference was also present in the expression of Cox-2 in specimens with different histological types, status of regional lymph nodes and TNM stages (P = 0.013, 0.019, 0.008).
CONCLUSION: The expression of caspase-3 is relatively low, and Bcl-XL and Cox-2 are high in human gastric cancer tissues. There is an inverse association between the expression of caspase-3 and Bcl-XL, and a positive correlation between Bcl-XL and Cox-2. The expression of caspase-3, Bcl-XL and Cox-2 was closely related to histological types, Laurren classification, TNM stages and status of regional lymph nodes. Their expression seems to add significant values for the prognosis of gastric cancers.
- Citation: Zhao Y, Zhang TB, Wang Q. Expression and clinicopathological relationship of caspase-3, Bcl- XL and Cox-2 in gastric cancer tissue. Shijie Huaren Xiaohua Zazhi 2005; 13(6): 711-715
- URL: https://www.wjgnet.com/1009-3079/full/v13/i6/711.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i6.711
胃癌是危害人类健康的主要恶性肿瘤之一, 其发病原因尚未明了. 近年来众多研究表明细胞凋亡异常与肿瘤的发生发展有着密切关系. 机体组织自稳态调节紊乱导致细胞增生与凋亡平衡失调, 以及细胞增生和细胞凋亡的相互消长决定了肿瘤的发生、发展及转归[1]. 分子生物学及生物化学研究表明caspase家族是直接导致细胞凋亡解体的蛋白酶系统, 在细胞凋亡机制网络中居中心地位. 系统caspase级联切割的过程构成凋亡的执行系统[2]. 我们采用免疫组织化学方法观察caspase-3, Bcl-XL及Cox-2在胃癌组织中的表达, 并探讨三者与胃癌生物学行为及预后的关系.
中国医科大学第二临床学院病理科2000/2003年存档的胃癌及癌旁组织石蜡切片标本(术前均未经放化疗及非甾体类抗炎药治疗)54例, 男女比1.7: 1, 年龄38-78(平均60)岁. 组织学分型参照全国胃癌诊治统一方案[3]; 按Laurren方案将胃癌分成肠型和弥漫型; 根据有无胃周围淋巴结转移分为转移组和非转移组; 按照日本胃癌协会方案分为早期胃癌与进展期胃癌; 临床分期采用UICC的TNM方案. caspase-3, Bcl-XL, Cox-2鼠抗人浓缩型mAb购自北京中山公司(JHM62, ZM-0320; ZH12, ZM-0301; COX229, ZM-0035), 工作浓度分别为1: 200, 1: 100, 1: 50, 免疫组化S-ABC试剂盒购自武汉博士德公司(SA1021), APEs粘片剂和DAB显色试剂盒购自福州迈新公司(AR1022).
采用SABC法进行免疫组化染色. 以胞质中出现棕黄色颗粒为阳性细胞, 参照Chhanabhai et al[4]的计数方法, 400倍光镜下计数5个视野, 阳性细胞率=阳性细胞数/总细胞数100%, 对于视野中肿瘤细胞阳性程度不同时, 取明显着色者计数. 按阳性细胞数所占比例分为: 阳性细胞数<5%为表达阴性组, 阳性细胞数≥5%为表达阳性组.
统计学处理 采用SPSS11.5分析软件进行统计学处理, 应用χ2检验分析caspase-3, Bcl-XL, Cox-2表达与临床病理行为的关系, 应用相关分析检验caspase-3, Bcl-XL, Cox-2表达间的相关性(P<0.05为差异显著性标准).
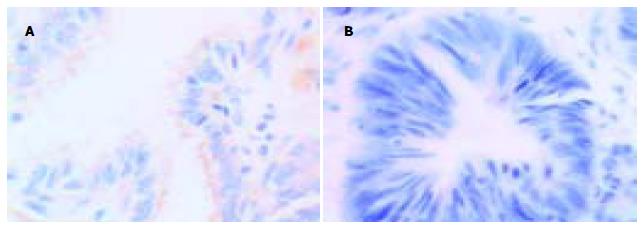
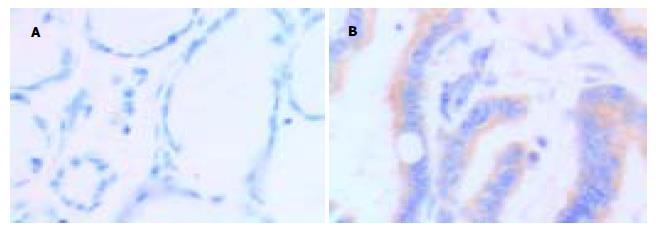
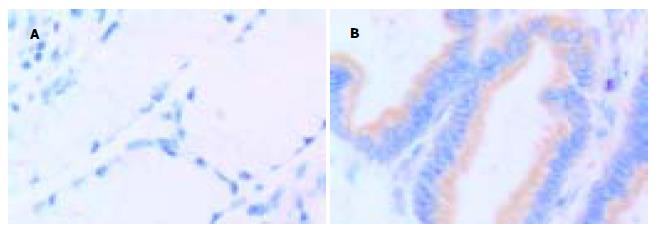
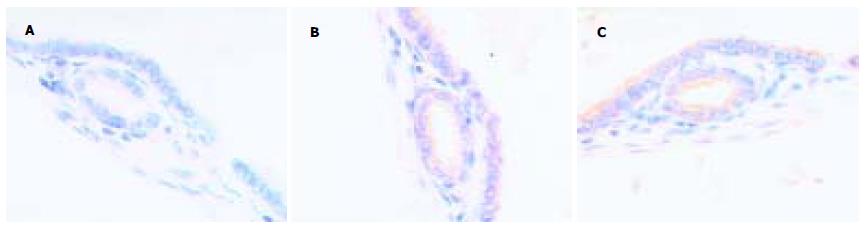
正常胃黏膜caspase-3阳性染色位于胃小凹的黏液上皮细胞, 顶部染色最强, 颈部细胞和固有腺体少见阳性细胞. Bcl-XL阳性染色见于胃小凹黏液上皮细胞、壁细胞和主细胞. Cox-2阳性染色见于胃癌上皮细胞的胞质或沿核膜周边呈线状分布. caspase-3在胃癌和癌旁组织中阳性率分别为22.2%和55.6%, Bcl-XL在胃癌和癌旁组织中阳性率分别为53.7%和33.3%, Cox-2在胃癌和癌旁组织中阳性率分别为62.9%和16.7%, 三组均有显著性差异(P<0.05). 早期胃癌和进展期胃癌中caspase-3阳性率分别为40%, 20.4%; Bcl-XL阳性率分别为60%, 53.1%; Cox-2阳性率分别为80%, 61.2%. 三组均未见显著差异(P = 0.315, P = 0.767, P = 0.418).
caspase-3阳性率在不同组织学分级间有显著差异(P = 0.022); 在淋巴结转移组与非转移组有显著差异(P = 0.010); 在不同TNM分期间有显著差异(P = 0.007); 肠型和弥漫型胃癌的caspase-3阳性率无显著差异(P = 0.826). Bcl-XL阳性率在不同组织学分级间有显著差异(P = 0.033); 肠型与弥漫型胃癌的Bcl-XL阳性率有显著差异(P = 0.005); 在淋巴结转移组与非转移组有显著差异(P = 0.016); 在不同TNM分期间有显著差异(P = 0.009). Cox-2阳性率在不同组织学分级间Cox-2阳性率有显著差异(P = 0.013); 在淋巴结转移组与非转移组间有显著差异(P = 0.019); 在不同TNM分期间有显著差异(P = 0.008); 在Laurren分型间差异无显著性(P = 0.614).
caspase-3和Bcl-XL表达呈负相关(r = -0.308, P = 0.024), Bcl-XL和Cox-2表达呈正相关(r = 0.442, P = 0.001), caspase-3与Cox-2表达无明显相关性(r = -0.051, P = 0.713).
在多种刺激引起的凋亡中, caspase-3是关键的效应分子, 激活的caspase-3能使许多细胞结构、细胞周期及DNA修复等相关蛋白或激酶失活, 从而使细胞凋亡. Bcl-XL是最近发现的bcl-2基因家族编码的一种蛋白, 其氨基酸序列及结构与bcl-2具有很大相似性, 因此, 在功能上也具有抑制细胞凋亡的作用[5]. Bcl-XL不仅可能通过抑制细胞色素C等从线粒体的释放调控着线粒体渗透性转换孔的开启, 从而抑制caspase-3的活化, 还可能参与抑制caspase-3的合成[6-7]; 这种联系类似于线虫细胞凋亡过程中CED-9对CED-3的抑制(线虫的CED-9和CED-3蛋白分别与哺乳动物bcl-2及caspase家族在进化上具有同源性)[5,7], Bcl-XL抑制凋亡主要是通过抑制caspase-3的激活实现的[8-9]. 动物实验表明, Cox-2表达增加了PGE2(prostaglandin endoperoxide synthase-2)的合成, PGE2可诱导细胞增生并刺激Bcl-2蛋白表达, 从而抑制凋亡, 促进肿瘤发生. 我们检验胃癌组织中caspase-3, Bcl-XL, Cox-2的表达来观察他们之间的相互关系、与胃癌组织病理特点的关系及对预后的影响. 结果发现胃癌组织中caspase-3表达较低, 而Bcl-XL及Cox-2有较高表达, 这与Yamamoto et al[10]、Hoshi et al[11]、van der Woude et al[12]的研究结果一致. 提示在胃癌的发生发展过程中, 存在三者表达的失调.
根据caspase-9, bcl-XL, Apaf-1形成的三元复合物"瀑布"学说[13], Apaf-1与caspase-9的氨基端相结合, 导致caspase-9活化, 而活化的caspase-9又继续激活caspase-3, 从而导致细胞内重要蛋白的溶解和细胞凋亡, 因此caspase-3的激活可能是导致细胞凋亡最后的通路. Bcl-XL能与Apaf-1和caspase-9形成的复合物结合, 形成上述的三元复合物, 而该复合物抑制caspase-9的活性, 阻断了"瀑布"的形成, 从而抑制细胞凋亡. 与Hoshi et al的研究相似[11], 我们通过联合检测54例胃癌组织中caspase-3和Bcl-XL的表达, 发现早期和进展期胃癌中caspase-3和Bcl-XL的表达无显著差异, 说明在肿瘤演进过程中, caspase-3与Bcl-XL表达异常可能是早期事件, 这与梁智勇et al[14]的研究一致, 这就提示我们能否把caspase-3, Bcl-XL的检测作为早期发现胃癌的方法. 进一步分析caspase-3和Bcl-XL与胃癌临床病理行为之间的关系发现, 随肿瘤组织分化程度的降低, caspase-3表达阳性率降低, 而Bcl-XL表达阳性率升高, 并且caspase-3和Bcl-XL的表达与TNM分期均有相关性, 提示caspase-3与Bcl-XL的表达强度影响肿瘤的恶性程度及发展趋势, 可在一定程度上提示胃癌患者的预后. caspase-3和Bcl-XL的表达呈负相关, 提示在胃癌的发展过程中Bcl-XL可能抑制caspase-3的表达. 最近, 凋亡信号转导的理论研究又取得了新的进展, Kirsch et al[15]研究发现caspase-3亦可作为Bcl-2家族的上游调控机制, caspase-3剪切Bcl-2后形成的片段可以进一步促进下游caspase-3激活和放大caspase级联效应, 这样就形成了一个caspase级联反应的阳性反馈环路.
环氧化酶(cyclooxygenase, Cox)是前列腺素合成过程中的限速酶, 有Cox-1(结构型)和Cox-2(诱导型)两种亚型. Cox-1在大多数组织中均有表达, 主要参与维持机体的正常生理功能, 而Cox-2在正常生理状态下多数组织检测不到, 只有在细胞因子、肿瘤促进剂、癌基因等刺激下才能在某些细胞内迅速产生[10,16-17]. Cox-2抑制凋亡发生, 促进细胞黏附. 研究表明, 在胃癌等消化道肿瘤中, Cox-2呈高度表达, 并且Cox-2表达与胃癌淋巴结转移、TNM分期及组织病理分级密切相关, 但与Laurren分型及肿瘤早期和进展期不相关[17]. 本研究也显示了类似的结果, 说明Cox-2的过度表达参与了胃癌的发展过程, 并可增强胃癌的淋巴转移, 提示预后不佳, 在判定临床治疗的效果上有一定的指导意义. Tsujii et al[18]认为Cox-2的表达增高可引起Bcl-2高度表达, 降低E-钙粘蛋白的活性, 抑制细胞凋亡, 从而导致肠道肿瘤的发生, 并可增加恶性肿瘤的细胞侵袭力, 表明Cox-2过度表达改变了细胞某些增生和凋亡相关基因的表达, 从而促进肿瘤恶性行为的发生. 通过本实验我们发现, 与癌旁组织相比, 胃癌组织中Cox-2与Bcl-XL都存在高度表达, 而且Cox-2与Bcl-XL表达间存在正相关, 其可能的机制是Cox-2可能是Bcl-XL的上游调节者, 通过促进Bcl-XL的表达而抑制胃癌细胞凋亡, 促进其发生发展. 通过本实验我们认为Cox-2的过度表达抑制了胃癌细胞凋亡, 加速细胞增生, 促进了胃癌的发生和发展, 这为Cox-2抑制剂可能用于某些肿瘤的预防和治疗提供了一定的理论依据. 目前, 尚需进一步研究来明确caspase-3, Bcl-XL, Cox-2在胃肠肿瘤形成及凋亡发生中所起的作用, 为胃肠肿瘤的治疗和化疗方案的制定开辟新的途径.
编辑: 张海宁 电编: 潘伯荣
| 1. | Jung C, Motwani M, Kortmansky J, Sirotnak FM, She Y, Gonen M, Haimovitz-Friedman A, Schwartz GK. The cyclin-dependent kinase inhibitor flavopiridol potentiates gamma-irradiation-induced apoptosis in colon and gastric cancer cells. Clin Cancer Res. 2003;9:6052-6061. [PubMed] |
| 2. | Cho SJ, Kang NS, Park SY, Kim BO, Rhee DK, Pyo S. Induction of apoptosis and expression of apoptosis related genes in human epithelial carcinoma cells by Helicobacter pylori VacA toxin. Toxicon. 2003;42:601-611. [PubMed] |
| 3. | 中国抗癌协会编. 新编常见恶性肿瘤诊治规范. 北京: 北京医科大学、北京协和医科大学联合出版社 1999; 5-7. |
| 4. | Chhanabhai M, Krajewski S, Krajewska M, Wang HG, Reed JC, Gascoyne RD. Immunohistochemical analysis of interleukin-1 b-converting enzyme/Ced-3 family protease, CPP32/Yama/caspase-3, in Hodgkin's disease. Blood. 1997;90:2451-2455. [PubMed] |
| 5. | Irvin BJ, Wood LD, Wang L, Fenrick R, Sansam CG, Packham G, Kinch M, Yang E, Hiebert SW. TEL, a putative tumor suppressor, induces apoptosis and represses transcription of Bcl-XL. J Biol Chem. 2003;278:46378-46386. [PubMed] |
| 6. | Voutsadakis IA. Apoptosis and the pathogenesis of lymphoma. Acta Oncol. 2000;39:151-156. [PubMed] |
| 7. | Swanton E, Savory P, Cosulich S, Clarke P, Woodman P. Bcl-2 regulates a caspse-3/caspase-2 apoptotic cascade in cytosolic extracts. Oncogene. 1999;18:1781-1787. [PubMed] |
| 8. | Abdelhaleem M. Differential effect of Bcl-xl over-expression on cell death of the monocytic leukemia cell line U937. Anticancer Res. 2002;22:3911-3915. [PubMed] |
| 9. | Chen YC, Shen SC, Lee WR, Hsu FL, Lin HY, Ko CH, Tseng SW. Emodin induces apoptosis in human promyeloleukemic HL-60 cells accompanied by activation of caspase 3 cascade but independent of reactive oxygen species production. Biochem Pharmacol. 2002;64:1713-1724. [PubMed] |
| 10. | Yamamoto H, Itoh F, Fukushima H, Hinoda Y, Imai K. Overexpression of cyclooxygenase-2 protein is less frequent in gastric cancers with microsatellite instability. Int J Cancer. 1999;84:400-403. [PubMed] |
| 11. | Hoshi T, Sasano H, Kato K, Yabuki N, Ohara S, Konno R, Asaki S, Toyota T, Tateno H, Nagura H. Immunohistochemistry of Caspase-3/CPP32 in human stomach and its correlation with cell proliferation and apoptosis. Anticancer Res. 1998;16:4347-4353. [PubMed] |
| 12. | van der Woude CJ, Kleibeuker JH, Tiebosch AT, Homan M, Beuving A, Jansen PL, Moshage H. Diffuse and intestinal type gastric carcinomas differ in their expression of apoptosis related proteins. J Clin Pathol. 2003;56:699-702. [PubMed] |
| 13. | Pan G, O'Rourke K, Dixit VM. Caspase-9, Bcl-XL, and Apaf-1 form a ternary complex. J Biol Chem. 1998;273:5841-5845. [PubMed] |
| 15. | Kirsch OG, Doseff A, Chau BN, Lim DS, de Souza-Pinto NC, Hansford R, Kastan MB, Lazebnik YA, Hardwick JM. Caspase-3-dependent cleavage of Bcl-2 promotes ralease of cytothrome C. J Biol Chem. 1999;274:21155-21162. [PubMed] |
| 16. | Ratnasinghe D, Tangrea JA, Roth MJ, Dawsey SM, Anver M, Kasprzak BA, Hu N, Wang QH, Taylor PR. Expression of cyclooxygenase-2 in human adenocarcinomas of the gastric cardia and corpus. Oncol Rep. 1999;6:965-968. [PubMed] |
| 17. | Murata H, Kawano S, Tsuji S, Tsuji M, Sawaoka H, Kimura Y, Shiozaki H, Hori M. Cyclooxygenase-2 overexpression enhances lymphatic invasion and metastasis in human gastric carcinoma. Am J Gastroenterol. 1999;94:451-455. [PubMed] |