修回日期: 2004-11-07
接受日期: 2004-11-12
在线出版日期: 2005-01-15
目的: 构建血管内皮细胞生长因子受体2(VEGFR2) siRNA腺病毒载体, 并研究其对结肠癌细胞系LOVO VEGFR2表达的影响.
方法: 首先构建含有VEGFR2siRNA的鼠U6载体(mU6-VEGFR2siRNA); 利用HindⅢ与XbaⅠ双酶切将鼠U6载体启动子和VEGFR2siRNA克隆入无启动子穿梭载体promoterless pShuttle vector, 得到pShuttle-mU6pro-VEGFR2siRNA; 将pShuttle-mU6pro-VEGFR2siRNA与腺病毒骨架质粒(pAdeasy-1)在BJ5183细菌中进行同源重组, 得到pAdeasy-mU6pro-VEGFR2siRNA; 利用得到的重组腺病毒感染人结肠癌LOVO细胞系, 观察VEGFR2 siRNA对结肠癌细胞VEGFR2表达的影响. 采用West-blot检测感染前后VEGFR2蛋白表达水平的变化.
结果: 成功构建血管内皮细胞生长因子受体2(VEGFR2) siRNA腺病毒载体, 该载体显著抑制LOVO细胞中VEGFR2的蛋白表达水平(P<0.01).
结论: 构建的Adeasy-mU6pro-VEGFR2siRNA腺病毒能有效地抑制LOVO细胞中VEGFR2表达, 从而为肿瘤的基因治疗打下基础, 也为肿瘤血管抑制治疗提供了新思路.
引文著录: 黄大伟, 吴开春, 潘阳林, 林涛, 刘长江, 郭长存, 樊代明. VEGFR2siRNA腺病毒载体的构建及其对人结肠癌细胞系的影响. 世界华人消化杂志 2005; 13(2): 184-188
Revised: November 7, 2004
Accepted: November 12, 2004
Published online: January 15, 2005
AIM: To construct an adenovirus vector for efficient delivery of vascular endothelial growth factor receptor 2 (VEGFR2) siRNA, and to investigate its effect on human colorectal cancer LOVO cells.
METHODS: After digestion with Hind III and Xba I, the U6 promoter and VEGFR2 siRNA were cloned into the promoterless shuttle vector to construct pShuttle-mU6pro-VEGFR2siRNA. Then the product vector was cotransformed with adenovirus backbone containing plasmid pAdeasy-1to produce pAdeasy-mU6pro-VEGFR2siRNA by homologous recombinantion. Finally the human colorectal cancer LOVO cells were infected with the recombinant adenovirus and the VEGFR2 expression was examined using Western-blot.
RESULTS: The pAdeasy-mU6pro-VEGFR2siRNA was successfully constructed. VEGFR2siRNA mediated by the adenovirus significantly inhibited the expression of VEGFR2 in LOVO cell lines (P < 0.01).
CONCLUSION: The pAdeasy-mU6pro-VEGFR2siRNA can effectively down-regulate VEGFR2 expression in LOVO cell line, which lays the foundation for gene therapy of colorectal cancer.
- Citation: Huang DW, Wu KC, Pan YL, Lin T, Liu CJ, Guo CC, Fan DM. Construction of adenoviral vector encoding VEGFR2 siRNA and its effect on human colorectal cancer LOVO cell line. Shijie Huaren Xiaohua Zazhi 2005; 13(2): 184-188
- URL: https://www.wjgnet.com/1009-3079/full/v13/i2/184.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i2.184
基因治疗作为一种治疗肿瘤的新手段日益受到人们的重视. 腺病毒由于其安全、高效而在基因治疗中广泛被用做载体. 肿瘤的生长需要丰富的血供, 血管内皮生长因子(VEGF)是肿瘤血管生长的重要调节因子, 与血管内皮细胞上的VEGF受体结合后能促进肿瘤血管的生长, 加快肿瘤的生长和转移. 但外源性VEGF也可直接与肿瘤细胞表面的VEGF受体结合, 促进肿瘤细胞的生长[1]. 我们利用小干扰RNA技术, 阻断或降低肿瘤细胞表达VEGF受体, 进而抑制其与VEGF的结合, 达到阻滞肿瘤生长的目的.
LOVO细胞株由第四军医大学动物中心提供, 293细胞、BJ5183细菌和腺病毒(Ad5)骨架质粒(pAdeasy-1)由本所保存, promoterless shuttle vector(pshuttle)由第四军医大学生化教研室杨安钢教授惠赠. 胎牛血清、新生牛血清购自杭州四季青生物材料工程有限公司, DMEM系Gibco产品, HindⅢ、XbaⅠ为Takara公司产品. Oligo1、Oligo2由上海生工合成, 质粒小量提取试剂盒和小量胶回收试剂盒, 购自上海华舜公司. 胰蛋白胨及酵母提取物, 购自宝泰克公司. 抗KDR一抗(mAb)及二抗均购自北京中山公司, 其余试剂均为国产分析纯.
VEGFR2 siRNA的设计及pShuttle-mU6pro-VEGFR2siRNA、pShuttle-mU6pro构建设计针对VEGF受体2(基因号AF063658)3641-3660bp的小干扰RNA, 具体设计如下: Forward. primer:5'-TTTGATTCCTGCTGTGTTGTCAACATGACAACACAGCAGGAATCTTTTT-3'reverse. primer:5'-ctagaaaaagattcctgctgtgttgtcatgttgacaacacagcaggaat-3', 将Oligo1、Oligo2根据退火条件在95 ℃退火5 min, 自然冷却, 得到退火产物VEGFR2siRNA, 以小提质粒试剂盒提取U6质粒, BbsI、XbaI双酶切U6质粒, 胶回收大片段, 用T4 DNA连接酶连接胶回收片段和退火产物VEGFR2siRNA, 16 ℃连接12 h, 将获得的连接产物10 μL与低温CaCl2制备的E. coli DH5α感受态细菌轻轻旋转混匀, 加入LB 0.8 mL, 37 ℃摇床160 r/min摇动1 h, 将得到的产物4000 r/min离心5 min, 去掉大部分上清, 留取液体200 μL, 混匀沉淀, 将其涂于氨苄抗性的平皿上, 过夜培养, 挑取克隆, 测序证明无误, 得到mU6-VEGFR2siRNA, 再以XbaI、HindⅢ双酶切mU6-VEGFR2siRNA和pshuttle质粒, 分别胶回收小、大片段, T4 DNA连接酶连接胶回收片段, 16 ℃连接12 h, 转化E. coli DH5α感受态细菌, 铺于卡那霉素抗性平皿上, 过夜培养, 挑取克隆, 测序证明无误, 最后得到pShuttle-mU6pro-VEGFR2siRNA. pShuttle-mU6pro的构建设计引物: forward primer:5'-GGGGTACCCCATCCGACGCCGCCATCTCTA-3'(带有KpnI酶切位点)reverse primer:5'-GCTCTAGAGCGGATCCGAAGACCACAAAC-3' (带有XbaI酶切位点), 以U6质粒为模板进行PCR, 94 ℃ 5 min 1个循环, 94 ℃ 1 min、60 ℃ 45 s、72 ℃ 45 s共5个循环, 之后94 ℃ 1 min、65 ℃ 45 s、72 ℃ 45 s共30个循环, 72 ℃ 10 min1个循环. 将PCR扩增产物及穿梭载体(Pshuttle)分别用KpnI、XbaI双酶切, 胶回收相应片段, T4 DNA连接酶连接, 得到Pshuttle-U6pro, 测序并酶切鉴定.
1.2.1 同源重组: 将质粒pShuttle-mU6pro、pShuttle-mU6pro-VEGFR2siRNA用PmeI酶切, 回收线性化载体, 去磷酸化后分别与腺病毒骨架质粒pAdeasy-1(摩尔数之比均为10:1)共转染BJ5183电转化感受态细胞. pShuttle-mU6pro组: 电压2412V, 电阻200 , 电容25 μF, 电穿时间4.3 ms; pShuttle-mU6pro-VEGFR2siRNA组: 电压2417V, 电阻200 , 容25 μF, 电穿时间3.8 ms. 之后在电穿孔杯内各加入LB 0.5 mL, 分别混匀后铺于卡那霉素抗性平皿上, 过夜培养, 挑取克隆, 用PacI酶切鉴定, 得到pAd-mU6pro-VEGFR2siRNA、pAd-mU6pro. 将正确克隆的质粒转入DH5α感受态细胞中扩增.
1.2.2 重组腺病毒的包装、扩增及滴度测定: 包装细胞293细胞于250 mL培养瓶中培养, 加入DMEM、100 mL/L胎牛血清、以及100 kU/L青霉素、100 mg/L链霉素. 转染前1 d, 将1.5106 293细胞种植于6孔板中, 将腺病毒Ad-mU6pro-VEGFR2siRNA、Ad-mU6pro DNA各5 μg用PacI酶切并胶回收. 用10 μL LipofectamineTM 2000按照使用说明转染(Invitrogen). 第2 d, 加入适量培养液继续培养7-10 d, 至细胞出现肿胀、变圆、脱落以及聚集成团的病变现象时收获细胞, 反复冻融法收集病毒. 反复感染、冻融293细胞, 最后测定Ad-mU6pro-VEGFR2siRNA、Ad-mU6pro的滴度分别为1.3×1016 PFU/L, 1.0×1016 PFU/L.
1.2.3 LOVO细胞的转染: LOVO细胞用100 mL/L小牛血清完全培养基, pH值7.1-7.3, 置于37 ℃含50 mL/L CO2培养箱中培养. 感染前1 d, 1.5×106LOVO细胞种植于6孔板上, 第2 d, 每孔LOVO细胞用0.1 mL病毒液(Ad-mU6pro或Ad-mU6pro-VEGFR2siRNA, MOI为10-20)转染, 置于37 ℃, 50 mL/L CO2孵箱培养1-2 h, 每孔再加入2 mL新鲜培养液继续培养2-3 d. 转染后72 h, 收集细胞, 用冰冷的PBS溶液冲洗细胞, 三去污裂解液裂解细胞(50 mmol/L Triscl pH 8.0, 150 mmol/L NaCl, 0.2 g/L叠氮钠, 1 g/LSDS, 100 mg/L Aprotin, 10 g/L NP-40, 5 g/L去氧胆酸钠, 100 mg/L PMSF). 按照80 μg蛋白/泳道上样, 80 g/L聚丙烯酰胺电泳, 用硝酸纤维素膜转膜. 100 g/L的脱脂奶粉溶液(溶于PBS)封闭过夜. 然后将一抗按照体积比1:50溶于50 g/L的脱脂奶粉溶液(溶于PBS), 室温条件下与膜共孵育8 h, 用250 mLPBST(吐温按照体积比1:1000加入)漂洗膜3次, 每次10 min, 二抗按照体积比1:2000溶于50 g/L的脱脂奶粉溶液, 室温条件下与膜共孵育3 h, 250 mLPBST漂洗膜3次, 每次10 min, PBST充分洗涤后ECL化学发光系统显色、压片、曝光、显影、定影后晾干保存.
统计学处理 所有数据用mean±SD表示, 组间差异应用t检验, 以P<0.05具有统计学差异.
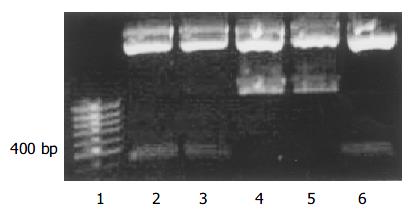
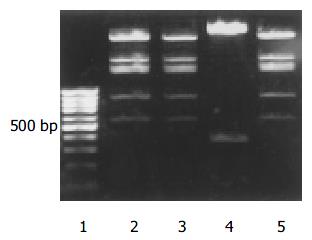
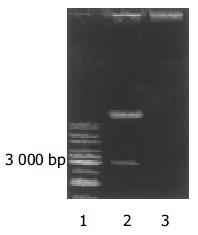
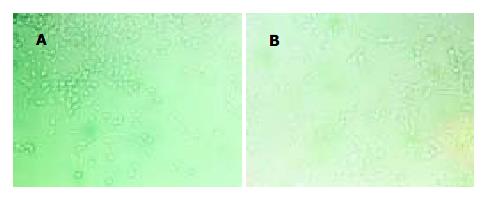
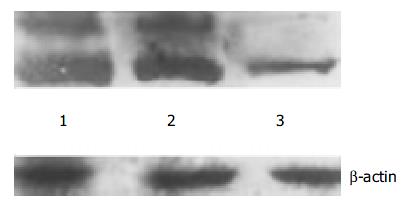
带有VEGFR2siRNA的腺病毒载体以及空载体构建成功, 测序及酶切鉴定示结果正确(图1, 图2, 图3, 图4, 图5). 用Ad-mU6pro-VEGFR2siRNA转染人LOVO细胞后, Western blot结果(图6)经相对蛋白含量分析显示: 亲本细胞组3.61±0.12; 空载体组 3.42±0.14; 转染组 2.35±0.09, 每组均重复测量10次, 取平均值. 可发现VEGFR2(KDR)表达水平在转染组明显降低(P<0.01); 而空载体组和亲本细胞组KDR表达水平变化不明显.
肿瘤细胞过度分泌VEGF与肿瘤血管内皮细胞过度表达VEGF受体均能够促进肿瘤的生长和转移[2], VEGF及其受体可作为肿瘤抑制治疗的靶分子, 利用抗体中和血管生长因子的活性或采用生长因子类似物封闭内皮细胞上生长因子的功能性受体是抑制肿瘤血管生成的有效手段[3-4], 如抗VEGF的抗体[5-6]、可溶性VEGF受体[7]、反义VEGF基因表达[8]和VEGF受体抑制剂[9]等. VEGF在肿瘤血管生成中发挥关键的作用[10], 其受体包括VEGFR-1(Flt-1), VEGFR-2(KDR/Flk-1)和VEGFR-3(Flt-4)等. 其中VEGFR-2(KDR/Flk-1)被认为是血管内皮最重要的靶标[11]. KDR不仅表达在肿瘤血管内皮细胞中, 而且表达在肿瘤细胞上[12]. zhang证明, 外源性VEGF可刺激KDR阳性胃癌细胞系NCI-N87和AGS-1的细胞生长[1]. 因此抑制肿瘤细胞和/或肿瘤血管内皮细胞上[13]VEGF受体的表达, 不仅可阻止肿瘤细胞的生长, 也可抑制肿瘤血管的生成, 从而阻断肿瘤的生长和转移[14].
肿瘤的基因治疗中, 腺病毒载体是重要的运载工具. 动物实验发现腺病毒DNA在体内的清除主要依赖先天的免疫清除机制, 该途径能清除约90%的腺病毒[15]. 目前应用的腺病毒载体(Ad5和Ad2)经瘤内注射、胸腔内注射、气管内滴注等局部途径的体内转染实验表明, 在有效剂量范围内, 尽管可引起局部轻度的、可逆的、自限性炎性反应, 但无明显的急性毒性和可检测的慢性毒性产生[16-21]. 实验证明, 腺病毒基因组性质稳定, 转染后不整合入靶细胞基因组[22], 且感染广泛、感染效率高、能达到较高的滴度, 同时既可以感染分裂细胞又可以感染静止细胞, 他是一种安全、高效、稳定的重要载体.
RNAi是一种高效、特异的阻断体内某些特定基因表达、诱导细胞特定基因缺失的一种重要手段, 比反义RNA技术、基因突变体技术有更大的优势[23]. Dicer酶(RNA酶Ⅲ家族成员)能够以ATP依赖的方式将dsRNA切割降解为21-23碱基的siRNA, 然后siRNA双链结合一个核酶复合物, 形成RNA诱导沉默的复合物(RNA-induced silencing complex, RISC). 激活的RISC通过碱基互补配对定位到同源mRNA转录本上, 在距离siRNA 3'端12个碱基的位置切割mRNA[24-27]. SiRNA也可直接源于细胞内RNA-依赖的聚合酶(RNA-dependent RNA polymerase, RdRP)在被RNAi作用的靶mRNA上的活动28. 在RdRP作用下, 进入细胞内的dsRNA以指数级数量扩增[24-26].
以腺病毒为工具, 应用RNA干扰技术可以特异、有效地抑制肿瘤细胞内靶基因的表达. Shen利用装载有H1-RNA启动子的穿梭载体pshuttle与腺病毒骨架质粒进行同源重组, 在细胞内成功表达P53基因的siRNA, 使P53基因静默[29]. 在本实验中, 我们将鼠U6基因启动子克隆入无启动子穿梭载体pshuttle, 并与腺病毒骨架质粒进行同源重组, 成功地构建了带有VEGF受体-2(KDR)小干扰RNA的重组腺病毒Ad-mU6pro-VEGF2siRNA, 转染LOVO细胞后明显抑制了KDR的蛋白表达水平, 从而能够抑制VEGF与VEGFR-2(KDR)的结合, 阻止肿瘤细胞的生长. 在另一实验中, 我们应用该重组腺病毒转染人脐静脉内皮细胞系(human umbilical vein endothelial cells HUVEC), 结果发现其KDR的表达水平明显降低, 且细胞生长受到显著抑制. 上述策略为肿瘤的基因治疗奠定了基础, 也为肿瘤的血管抑制治疗提供了思路. 但该载体是否可通过抑制VEGFR-2的表达而发挥抗肿瘤生长、抑制肿瘤血管生成的作用, 我们将在体内实验中进一步验证.
编辑: 潘伯荣 审读: 张海宁
| 1. | Zhang H, Wu J, Meng L, Shou CC. Expression of vascular endothelial growth factor and its receptors KDR and Flt-1 in gastric cancer cells. World J Gastroenterol. 2002;8:994-998. [PubMed] |
| 2. | Brown LF, Berse B, Jackman RW, Tognazzi K, Manseau EJ, Senger DR, Dvorak HF. Expression of vascular permeability factor (vascular endothelial growth factor) and its receptors in adenocarcinomas of the gastrointestinal tract. Cancer Res. 1993;53:4727-4735. [PubMed] |
| 3. | Ke LD, Shi YX, Im SA, Chen X, Yung WK. The relevance of cell proliferation, vascular endothelial growth factor, and basic fibroblast growth factor production to angiogenesis and tumorigenicity in human glioma cell lines. Clin Cancer Res. 2000;6:2562-2572. [PubMed] |
| 4. | Zhong H, Chiles K, Feldser D, Laughner E, Hanrahan C, Georgescu MM, Simons JW, Semenza GL. Modulation of hypoxia-inducible factor 1alpha expression by the epidermal growth factor/phosphatidylinositol 3-kinase/PTEN/AKT/FRAP pathway in human prostate cancer cells: implications for tumor angiogenesis and therapeutics. Cancer Res. 2000;60:1541-1545. [PubMed] |
| 5. | 阎 锡蕴, 汤 健, 吴 小平, 王 凤采, 李 建生, 杨 东玲. 血管内皮细胞生长因子人单链抗体的基因克隆、高效表达、亲和力成熟及生物活性鉴定. 中国科学C辑. 2000;30:394-400. |
| 6. | Borgström P, Bourdon MA, Hillan KJ, Sriramarao P, Ferrara N. Neutralizing anti-vascular endothelial growth factor antibody completely inhibits angiogenesis and growth of human prostate carcinoma micro tumors in vivo. Prostate. 1998;35:1-10. [PubMed] |
| 7. | 宋 述梅, 吴 健, 寿 成超. VEGF受体KDR胞外配基结合区单抗对内皮细胞增生及血管形成的抑制. 中华微生物学与免疫学杂志. 2000;20:327-330. |
| 8. | 吴 晓, 郑 杰, 付 坚, 由 江峰, 崔 湘琳, 王 洁良, 方 伟岗, 周 爱儒, 吴 秉铨. 反义VEGF基因转染在调节人肺巨细胞肺癌血管生成和转移的作用. 中华医学杂志. 2000;80:943-946. |
| 9. | Millauer B, Longhi MP, Plate KH, Shawver LK, Risau W, Ullrich A, Strawn LM. Dominant-negative inhibition of Flk-1 suppresses the growth of many tumor types in vivo. Cancer Res. 1996;56:1615-1620. [PubMed] |
| 10. | Ferrara N, Davis-Smyth T. The biology of vascular endothelial growth factor. Endocr Rev. 1997;18:4-25. [PubMed] |
| 11. | Brekken RA, Overholser JP, Stastny VA, Waltenberger J, Minna JD, Thorpe PE. Selective inhibition of vascular endothelial growth factor (VEGF) receptor 2 (KDR/Flk-1) activity by a monoclonal anti-VEGF antibody blocks tumor growth in mice. Cancer Res. 2000;60:5117-5124. [PubMed] |
| 13. | McDonnell CO, Hill AD, McNamara DA, Walsh TN, Bouchier-Hayes DJ. Tumour micrometastases: the influence of angiogenesis. Eur J Surg Oncol. 2000;26:105-115. [PubMed] |
| 14. | Melnyk O, Zimmerman M, Kim KJ, Shuman M. Neutralizing anti-vascular endothelial growth factor antibody inhibits further growth of established prostate cancer and metastases in a pre-clinical model. J Urol. 1999;161:960-963. [PubMed] |
| 15. | Worgall S, Wolff G, Falck-Pedersen E, Crystal RG. Innate immune mechanisms dominate elimination of adenoviral vectors following in vivo administration. Hum Gene Ther. 1997;8:37-44. [PubMed] |
| 16. | Kucharczuk JC, Raper S, Elshami AA, Amin KM, Sterman DH, Wheeldon EB, Wilson JM, Litzky LA, Kaiser LR, Albelda SM. Safety of intrapleurally administered recombinant adenovirus carrying herpes simplex thymidine kinase DNA followed by ganciclovir therapy in nonhuman primates. Hum Gene Ther. 1996;7:2225-2233. [PubMed] |
| 17. | Clayman GL, el-Naggar AK, Roth JA, Zhang WW, Goepfert H, Taylor DL, Liu TJ. In vivo molecular therapy with p53 adenovirus for microscopic residual head and neck squamous carcinoma. Cancer Res. 1995;55:1-6. [PubMed] |
| 18. | Goldman MJ, Litzky LA, Engelhardt JF, Wilson JM. Transfer of the CFTR gene to the lung of nonhuman primates with E1-deleted, E2a-defective recombinant adenoviruses: a preclinical toxicology study. Hum Gene Ther. 1995;6:839-851. [PubMed] |
| 19. | Prince GA, Porter DD, Jenson AB, Horswood RL, Chanock RM, Ginsberg HS. Pathogenesis of adenovirus type 5 pneumonia in cotton rats (Sigmodon hispidus). J Virol. 1993;67:101-111. [PubMed] |
| 20. | Simon RH, Engelhardt JF, Yang Y, Zepeda M, Weber-Pendleton S, Grossman M, Wilson JM. Adenovirus-mediated transfer of the CFTR gene to lung of nonhuman primates: toxicity study. Hum Gene Ther. 1993;4:771-780. [PubMed] |
| 21. | Wilmott RW, Amin RS, Perez CR, Wert SE, Keller G, Boivin GP, Hirsch R, De Inocencio J, Lu P, Reising SF. Safety of adenovirus-mediated transfer of the human cystic fibrosis transmembrane conductance regulator cDNA to the lungs of nonhuman primates. Hum Gene Ther. 1996;7:301-318. [PubMed] |
| 22. | Brody SL, Crystal RG. Adenovirus-mediated in vivo gene transfer. Ann N Y Acad Sci. 1994;716:90-101; discussion 101-103. [PubMed] |
| 23. | 杨 吉成. 2002年世界十大科学成就之首-siRNA和RNAi. 苏州大学学报�医学版. 2003;23:253-256. |
| 24. | Hammond SM, Caudy AA, Hannon GJ. Post-transcriptional gene silencing by double-stranded RNA. Nat Rev Genet. 2001;2:110-119. [PubMed] |
| 26. | Hutvágner G, Zamore PD. RNAi: nature abhors a double-strand. Curr Opin Genet Dev. 2002;12:225-232. [PubMed] |
| 27. | Nykänen A, Haley B, Zamore PD. ATP requirements and small interfering RNA structure in the RNA interference pathway. Cell. 2001;107:309-321. [PubMed] |