修回日期: 2003-03-20
接受日期: 2003-03-25
在线出版日期: 2003-11-15
探讨农村正常婴幼儿肠道微生物菌群分布情况, 为从饮食上调节婴幼儿肠道微生物菌群的正常分布提供实验基础, 从而减少婴幼儿肠道疾病的发生, 增进儿童健康.
采用分层随机抽样方法抽取陕西省部分农村0-18 mo的婴幼儿55人, 用Eugon Tomato、MRS+antibiotics、NN-agar、Shaedler Neo Vanco平板培养, 测定其肠道内粪双歧杆菌属, 粪肠杆菌, 粪乳酸菌属, 粪拟杆菌属, 粪产气荚膜梭菌的数量及年龄分布情况.
0-18 mo婴幼儿粪便中的益生菌含量与发达国家的健康婴幼儿相比, 低了两个对数值, 产气荚膜杆菌升高了两个对数值; 乳酸菌和双歧杆菌在各组中含量偏低, 尤其在4-6 mo最低.
及时调节婴幼儿肠道微生物菌群是防病、治病的关键.
引文著录: 孙晓勉, 刘黎明, 郝炳华, 杨文方, 贾梅, KevinAcheson. 陕西部分农村0-18 mo婴幼儿肠道内微生物菌群状况研究. 世界华人消化杂志 2003; 11(11): 1839-1841
Revised: March 20, 2003
Accepted: March 25, 2003
Published online: November 15, 2003
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2003; 11(11): 1839-1841
- URL: https://www.wjgnet.com/1009-3079/full/v11/i11/1839.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i11.1839
胃肠道内微生物菌群的分布(特别是厌氧菌的分布)与婴幼儿的健康或疾病关系密切. 胃肠道内寄生着大量的细菌, 大部分细菌的生长和繁殖需要厌氧环境, 为专性厌氧菌. 在生后第1 wk, 绝大部分婴儿肠内可以发现大量的肠杆菌和肠球菌, 并且发现在以后的数周内, 双歧杆菌和拟杆菌的数量不断增多[1,2]. 人类肠道内的厌氧菌群具有许多有益于健康的作用, 为宿主提供抗移植性就是有益于健康的作用之一[3,4]. 抗移植的能力高, 意味着来自周围环境中的潜在病原菌不能够移植; 同样, 个体肠道内的抗移植能力高时, 一些来自宿主自身肠道菌群的潜在病原菌也不能够移植. 因此, 抗移植性可以保护宿主, 使其避免潜在病原菌的移植以及由此引起的感染. 然而, 抗移植能力的高低, 与肠道内菌群的组成有关. 所以使用精确的定量方法检测菌群的组成显得十分重要. 但是人们目前对于肠道内厌氧菌群随年龄的变化以及其意义研究较少.
2岁以内的婴幼儿, 经历了从母体宫腔内的生活环境到类似于成人生活环境的转变过程. 其体内微生物环境变化极大, 逐渐从无菌状态达到类似成人的多菌群共生状态. 与成人相比, 菌群的平衡和协调对婴幼儿的健康状况影响更大, 是保证婴幼儿健康的重要因素.
本次研究的对象为陕西省部分农村0-18 mo的婴幼儿, 按年龄段分为5组: A组为出生至3 mo30 d, B组为4-6 mo 30 d, C组为7-9 mo 30 d, D组为10-12 mo 30 d, E组为13-17 mo 30 d.
抽样方法: 采用分层随机抽样方法, 随机抽取陕西省富平、澄城两县共6个乡, 每个乡随机抽取2-5个自然村, 共抽取18个自然村, 每个自然村再按婴幼儿的年龄段分组随机抽取, 每组抽取11人, 共55人. 剔除近1 mo内有过腹泻或上呼吸道感染者, 剔除近2 mo内使用过抗菌素者. 采样方法: 粪便的现场采样由专人负责, 在婴幼儿清晨第1次排便时, 用粪便专用无菌采样勺立即采集粪便约5 g, 快速置于无菌粪便采样瓶中并装入放有厌氧剂的铝袋中密封, 再将铝袋置于GasPak罐中 (装有厌氧剂和经过氢气还原的钯粒), 4 °C冷藏, 由采样现场迅速运输至实验室进行厌氧和需氧细菌培养. 培养方法: 厌氧细菌培养采用Eugon Tomato、MRS+antibiotics、NN-agar、Shaedler Neo Vanco平板, 需氧细菌培养采用Drigalski平板, 计数各种菌落数, 并进行显微镜检查和生化鉴定. 检测细菌属: 粪双歧杆菌属, 粪肠杆菌, 粪乳酸菌属, 粪拟杆菌属, 粪产气荚膜梭菌.
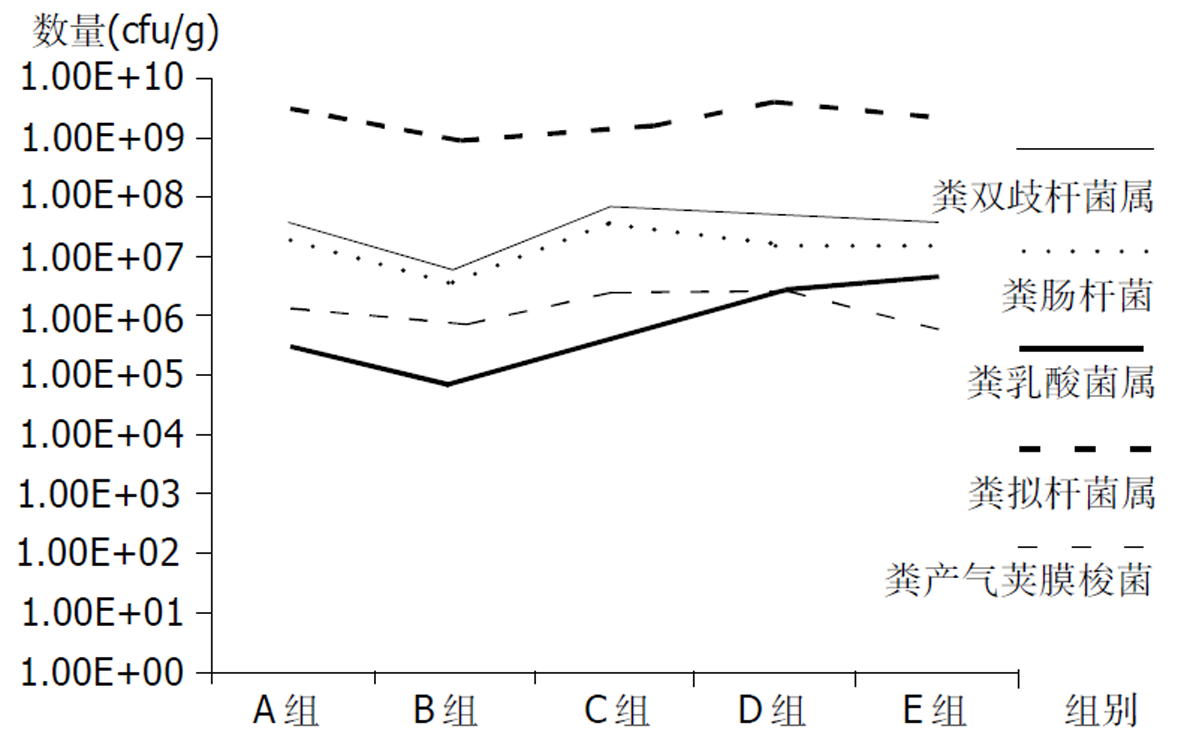
婴幼儿粪便中拟杆菌属数量最高, 明显高于其他菌属, 其次为双歧杆菌及肠杆菌, 乳酸菌及产气荚膜梭菌最低. 其中双歧杆菌在B组最低, C组最高之后缓慢下降. 乳酸在B组后逐渐升高, 1岁后缓慢上升(表1, 图1).
| 组别 | 细菌平均值(cfu/g) | ||||
| 粪双歧杆菌属 | 粪肠杆菌 | 粪乳酸菌属 | 粪拟杆菌属 | 粪产气荚膜梭菌 | |
| A组 | 3.25E+07 | 1.97E+07 | 3.05E+05 | 3.40E+09 | 1.44E+06 |
| B组 | 6.06E+06 | 3.43E+06 | 7.98E+04 | 9.87E+08 | 7.19E+05 |
| C组 | 6.31E+07 | 3.77E+07 | 4.16E+05 | 1.40E+09 | 2.48E+06 |
| D组 | 4.59E+07 | 1.81E+07 | 2.68E+06 | 3.68E+09 | 3.00E+06 |
| E组 | 3.31E+07 | 1.71E+07 | 4.51E+06 | 1.90E+09 | 6.35E+05 |
目前, 消化道内的益生菌包括乳酸杆菌和双歧杆菌, 均为人体的正常菌群. 乳酸杆菌能刺激宿主的免疫系统, 其细胞壁的组分肽聚糖、多糖和磷壁酸具有免疫刺激特性. 肽聚糖亦对免疫反应具有佐剂作用. 乳酸杆菌细胞壁酶促消化可提高宿主单核细胞对利斯特菌、克雷伯菌和肿瘤细胞的免疫力, 提高人外周血单核细胞的细胞因子产量、淋巴细胞增生活性以及乙肝抗体滴度. 某些乳酸杆菌菌株的胞质也具有免疫刺激作用, 其胞质组分可以刺激淋巴细胞的增生活性. 乳酸杆菌的免疫原性取决于这类细菌在胃肠道的存活情况、对胃酸和胆汁酸的抗性和附着在黏膜细胞表面的能力[5,6].
乳酸杆菌可通过影响胃肠道的微生物生态系统来预防胃肠道感染. 乳酸菌可以产生多种抑菌活性物质[7], 其抗菌作用及潜在的应用价值也引起了研究者的关注[8]. 口服含有乳酸杆菌的微生物制剂可以有效地防止抗生素诱导的胃肠道疾病, 减轻抗生素引起的肠道微生物群的改变, 从而使腹泻更快地康复. 乳酸杆菌还可以有效地缩短轮状病毒水样腹泻的病程, 亦可明显降低轮状病毒腹泻的危险性[9-11], 由于含有乳酸菌的酸奶可以缩短各种腹泻, 尤其是儿童腹泻的病程, 因此, 世界卫生组织建议在治疗腹泻期间以酸奶代替牛奶.
双歧杆菌对人体的生物学作用主要有: 生物屏障作用、营养作用、抗肿瘤作用、免疫增强作用、改善胃肠道功能和抗衰老作用等[12,13]. 人类消化道内多种细菌积极参与各种物质的新陈代谢, 而菌群失调又是许多人类疾病发生发展的引发因素[14]. 本次调查的0-18 mo婴幼儿粪便中的各类细菌含量与发达国家的健康婴幼儿相比[15,16], 主要的差别在于: 有益于婴幼儿胃肠道健康的双歧杆菌大约低了两个对数值, 而具有潜在致病作用的产气荚膜杆菌升高了两个对数值(产气荚膜杆菌是一种潜在的病原菌, 可以产生内毒素, 有些类型能够引起胃肠炎和腹泻). 肠道菌群的失衡增加了婴幼儿对胃肠道感染的易感性, 使其更易受到病原菌的侵袭而患病, 危害婴幼儿的健康.
通过对婴幼儿体内微生态的研究, 特别是对益生菌的研究, 为针对性的在婴幼儿食物中添加一定量的益生菌以促进婴幼儿生长发育提供了理论基础.
| 1. | Orrhage K, Nord CE. Factors controlling the bacterial colonization of the intestine in breastfed infants. Acta Paediatr Suppl. 1999;88:47-57. [PubMed] [DOI] |
| 2. | Roberfroid MB, Bornet F, Bouley C, Cummings JH. Colonic microflora: nutrition and health. Summary and conclusions of an international life sciences institute (ILSI) [Europe] workshop held in barcelona, spain. Nutr Rev. 1995;53:127-130. [DOI] |
| 4. | Varel VH, Yen JT. Microbial perspective on fiber utilization by swine. J Anim Sci. 1997;75:2715-2722. [DOI] |
| 5. | Gill HS, Rutherfurd KJ, Cross ML, Gopal PK. Enhancement of immunity in the elderly by dietary supplementation with the probiotic Bifidobacterium lactis HN019. Am J Clin Nutr. 2001;74:833-839. [DOI] |
| 6. | Schiffrin EJ, Rochat F, Link-Amster H, Aeschlimann JM, Donnet-Hughes A. Immunomodulation of human blood cells following the ingestion of lactic acid bacteria. J Dairy Sci. 1995;78:491-497. [DOI] |
| 7. | Van de Guchte M, Ehrlich SD, Maguin E. Production of growth-inhibiting factors by Lactobacillus delbrueckii. J Appl Microbiol. 2001;91:147-153. [DOI] |
| 8. | Hessle C, Hanson LA, Wold AE. Lactobacilli from human gastrointestinal mucosa are strong stimulators of IL-12 production. Clin Exp Immunol. 1999;116:276-282. [DOI] |
| 9. | Miettinen M, Matikainen S, Vuopio-Varkila J, Pirhonen J, Varkila K, Kurimoto M, Julkunen I. Lactobacilli and streptococci induce interleukin-12 (IL-12), IL-18, and gamma interferon production in human peripheral blood mononuclear cells. Infect Immun. 1998;66:6058-6062. [PubMed] |
| 10. | Isolauri E, Juntunen M, Rautanen T, Sillanaukee P, Koivula T. A human Lactobacillus strain (Lactobacillus casei sp strain GG) promotes recovery from acute diarrhea in children. Pediatrics. 1991;88:90-97. [PubMed] |
| 11. | Shornikova AV, Casas IA, Isolauri E, Mykkanen H, Vesikari T. Lactobacillus reuteri as a therapeutic agent in acute diarrhea in young children. J Pediatr Gastroenterol Nutr. 1997;24:399-404. |
| 12. | Reddy BS, Rivenson A. Inhibitory effect of Bifidobacterium longum on colon, mammary, and liver carcinogenesis induced by 2-amino-3-methylimidazo[4, 5-f] quinoline, a food mutagen. Cancer Res. 1993;53:3914-3918. |
| 13. | Sekine K, Ohta J, Onishi M, Tatsuki T, Shimokawa Y, Toida T, Kawashima T, Hashimoto Y. Analysis of antitumor properties of effector cells stimulated with a cell wall preparation (WPG) of Bifidobacterium infantis. Biol Pharm Bull. 1995;18:148-153. [DOI] |
| 14. | Baricault L, Denariaz G, Houri JJ, Bouley C, Sapin C, Trugnan G. Use of HT-29, a cultured human colon cancer cell line, to study the effect of fermented milks on colon cancer cell growth and differentiation. Carcinogenesis. 1995;16:245-252. [DOI] |
| 15. | Shenderov BA. Role of anaerobic non spore-forming bacteria in maintaining human health. Vestn Ross Akad Med Clin Exp Immunol. 1999;116:276-282. |
| 16. | Benno Y, Sawada K, Mitsuoka T. The intestinal microflora of infants: fecal flora of infants with vitamin K deficiency. Microbiol Immunol. 1985;29:243-250. [DOI] |