修回日期: 2022-03-02
接受日期: 2022-04-19
在线出版日期: 2022-05-08
Circ_0044516在胃癌中高表达, 抑制circ_0044516能促进胃癌细胞增殖和诱导凋亡. 生物学软件预测miR-516a-5p与circ_0044516相互结合, miR-516a-5p在非小细胞肺癌低表达,但是在胃癌细胞研究暂不清楚. 本研究主要探究circ_0044516靶向调控miR-516a-5p对胃癌细胞增殖、迁移和凋亡的影响.
探究circ_0044516是否靶向调控miR-516a-5p及对胃癌细胞增殖、迁移和凋亡的影响.
qRT-PCR实验检测胃上皮细胞GES-1和胃癌细胞SNU-16、HGC-27中circ_0044516、miR-516a-5p表达水平. 将HGC-27细胞分为si-NC组(转染si-NC)、si-circ_0044516组(转染si-circ_0044516)、miR-NC组(转染miR-NC)、miR-516a-5p组(转染miR-516a-5p)、si-circ_0044516+anti-miR-NC组(共转染si-circ_0044516和anti-miR-NC)、si-circ_0044516+anti-miR-516a-5p组(共转染si-circ_0044516+anti-miR-516a-5p). 定量即时聚合酶链锁反应(quantitative real time polymerase chain reaction, qRT-PCR)实验检测circ_0044516和miR-516a-5p表达水平; 噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide, MTT)实验检测细胞增殖; 流式细胞术实验检测细胞凋亡; Transwell实验检测细胞迁移; 蛋白免疫印迹(Western blot)实验检测p21、Bcl-2相关X蛋白(Bcl-2 associated X protein, Bax)、B细胞淋巴瘤/白血病-2(B cell lymphoma/lewkmia-2, Bcl-2)、基质金属蛋白酶-2(matrix metalloproteinase 2, MMP2)蛋白表达; 双荧光素酶报告实验检测circ_0044516和miR-516a-5p靶向关系.
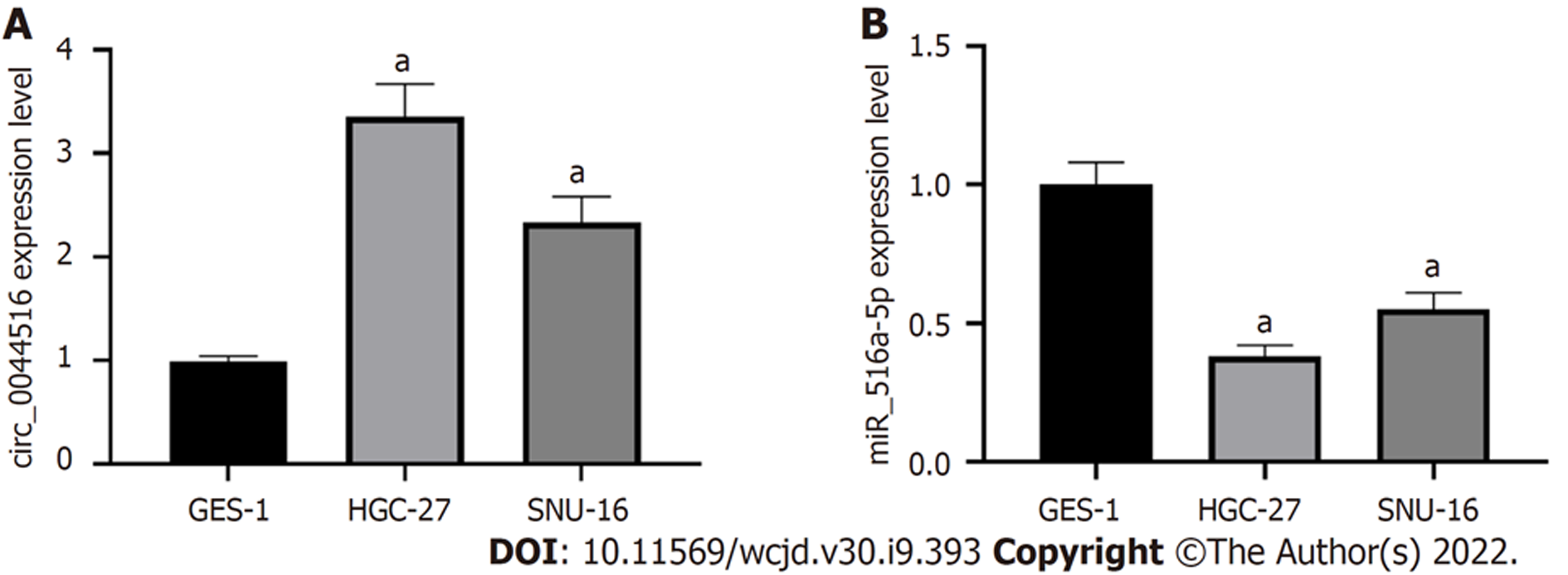
与胃上皮细胞GES-1相比, circ_0044516在胃癌细胞SNU-16、HGC-27中表达水平增加, miR-516a-5p表达水平降低. 沉默circ_0044516或过表达miR-516a-5p降低胃癌细胞存活率、迁移细胞数, 增加细胞凋亡率, 增加p21、Bax蛋白表达, 降低Bcl-2、MMP2蛋白表达. circ_0044516靶向负调控miR-516a-5p的表达, 抑制miR-516a-5p可以部分回复沉默circ_0044516对胃癌细胞增殖、迁移和凋亡的影响.
Circ_0044516可通过靶向负调控miR-516a-5p抑制胃癌细胞增殖和迁移, 并诱导细胞凋亡.
核心提要: 在胃癌细胞中circ_0044516高表达, miR-516a-5p地表达, circ_0044516可通过靶向负调控miR-516a-5p抑制胃癌细胞增殖和迁移, 并诱导细胞凋亡.
引文著录: 方惠, 李莹, 桑怡. Circ_0044516靶向调控miR-516a-5p对胃癌细胞增殖、迁移和凋亡的影响. 世界华人消化杂志 2022; 30(9): 393-401
Revised: March 2, 2022
Accepted: April 19, 2022
Published online: May 8, 2022
Circ_0044516 is highly expressed in gastric cancer, and inhibition of circ_0044516 can promote gastric cancer cell proliferation and induce apoptosis. Bioinformatics analysis predicts that miR-516a-5p binds to circ_0044516. The expression of miR-516a-5p is low in non-small cell lung cancer, but its role is unclear in gastric cancer cells. This study mainly explored the effect of circ_0044516 targeting miR-516a-5p on the proliferation, migration, and apoptosis of gastric cancer cells.
To explore whether circ_0044516 targets and regulates miR-516a-5p and its effects on the proliferation, migration, and apoptosis of gastric cancer cells.
Quantitative real time polymerase chain reaction (qRT-PCR) was first used to detect the expression levels of circ_0044516 and miR-516a-5p in gastric epithelial cells GES-1 and gastric cancer cells (SNU-16 and HGC-27). HGC-27 cells were then divided into si-NC group (transfected with si-NC), si-circ_0044516 group (transfected with si-circ_0044516), miR-NC group (transfected with miR-NC), miR-516a-5p group (transfected with miR-516a-5p), si-circ_0044516 + anti-miR-NC group (co-transfected with si-circ_0044516 and anti-miR-NC), and si-circ_0044516 + anti-miR-516a-5p group (co-transfected with si-circ_0044516 and anti-miR-516a-5p). qRT-PCR was used to detect the expression levels of circ_0044516 and miR-516a-5p, MTT assay was used to detect cell proliferation, flow cytometry was performed to detect cell apoptosis, Transwell assay was used to detect cell migration, Western blot analysis was performed to detect the protein expression of p21, Bcl-2 associated X protein (Bax), B cell lymphoma/lewkmia-2 (Bcl-2), and matrix metalloproteinase 2 (MMP2), and dual luciferase reporter assay was ued to detect the targeting relationship between circ_0044516 and miR-516a-5p.
Compared with gastric epithelial cells GES-1, the expression level of circ_0044516 was increased in gastric cancer cells SNU-16 and HGC-27, and the expression level of miR-516a-5p was decreased. Silencing circ_0044516 or overexpression of miR-516a-5p decreased the survival rate of gastric cancer cells and the number of migrating cells, increased the rate of cell apoptosis and the expression of p21 and Bax proteins, and reduced the expression of Bcl-2 and MMP2 proteins. Circ_0044516 targets and negatively regulates the expression of miR-516a-5p, and inhibition of miR-516a-5p partially restored the effect of silencing circ_0044516 on the proliferation, migration, and apoptosis of gastric cancer cells.
Circ_0044516 inhibits cell proliferation and migration and induces apoptosis in gastric cancer cells through targeted negative regulation of miR-516a-5p.
- Citation: Fang H, Li Y, Sang Y. Circ_0044516 inhibits cell proliferation and migration and induces apoptosis in gastric cancer cells by targeting miR-516a-5p. Shijie Huaren Xiaohua Zazhi 2022; 30(9): 393-401
- URL: https://www.wjgnet.com/1009-3079/full/v30/i9/393.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v30.i9.393
胃癌作为常见的恶性肿瘤, 与饮食习惯、遗传、地域等因素有关, 在我国南方胃癌患病人数高于北方, 病死率也较高[1]. 化疗手段是治疗晚期胃癌患者的最佳方式, 由于化疗药物治疗出现耐药性及毒副作用影响了治疗效果[2], 因此寻找新的治疗方式迫在眉睫, 而新型靶向治疗已成为胃癌治疗的主要手段之一. 环状RNA(circular RNA, circRNA)是一种内源性非编码RNA分子, 具有共价闭合结构, 已成为近年的人类疾病和肿瘤研究的热点[3,4]. 研究结果表明[5], 在胃癌组织和细胞中circ_0044516表达水平增加, 可能通过靶向调控miR-149促进胃癌细胞增殖和诱导凋亡. 通过在线生物信息学软件预测显示, miR-516a-5p与circ_0044516相互结合, 研究结果显示, miR-516a-5p在非小细胞肺癌细胞中低表达, 与患者年龄、病理分期、肿瘤大小有关, 可能通过靶向负调控HIST3H2A抑制非小细胞肺癌细胞增殖[6], 但是在胃癌细胞及对胃癌细胞的生物学行为暂不清楚. 关于circ_0044516和miR-516a-5p靶向调控作用尚不明确, 鉴于此, 本研究主要观察circ_0044516可能通过靶向调控miR-516a-5p对胃癌细胞增殖、迁移和凋亡的影响
细胞和主要试剂. 胃上皮细胞(GES-1)、胃癌细胞(SNU-16、HGC-27)购于中科院上海细胞中心; 改良Eagle培养基(Dulbecco's Minimum Essential, DMEM)培养基、胎牛血清购于美国Gibco公司; LipofectamineTM2000试剂盒购于美国Invitrogen公司; 实验中所用序列、引物购于上海吉玛公司; TRIzol试剂盒、逆转录试剂盒、荧光定量试剂盒购于美国Thermo fisher公司; 噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide, MTT)试剂盒、凋亡试剂盒购于上海碧云天生物; Transwell小室购于上海泽迈生物技术有限公司; p21抗体、Bcl-2相关X蛋白(Bcl-2 associated X protein, Bax)抗体、B细胞淋巴瘤/白血病-2(B cell lymphoma/lewkmia-2, Bcl-2)抗体、基质金属蛋白酶-2(matrix metalloproteinase 2, MMP2)抗体、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)抗体购于美国Abcam公司; 双荧光素酶检测试剂盒购于北京索莱宝科技有限公司.
1.2.1 细胞培养和转染: 将胃上皮细胞GES-1、胃癌细胞(SNU-16、HGC-27)培养在DMEM培养基内, 且含有10%胎牛血清、青霉素、链霉素, 培养条件为37 ℃、5% CO2. 观察细胞融合情况, 融合度为90%时, 加入0.25%胰蛋白酶消化传代培养细胞.
取对数期HGC-27细胞, 将细胞接种至96孔板中, 细胞融合达到80%, 按照LipofectamineTM2000试剂盒说明书将si-NC、si-circ_0044516、miR-NC、miR-516a-5p、pcDNA、pcDNA-circ_0044516转染细胞中, 记为si-NC组、si-circ_0044516组、miR-NC组、miR-516a-5p组、pcDNA组、pcDNA-circ_0044516组; 共转染si-circ_0044516和anti-miR-NC、si-circ_0044516+anti-miR-516a-5p至细胞内, 记为si-circ_0044516+anti-miR-NC组、si-circ_0044516+anti-miR-516a-5p组. 细胞转染6h换细胞培养液, 培养48 h后进行后续实验.
1.2.2 qRT-PCR实验检测circ_0044516和miR-516a-5p表达水平: 按照TRIzol法提取胃上皮细胞GES-1、胃癌细胞(SNU-16、HGC-27)、及各组HGC-27细胞中总RNA, 检测RNA浓度后, 按照逆转录试剂盒说明书将RNA合成cDNA, 使用cDNA为模板进行PCR反应, 反应体系共20 μL, 为10 μL SYBR Premix Ex Taq Ⅱ(2×), 1 μL cDNA, 上、下游引物各0.8 μL, ddH2O 7.4 μL. circ_0044516以GAPDH作为内参, miR-516a-5p以U6作为内参, 采用2-ΔΔCt法计算circ_0044516和miR-516a-5p表达水平.
1.2.3 MTT实验检测细胞增殖: 收集各组细胞HGC-27细胞(pcDNA组、pcDNA-circ_0044516组除外), 将细胞制成密度为3×104个/mL, 接种96孔板中, 培养48 h, 每孔加入20 μL MTT, 继续培养4 h, 加入150 μL DMSO试剂, 低速震荡至结晶溶解, 使用酶标仪检测490 nm处细胞吸光度值(A), 计算细胞活性(%).
1.2.4 流式细胞术实验检测细胞凋亡: 收集各组细胞HGC-27细胞(pcDNA组、pcDNA-circ_0044516组除外), 预冷磷酸缓冲盐溶液(phosphate buffered saline, PBS)清洗细胞, 使用结合缓冲液500 μL制备细胞悬液, 然后先加入5 μL膜联蛋白 V-FITC (Annexin V-FITC), 再加入5 μL碘化丙啶(propidium iodide, PI), 混匀后避光反应15 min, 上流式细胞仪检测细胞凋亡情况.
1.2.5 Transwell实验检测细胞迁移: 收集各组细胞HGC-27细胞(pcDNA组、pcDNA-circ_0044516组除外), 加入不含血清培养基调整细胞浓度, 浓度为2×104个/mL. 在Transwell小室上室中加入200 μL细胞悬液, 下室加入500 μL含血清的培养基, 继续培养24 h, 拿出小室擦掉没有迁移的细胞, 用4%多聚甲醛固定30 min, 结晶紫染色20 min, 在显微镜下观察细胞, 并拍照, 即为迁移细胞数.
1.2.6 Western blot实验检测p21、Bax、Bcl-2、MMP2蛋白表达: 将蛋白裂解液加各组细胞HGC-27细胞(pcDNA组、pcDNA-circ_0044516组除外), 提取的细胞总蛋白使用BCA试剂盒检测定量, 加入上样缓液, 进行聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis, SDS-PAGE)凝胶处理, 转膜, 脱脂奶粉封闭2 h, 加入一抗p21、Bax、Bcl-2、MMP2、GAPDH抗体, 4 ℃过夜孵育, 加入带标记的二抗室温下孵育2 h, 将电化学发光(electro-chemi-luminescence, ECL)滴入聚偏二氟乙烯(polyvinylidene fluoride, PVDF)膜上, 显影、曝光. 使用Image J软件分析蛋白条带密度值, 以GAPDH作为内参.
1.2.7 双荧光素酶报告实验检测circ_0044516和miR-516a-5p靶向关系: 构建miR-516a-5p结合位点的circ_0044516野生型、突变型载体序列(circ_0044516 WT、circ_0044516 MUT), 取HGC-27细胞接种24孔中, 将circ_0044516 WT、circ_0044516 MUT分别与miR-NC或miR-516a-5p共转染细胞, 48 h收集细胞, 按照双荧光素酶检测试剂盒操作步骤, 检测荧光素酶活性.
统计学处理 使用SPSS 20.0软件处理数据, 结果采用mean±SD表示, 多组间比较使用单因素方差分析, 两组间比较使用独立样本t检验. P<0.05表示差异有统计学意义.
与胃上皮细胞GES-1相比, 胃癌细胞SNU-16、HGC-27中circ_0044516相对表达水平显著增加(P<0.05), miR-516a-5p相对表达水平显著降低(P<0.05). 图1.
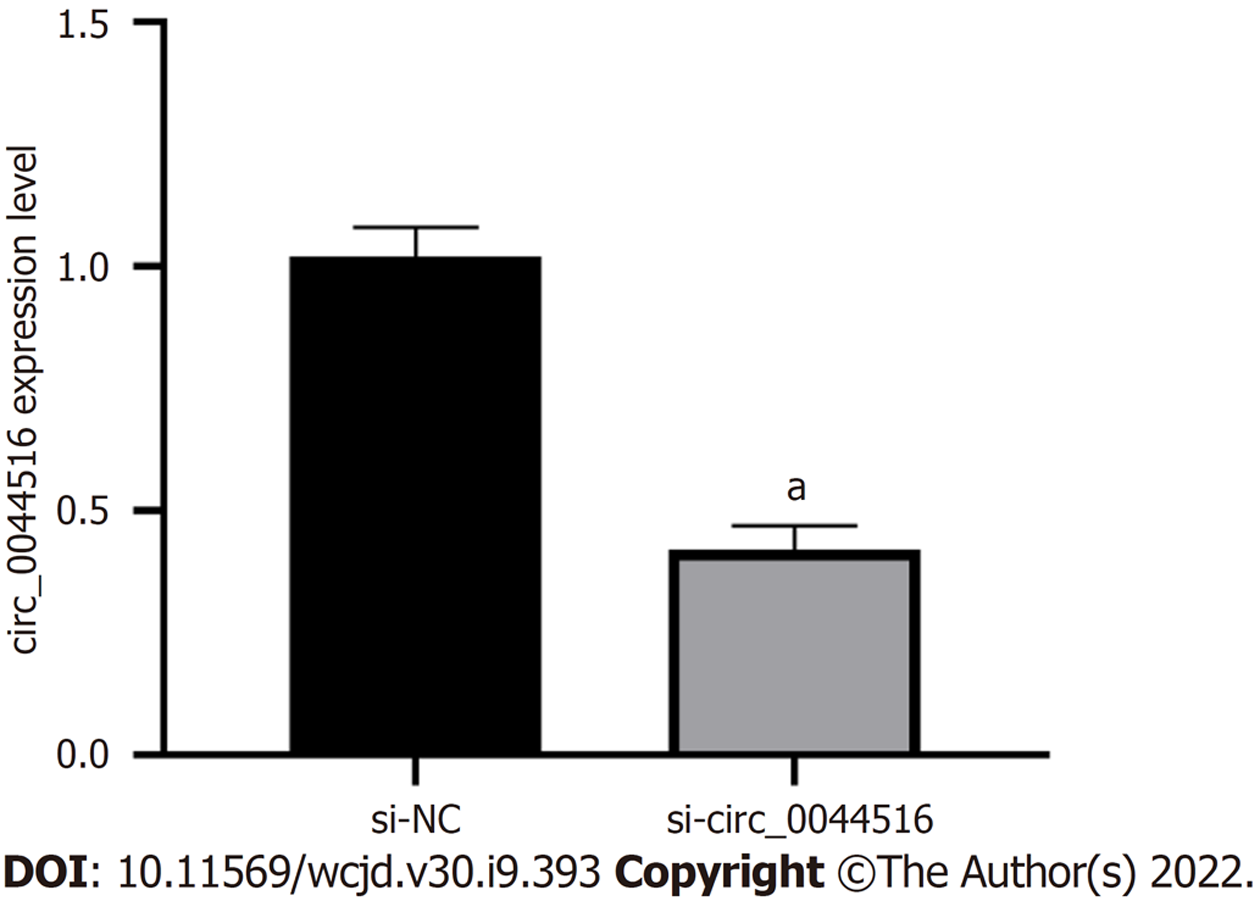
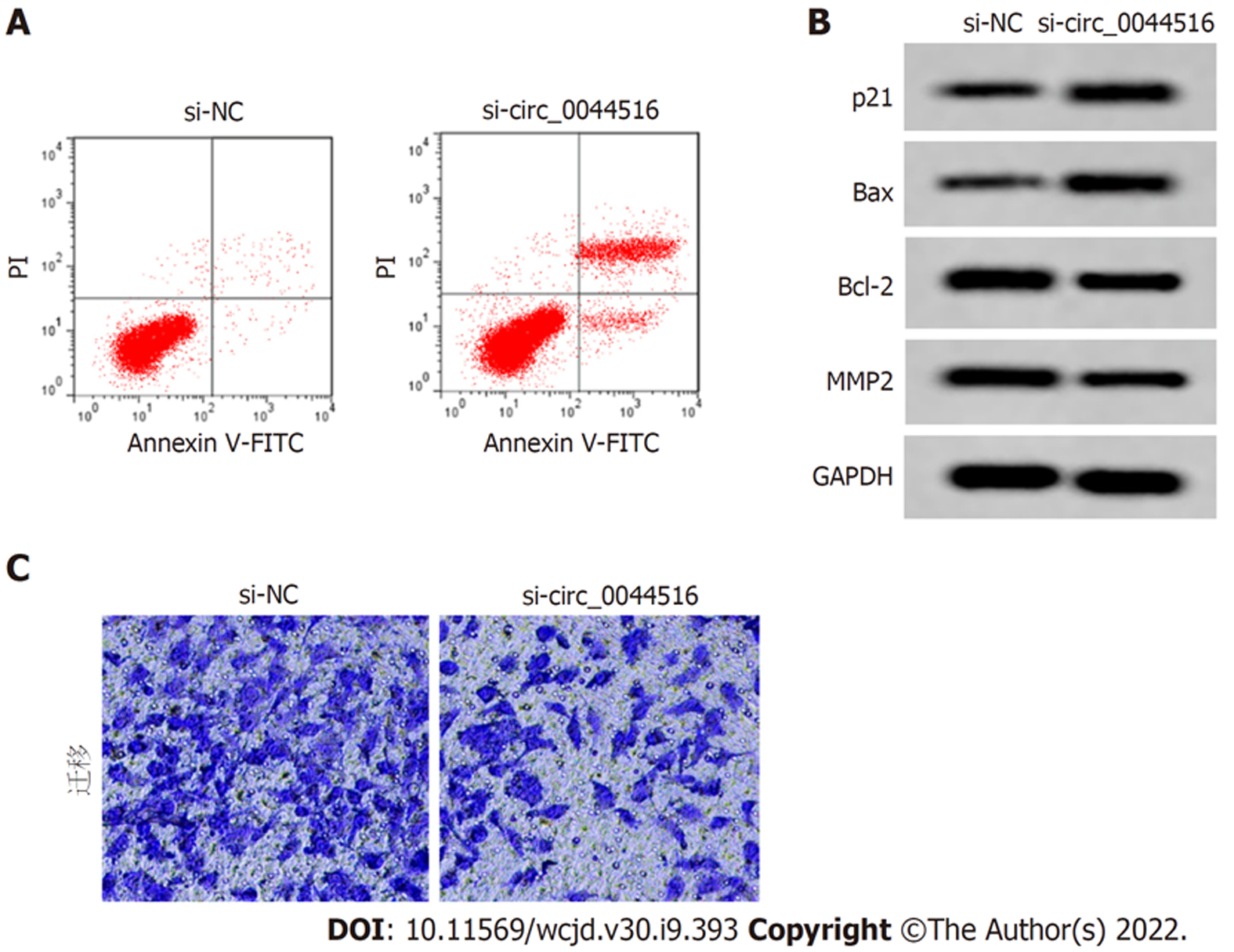
与si-NC组比较, si-circ_0044516组circ_0044516相对表达水平显著降低(P<0.05), 细胞活性、迁移细胞数降低(P<0.05), 凋亡率显著升高(P<0.05), p21、Bax蛋白表达增加(P<0.05), Bcl-2、MMP2蛋白表达降低(P<0.05). 图2、图3、表1.
| 分组 | 存活率(%) | 凋亡率(%) | 迁移细胞数(个) | p21 | Bax | Bcl-2 | MMP2 | |
| 24 h | 48 h | |||||||
| si-NC | 99.97±9.12 | 98.51±6.78 | 6.50±0.62 | 86.36±6.83 | 0.31±0.03 | 0.26±0.03 | 0.65±0.04 | 0.51±0.04 |
| si-circ_0044516 | 69.17±5.68a | 46.88±4.56a | 20.26±2.30a | 39.47±5.12a | 0.52±0.04a | 0.43±0.02a | 0.40±0.05a | 0.35±0.04a |
| t | 8.600 | 18.957 | 17.329 | 16.480 | 12.600 | 14.145 | 11.713 | 8.485 |
| P | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
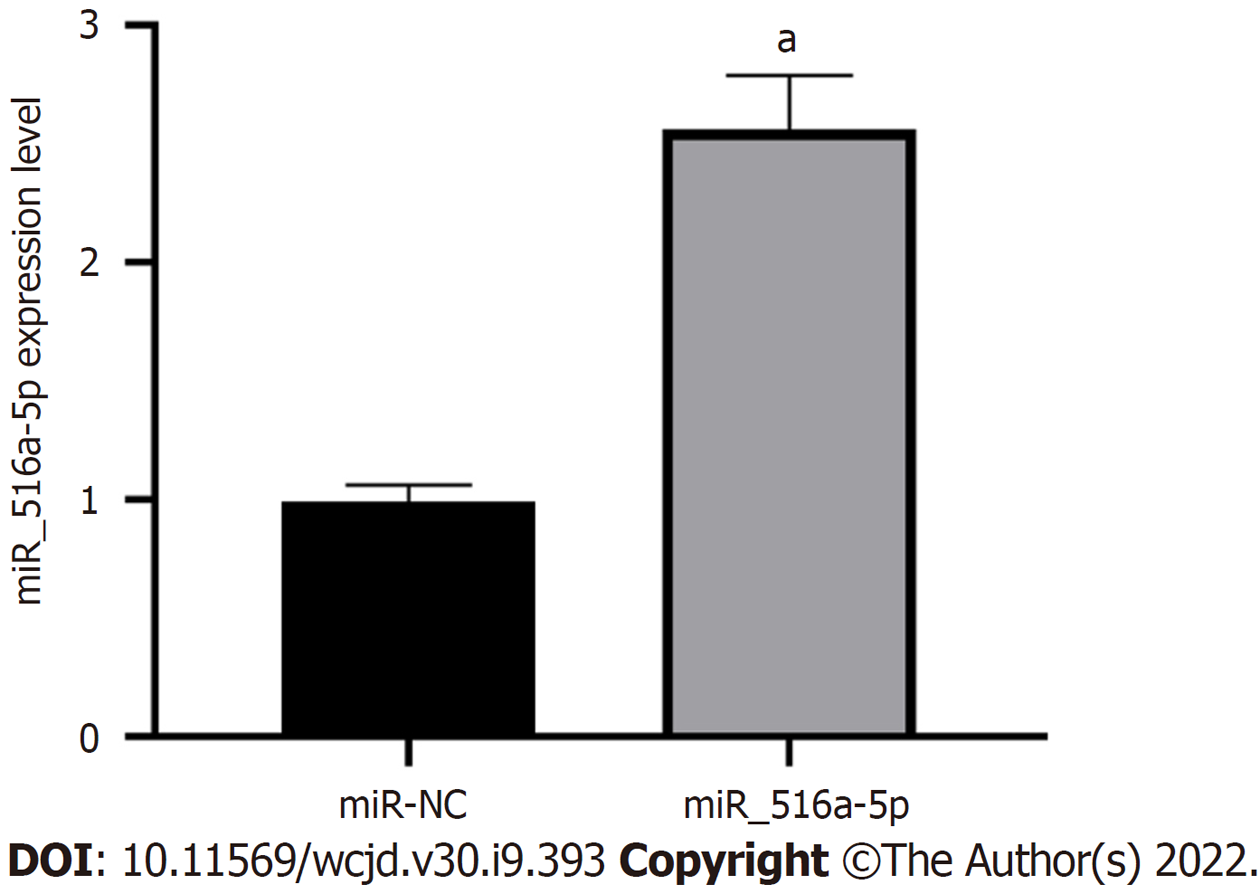
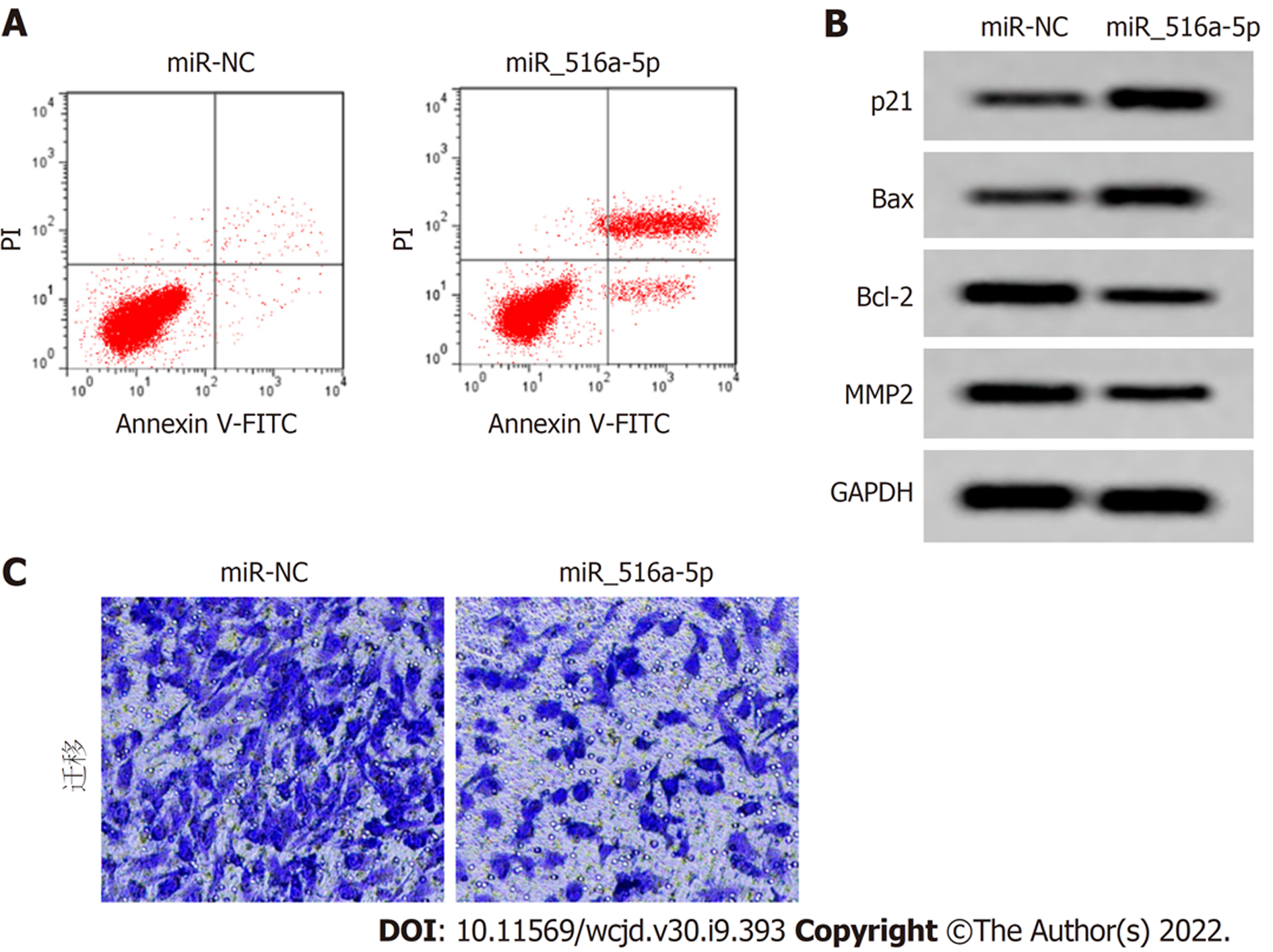
与miR-NC组比较, miR-516a-5p组miR-516a-5p相对表达水平显著增加(P<0.05), 细胞活性、迁移细胞数降低(P<0.05), 凋亡率显著增加(P<0.05), p21、Bax蛋白表达增加(P<0.05), Bcl-2、MMP2蛋白表达降低(P<0.05). 图4、图5、表2.
| 分组 | 存活率(%) | 凋亡率(%) | 迁移细胞数(个) | p21 | Bax | Bcl-2 | MMP2 | |
| 24 h | 48 h | |||||||
| miR-NC | 100.31±9.56 | 99.17±8.36 | 6.93±0.58 | 82.54±7.20 | 0.33±0.04 | 0.27±0.04 | 0.61±0.06 | 0.53±0.05 |
| miR-516a-5p | 70.24±6.86a | 49.44±5.02a | 21.31±2.26a | 43.56±3.98a | 0.50±0.05a | 0.46±0.05a | 0.36±0.04a | 0.33±0.04a |
| t | 7.667 | 15.299 | 18.489 | 14.215 | 7.965 | 8.902 | 7.904 | 9.370 |
| P | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
图6结果显示, circ_0044516和miR-516a-5p存在互补的结合位点. 表3结果显示, 与miR-NC组比较, miR-516a-5p组circ_0044516 WT荧光素酶活性显著降低(P<0.05), circ_0044516 MUT荧光素酶活性不受影响.
与pcDNA组相比, pcDNA-circ_0044516组中circ_0044516相对表达水平显著增加(P<0.05), miR-516a-5p相对表达水平显著降低(P<0.05). 表4.
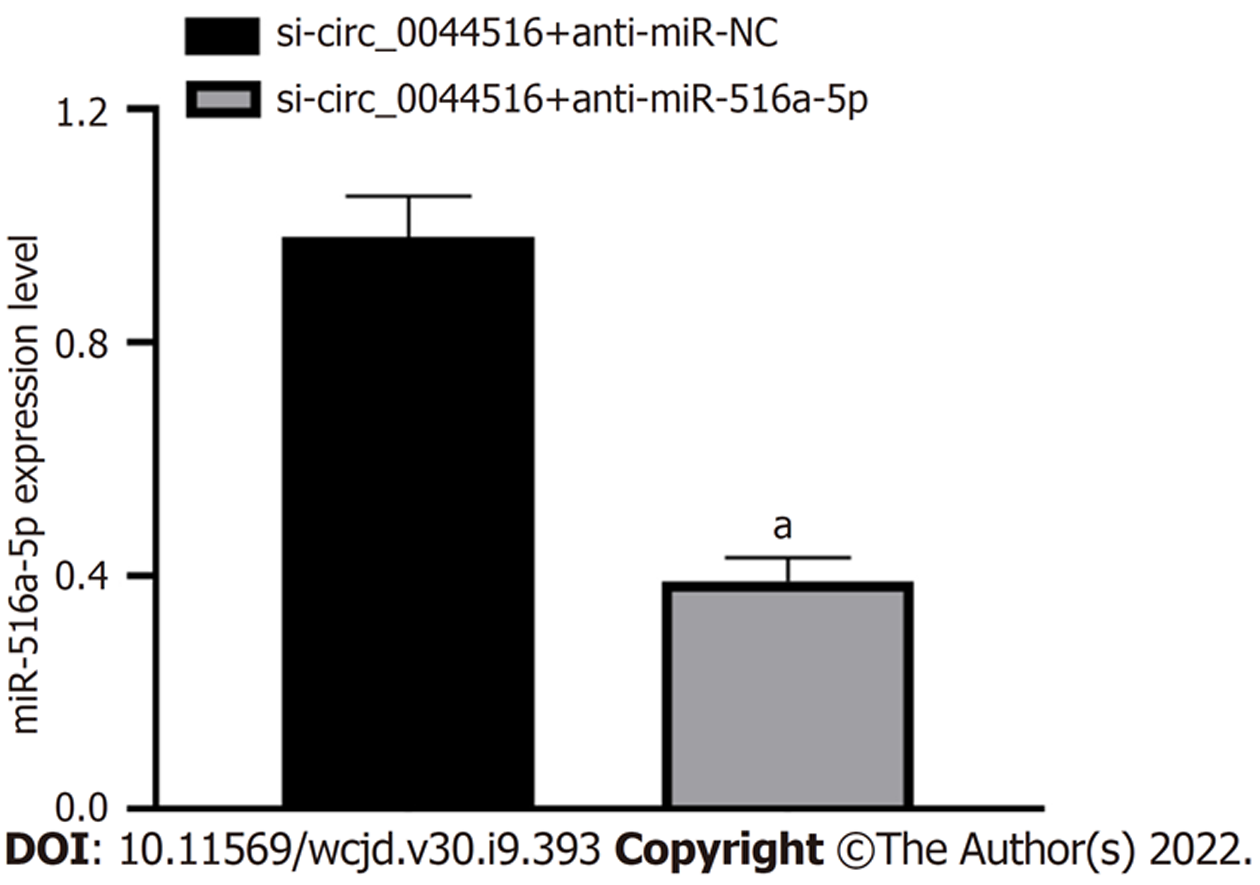
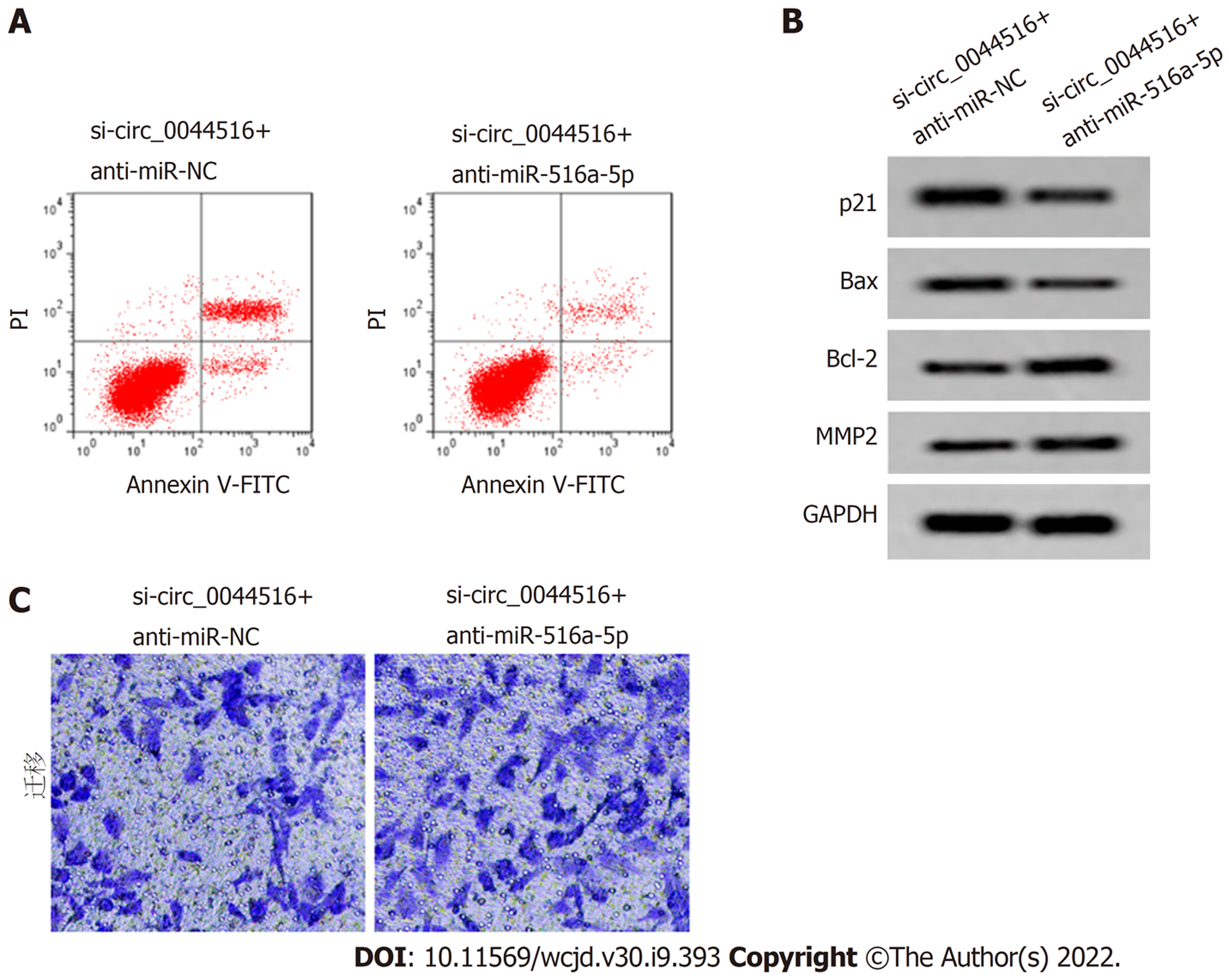
与si-circ_0044516+anti-miR-NC组比较, si-circ_0044516+anti-miR-516a-5p组miR-516a-5p相对表达水平显著降低(P<0.05), 细胞活性、迁移细胞数增加(P<0.05), 凋亡率显著降低(P<0.05), p21、Bax蛋白表达降低(P<0.05), Bcl-2、MMP2蛋白表达增加(P<0.05). 图7、图8、表5.
| 分组 | 存活率(%) | 凋亡率(%) | 迁移细胞数(个) | p21 | Bax | Bcl-2 | MMP2 | |
| 24 h | 48 h | |||||||
| si-circ_0044516+anti-miR-NC | 69.17±5.68 | 43.35±4.26 | 20.88±2.41 | 36.43±3.24 | 0.54±0.04 | 0.44±0.05 | 0.37±0.04 | 0.34±0.04 |
| si-circ_0044516+anti-miR-516a-5p | 85.88±7.21a | 68.94±6.53a | 13.67±1.52a | 55.21±4.70a | 0.43±0.03a | 0.32±0.03a | 0.50±0.04a | 0.45±0.04a |
| t | 5.462 | 9.846 | 7.591 | 9.869 | 6.600 | 6.174 | 6.894 | 5.834 |
| P | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
CircRNA在哺乳动物异常表达, 于20世纪70年代首次被发现, 目前已受到国内外研究学者的广泛关注, 还能够竞争结合微小RNA(microRNA, miRNA)参与肿瘤细胞增殖、迁移、凋亡等生物学过程[7,8]. 研究结果表明[9], 在胃癌组织中circ_001653表达增加, 体外实验显示下调circ_001653抑制胃癌细胞增殖、迁移和侵袭, 并诱导细胞凋亡, 可能调控miR-377/NR6A1轴促进胃癌发展. circ_0044516是最近被发现一种circRNA, 在肺癌组织和细胞中高表达, 敲低circ_0044516可明显抑制肺癌细胞增殖和阻滞细胞周期进展, 促进细胞凋亡[10]. 研究表明[11], 在前列腺癌组织外泌体中circ_0044516表达增加, 下调其表达对前列腺癌细胞增殖、迁移、侵袭由抑制作用. 在胃癌研究中发现, circ_0044516表达增加, 通过调控miR-149-5p促进HuR的表达, 进而促进胃癌细胞增殖、迁移和侵袭[12]. 本研究结果显示, 胃癌细胞中circ_0044516表达水平增加, 明显高于胃上皮细胞GES-1, 沉默circ_0044516降低胃癌细胞存活率、迁移细胞数, 增加细胞凋亡率. p21是Clp家族成员, 在癌组织中表达失调, 与细胞周期及增殖有关[13]. Bcl-2家族成员Bcl-2与Bax, 二者之间相互拮抗共同促进细胞发生凋亡[14]. MMP2基因位于16q12.2区域, 不仅能降解细胞外基质蛋白, 还可以促进细胞转移[15]. 上调p21、Bax蛋白表达, 下调Bcl-2、MMP2蛋白表达, 提示沉默circ_0044516抑制胃癌细胞增殖和迁移, 并诱导细胞凋亡.
miRNA在正常组织和癌组织中差异表达, 可以作为促癌基因或抑癌基因影响癌症的发展, 包括在内的胃癌[16], 如下调miR-335、miR-124、miR-218等[17], 上调miR-216a、miR-552、miR-592等[18,19]. 研究结果显示[20,,21], miR-516a-5p在肝细胞癌、膀胱癌等低表达, 上调miR-516a-5p表达能抑制癌细胞增殖、迁移和侵袭等过程. 还有研究结果表明[22], circ_MYC可能通过降低miR-516a-5p促进急性髓系白血病细胞增殖. 但是miR-516a-5p对胃癌细胞的研究暂不明确, 在本研究中发现, miR-516a-5p在胃癌细胞中表达水平降低, 过表达miR-516a-5p降低胃癌细胞存活率和迁移细胞数, 增加凋亡率, p21、Bax蛋白表达增加, Bcl-2、MMP2蛋白表达降低, 提示过表达miR-516a-5p抑制胃癌细胞增殖和迁移, 并诱导细胞凋亡. 在线生物信息软件和双荧光素酶报告实验显示, miR-516a-5p是circ_0044516靶基因. 过表达circ_0044516降低miR-516a-5p表达水平, 提示circ_0044516靶向负调控miR-516a-5p的表达. 进一步实验结果显示, 抑制miR-516a-5p对沉默circ_0044516处理胃癌细胞增殖、迁移和凋亡的影响, 提示circ_0044516可能通过负调控miR-516a-5p促进胃癌细胞发展.
综上所述, 沉默circ_0044516抑制胃癌细胞增殖和迁移, 并诱导细胞凋亡, 作用机制可能与调控miR-516a-5p有关. 当然, 本实验也存在不足的地方, 只注重研究体外细胞功能实验, 关于体内实验及可能相关信号通路等需要后一步继续验证, 为胃癌治疗提供新的分子靶向理论依据.
CircRNA具有共价闭合结构, 已成为近年的人类疾病和肿瘤研究的热点, 研究证明circRNA与胃癌发病有关, 可介导参与胃癌细胞增殖、迁移等过程.
在胃癌组织和细胞中circ_0044516高表达,通过靶向调控miRNA促进胃癌细胞生物学行为. 在线生物信息学软件预测显示, miR-516a-5p与circ_0044516相互结合,而miR-516a-5p在非小细胞肺癌细胞中低表达, 但是随胃癌细胞生物学行为暂不清楚. 本研究主要观察circ_0044516可能通过靶向调控miR-516a-5p对胃癌细胞增殖、迁移和凋亡的影响.
本研究主要观察circ_0044516对胃癌细胞增殖、迁移和凋亡的影响, 及其是否能通过调控miR-516a-5p影响胃癌细胞生物学行为, 旨在为胃癌研究提供新的作用靶点.
qRT-PCR实验检测胃上皮细胞GES-1和胃癌细胞SNU-16、HGC-27中circ_0044516、miR-516a-5p表达水平. 将HGC-27细胞分为si-NC组、si-circ_0044516组、miR-NC组、miR-516a-5p组、si-circ_0044516+anti-miR-NC组、si-circ_0044516+anti-miR-516a-5p组. qRT-PCR实验检测circ_0044516和miR-516a-5p表达水平; 噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide, MTT)实验检测细胞增殖; 流式细胞术实验检测细胞凋亡; Transwell实验检测细胞迁移; Western blot实验检测p21、Bax、Bcl-2、基质金属蛋白酶-2(matrix metalloproteinase 2, MMP2)蛋白表达; 双荧光素酶报告实验检测circ_0044516和miR-516a-5p靶向关系.
胃癌细胞circ_0044516高表达, 而miR-516a-5p低表达, 沉默circ_0044516或过表达miR-516a-5p抑制胃癌细胞增殖和迁移, 并诱导细胞凋亡, 抑制miR-516a-5p对沉默circ_0044516处理胃癌细胞增殖、迁移和凋亡的影响.
胃癌细胞circ_0044516高表达, 沉默circ_0044516抑制胃癌细胞增殖和迁移, 并诱导细胞凋亡, 作用机制可能与调控miR-516a-5p有关.
本实验也存在不足的地方, 只注重研究体外细胞功能实验, 关于体内实验及可能相关信号通路等需要后一步继续验证.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C, C
D级 (一般): 0
E级 (差): 0
科学编辑:张砚梁 制作编辑:张砚梁
| 1. | Li P, Jing J, Li R, Ge M, Jia P, Hu W, Qi X, Wei WQ, Zhuang G. Upper Gastrointestinal Cancer in China: Spatial Epidemiologic Evidence from Screening Areas. Cancer Prev Res (Phila). 2020;13:935-946. [PubMed] [DOI] |
| 2. | Song Z, Wu Y, Yang J, Yang D, Fang X. Progress in the treatment of advanced gastric cancer. Tumour Biol. 2017;39:1010428317714626. [PubMed] [DOI] |
| 3. | Li R, Jiang J, Shi H, Qian H, Zhang X, Xu W. CircRNA: a rising star in gastric cancer. Cell Mol Life Sci. 2020;77:1661-1680. [PubMed] [DOI] |
| 4. | Altesha MA, Ni T, Khan A, Liu K, Zheng X. Circular RNA in cardiovascular disease. J Cell Physiol. 2019;234:5588-5600. [PubMed] [DOI] |
| 5. | Fang J, Chen W, Meng X. Downregulating circRNA_0044516 Inhibits Cell Proliferation in Gastric Cancer Through miR-149/Wnt1/β-catenin Pathway. J Gastrointest Surg. 2021;25:1696-1705. [PubMed] [DOI] |
| 6. | Ye XY, Xu L, Lu S, Chen ZW. MiR-516a-5p inhibits the proliferation of non-small cell lung cancer by targeting HIST3H2A. Int J Immunopathol Pharmacol. 2019;33:2058738419841481. [PubMed] [DOI] |
| 7. | Zhou WY, Cai ZR, Liu J, Wang DS, Ju HQ, Xu RH. Circular RNA: metabolism, functions and interactions with proteins. Mol Cancer. 2020;19:172. [PubMed] [DOI] |
| 8. | Khan S, Jha A, Panda AC, Dixit A. Cancer-Associated circRNA-miRNA-mRNA Regulatory Networks: A Meta-Analysis. Front Mol Biosci. 2021;8:671309. [PubMed] [DOI] |
| 9. | Zhou W, Jiang R, Wang Y, Li Y, Sun Z, Zhao H. hsa_circ_001653 up-regulates NR6A1 expression and elicits gastric cancer progression by binding to microRNA-377. Exp Physiol. 2020;105:2141-2153. [PubMed] [DOI] |
| 10. | Chen YW, Du QR, He YJ, Chen WS, Jiang WY, Gui Q, Xu CC, Wang W, Cheng HY. Circ_0044516 Regulates miR-136/MAT2A Pathway to Facilitate Lung Cancer Development. J Immunol Res. 2021;2021:5510869. [PubMed] [DOI] |
| 11. | Li T, Sun X, Chen L. Exosome circ_0044516 promotes prostate cancer cell proliferation and metastasis as a potential biomarker. J Cell Biochem. 2020;121:2118-2126. [PubMed] [DOI] |
| 12. | Yang Y, Cai B, Shi X, Duan C, Tong T, Yu C. circ_0044516 functions in the progression of gastric cancer by modulating MicroRNA-149-5p/HuR axis. Mol Cell Biochem. 2021;. [PubMed] [DOI] |
| 13. | Shamloo B, Usluer S. p21 in Cancer Research. Cancers (Basel). 2019;11. [PubMed] [DOI] |
| 14. | Warren CFA, Wong-Brown MW, Bowden NA. BCL-2 family isoforms in apoptosis and cancer. Cell Death Dis. 2019;10:177. [PubMed] [DOI] |
| 15. | Sanyal S, Amin SA, Adhikari N, Jha T. Ligand-based design of anticancer MMP2 inhibitors: a review. Future Med Chem. 2021;13:1987-2013. [PubMed] [DOI] |
| 16. | Alessandrini L, Manchi M, De Re V, Dolcetti R, Canzonieri V. Proposed Molecular and miRNA Classification of Gastric Cancer. Int J Mol Sci. 2018;19. [PubMed] [DOI] |
| 17. | Zare A, Ahadi A, Larki P, Omrani MD, Zali MR, Alamdari NM, Ghaedi H. The clinical significance of miR-335, miR-124, miR-218 and miR-484 downregulation in gastric cancer. Mol Biol Rep. 2018;45:1587-1595. [PubMed] [DOI] |
| 18. | Safaralizadeh R, Ajami N, Nemati M, Hosseinpourfeizi M, Azimzadeh Isfanjani A, Moaddab SY. Disregulation of miR-216a and miR-217 in Gastric Cancer and Their Clinical Significance. J Gastrointest Cancer. 2019;50:78-83. [PubMed] [DOI] |
| 19. | 李 猛, 仲 雅婷, 陈 成, 徐 维, 高 超. miR-552和miR-592在胃癌组织中的表达及其与临床病理特征的关系. 胃肠病学和肝病学杂志. 2021;30:1096-1100+1106. [DOI] |
| 20. | Yao Z, Xu R, Yuan L, Xu M, Zhuang H, Li Y, Zhang Y, Lin N. Circ_0001955 facilitates hepatocellular carcinoma (HCC) tumorigenesis by sponging miR-516a-5p to release TRAF6 and MAPK11. Cell Death Dis. 2019;10:945. [PubMed] [DOI] |
| 21. | Huang W, Lu Y, Wang F, Huang X, Yu Z. Circular RNA circRNA_103809 Accelerates Bladder Cancer Progression and Enhances Chemo-Resistance by Activation of miR-516a-5p/FBXL18 Axis. Cancer Manag Res. 2020;12:7561-7568. [PubMed] [DOI] |
| 22. | Zou X, Jiang M. CircMYC regulates the mitochondrial respiration and cell viability via miR-516a-5p/AKT3 axis in acute myeloid leukemia. Am J Transl Res. 2021;13:10112-10126. [PubMed] |