修回日期: 2021-02-25
接受日期: 2021-03-15
在线出版日期: 2021-04-28
目前非酒精性脂肪肝性病(non-alcoholic fatty liver disease, NAFLD)已经成为被严重低估的重大健康威胁. 尽管NAFLD发病机理复杂, 但是越来越多的证据表明microRNAs (miRNAs)在调控NAFLD的发生和发展中起着重要的作用. 其中, miR-484是否参与NAFLD发生和发展仍有待阐明.
研究miR-484参与肝脏脂肪变性的损伤作用机制.
通过喂养高脂饲料建立小鼠高脂模型, 采用RT-qPCR和Western blot方法测定肝组织中miR-484和SIRT1的mRNA和蛋白水平, 再次构建miR-484基因敲除NAFLD小鼠模型, 检测小鼠血清ALT、AST、TG、TC变化水平, 通过油红O染色、HE染色和TUNEL染色检测脂肪变性程度和细胞凋亡水平. 此外, 通过游离脂肪酸构建NAFLD细胞模型, 采用双荧光素酶报告基因实验验证miR-484和SIRT1的直接靶向关系; 通过转染pc-DNA和pc-DNA SIRT1构建SIRT1过表达模型, 通过油红O染色检测脂质积累和流式细胞学检测细胞凋亡水平.
在NAFLD小鼠模型中, miR-484表达明显上调, 而SIRT1表达下降; 敲除miR-484后小鼠脂肪变性程度减轻,血清ALT和AST明显降低. 在NAFLD细胞模型中, miR-484能够通过直接靶向SIRT1, 过表达SIRT1显著降低细胞凋亡率, 减轻肝细胞脂质积累.
miR-484通过靶向SIRT1调控细胞凋亡, 加重肝细胞脂质积累, 表明miR-484可能是NAFLD的治疗靶标.
核心提要: 近年来, miR-484在调控肿瘤缺氧微环境(肺癌、乳腺癌、结直肠癌、胃癌、肝癌、胰腺癌等)中发挥重要作用, 但目前对miR-484是否参与NAFLD损伤作用机制国内外均尚无相关研究报道. 本研究通过建立小鼠和细胞高脂模型发现: miR‐484通过下调SIRT1表达, 诱导细胞凋亡加重非酒精性脂肪肝损伤. 降低miR-484表达或者上调SIRT1表达能够通过抑制细胞凋亡减轻非酒精性脂肪肝损伤, 为预防或治疗NAFLD损伤提供新的靶点.
引文著录: 贾银钊, 枚巧娟, 张勇. miR-484通过靶向SIRT1介导细胞凋亡参与非酒精性脂肪肝性肝病损伤. 世界华人消化杂志 2021; 29(8): 389-397
Revised: February 25, 2021
Accepted: March 15, 2021
Published online: April 28, 2021
Non-alcoholic fatty liver disease (NAFLD) has become a major health threat that is seriously underestimated. Although the pathogenesis of NAFLD is complex, more and more evidence shows that microRNAs (miRNAs) play an important role in regulating the occurrence and development of NAFLD. Whether miR-484 is involved in the occurrence and development of NAFLD remains to be clarified.
To explore the mechanism of miR-484 in the damage of liver steatosis.
A mouse model of NAFLD was established by feeding mice a high-fat diet, and the expression levels of miR-484 and SIRT1 in liver tissues were measured by RT-qPCR and Western blot. A miR-484 knockout NAFLD mouse model was constructed, the degree of steatosis and apoptosis were detected by oil red O staining, HE staining, and TUNEL staining, and the levels of serum ALT and AST were detected. In addition, a cell model of NAFLD was constructed through free fatty acid exposure. The dual luciferase reporter gene assay was first used to verify the direct targeting relationship between miR-484 and SIRT1, then an SIRT1 overexpression model was constructed by transfection with pc-DNA and pc-DNA SIRT1. Oil red O staining was used to detect lipid accumulation and flow cytometry was used to detect cell apoptosis.
In the mouse model of NAFLD, the expression of miR-484 was significantly up-regulated, while the expression of SIRT1 was decreased. The degree of steatosis was reduced and serum ALT and AST levels were significantly reduced in miR-484 knockout mice. In the cell model of NAFLD, miR-484 can directly target SIRT1. In addition, overexpression of SIRT1 significantly decreased the rate of apoptosis and alleviated lipid accumulation in liver cells
MiR-484 regulates cell apoptosis by targeting SIRT1 and aggravates lipid accumulation in liver cells, which suggests that miR-484 may be a therapeutic target for NAFLD.
- Citation: Jia YZ, Mei QJ, Zhang Y. MiR-484 participates in non-alcoholic fatty liver injury by targeting SIRT1 to mediate cell apoptosis. Shijie Huaren Xiaohua Zazhi 2021; 29(8): 389-397
- URL: https://www.wjgnet.com/1009-3079/full/v29/i8/389.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i8.389
当前中国脂肪肝的发病率正以每年0.594%的速度上升, 最新数据显示已有20%的中国人患有脂肪肝[1]. 脂肪肝已经成为被严重低估的重大健康威胁. 非酒精性脂肪肝性肝病(nonalcoholic fatty liver disease, NAFLD)是我国脂肪肝最主要的病理类型, 也是全球患病人数最多的肝脏慢性疾病. NAFLD在引起肝功能严重受损的同时, 部分患者还可进一步发展为纤维化、肝硬化, 甚至可直接演变成肝癌[2,3]. 尽管目前对NAFLD的研究很多, 但是其病因及分子作用机制尚不清楚, 胰岛素抵抗(insulin resistance, IR)[4]、氧化应激[5]与脂质过氧化物[6,7]可能是其病因的关键因素, 其他因素如瘦素[8]、脂联体[9]、抵抗素、肿瘤坏死因子(tumor necrosis factor, TNF)[10]等多种脂肪因子参与NAFLD的形成、炎性改变和纤维化过程. 一直以来, NAFLD 发病机制是基于"二次打击"理论, 但随着近几年研究的深入进一步揭示NAFLD发生的许多分子途径, 导致其发生机制仍处于争论中.
微小RNAs (microRNA, miRNA, miR)为19-24个核苷酸之间的内源性短链非编码RNA, 通过与靶mRNA的3'-非翻译区(3'-UTR)结合, 在基因沉默和翻译抑制中发挥作用, 调控多种生物学功能. 前期已有研究证实miR-484在癌前病变到癌症的过程中是一个关键的调节因子[11-13]. 然而, miR-484是否参与非酒精性脂肪肝性肝病的损伤过程及机制尚不清楚.
NAD+依赖的组蛋白去乙酰化酶Sirtuin 1 (SIRT1)参与许多细胞的生理功能, 包括肝脂肪酸代谢、线粒体功能、肝糖异生、胰岛素分泌和脂肪细胞成熟. SIRT1是控制肝脏脂质代谢的主要调控因子[14]. 尽管已有研究报道肝脏特异性SIRT1的缺失会促进肝脂肪变性[15,16], 但尚不清楚miR-484是否通过靶向SIRT1来调节NAFLD中的脂肪蓄积. 因此, 本研究旨在探讨miR-484在NAFLD中对SIRT1的作用和潜在的调节机制, 将为NAFLD的诊断和治疗提供参考. 结果报道如下.
SPF级C57/BL小鼠(购自湖北省实验动物研究中心, 许可证号: SCXK(鄂)-2015-0018,6-8周龄); miR-484基因敲除鼠(购买于南京大学-南京生物医药研究院, 品系编号: T000103); 人正常肝脏细胞(LO2细胞系)(购自中国武汉普诺赛生命科技公司); DMEM 培养基、胎牛血清、胰蛋白酶、青霉素和链霉素(美国Gibco公司); Trizol试剂、逆转录试剂盒、SYBR Green PCR Master Mix试剂盒、双荧光素酶报告试剂盒(南京诺唯赞生物科技股份有限公司); miR-484 mimic、inhibitor与阴性对照mimic control、inhibitor control(广州锐博生物有限公司); 引物合成、PGL3-CMV-LUC- SIRT1 3'UTR突变型和野生型质粒构建、pc-DNA、pc-DNA SIRT1(吉满生物科技(上海)有限公司合成); Lipofectamine TM3000(美国Invitrogen公司); SDS-PAGE试剂盒、ECL发光液、BCA蛋白定量试剂盒和RIPA蛋白裂解液(碧云天生物技术公司); PVDF膜(美国Abcam公司); ALT、AST、TG、TC试剂盒(南京建成生物工程研究所); TUNEL试剂盒(武汉赛维尔生物科技有限公司); 油红O染色剂、油酸(O1383)、棕榈酸(P5585)(美国Sigma公司); 膜联蛋白V-异硫氰酸荧光素(annexin V-FITC)和碘化丙啶(propidium iodide, PI) (安迪福诺生物科技(武汉)有限公司); 高纯度质粒小提中量试剂盒(DP107) (TIANGEN公司); SIRT1抗体、β-ACTIN抗体及二抗(美国CST公司).
1.2.1 动物分组及动物模型: 取SPF级6-8周龄雄性野生型(WT组)和miR-484敲除型(KO组)C57/BL小鼠各40只, 体重28-32 g之间, 置于恒温(25 ℃), 湿度为70%的动物房适应性喂养1 wk后, 将各组小鼠随机分为正常对照组(NC组)和高脂饮食组(HF组), 分别给予普通饲料和高脂饲料(基础饲料、2%胆固醇、15%猪油)喂养16 wk后, 造模结束后取眼眶静脉丛采血, 留取肝脏, 一部分甲醛固定, 另一部分液氮速冻后于-80 ℃保存. 血清获取方法: 血液室温静置4 h后, 2500 rpm/min, 离心10 min, 得到的上清液即为血清, 分装后放置-80 ℃备用.
1.2.2 LO2细胞培养: 将冻存的2代LO2细胞复苏, 接种于含10%胎牛血清、1%青霉素-链霉素的DMEM培养液中, 在37 ℃、5% CO2恒温培养箱中培养. 根据细胞的生长情况, 用含0.25%胰蛋白酶的EDTA消化液进行传代培养, 取第4-7代的LO2细胞用于后续试验.
1.2.3 LO2脂肪变性造模: 将呈对数生长期的细胞转接种入6孔板中, 6孔板中提前置入多聚赖氨酸包被的无菌盖玻片1片, 培养24 h后, 用移液器去除培养液, 更换为含有0.4 Mm棕榈酸和0.2 Mm油酸的游离脂肪酸(free fatty acid, FFA)DMEM培养液继续培养, FFA干预24 h后用于后续实验[17].
1.2.4 细胞转染和分组: 转染前1 d将LO2细胞接种到6孔板中, 接种密度为2×105个/孔, 放置于37 ℃培养箱内继续培养, 待细胞生长密度达40%-50%时, 分别将miR-484 mimic(M组)、mimic control(MC组)、miR-484 inhibitor(I组)、inhibitor control(IC组)、pcDNA SIRT1(overexpression, OE组)和pcDNA(overexpression normal control, OE-NC组)转染至LO2细胞, 转染操作步骤严格参照Lipofectamine 3000转染试剂说明书进行, 转染后的细胞继续放置于37 ℃培养箱中培养, 转染持续8-10 h后更换含FFA培养基干预24 h后, 用于后续实验.
1.2.5 HE染色: 取各组肝组织石蜡包埋切片、脱蜡至水、苏木素染细胞核、伊红染细胞质、脱水封片, 用显微镜观察各组肝组织结构.
1.2.6 油红O染色: 油红染色步骤如下: (1)固定: 将冰冻切片复温干燥10 min; 细胞爬片4%多聚甲醛固定10 min, PBS充分洗涤; (2)染色: 油红工作液孵育10-15 min; 细胞爬片破膜10-15 min, PBS漂洗3次, 5 min/次, 随后以60%异丙醇浸洗约15 s, 入油红O工作液染色10 min; (3)分化: 75%酒精分化2 s, 水洗1 min; 细胞爬片用60%异丙醇分化至间质清晰后用蒸馏水洗涤; (4)复染细胞核: Harris苏木素复染1 min左右, 蒸馏水冲洗, 1%的盐酸酒精分化数秒, 蒸馏水冲洗, 氨水返蓝, 流水冲洗; (5)封片: 用纸巾吸去周边水分, 甘油明胶封片.
1.2.7 TUNEL染色: 上述各组肝组织切片染色步骤: 脱蜡至水, 蛋白酶K修复, 破膜通透, 孵育tunel反应液, 孵育POD反应液, DAB显色, 苏木素染核, 脱水封片, 镜检拍照.
1.2.8 流式细胞学: 通过流式细胞术检测细胞凋亡: (1)收集上清: 收集培养液于流式管中(有少量悬浮细胞); (2)收集细胞: 六孔板中的细胞用PBS洗涤一次, 加入1 mL 0.25%胰酶消化细胞, 待细胞变圆且有部分细胞悬浮, 即加入培养基终止消化. 用移液枪轻轻吹打细胞, 使细胞悬浮. 收集于流式管中, 1500 rpm离心5 min, 弃上清; (3)PBS洗涤细胞: 加入3 mL 4 ℃预冷的PBS完全重悬细胞, 1500 rpm离心5 min, 弃上清. 沉淀用300 μL的Binding Buffer重悬; (4)荧光标记: 加入5 μL Annexin V-FITC混匀后, 加入5 μL Propidium Iodide, 混匀. 室温下避光反应5-15 min; (5)于1 h内上机检测: Annexin V-FITC的绿色荧光通过FITC通道(FL1)检测, PI红色荧光通过PI通道(FL2)检测. 流式细胞仪参数如下: 激发波长Ex = 488 nm, 发射波长Em = 530 nm.
1.2.9 RT-qPCR: 采用Trizol试剂提取各组肝组织和细胞中总RNA, 使用Nanodrop超微量核酸蛋白检测仪测定所提RNA的浓度和纯度. 各组按照逆转录试剂盒说明书进行操作, 使用RT-qPCR法检测miR-484和SIRT1基因的表达, 使用软件分析检测样本的CT值, 采用2-△△CT值反映相对表达水平. 相关引物序列见表1
| Primer | Sequence 5'-3' |
| miR-484-F | GCGTCAGGCTCAGTCCCCT |
| miR-484-R | AGTGCAGGGTCCGAGGTATT |
| miR-484-RT | GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACATCGGG |
| U6-F | CTCGCTTCGGCAGCACA |
| U6-R | AACGCTTCACGAATTTGCGT |
| U6-RT | AACGCTTCACGAATTTGCGT |
| mou-SIRT1-F | CAGGTTGCAGGAATCCAAA |
| mou-SIRT1-R | CAAATCAGGCAAGATGCTGT |
| mou-β-actin-F | AAGTGCTTCTAGGCGGACTGTT |
| mou-β-actin-R | TTTTCTGCGCAAGTTAGGTTTTG |
| has- SIRT1-F | CCAGAACATAGACACGCTGGAAC |
| has- SIRT1-R | CTCCTCGTACAGCTTCACAGTCA |
| hsa-β-actin-F | TCACCCACACTGTGCCCATCTACG |
| hsa-β-actin-R | CAGCGGAACCGCTCATTGCCAATG |
1.2.10 Western Blot: 测定组织和细胞蛋白上清中SIRT1、β-actin的蛋白表达量:取适量对数生长期的LO2细胞和适量大小肝组织(约80 mg), RIPA裂解后采用 BCA法进行蛋白定量, 高温变性离心后取上清进行蛋白上样(蛋白量约50 ug). 按照Western Blot实验常规操作流程进行. Image J分析目的条带的灰度值, 以目的条带灰度值与β-actin灰度值的比值表示目的蛋白的表达.
统计学处理 实验数据采用GraphPad Prism 8.0版软件进行分析, 计量资料以mean±SD表示, 组间采用单因素方差分析比较, 以P<0.05为差异有统计学意义.
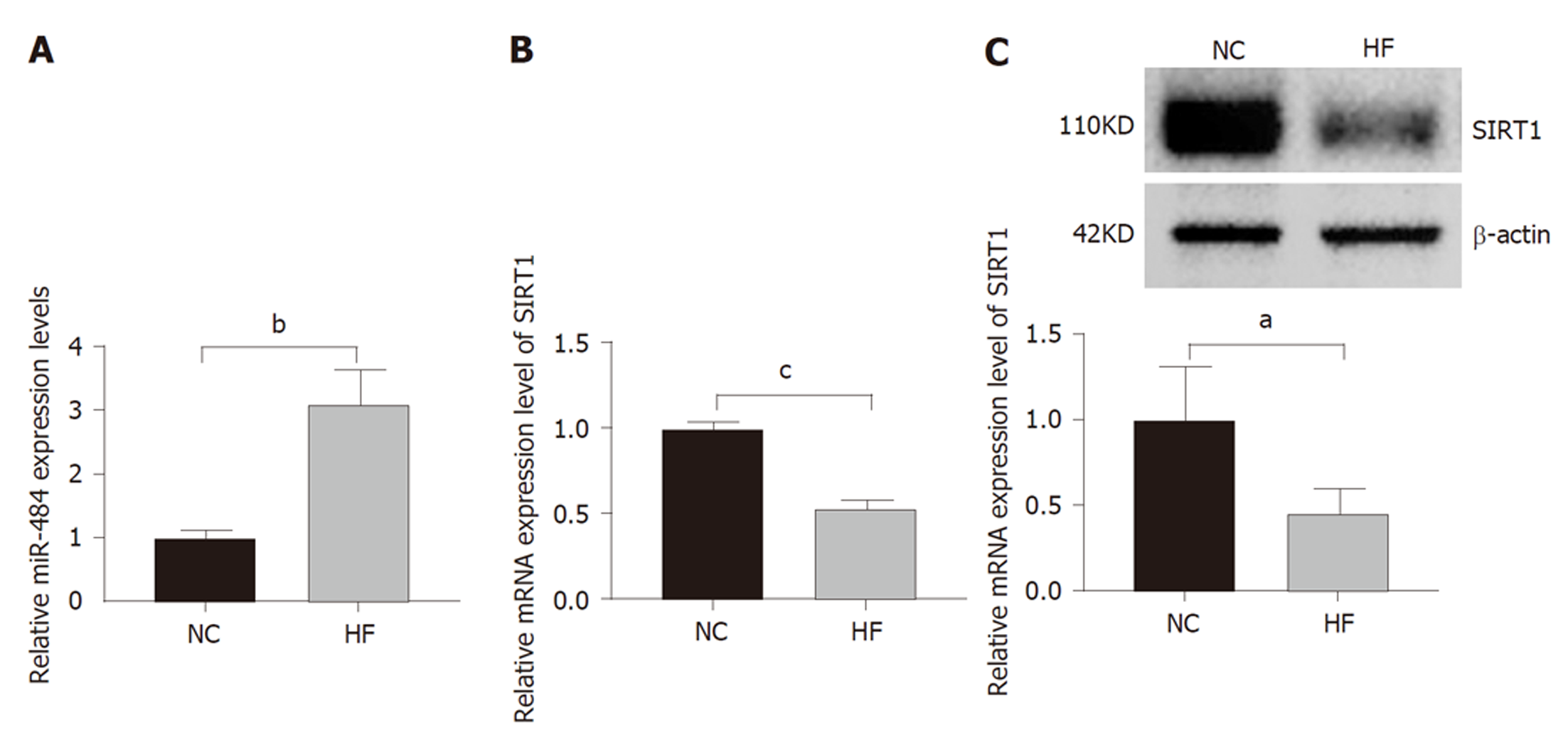
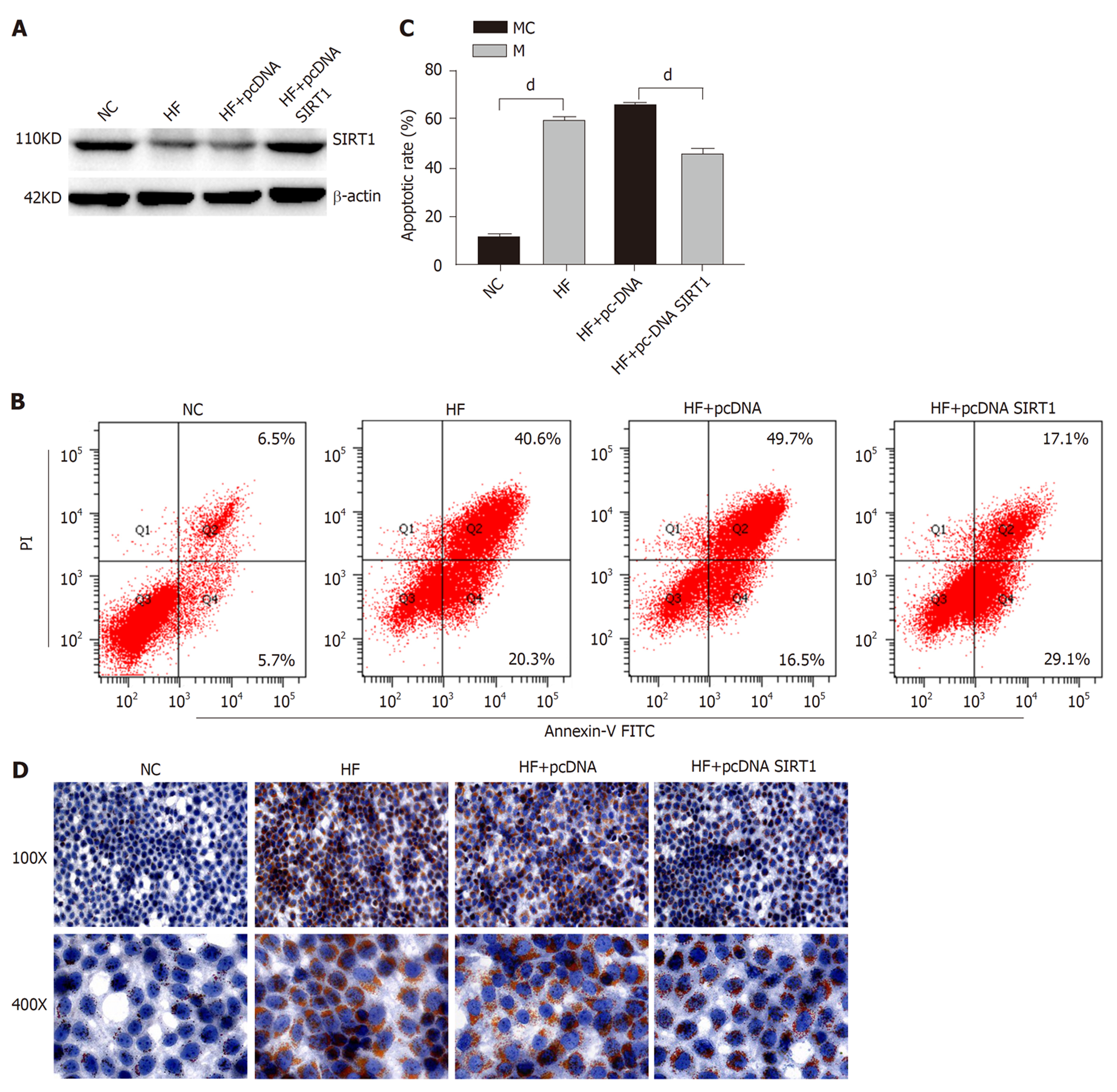
与NC组相比, HF组肝组织中miR-484表达显著升高, SIRT1的mRNA和蛋白表达均显著降低(P<0.05), 见图1. 这表明高脂暴露诱导肝组织miR-484的表达增加, 伴随SIRT1的表达下调.
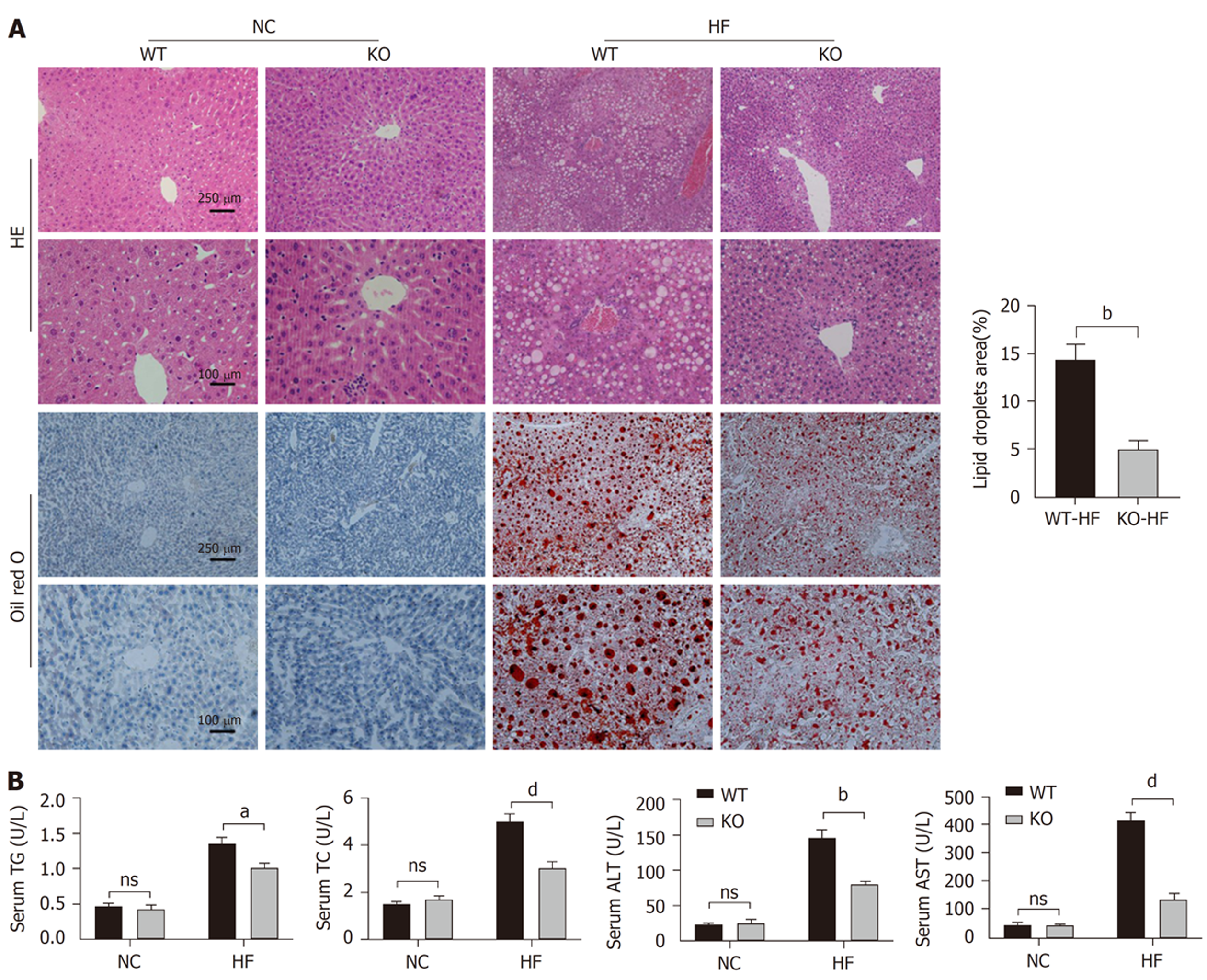
与NC组相比, HF组小鼠肝脏脂滴形成明显增高; 与WT-HF组相比, KO-HF组小鼠肝脏中脂滴积累明显减少(P<0.05), 见图2A. HF组小鼠血清TC和TG含量明显高于NC组, KO-HF组小鼠血清中TC和TG含量较WT-HF组明显降低, 见图2B. 此外, 与NC组相比, HF组小鼠血清ALT和AST明显增高; 与WT-HF组相比, KO-HF组小鼠血清中ALT和AST明显减少(P<0.05), 见图2B. 这一结果提示miR-484不仅能够抑制肝脏脂肪蓄积, 同时减轻肝细胞损伤.
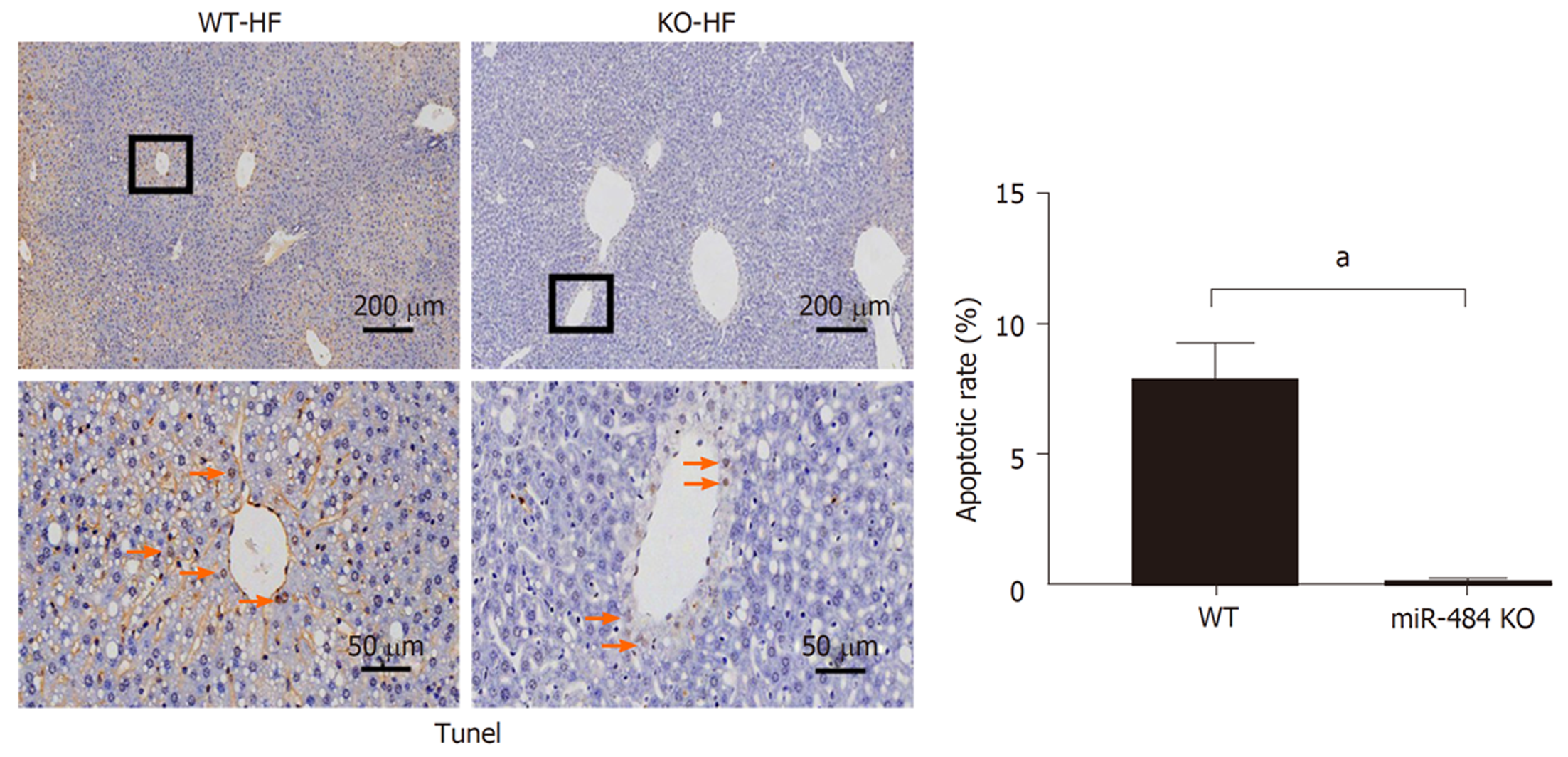
与WT-NC组相比, WT-HF组细胞凋亡明显, 与WT-HF组相比, KO-HF组细胞凋亡显著减轻, 见图3. 这一结果提示, miR-484可促进高脂暴露下的细胞凋亡.
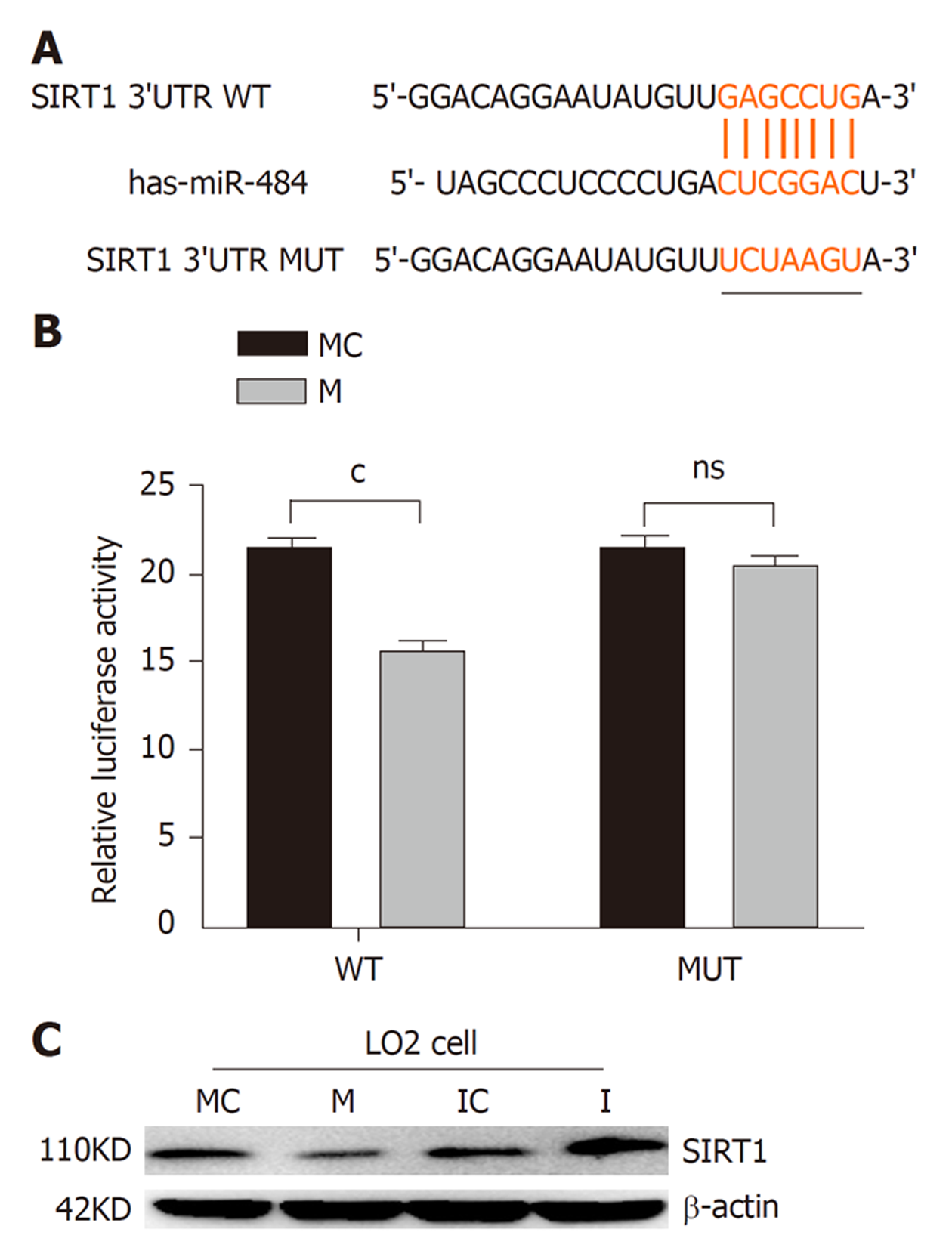
运用miRanda数据库预测到miR-484与SIRT1 3'UTR存在结合位点, 见图4A. 双荧光素酶活性检测结果显示, 与MC组相比, M组WT-SIRT1细胞中萤光素酶活性显著降低, MUT-SIRT1细胞中萤光素酶活性不受影响, 见图4B. 与MC组相比, M组细胞中SIRT1表达明显显著降低; 与IC组相比, Ⅰ组细胞中SIRT1表达明显升高, 见图4C. 上述结果提示, miR-484可靶向调控SIRT1.
与HF+pcDNA组相比, HF+pcDNA-SIRT1组LO2细胞中SIRT1的蛋白表达显著升高, 细胞的凋亡率显著降低(P<0.05), 见图5. 这一结果提示SIRT1可能通过降低细胞凋亡减轻肝细胞脂肪变性.
NAFLD因其患病率高, 发病机理复杂加之缺乏标准的治疗方法, 目前已成为当今全球第一大肝脏疾病[18]. 虽然对其诊治和发病机制的研究很多年, 但是有效药物和治疗方案仍处于探索阶段[19]. 目前已有研究证明NAFLD存在表达失调现象[20], 而且miRNA被视为质稳态和健康的关键调节因子, 在调控肝脏脂肪酸和胆固醇合成中具有潜在的病理作用[21], 所以miRNAs在NAFLD中具有作为诊断和预后水平的生物标志物的前景价值. 因此在本研究中, 我们首次发现NAFLD中miR-484的异常表达, 并通过靶向SIRT1研究miR-484在NAFLD中脂质积累的调节.
目前研究已证实miR-484参与调控肿瘤发生与发展, 被视为是癌前病变的关键触发器[22,23]. 值得注意的是, miR-484可以通过靶向Fis1表达, 调节线粒体形态从而改变细胞凋亡[24]. Li等[25]证实miR-484通过抑制Apaf-1和凋亡相关蛋白表达促进非小细胞肺癌的发生. Liu研究[26]认为miR-484通过抑制Caspase-3和Caspase-9表达保护大鼠心肌细胞免受缺血再灌注损伤. 然而, 其他学者[27]提出miR-484在胃癌中通过CCL-18/PI3K/AKT促进细胞凋亡, 从而发挥抗癌作用. Li等[28]揭示长链非编码RNA LINC00339能够通过靶向miR-484加重阿霉素诱导的心肌细胞凋亡. 本研究构建了体内和体外高脂损伤模型, 发现高脂暴露下miR-484表达异常升高, 深入研究发现, 抑制miR-484能够减轻细胞凋亡, 这与后者研究结果相一致. 这是国内外首次揭示在非酒精性脂肪肝性肝病中miR-484与细胞凋亡的相关性, 为miR-484在NAFLD中的功能研究和机制探索奠定了基础, 推进了miR-484在肝脏疾病中潜在的治疗价值的进一步深入研究. 本研究通过双荧光素酶报告基因实验进一步验证miR-484能够直接负调控SIRT1, 揭示了靶向 SIRT1为miR-484在肝脏细胞中的调控网络之一.
SIRT1是一种依赖于NAD+的去乙酰化酶, 在氧化和毒性应激下调节细胞凋亡, 被视为调节代谢稳态的关键代谢传感器. 已有研究证实SIRT1可以直接调控脂肪代谢相关基因(如sterol regulatory element binding proteins, SREBPs、FASN和ACC)表达的增加[29]. 值得注意的是, SIRT1能够抑制脂肪生成, 增加脂类分解, 刺激三酰甘油脂肪酶基因转录, 激活相关的过氧化物酶体增殖物激活受体γ调节叉头形盒子1的脱乙酰作用, 加快体内脂解作用[30-32]. 本研究通过细胞油红O染色实验证实过表达SIRT1能够降低细胞凋亡同时伴随LO2脂滴蓄积程度降低. 已有研究证实SIRT1能够通过下调p53表达对高脂诱导的肝细胞凋亡产生保护作用[32]. 本研究结果与前者一致: 过表达SIRT1能够减轻高脂暴露下细胞凋亡严重程度. 以上研究结果说明SIRT1参与细胞的凋亡过程, 为研究SIRT1参与NAFLD损伤作用机制提供参考依据.
综上所述, miR-484能够加重肝细胞脂肪变性过程, 其机制与靶向SIRT1有关, 靶向miR-484/SIRT1可能将来新的NAFLD治疗方法.
近年来, miR-484在调控肿瘤缺氧微环境(肺癌、乳腺癌、结直肠癌、胃癌、肝癌、胰腺癌等)中发挥重要作用, 但目前对miR-484是否参与NAFLD损伤作用机制国内外均尚无相关研究报道.
本研究旨在研究miR-484在高脂暴露下对肝细胞凋亡影响, 并探讨其分子作用机制, 为预防或治疗NAFLD损伤提供新的靶点.
探讨miR-484通过SIRT1介导细胞凋亡参与NAFLD损伤机制, 为临床治疗或诊断NAFLD提供科研依据.
首先, 我们采用野生组(WT组)、miR-484敲除组(miR-484 KO组)小鼠进行高脂造模, 通过RT-qPCR和Western blot实验验证miR-484对下游分子SIRT1的表达影响. 此外, 用一定浓度的游离脂肪酸建立NAFLD细胞模型, 随机分成miR-484 mimic(M组)、miR-484 mimic NC(MC组)、miR-484 inhibitor(I组)、miR-484 inhibitor NC(IC组)、pcDNA SIRT1组、pcDNA组, 采用油红O染色法分析脂滴积累情况, 流式细胞学分析细胞凋亡, Western blot检测LO2细胞SIRT1蛋白表达, 双荧光素酶报告基因检测实验验证miR-484与SIIRT1的靶向关系.
本研究通过建立小鼠和细胞高脂模型发现: miR-484通过下调SIRT1表达, 诱导细胞凋亡加重非酒精性脂肪肝损伤. 降低miR-484表达或者上调SIRT1表达能够通过抑制细胞凋亡减轻非酒精性脂肪肝损伤.
肝脏细胞在高脂暴露下通过促进miR-484表达上调, 导致下游分子SIRT1表达下调, 进一步加速细胞凋亡, 加重非酒精性脂肪肝损伤作用.
本研究通过体内及体外实验共同验证miR-484在高脂暴露下抑制SIRT1表达, 通过促进细胞凋亡, 后期还需要进一步研究高脂暴露下如何促进miR-484表达上调, 明确miR-484上游调控分子, 以更清晰的展示非酒精性脂肪肝损伤作用机制, 也为治疗非酒精性脂肪肝损伤提供理论依据.
学科分类: 胃肠病学和肝病学
手稿来源地: 湖北省
同行评议报告学术质量分类
A级 (优秀): A, A
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
科学编辑:刘继红 制作编辑:张砚梁
| 1. | Tanaka N, Kimura T, Fujimori N, Nagaya T, Komatsu M, Tanaka E. Current status, problems, and perspectives of non-alcoholic fatty liver disease research. World J Gastroenterol. 2019;25:163-177. [PubMed] [DOI] |
| 2. | Fang YL, Chen H, Wang CL, Liang L. Pathogenesis of non-alcoholic fatty liver disease in children and adolescence: From "two hit theory" to "multiple hit model". World J Gastroenterol. 2018;24:2974-2983. [PubMed] [DOI] |
| 3. | Issa D, Patel V, Sanyal AJ. Future therapy for non-alcoholic fatty liver disease. Liver Int. 2018;38 Suppl 1:56-63. [PubMed] [DOI] |
| 4. | Utzschneider KM, Kahn SE, Polidori DC. Hepatic Insulin Extraction in NAFLD Is Related to Insulin Resistance Rather Than Liver Fat Content. J Clin Endocrinol Metab. 2019;104:1855-1865. [PubMed] [DOI] |
| 5. | Satapati S, Kucejova B, Duarte JA, Fletcher JA, Reynolds L, Sunny NE, He T, Nair LA, Livingston KA, Fu X, Merritt ME, Sherry AD, Malloy CR, Shelton JM, Lambert J, Parks EJ, Corbin I, Magnuson MA, Browning JD, Burgess SC. Mitochondrial metabolism mediates oxidative stress and inflammation in fatty liver. J Clin Invest. 2015;125:4447-4462. [PubMed] [DOI] |
| 6. | Ore A, Akinloye OA. Oxidative Stress and Antioxidant Biomarkers in Clinical and Experimental Models of Non-Alcoholic Fatty Liver Disease. Medicina (Kaunas). 2019;55. [PubMed] [DOI] |
| 7. | Zhao T, Wu K, Hogstrand C, Xu YH, Chen GH, Wei CC, Luo Z. Lipophagy mediated carbohydrate-induced changes of lipid metabolism via oxidative stress, endoplasmic reticulum (ER) stress and ChREBP/PPARγ pathways. Cell Mol Life Sci. 2020;77:1987-2003. [PubMed] [DOI] |
| 8. | 徐 丹, 黄 晓东, 罗 和生, 袁 静萍, 张 姮, 吴 杰. 一种新的瘦素抵抗机制:非酒精性脂肪肝性肝病瘦素/PI3-K/Akt信号通路的激活缺陷. 世界华人消化杂志. 2012;20:3095-3100. [DOI] |
| 9. | 张 炜, 朱 丽群, 蒋 小猛, 曹 亮, 程 兆明, 徐 岷. 非酒精性脂肪肝性肝病患者脂联素基因-4522位点的单核苷酸多态性. 世界华人消化杂志. 2013;21:1660-1663. [DOI] |
| 10. | 许 腊梅, 孙 丹莉, 张 予蜀, 张 振玉, 李 晓翠. 紧密连接蛋白Occludin在非酒精性脂肪肝性肝病大鼠肠上皮细胞中的表达及其与TNF-α的关系. 世界华人消化杂志. 2010;18:981-986. [DOI] |
| 11. | Wang S, Wang W, Han X, Wang Y, Ge Y, Tan Z. Dysregulation of miR484-TUSC5 axis takes part in the progression of hepatocellular carcinoma. J Biochem. 2019;166:271-279. [PubMed] [DOI] |
| 12. | Lechel A, Gougelet A. Early HCC treatment: a future strategy against interferon/miR-484 axis to revert precancerous lesions? Gut. 2016;65:1073-1074. [PubMed] [DOI] |
| 13. | Qiu L, Huang Y, Li Z, Dong X, Chen G, Xu H, Zeng Y, Cai Z, Liu X, Liu J. Circular RNA profiling identifies circADAMTS13 as a miR-484 sponge which suppresses cell proliferation in hepatocellular carcinoma. Mol Oncol. 2019;13:441-455. [PubMed] [DOI] |
| 14. | Khan SA, Sathyanarayan A, Mashek MT, Ong KT, Wollaston-Hayden EE, Mashek DG. ATGL-catalyzed lipolysis regulates SIRT1 to control PGC-1α/PPAR-α signaling. Diabetes. 2015;64:418-426. [PubMed] [DOI] |
| 15. | Purushotham A, Schug TT, Xu Q, Surapureddi S, Guo X, Li X. Hepatocyte-specific deletion of SIRT1 alters fatty acid metabolism and results in hepatic steatosis and inflammation. Cell Metab. 2009;9:327-338. [PubMed] [DOI] |
| 16. | Li Y, Wong K, Giles A, Jiang J, Lee JW, Adams AC, Kharitonenkov A, Yang Q, Gao B, Guarente L, Zang M. Hepatic SIRT1 attenuates hepatic steatosis and controls energy balance in mice by inducing fibroblast growth factor 21. Gastroenterology. 2014;146:539-49.e7. [PubMed] [DOI] |
| 17. | Li T, Xian WJ, Gao Y, Jiang S, Yu QH, Zheng QC, Zhang Y. Higd1a Protects Cells from Lipotoxicity under High-Fat Exposure. Oxid Med Cell Longev. 2019;2019:6051262. [PubMed] [DOI] |
| 20. | Tessitore A, Cicciarelli G, Del Vecchio F, Gaggiano A, Verzella D, Fischietti M, Mastroiaco V, Vetuschi A, Sferra R, Barnabei R, Capece D, Zazzeroni F, Alesse E. MicroRNA expression analysis in high fat diet-induced NAFLD-NASH-HCC progression: study on C57BL/6J mice. BMC Cancer. 2016;16:3. [PubMed] [DOI] |
| 21. | Sedgeman LR, Michell DL, Vickers KC. Integrative roles of microRNAs in lipid metabolism and dyslipidemia. Curr Opin Lipidol. 2019;30:165-171. [PubMed] [DOI] |
| 22. | Lee D, Tang W, Dorsey TH, Ambs S. miR-484 is associated with disease recurrence and promotes migration in prostate cancer. Biosci Rep. 2020;40. [PubMed] [DOI] |
| 23. | Hu Y, Xie H, Liu Y, Liu W, Liu M, Tang H. Correction to: miR-484 suppresses proliferation and epithelial-mesenchymal transition by targeting ZEB1 and SMAD2 in cervical cancer cells. Cancer Cell Int. 2020;20:318. [PubMed] [DOI] |
| 24. | Wang K, Long B, Jiao JQ, Wang JX, Liu JP, Li Q, Li PF. miR-484 regulates mitochondrial network through targeting Fis1. Nat Commun. 2012;3:781. [PubMed] [DOI] |
| 25. | Li T, Ding ZL, Zheng YL, Wang W. MiR-484 promotes non-small-cell lung cancer (NSCLC) progression through inhibiting Apaf-1 associated with the suppression of apoptosis. Biomed Pharmacother. 2017;96:153-164. [PubMed] [DOI] |
| 26. | Liu H, Li S, Jiang W, Li Y. MiR-484 Protects Rat Myocardial Cells from Ischemia-Reperfusion Injury by Inhibiting Caspase-3 and Caspase-9 during Apoptosis. Korean Circ J. 2020;50:250-263. [PubMed] [DOI] |
| 27. | Liu J, Li SM. MiR-484 suppressed proliferation, migration, invasion and induced apoptosis of gastric cancer via targeting CCL-18. Int J Exp Pathol. 2020;101:203-214. [PubMed] [DOI] |
| 28. | Li J, Li L, Li X, Wu S. Long noncoding RNA LINC00339 aggravates doxorubicin-induced cardiomyocyte apoptosis by targeting MiR-484. Biochem Biophys Res Commun. 2018;503:3038-3043. [PubMed] [DOI] |
| 29. | Wu T, Liu YH, Fu YC, Liu XM, Zhou XH. Direct evidence of sirtuin downregulation in the liver of non-alcoholic fatty liver disease patients. Ann Clin Lab Sci. 2014;44:410-418. [PubMed] |
| 30. | Colak Y, Yesil A, Mutlu HH, Caklili OT, Ulasoglu C, Senates E, Takir M, Kostek O, Yilmaz Y, Yilmaz Enc F, Tasan G, Tuncer I. A potential treatment of non-alcoholic fatty liver disease with SIRT1 activators. J Gastrointestin Liver Dis. 2014;23:311-319. [PubMed] [DOI] |
| 31. | Chakrabarti P, English T, Karki S, Qiang L, Tao R, Kim J, Luo Z, Farmer SR, Kandror KV. SIRT1 controls lipolysis in adipocytes via FOXO1-mediated expression of ATGL. J Lipid Res. 2011;52:1693-1701. [PubMed] [DOI] |
| 32. | Wang H, Qiang L, Farmer SR. Identification of a domain within peroxisome proliferator-activated receptor gamma regulating expression of a group of genes containing fibroblast growth factor 21 that are selectively repressed by SIRT1 in adipocytes. Mol Cell Biol. 2008;28:188-200. [PubMed] [DOI] |