修回日期: 2021-02-02
接受日期: 2021-03-02
在线出版日期: 2021-04-08
目前临床缺乏对结直肠癌前病变有效的无创筛查手段, 识别高危人群和多指标联合检测已成为癌及癌前病变筛查的趋势. 多种炎症指标已广泛用于各种肿瘤的诊断及预后, 而对癌前病变诊断价值的研究较少.
探讨粪便免疫潜血实验(immunochemical fecal occult blood testing, IFOBT), 肿瘤标志物(CEA、CA199), 炎症指标包括中性粒细胞/淋巴细胞比值(neutrophil/lymphocyte ratio, NLR)、血小板/淋巴细胞比值(platelet/lymphocyte ratio, PLR)及一般临床特征对结直肠进展期腺瘤息肉发生的预测价值.
回顾性分析我院2014-2018年行电子结肠镜检查并经病理学证实的295例结直肠进展期腺瘤病例作为观察组, 选择同期448例非进展期腺瘤病例作为对照组, 收集患者的一般临床资料包括基本特征(性别、年龄)、生活习惯(吸烟史、饮酒史)、既往史(高血压史、冠心病史、糖尿病史), 手术史(胆囊或阑尾切除史); 实验室检查(NLR、PLR、CEA、CA199、IFOBT); 进行单因素差异分析, 将有意义的结果纳入二元logistic回归分析, 绘制ROC曲线, 评估相关指标对结直肠进展期腺瘤发生的预测价值.
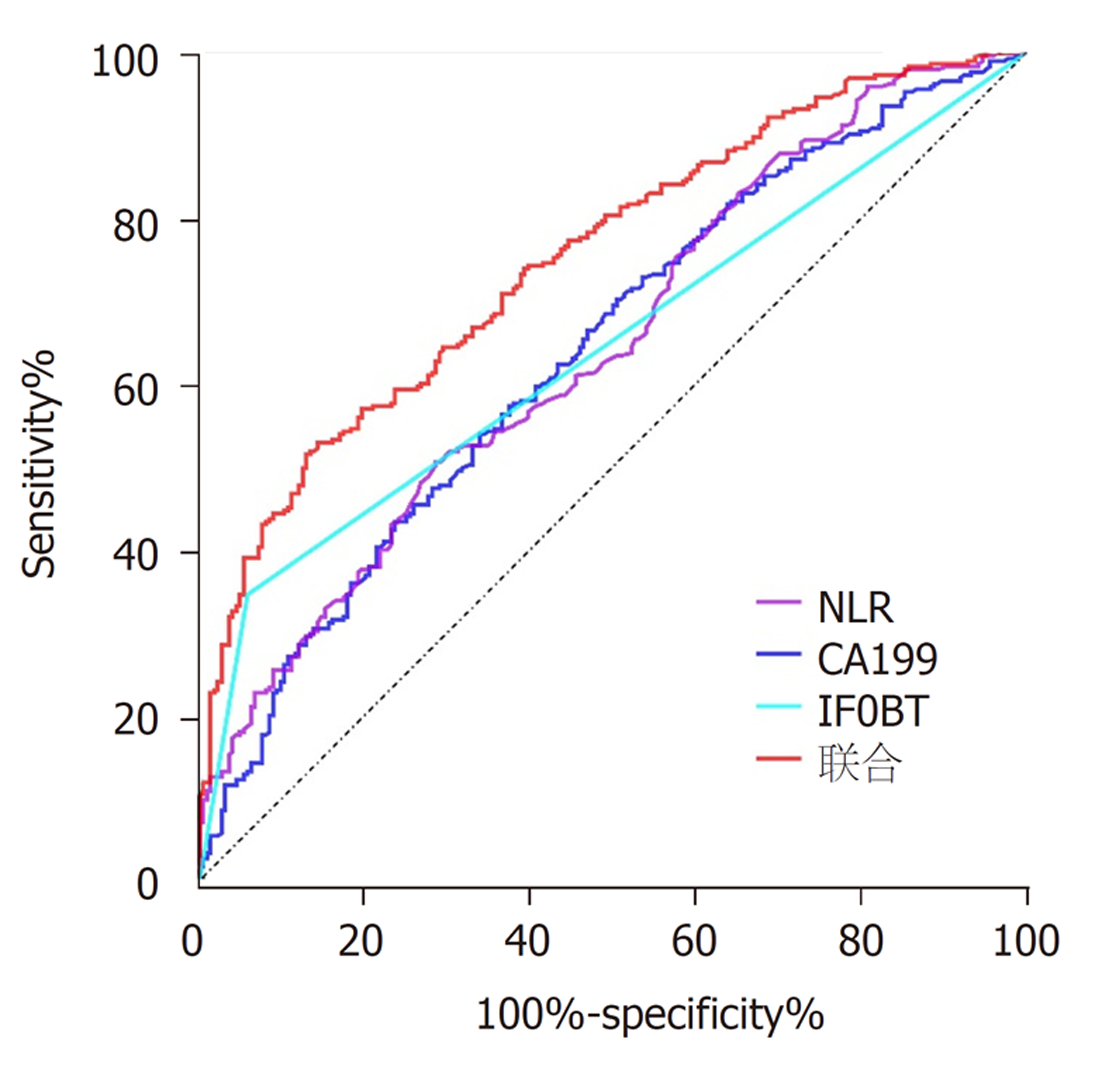
Logistic回归分析显示: 年龄(OR = 1.047, 95%CI: 1.028-1.066, P = 0.000)、吸烟(OR = 1.880, 95%CI: 1.250-2.826, P = 0.002)、糖尿病(OR = 2.073, 95CI%: 1.216-3.535, P = 0.007)、既往胆囊切除(OR = 9.206, 95CI%: 2.904-29.181, P = 0.000)、IFOBT (OR = 7.681, 95%CI: 4.585-12.869, P = 0.000)、CA199 (OR = 1.039, 95%CI: 1.018-1.059, P = 0.000)、NLR (OR = 1.706, 95%CI: 1.388-2.097, P = 0.000)与进展期腺瘤的发生独立相关. 对于预测进展期腺瘤的发生, IFOBT的灵敏度为34.6%, 特异度为94.2%, AUC为0.644, 95%CI: 0.602-0.686, CA199的最佳截断点为7.87 U/mL, 灵敏度为53.9%, 特异度为66.1%, AUC为0.639, 95%CI: 0.598-0.679, NLR的最佳截断点为2.04, 灵敏度为50.2%. 特异度为71.8%, AUC为0.645, 95%CI: 0.605-0.685, 当三者联合检测时其灵敏度为52.9%, 特异度为82.8%, AUC 95%CI为0.752 (0.716-0.788), 进展期腺瘤亚组分析中, IFOBT(-)和 IFOBT(+)亚组之间的腺瘤位置(P = 0.048)、腺瘤直径(P = 0.000)、分化级别(P = 0.000)差异有统计学意义, 低NLR(<2.04)和高NLR (≥2.04)亚组之间的性别(P = 0.004)、腺瘤直径(P = 0.028)、分化级别(P = 0.000)差异有统计学意义.
高龄、吸烟、糖尿病、既往胆囊切除人群更易发生结直肠进展期腺瘤, 临床需对此类人群提高重视, IFOBT、NLR、CA199对进展期腺瘤的发生具有诊断意义, 三者联合检测时其诊断效能最佳.
核心提要: 年龄、吸烟、糖尿病、既往胆囊切除是结直肠进展期腺瘤发生的独立危险因素, 中性粒细胞/淋巴细胞比值、肿瘤标志物、粪便免疫潜血实验对结直肠进展期腺瘤具有诊断价值, 尤其三者联合检测时诊断效果最佳, 本研究结果对结直肠进展期腺瘤的无创筛查方案建立有一定的指导意义.
引文著录: 王绪, 张竞宇, 郑忠青, 王涛, 朴美玉, 刘恒, 刘静, 刘文天. IFOBT与肿瘤标志物、炎症指标联合检测对结直肠进展期腺瘤发生的预测价值. 世界华人消化杂志 2021; 29(7): 347-355
Revised: February 2, 2021
Accepted: March 2, 2021
Published online: April 8, 2021
At present, there is a lack of effective, non-invasive screening tests for colorectal precancerous lesions. Identification of high-risk groups and multi-biomarker detection have become the trend of cancer and precancerous lesion screening. Inflammatory markers have been widely used in the diagnosis and prognosis of various tumors, but there are few studies on their diagnostic value in precancerous lesions.
To explore the predictive value of the general characteristics, neutrophil to lymphocyte ratio (NLR), platelet to lymphocyte ratio (PLR), CEA, CA199, and immunochemical fecal occult blood testing (IFOBT) in the occurrence of advanced colorectal adenoma.
Two hundred and ninety-five cases of advanced colorectal adenomas confirmed by pathology and electronic colonoscopy at our hospital from 2014 to 2018 were retrospectively analyzed, and 448 cases of non-advanced adenomas in the same period were selected as a control group. The general clinical data of the patients, including basic characteristics (gender and age), living habits (smoking and drinking), and past history of disease (hypertension, coronary heart disease, diabetes), history of surgery (history of cholecystectomy or appendectomy), and laboratory examinations (NLR, PLR, CEA, CA199, and IFOBT) were collected. Measurement data were compared using t-test or Mann-Whitney U test, and count data were compared using χ2 test. Statistically significant variables were included in binary logistic regression analysis. ROC curve was drawn to evaluate the predictive value of related indexes in the occurrence of advanced colorectal adenoma.
Multivariate logistic regression analysis demonstrated that age (odds ratio [OR] = 1.047, 95% confidence interval [CI]: 1.028-1.066, P = 0.000), smoking (OR = 1.880, 95%CI: 1.250-2.826, P = 0.002), diabetes (OR = 2.073, 95CI%: 1.216-3.535, P=0.007), previous cholecystectomy (OR = 9.206, 95CI%: 2.904-29.181, P = 0.000), IFOBT (OR = 7.681, 95%CI: 4.585-12.869, P = 0.000), CA199 (OR = 1.039, 95%CI: 1.018-1.059, P = 0.000), and NLR (OR = 1.706, 95%CI: 1.388-2.097, P = 0.000) were independent factors for advanced colorectal adenoma. ROC analysis showed that the areas under the ROC curves (AUCs) of IFOBT, CA199, and NLR in predicting advanced colorectal adenoma were 0.644 (95%CI: 0.602-0.686), 0.639 (95%CI: 0.598-0.679), and 0.645 (95%CI: 0.605-0.685), respectively. The optimal cutoff values for NLR and CA199 were 2.04 and 7.87 U/mL, respectively. The sensitivity and specificity of IFOBT, CA199, and NLR in predicting advanced colorectal adenoma were 34.6% and 94.2%, 53.9% and 66.1%, and 50.2% and 71.8%, respectively. The AUC of combination of the three biomarkers for the diagnosis of advanced adenoma was 0.752 (95%CI: 0.716-0.788), with a sensitivity of 52.9%and specificity of 82.8%. In the subgroup analysis, there were significant differences between the IFOBT(+) subgroup and IFOBT(-) subgroups with regard to tumor location (P = 0.048), diameter (P = 0.000), and differentiation(P = 0.000). There were also significant differences between the low NLR (< 2.04) subgroup and high NLR (≥ 2.04) subgroup with regard to gender (P = 0.004), tumor diameter (P = 0.028), and tumor differentiation (P = 0.000).
Advanced colorectal adenoma is associated with advanced age, smoking, diabetes, and previous cholecystectomy, and more attention should be paid to populations with these risk factors. IFOBT, NLR, and CA199 have appreciated diagnostic value for advanced colorectal adenoma, with the combination of all three having the highest diagnostic value.
- Citation: Wang X, Zhang JY, Zheng ZQ, Wang T, Piao MY, Liu H, Liu J, Liu WT. Value of combined detection of IFOBT, tumor markers, and inflammatory markers in predicting occurrence of advanced colorectal adenoma. Shijie Huaren Xiaohua Zazhi 2021; 29(7): 347-355
- URL: https://www.wjgnet.com/1009-3079/full/v29/i7/347.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i7.347
结直肠癌(colorectal cancer, CRC)是全球第三大最常见的肿瘤, 同时也是第四大癌症死亡原因, 仅2012年全球就有120万的新发病例和70万的死亡病例[1], 结直肠腺瘤被认为是CRC的前体, 在肠道中多以息肉的形式存在, 目前认为约80%的CRC是从结直肠腺瘤转变而来, "正常粘膜-腺瘤-癌"路径被认为是散发CRC的主要发展演变过程[2], 结直肠腺瘤的发展为浸润性癌的年转化率为0.25%, 而进展期腺瘤最高可达5.7%[3,4], 对平均风险人群的CRC筛查主要依赖于腺瘤, 特别是进展期腺瘤的检测, 研究表明结肠镜可以发现和切除癌前病变, 有效预防90%的CRC[5,6], 但是对平均风险人群实现大规模结肠镜筛查会大大增加医疗资源的压力, 因此建立高效且节约医疗资源的进展期腺瘤筛查体系异常重要, 虽然粪便免疫潜血实验(immunochemical fecal occult blood testing, IFOBT)对CRC有较佳的灵敏度和特异度, 但对腺瘤的敏感性较低[7], CEA、CA199为CRC相关的常见研究指标[8,9], 但少有关于CEA、CA199与结直肠进展期腺瘤的研究, 而外周血中性粒细胞/淋巴细胞比值(neutrophil to lymphocyte ratio, NLR)、血小板/淋巴细胞比值(platelet to lymphocyte ratio, PLR)作为炎症观察指标, 可用来观察机体抗肿瘤与促肿瘤之间的动态平衡[10], 本文旨在探讨临床一般特征及NLR、PLR、CEA、CA199、IFOBT与进展期腺瘤发生的相关性, 为进展期腺瘤的非侵入筛查提供有效指导.
1.1.1 研究对象: 均为2014-2018年于我院行结肠镜检查并经病理学确诊的进展期腺瘤病例. 其中进展期腺瘤[3]为满足下列1条或多条定义的腺瘤: (1)腺瘤直径≥10 mm; (2)含有绒毛成分; (3)高级别上皮内瘤变. 非进展腺瘤定义同时满足以下条件的腺瘤: (1)直径<10 mm; (2)不含有绒毛成分; (3)无高级别上皮内瘤变. 排除标准: (1)既往诊断为CRC或其他癌者; (2)既往因结直肠息肉、腺瘤及其他原因行结直肠手术者; (3)既往有家族性腺瘤性息肉病或炎症肠病病史者; (4)因梗阻或无法耐受导致肠镜未完成者; (5)肠道准备不佳而导致肠镜视野不清晰者; 研究共纳入295例进展期腺瘤作为观察组, 另选取同期448例非进展期腺瘤作为对照组.
1.1.2 一般特征: 收集患者的一般资料, 包括性别、年龄、吸烟史(阳性定义为每天至少一支, 持续时间≥6 mo)、饮酒史(根据白酒或啤酒不同的酒精度数换算, 阳性定义为平均每天酒精摄入量≥10 mL, 持续时间≥6 mo)、既往史(至少在二级医院以上确诊的糖尿病、高血压、冠心病等)、阑尾及胆囊切除史(既往因阑尾炎或者胆囊结石等疾病行阑尾或胆囊切除术).
NLR、PLR、IFOBT、CEA、CA199: 血常规检查: 血液标本均选用EDTA-K2抗凝真空管采集, 均通过自动血液分析仪测量得出中性粒细胞计数、淋巴细胞计数及血小板计数, 计算NLR、PLR; IFOBT: 采用胶体金法, 患者留取一次清晨自然便样本进行IFOBT, IFOBT检测试剂均购自北京万华普曼公司, 由消化内科实验室按产品说明书进行检测; 肿瘤标志物(CEA、CA199): 检测均采用ARCHITECTi2000全自动发光仪和配套的试剂盒进行, 由美国雅培公司生产,其中检测方法采用化学发光微粒子免疫,按说明书进行操作.
统计学处理 采用SPSS 23软件对数据进行统计学分析, 其中符合正态分布的计量资料采用mean±SD表示, 组间比较采用独立样本t检验, 偏态分布的资料采用M (P25, P75)表示, 组间比较采用Mann-Whitney U检验, 计数资料采用率(%)表示, 组间比较采用χ2检验, 多因素分析采用二元logistic回归分析, 绘制进展期腺瘤的受试者工作特征(ROC)曲线, 计算灵敏度、特异度和曲线下面积(AUC), 评价各项指标对进展期腺瘤的诊断价值, 以P<0.05有统计学意义.
单因素分析显示观察组饮酒者、阑尾切除者占比与对照组相比差异无统计学意义(均P>0.05), 另外观察组男性、吸烟者、糖尿病者、高血压者、冠心病者、既往胆囊切除者和IFOBT阳性人数占比显著高于对照组(均P<0.05). 观察组年龄、CEA、CA199、NLR水平显著高于对照组(均P<0.05), 而两组的PLR水平无显著差异(P>0.05), 具体见表1.
| 项目 | 观察组 | 对照组 | 统计值 | P |
| n = 295 | n = 448 | |||
| 性别 | ||||
| 男 | 175 (59.3%) | 230 (51.3%) | 4.571 | 0.033 |
| 女 | 120 (40.7%) | 218 (48.7%) | ||
| 年龄(岁) | ||||
| 62.5±10.8 | 56.7±11.7 | 6.923 | 0.000 | |
| 吸烟史 | ||||
| 有 | 104 (35.3%) | 106 (23.7%) | 11.792 | 0.001 |
| 无 | 191 (64.7%) | 342 (76.3%) | ||
| 饮酒史 | ||||
| 有 | 84 (28.5%) | 132 (29.5%) | 0.084 | 0.771 |
| 无 | 211 (71.5%) | 316 (70.5%) | ||
| 糖尿病 | ||||
| 有 | 54 (18.3%) | 36 (8.0%) | 17.621 | 0.000 |
| 无 | 241 (81.7%) | 412 (92.0%) | ||
| 高血压 | ||||
| 有 | 121 (41.0%) | 122 (27.2%) | 15.357 | 0.000 |
| 无 | 174 (59.0%) | 326 (72.8%) | ||
| 冠心病 | ||||
| 有 | 41 (13.9%) | 34 (7.6%) | 7.801 | 0.005 |
| 无 | 254 (86.1%) | 414 (92.4%) | ||
| 阑尾切除史 | ||||
| 有 | 29 (9.8%) | 53 (11.8%) | 0.725 | 0.395 |
| 无 | 266 (90.2%) | 395 (88.2%) | ||
| 胆囊切除史 | ||||
| 有 | 19 (6.4%) | 4 (0.9%) | 18.250 | 0.000 |
| 无 | 276 (93.6%) | 444 (99.1%) | ||
| IFOBT | ||||
| (+) | 102 (34.6%) | 26 (5.8%) | 109.150 | 0.000 |
| (-) | 193 (65.4%) | 422 (94.2%) | ||
| CEA (ng/mL) | 2.40 (1.52, 3.64) | 2.05 (1.38, 3.07) | 9.301 | 0.003 |
| CA199 (U/mL) | 8.17 (4.84, 14.72) | 5.74 (3.45, 9.89) | 41.077 | 0.000 |
| NLR | 2.46±1.51 | 1.77±0.76 | 7.160 | 0.000 |
| PLR | 125.37±53.61 | 119.51±38.80 | 1.701 | 0.090 |
把性别(女性 = 0、男性 = 1)、年龄、吸烟(吸烟 = 1、不吸烟 = 0)、糖尿病(糖尿病 = 1、无糖尿病 = 0)、高血压(高血压 = 1、无高血压 = 0)、冠心病(冠心病 = 1、无冠心病 = 0)、胆囊切除史(既往胆囊切除 = 1、无胆囊切除史 = 0)、IFOBT((+) = 1、(-) = 0)、CEA、CA199、NLR等因素纳入二元Logistic回归分析, 采用强迫进入法, 分析结果显示, 年龄(OR = 1.047, 95%CI: 1.028-1.066, P = 0.000)、吸烟(OR = 1.880, 95%CI: 1.250-2.826, P = 0.002)、糖尿病(OR = 2.073, 95CI%: 1.216-3.535, P = 0.007)、既往胆囊切除(OR = 9.206, 95CI%: 2.904-29.181, P = 0.000)、IFOBT (OR = 7.681, 95%CI: 4.585-12.869, P = 0.000)、CA199 (OR = 1.039, 95%CI: 1.018-1.059, P = 0.000)、NLR (OR = 1.706, 95%CI: 1.388-2.097, P = 0.000)与进展期腺瘤的发生独立相关, 具体见表2.
| 项目 | B值 | SE | Wald | P | OR | 95%CI |
| 性别 | 0.281 | 0.194 | 2.103 | 0.147 | 1.324 | 0.096-1.936 |
| 年龄 | 0.045 | 0.009 | 23.805 | 0.000 | 1.047 | 1.028-1.066 |
| 吸烟史 | 0.631 | 0.208 | 9.196 | 0.002 | 1.880 | 1.250-2.826 |
| 糖尿病 | 0.729 | 0.272 | 7.170 | 0.007 | 2.073 | 1.216-3.535 |
| 高血压 | 0.304 | 0.197 | 2.387 | 0.122 | 1.355 | 0.922-1.992 |
| 冠心病 | 0.301 | 0.299 | 1.014 | 0.314 | 1.352 | 0.752-2.431 |
| 胆囊切除 | 2.220 | 0.589 | 14.224 | 0.000 | 9.206 | 2.904-29.181 |
| IFOBT | 2.039 | 0.263 | 59.958 | 0.000 | 7.681 | 4.585-12.869 |
| CEA | 0.011 | 0.048 | 0.056 | 0.813 | 1.011 | 0.920-1.112 |
| CA199 | 0.038 | 0.010 | 14.268 | 0.000 | 1.039 | 1.018-1.059 |
| NLR | -0.002 | 0.002 | 1.017 | 0.000 | 1.706 | 1.388-2.097 |
ROC曲线分析显示, IFOBT、CA199、NLR对预测结直肠进展期腺瘤的发生的灵敏度分别为: 34.6%、53.9%、50.2%, 特异度分别为: 94.2%、66.1%、71.8%, 其ROC曲线下面积(AUC) 95%CI分别为: 0.644 (0.602-0.686)、0.639 (0.598-0.679)、0.645 (0.605-0.685), NLR的最佳截断点为2.04; CA199的最佳截断点为7.87 U/mL, 将IFOBT、CA199、NLR纳入Logistic回归分析评估三者联合检测的诊断效能, 当三者联合检测时其AUC (95%CI)为0.752 (0.716-0.788), 灵敏度为52.9%, 特异度为82.8%, 具体见图1, 表3.
| 项目 | 灵敏度(%) | 特异度(%) | AUC | 95%CI | P |
| IFOBT | 34.6 | 94.2 | 0.644 | 0.602-0.686 | 0.000 |
| CA199 | 53.9 | 66.1 | 0.639 | 0.598-0.679 | 0.000 |
| NLR | 50.2 | 71.8 | 0.645 | 0.605-0.685 | 0.000 |
| 联合 | 52.9 | 82.8 | 0.752 | 0.716-0.788 | 0.000 |
根据IFOBT结果和CA199、NLR的最佳截断点可将结直肠进展期腺瘤分为IFOBT(-)亚组、IFOBT(+)亚组, 高CA199亚组(≥7.87 U/mL)、低CA199亚组(<7.87 U/mL), 高NLR亚组(≥2.04)、低NLR亚组(<2.04), IFOBT(-)和IFOBT(+)亚组之间的腺瘤位置(P = 0.048)、腺瘤直径(P = 0.000)、分化级别(P = 0.000)差异有统计学意义, 低CA199和高CA199亚组之间年龄、性别、腺瘤位置、腺瘤直径、病理类型、分化级别均无显著差异(均P>0.05), 低NLR和高NLR亚组之间的性别(P = 0.004)、腺瘤直径(P = 0.028)、分化级别(P = 0.000)差异有统计学意义, 见表4.
| 项目 | 例数 | IFOBT(-) | IFOBT(+) | P | 低CA199 | 高CA199 | P | 低NLR | 高NLR | P |
| (n = 193) | (n = 102) | (n = 136) | (n = 159) | (n = 147) | (n = 148) | |||||
| 年龄(岁) | 0.247 | 0.446 | 0.101 | |||||||
| <50 | 32 | 17 | 15 | 17 | 15 | 12 | 20 | |||
| 50-59 | 71 | 45 | 26 | 36 | 35 | 37 | 34 | |||
| 60-69 | 118 | 77 | 41 | 54 | 64 | 67 | 51 | |||
| ≥70 | 74 | 54 | 20 | 29 | 45 | 31 | 43 | |||
| 性别 | 0.384 | 0.581 | 0.004 | |||||||
| 女 | 120 | 82 | 38 | 53 | 67 | 72 | 48 | |||
| 男 | 175 | 111 | 64 | 83 | 92 | 75 | 100 | |||
| 腺瘤位置 | 0.048 | 0.132 | 0.503 | |||||||
| 近端结肠 | 91 | 67 | 24 | 36 | 55 | 48 | 43 | |||
| 远端结肠 | 204 | 126 | 78 | 100 | 104 | 99 | 105 | |||
| 腺瘤直径 | 0.000 | 0.220 | 0.028 | |||||||
| <10 mm | 48 | 42 | 6 | 25 | 23 | 28 | 20 | |||
| 10-19 mm | 143 | 99 | 44 | 70 | 73 | 78 | 65 | |||
| ≥20 mm | 104 | 52 | 52 | 41 | 63 | 41 | 63 | |||
| 病理类型 | 0.355 | 0.980 | 0.078 | |||||||
| TA | 100 | 69 | 31 | 46 | 54 | 57 | 43 | |||
| TVA+VA | 195 | 124 | 71 | 90 | 105 | 90 | 105 | |||
| 分化级别 | 0.000 | 0.863 | 0.000 | |||||||
| 低级别 | 214 | 153 | 61 | 98 | 116 | 111 | 93 | |||
| 高级别 | 81 | 40 | 41 | 38 | 43 | 36 | 55 |
CRC在我国为最常见的恶性肿瘤之一, 死亡率较高, 临床上CRC发现时多为晚期, 因此对CRC前病变的筛查就显得极为重要, 由于大多数CRC均由结直肠腺瘤演变而来, 尤其是进展期腺瘤的癌变率远高于非进展期, 所以临床对进展期腺瘤尤为重视, 目前多数文献建议从50岁开始行结肠镜检查, 平均每10年检查一次可以有效预防CRC[11], 年龄是目前公认的进展期腺瘤危险因素之一, 且有研究[12,13]显示进展期腺瘤发病年龄有逐渐年轻化的趋势, 考虑与年轻人群的生活饮食结构变化相关. 吸烟和饮酒是许多疾病的危险因素, 本研究观察到吸烟史进展期腺瘤的独立危险因素, 考虑吸烟可通过氧化损伤造成DNA的错误编码, 促进腺瘤的发生[14], 关于饮酒对进展期腺瘤的影响目前存在争议, 有研究[15,16]认为饮酒可显著增加进展期腺瘤的发病风险, 且饮酒时间越长, 风险越高, 本研究未观察到两组之间饮酒史存在明显差异, 考虑本研究未对具体饮酒量分层, 因此关于饮酒与进展期腺瘤的之间的关系尚需更加详细分层研究.
国外研究[17]同样显示血糖控制不良人群的进展期腺瘤发病率明显增加, 本研究显示糖尿病是进展期腺瘤的独立危险因素, 与国外研究基本相符, 关于胆囊切除与进展期腺瘤之间关系鲜有文献报道, 本研究显示既往囊切除与进展期腺瘤的发生显著相关, 目前大部分研究为胆囊切除与结肠癌之间的关系, 胆囊切除与CRC之间的机制尚不十分明确, 主要认为胆囊切除后胆汁的肝肠循环增加以及肝脏合成加快, 大量胆汁酸进入肠道, 初级胆汁酸脱羟化转变为次级胆酸, 次级胆酸作为一种致癌因子反复长期作用于肠粘膜最终导致CRC的发生. 关于胆囊切除与进展期腺瘤之间的关系尚需更深入的研究来明确.
粪便潜血实验及肿瘤标志物常用于CRC的早期诊断, 其中便潜血实验有取材方便, 操作简单、快速得出结果等优点, 但是化学法粪便潜血实验因为受到食物、药物、以及患者依从性问题所以假阳性率较高[18], 而IFOBT的原理在于检测试剂中人特异性Hb抗体可与粪便中的Hb结合, 非人Hb以及食物中的过氧化物酶无法与之结合, 从而大大降低了潜血实验的假阳性率, 本研究显示IFOBT对诊断进展期腺瘤的敏感度为34.6%, 而特异度为94.2%, 与国外研究[19,20]基本相符, 而单独的IFOBT对进展期腺瘤的诊断的灵敏度不佳, 常需要联合指标检测提高灵敏度, CEA、CA199作为CRC常用的辅助诊断指标, 与结直肠肿瘤的存在与严重程度密切相关[21], 临床上多为关于CEA、CA199与CRC的研究, 而关于CEA和CA199与进展期腺瘤的研究鲜有报道, 本研究显示CEA与进展期腺瘤的发生无明显相关性, 而进展期腺瘤的CA199水平显著高于对照组, CA199作为肿瘤判断的广谱标志物, 其广泛分布于多种恶性肿瘤组织, 如果细胞有恶性转化趋势, 糖基化酶会受到激活作用, 糖基结构发生改变, 患者血液中CA199表达水平升高, 临床上通常认为CA199对消化道肿瘤的预后有较佳的提示意义, 而对消化道肿瘤诊断的灵敏度不佳. 本研究发现虽然进展期腺瘤的CA199水平多数在正常值(<37 U/mL)范围之内, 但其平均水平显著高于对照组, 当CA199的最佳截断点为7.87 U/mL时, 对进展期腺瘤诊断灵敏度为53.9%, 特异度为66.1%, 提示CA199对进展期腺瘤具有一定的诊断意义.
NLR和PLR作为一种全身炎症反应标志物, 在多种肿瘤具有预后价值[22,23],目前已有许多研究指出NLR、PLR与多种肿瘤的预后相关, 因此NLR、PLR水平可能对进展期腺瘤的发生有一定的提示作用, Zhou[24]等人研究指出, 在健康人、腺瘤组、CRC组中其NLR水平依次递增, 对于腺瘤性息肉, NLR的最佳截断点为2.14时, 其敏感性和特异性水平分别为36.7%和80.9%, 结果提示NLR与结直肠腺瘤的发生密切相关. 炎症反应与肿瘤的发生、发展以及转移密切相关, 炎症细胞可释放炎性介质、上调各种细胞因子、改变肿瘤微环境等因素, 肿瘤局部的炎症反应会对肿瘤细胞增殖有促进作用. 另一方面, 机体在炎症反应时可释放一系列能导致机体免疫功能紊乱以及肿瘤免疫逃避的抑制性的免疫介质, NLR反映了机体炎症与肿瘤免疫状态,该指标容易获取、操作简便,是肿瘤早期筛查的热点,目前关于NLR联合肿瘤标志物筛查进展期腺瘤的研究较少, 本研究发现当NLR、CA199取最佳截断点和IFOBT三者联合预测进展期腺瘤时可大大提高其诊断效能.
综上所述, 本研究中分析了一般临床特征对结直肠进展期腺瘤的发生影响及NLR、PLR、IFOBT、CEA、CA199对进展期腺瘤的诊断意义, 结果显示: (1)年龄、吸烟、糖尿病、既往胆囊切除是进展期腺瘤发生的独立危险因素; (2)单一指标检测时, NLR、CA199最佳截断点分别为2.04和7.87 U/mL时对进展期腺瘤的诊断效果最佳, 其灵敏度分别为50.2%、53.9%, 特异度分别为71.8%、66.1%, 而IFOBT对进展期腺瘤诊断的特异度较佳而灵敏度较差; (3)采用NLR、CA199、IFOBT联合检测时可提高其对进展期腺瘤的诊断效能; (4)IFOBT结果受腺瘤直径和分化级别影响, 而NLR水平受性别、腺瘤直径、分化级别的影响.
结直肠进展期腺瘤的发生是多因素参与、多阶段发展的结果, 临床需对高风险人群给予足够重视, 争取采取对腺瘤-癌途径的早期干预, 考虑结肠镜大面积筛查成本高且人群依从性差, 本研究发现IFOBT、NLR、CA199作为简便、易行、快速、经济的非侵入方法可为进展期腺瘤的筛查提供有效指导, 同样作为非侵入筛查手段, 炎性标志物、肿瘤标志物、粪便免疫潜血实验之间可以互相补充, 提高对结直肠进展期腺瘤诊断的敏感度, 本研究为单中心研究、且样本量有待丰富, 因此本研究结果需更多大样本、多中心研究来更加标准化各个指标的最佳截断点, 为临床提供更加科学的诊断依据.
目前临床缺乏对进展期腺瘤有效的无创筛查手段, 而实现进展期腺瘤早期检测及干预又极为重要, 识别高危人群和多指标联合检测成为癌及癌前病变筛查的趋势, 既往研究指出粪便免疫潜血实验(immunochemical fecal occult blood testing, IFOBT)和肿瘤标志物对进展期腺瘤诊断价值不佳, 炎症指标如中性粒细胞/淋巴细胞比值(neutrophil to lymphocyte ratio, NLR)、血小板/淋巴细胞比值(platelet to lymphocyte ratio, PLR)已被证实与多种肿瘤的诊断及预后相关, 而关于炎症指标对癌前病变的诊断价值研究较少.
本文在既往研究基础上选取进展期腺瘤患者IFOBT、CEA、CA199、NLR、PLR五种指标并评估患者的一般临床特征, 旨在评估各指标对进展期腺瘤的诊断价值及识别高风险人群, 为建立合理有效的无创筛查方案提供参考.
通过纳入排除标准回顾性分析了295例进展期腺瘤患者数据, 通过t检验、Mann-Whitney U检验、卡方检验和Logistic回归分析评估了进展期腺瘤的独立影响因素,通过受试者工作特征(receiver operating characteristic, ROC)曲线确定了IFOBT、CA199、NLR对进展期腺瘤的诊断价值.
本研究发现年龄、吸烟、糖尿病、既往胆囊切除是进展期腺瘤的独立危险因素, IFOBT、CA199、NLR对进展期腺瘤均有一定诊断价值, 而CEA、PLR对进展期腺瘤无诊断意义, 当IFOBT、CA199、NLR三者联合检测时可显著提高对进展期腺瘤的诊断效能.分析另外发现IFOBT与腺瘤的位置、直径、分化级别相关, 而NLR与患者性别、腺瘤直径、分化级别相关.
高龄、吸烟、糖尿病、既往胆囊切除人群发生进展期腺瘤的风险更高, IFOBT、CA199、NLR联合检测时对进展期腺瘤具有良好的诊断价值, 本研究结果有望为结直肠癌前病变无创筛查方案建立提供有效参考.
本研究为单中心研究, 样本量有限, 需多中心、大样本研究来验证本研究结果, 未来需对进展期腺瘤患者进行随访, 监测指标的动态变化并评估相关指标对进展期腺瘤的复发及预后影响.
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告学术质量分类
A级 (优秀): A
B级 (非常好): B
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
科学编辑:刘继红 制作编辑:张砚梁
| 1. | Arnold M, Sierra MS, Laversanne M, Soerjomataram I, Jemal A, Bray F. Global patterns and trends in colorectal cancer incidence and mortality. Gut. 2017;66:683-691. [PubMed] [DOI] |
| 2. | Mang T. [Colorectal cancer: role of imaging in screening]. Radiologe. 2019;59:23-34. [PubMed] [DOI] |
| 3. | Winawer SJ, Zauber AG, Fletcher RH, Stillman JS, O'brien MJ, Levin B, Smith RA, Lieberman DA, Burt RW, Levin TR, Bond JH, Brooks D, Byers T, Hyman N, Kirk L, Thorson A, Simmang C, Johnson D, Rex DK. Guidelines for colonoscopy surveillance after polypectomy: a consensus update by the US Multi-Society Task Force on Colorectal Cancer and the American Cancer Society. CA Cancer J Clin. 2006;56:143-59; quiz 184-5. [PubMed] [DOI] |
| 4. | Eide TJ. Risk of colorectal cancer in adenoma-bearing individuals within a defined population. Int J Cancer. 1986;38:173-176. [PubMed] [DOI] |
| 5. | Winawer SJ, Zauber AG, Ho MN, O'Brien MJ, Gottlieb LS, Sternberg SS, Waye JD, Schapiro M, Bond JH, Panish JF. Prevention of colorectal cancer by colonoscopic polypectomy. The National Polyp Study Workgroup. N Engl J Med. 1993;329:1977-1981. [PubMed] [DOI] |
| 6. | Winawer SJ, Zauber AG, O'Brien MJ, Ho MN, Gottlieb L, Sternberg SS, Waye JD, Bond J, Schapiro M, Stewart ET. Randomized comparison of surveillance intervals after colonoscopic removal of newly diagnosed adenomatous polyps. The National Polyp Study Workgroup. N Engl J Med. 1993;328:901-906. [PubMed] [DOI] |
| 7. | Allison JE, Sakoda LC, Levin TR, Tucker JP, Tekawa IS, Cuff T, Pauly MP, Shlager L, Palitz AM, Zhao WK, Schwartz JS, Ransohoff DF, Selby JV. Screening for colorectal neoplasms with new fecal occult blood tests: update on performance characteristics. J Natl Cancer Inst. 2007;99:1462-1470. [PubMed] [DOI] |
| 9. | 许 昕, 常 金, 张 国庆, 刘 宝军, 张 艳英, 张 本华. Kaplan-Meier生存曲线分析CEA、CA19-9在结直肠癌中的临床价值. 泰山医学院学报. 2017;38:865-867. [DOI] |
| 11. | Winawer SJ. Screening sigmoidoscopy: can the road to colonoscopy be less traveled? Ann Intern Med. 2003;139:1034-1035. [PubMed] [DOI] |
| 12. | Lee SE, Jo HB, Kwack WG, Jeong YJ, Yoon YJ, Kang HW. Characteristics of and risk factors for colorectal neoplasms in young adults in a screening population. World J Gastroenterol. 2016;22:2981-2992. [PubMed] [DOI] |
| 13. | Karsenti D, Tharsis G, Burtin P, Venezia F, Tordjman G, Gillet A, Samama J, Nahon-Uzan K, Cattan P, Cavicchi M. Adenoma and advanced neoplasia detection rates increase from 45 years of age. World J Gastroenterol. 2019;25:447-456. [PubMed] [DOI] |
| 14. | Fagunwa IO, Loughrey MB, Coleman HG. Alcohol, smoking and the risk of premalignant and malignant colorectal neoplasms. Best Pract Res Clin Gastroenterol. 2017;31:561-568. [PubMed] [DOI] |
| 15. | Shin A, Hong CW, Sohn DK, Chang Kim B, Han KS, Chang HJ, Kim J, Oh JH. Associations of cigarette smoking and alcohol consumption with advanced or multiple colorectal adenoma risks: a colonoscopy-based case-control study in Korea. Am J Epidemiol. 2011;174:552-562. [PubMed] [DOI] |
| 16. | Song YK, Park YS, Seon CS, Lim HJ, Son BK, Ahn SB, Jo YK, Kim SH, Jo YJ, Lee JH, Kim SC. Alcohol drinking increased the risk of advanced colorectal adenomas. Intest Res. 2015;13:74-79. [PubMed] [DOI] |
| 17. | Huang X, Fan Y, Zhang H, Wu J, Zhang X, Luo H. Association between serum HbA1c levels and adenomatous polyps in patients with the type 2 diabetes mellitus. Minerva Endocrinol. 2015;40:163-167. [PubMed] |
| 19. | Park DI, Ryu S, Kim YH, Lee SH, Lee CK, Eun CS, Han DS. Comparison of guaiac-based and quantitative immunochemical fecal occult blood testing in a population at average risk undergoing colorectal cancer screening. Am J Gastroenterol. 2010;105:2017-2025. [PubMed] [DOI] |
| 20. | Yuan SY, Wu W, Fu J, Lang YX, Li JC, Guo Y, Wang YN, Qian JM, Li JN. Quantitative immunochemical fecal occult blood test for neoplasia in colon cancer screening. J Dig Dis. 2019;20:78-82. [PubMed] [DOI] |
| 21. | Kim NH, Lee MY, Park JH, Park DI, Sohn CI, Choi K, Jung YS. Serum CEA and CA 19-9 Levels are Associated with the Presence and Severity of Colorectal Neoplasia. Yonsei Med J. 2017;58:918-924. [PubMed] [DOI] |
| 22. | Paik KY, Lee IK, Lee YS, Sung NY, Kwon TS. Clinical implications of systemic inflammatory response markers as independent prognostic factors in colorectal cancer patients. Cancer Res Treat. 2014;46:65-73. [PubMed] [DOI] |
| 23. | Mano Y, Shirabe K, Yamashita Y, Harimoto N, Tsujita E, Takeishi K, Aishima S, Ikegami T, Yoshizumi T, Yamanaka T, Maehara Y. Preoperative neutrophil-to-lymphocyte ratio is a predictor of survival after hepatectomy for hepatocellular carcinoma: a retrospective analysis. Ann Surg. 2013;258:301-305. [PubMed] [DOI] |
| 24. | Zhou WW, Chu YP, An GY. Significant difference of neutrophil-lymphocyte ratio between colorectal cancer, adenomatous polyp and healthy people. Eur Rev Med Pharmacol Sci. 2017;21:5386-5391. [PubMed] [DOI] |