修回日期: 2021-01-20
接受日期: 2021-03-02
在线出版日期: 2021-03-28
目前对于结直肠癌的治疗方式仍以手术为主, 术后采用化疗、靶向药物治疗等药物辅助, 其中靶向药受到遗传基因和价格因素的制约, 化疗药物仍是治疗首选. 同时已被更多的研究所证实, 联合用药可以从更多途径抑制癌细胞的生长, 其疗效优于单一化疗药物.
探讨伊立替康辅助FOLFOX化疗方案在结直肠癌(colorectal cancer, CRC)中应用价值.
选取2017-03/2019-02我院CRC患者92例, 依据简单随机数字表法分为研究组(n = 46)与对照组(n = 46). 靶向治疗基础上对照组采取FOLFOX方案, 研究组在对照组基础上采取伊立替康. 统计2组肿瘤控制率、血清肿瘤标志物、miR-200a、miR-190表达情况、血清转化生长因子-α (TGF-α)、胰岛素样生长因子Ⅱ(IGF-Ⅱ)水平、毒副反应发生率, 随访12 mo, 统计2组生存率.
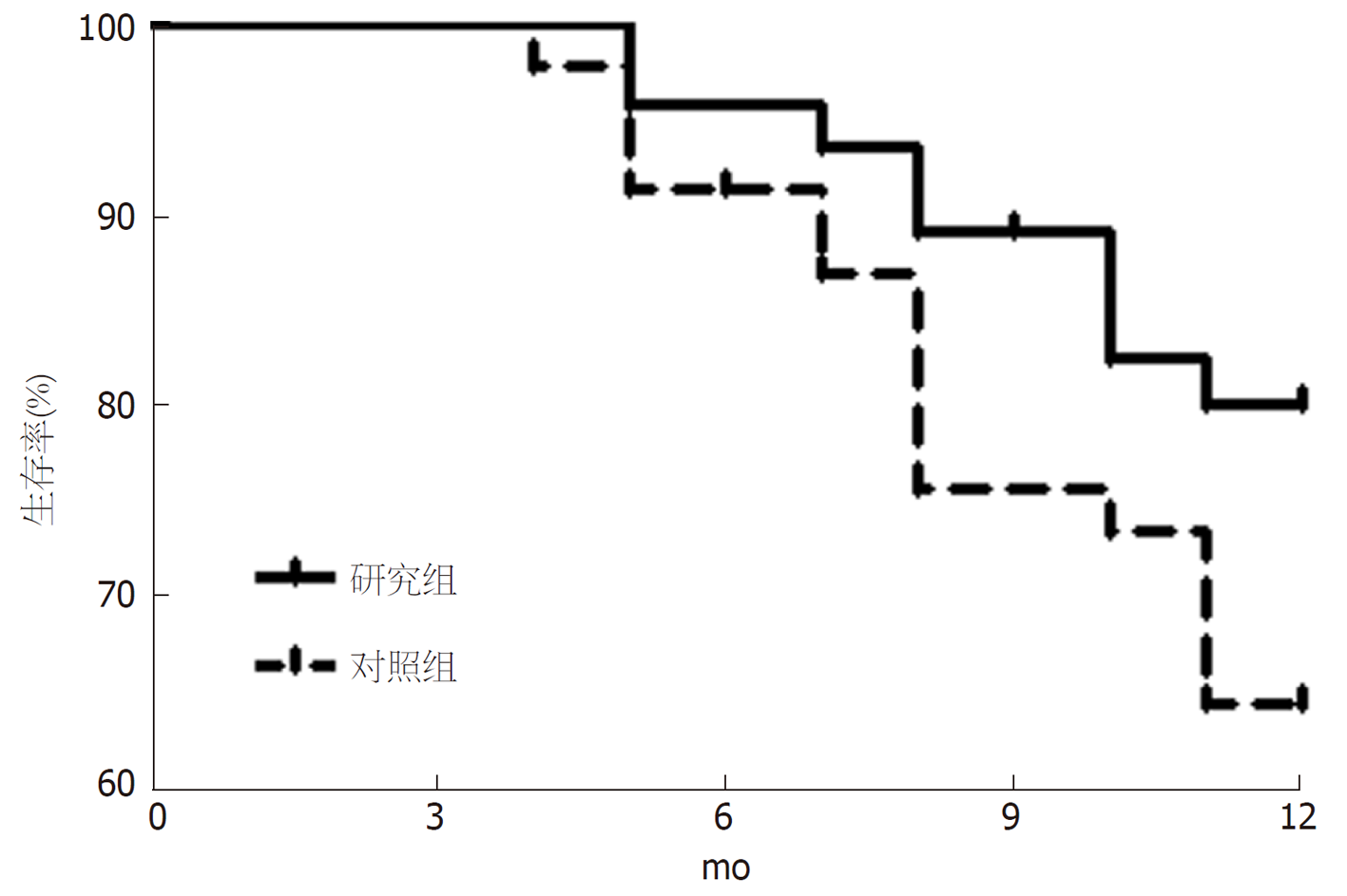
研究组肿瘤控制率(71.74%)与对照组(65.22%)间无显著差异(P>0.05); 治疗后研究组血清CEA、CA125、CA199、CA72-4、TGF-α、IGF-Ⅱ水平低于对照组(P<0.05); 治疗后研究组血清miR-200a、miR-190表达高于对照组(P<0.05); 2组均未发生Ⅳ度毒副反应, 且研究组的毒副反应发生率与对照组相比无明显差异(P>0.05); 研究组治疗后6 mo、9 mo、12 mo生存率(95.56%、88.89%、80.00%)与对照组(91.11%、75.56%、64.44%)间无显著差异(P>0.05).
联合采取FOLFOX化疗方案及伊立替康治疗CRC, 可降低血清肿瘤标志物、TGF-α、IGF-Ⅱ含量, 调节miR-200a、miR-190表达, 且不会增加毒副反应发生风险.
核心提要: 结直肠癌的化疗仍是主要的治疗方式, FOLFOX属于比较经典的治疗方案是治疗结直肠癌的首选. 同时, 伊立替康在抑制肿瘤生长, 促进细胞凋亡方面有较显著的效果. 本研究采用伊立替康联合FOLFOX的化疗方案对结直肠癌进行治疗, 分别从肿瘤控制率, 血清肿瘤标志物、miR-200a、miR-190的变化, 以及毒副反应、生存率等几个方面证实其相较单一化疗药物的疗效优势. 为结直肠癌的联合用药治疗提供临床借鉴.
引文著录: 吴林峰, 郑梦梦, 陈伟克, 肖荣耀. 伊立替康辅助FOLFOX化疗方案对结直肠癌患者血清肿瘤标志物及miR-200a、miR-190含量的影响. 世界华人消化杂志 2021; 29(6): 299-305
Revised: January 20, 2021
Accepted: March 2, 2021
Published online: March 28, 2021
At present, surgery is still the main treatment for colorectal cancer, and postoperative chemotherapy and targeted drug therapy are used as auxiliary treatments. Since targeted drugs are restricted by genetic and price factors, chemotherapy drugs are still the first choice for treatment. Many studies have demonstrated that drug combination can inhibit the growth of cancer cells in more ways, and its efficacy is better than single drug chemotherapy.
To investigate the application value of irinotecan-assisted FOLFOX chemotherapy in colorectal cancer.
A total of 92 patients with colorectal cancer treated at our hospital from March 2017 to February 2019 were selected and divided into a study group (n = 46) and a control group (n = 46) based on a simple random number table. On the basis of targeted therapy, the control group received the FOLFOX regimen, and the study group received irinotecan-assisted FOLFOX chemotherapy regimen. Tumor control rate, serum levels of tumor markers, miR-200a, miR-190, serum transforming growth factor-α (TGF-α), and insulin-like growth factor Ⅱ (IGF-Ⅱ), and the incidence of toxic and side effects were compared between the two groups. The patient were followed for 12 mo, and the survival rates of the two groups were calculated.
There was no significant difference in the tumor control rate between the study group (71.74%) and control group (65.22%; P > 0.05). After treatment, serum levels of CEA, CA125, CA199, CA72-4, TGF-α, and IGF-Ⅱ in the study group were significantly lower than those of the control group (P < 0.05), and the expression of serum miR-200a and miR-190 in the study group was significantly higher than that of the control group (P < 0.05). No grade 4 toxic and side effects occurred in either group, and there was no significant difference in the incidence of toxic and side effects between the two groups (P > 0.05). There was no significant difference in survival rates at 6 mo, 9 mo, and 12 mo after treatment between the study group (95.56%, 88.89%, and 80.00%) and control group (91.11%, 75.56%, and 64.44%; P > 0.05 for all).
The combination of FOLFOX chemotherapy and irinotecan in the treatment of colorectal cancer can reduce the serum levels of tumor markers, TGF-α, and IGF-Ⅱ, regulate the expression of miR-200a andmiR-190, but does not increase the risk of adverse reactions.
- Citation: Wu LF, Zheng MM, Chen WK, Xiao RG. Effect of irinotecan-assisted FOLFOX chemotherapy regimen on serum levels of tumor markers, miR-200a, and miR-190 in patients with colorectal cancer. Shijie Huaren Xiaohua Zazhi 2021; 29(6): 299-305
- URL: https://www.wjgnet.com/1009-3079/full/v29/i6/299.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i6.299
结直肠癌(colorectal cancer, CRC)为临床多发恶性肿瘤疾病, 近年来受膳食结构转变及不良生活习惯养成等影响, 其发病率持续增高, 已成为严重威胁人类生命健康的疾病类型[1,2]. 化疗为临床治疗CRC的重要方式, 其中FOLFOX (亚叶酸钙、奥沙利铂、氟尿嘧啶)为CRC常用化疗方案, 可杀除恶性肿瘤病灶发挥治疗作用, 但整体效果不佳[3-5]. 伊立替康在恶性肿瘤中也较常用, 其属选择性DNA拓扑异构酶Ⅰ抑制剂, 可结合于肿瘤细胞中DNA拓扑异构酶Ⅰ, 断裂DNA双链, 从而致使肿瘤细胞凋亡, 具备广谱抗肿瘤活性[6]. 此外, miRNAs为具有良好应用前景的生物标志物, 和肿瘤发生及进展关系密切, 并具有癌基因及抑癌基因功能[7], 因此认为通过观察miRNAs治疗前后变化情况可为临床治疗CRC提供新的思路. 基于此, 本研究选取我院结CRC者92例, 分组探讨伊立替康辅助FOLFOX化疗方案应用价值. 报告如下.
选取2017-03月/2019-02我院CRC患者92例, 依据简单随机数字表法分为研究组(n = 46)与对照组(n = 46). 2组性别、年龄、肿瘤位置、病理类型、体质量指数(BMI)、美国东部肿瘤协作组(ECOG)体力状况评分等临床资料均衡可比(P>0.05), 见表1, 且本研究经我院伦理委员会审批通过.
| 资料 | 研究组(n = 46) | 对照组(n = 46) | t/χ2值 | P值 |
| 年龄 | 46-76 (61.09±5.89) | 44-79 (60.97±6.11) | 0.096 | 0.924 |
| 性别 | ||||
| 男 | 25 (54.35) | 28 (60.87) | 0.401 | 0.527 |
| 女 | 21 (45.65) | 18 (39.13) | ||
| 肿瘤位置 | ||||
| 结肠 | 27 (58.70) | 25 (54.35) | 0.177 | 0.674 |
| 直肠 | 19 (41.30) | 21 (45.65) | ||
| 病理类型 | ||||
| 中分化腺癌 | 23 (50.00) | 22 (47.83) | 0.062 | 0.969 |
| 低分化腺癌 | 11 (23.91) | 11 (23.91) | ||
| 分化程度不明腺癌 | 12 (26.09) | 13 (28.26) | ||
| BMI (kg/m2) | 18.3-27.9 (23.10±2.01) | 17.8-28.2 (22.99±1.97) | 0.265 | 0.792 |
| ECOG评分 | ||||
| 0分 | 16 (34.78) | 17 (36.96) | 0.183 | 0.913 |
| 1分 | 21 (45.65) | 19 (41.30) | ||
| 2分 | 9 (19.57) | 10 (21.74) |
1.2.1 选取标准: 纳入标准: (1)符合《中国结直肠癌诊疗规范(2017年版)》[8]中原发性CRC诊断标准; (2)临床分期为Ⅳ期; (3)ECOG评分为0-2分; (4)预计生存期>6 mo; (5)年龄<80岁; (6)知晓本研究, 签署同意书.
排除标准: (1)合并其他良恶性肿瘤; (2)合并肾肝等脏器器质性病变者; (3)合并无法控制性高血压者; (4)消化道出血或存在出血倾向者; (5)存在重度营养不良者; (6)合并全身性感染性病变者; (7)骨髓造血功能障碍者; (8)发生肝肺转移者.
1.2.1 治疗方法: 两组均给予靶向治疗, 静脉滴注贝伐珠单抗5 mg/kg, 1次/3 wk;对照组采取FOLFOX方案, 第1 d静脉滴注奥沙利铂(江苏奥赛康药业有限公司, 国药准字H20064296)100 mg/m2、共滴注2 h, 第1 d静脉滴注亚叶酸钙(山西普德药业有限公司, 国药准字H14022464) 400 mg/m2、共滴注2 h, 第1 d静脉注入氟尿嘧啶(上海旭东海普药业有限公司, 国药准字H31020593) 400 mg/m2、随后持续滴注氟尿嘧啶2400 mg/m2, 治疗2 wk后休息1 wk, 共治疗4 wk. 研究组在对照组基础上采取伊立替康(江苏恒瑞医药股份有限公司, 国药准字H20061276), 静脉滴注350 mg/m2, 30-90 min内滴注完毕, 1次/3 wk, 共治疗4次.
1.2.2 检测方法: 治疗前及治疗4周期后第2 d晨起时, 在空腹状态下抽取5 mL外周静脉血, 离心(3000 r/min, 10 min)取上清液, 置于-80 ℃环境中储存待检; 以美国Bio-RAD公司Bio-RAD550型酶标仪与配套试剂盒经酶联免疫吸附法测定血清肿瘤标志物[癌胚抗原(CEA)、糖链抗原125 (CA125)、CA199、CA72-4]及转化生长因子-α (TGF-α)、胰岛素样生长因子Ⅱ (IGF-Ⅱ)水平; 取血清标本, 采用miRNA提取试剂盒(上海盈公生物技术有限公司)提取总RNA, 以Taqman miRNA检测试剂盒通过实时逆转录定量聚合酶链反应检测miR-200a、miR-190, 计算其相对表达量.
1.2.3 观察指标: (1)治疗4周期后统计2组肿瘤控制率, 依据RECIST标准予以评估, 完全缓解: 原发病灶消失, 且持续≥4 wk; 部分缓解: 原发肿瘤病灶最大单径之和缩小>30%, 且持续≥4 wk; 进展: 原发肿瘤病灶最大单径之和增大>20%或有新病灶出现; 其余为稳定; 肿瘤控制率 = (完全缓解+部分缓解+稳定)/总例数×100%[9]; (2)统计2组治疗前后血清肿瘤标志物(CEA、CA125、CA199、CA72-4)水平; (3)统计2组治疗前后血清miR-200a、miR-190表达情况; (4)统计2组治疗前后血清TGF-α、IGF-Ⅱ水平; (5)统计2组毒副反应发生率, 根据NCI标准评估, 并分为Ⅰ-Ⅳ度[10]; (6)随访12 mo, 统计2组生存率.
统计学处理 通过SPSS 22.0对数据进行分析, 计量资料(mean±SD)表示, t检验, 计数资料n(%)表示, χ2检验, P<0.05表示差异有统计学意义.
研究组肿瘤控制率(71.74%)与对照组(65.22%)间无显著差异(P>0.05). 见表2.
| 组别 | 例数 | 完全缓解 | 部分缓解 | 疾病稳定 | 疾病进展 | 肿瘤控制率 |
| 研究组 | 46 | 4 (8.70) | 13 (28.26) | 16 (34.78) | 13 (28.26) | 33 (71.74) |
| 对照组 | 46 | 1 (2.17) | 15 (32.61) | 14 (30.43) | 16 (34.78) | 30 (65.22) |
| χ2值 | 0.453 | |||||
| P值 | 0.501 |
治疗前2组血清CEA、CA125、CA199、CA72-4水平间无显著差异(P>0.05), 治疗后研究组血清CEA、CA125、CA199、CA72-4水平低于对照组(P<0.05). 见表3.
| 时间 | 组别 | 例数 | CEA (ng/mL) | CA125 (U/mL) | CA199 (U/mL) | CA724 (IU/mL) |
| 治疗前 | 研究组 | 46 | 9.83±1.96 | 34.89±10.33 | 42.39±8.51 | 42.15±6.71 |
| 对照组 | 46 | 10.10±2.11 | 36.04±9.71 | 44.07±9.02 | 44.01±7.20 | |
| t值 | 0.636 | 0.550 | 0.919 | 1.282 | ||
| P值 | 0.527 | 0.584 | 0.361 | 0.203 | ||
| 治疗后 | 研究组 | 46 | 5.06±1.35 | 9.13±2.68 | 8.51±3.01 | 14.81±3.66 |
| 对照组 | 46 | 7.70±1.56 | 13.91±2.45 | 13.11±2.83 | 20.45±3.82 | |
| t值 | 8.679 | 8.928 | 7.552 | 7.231 | ||
| P值 | 0.000 | 0.000 | 0.000 | 0.000 |
治疗前2组血清miR-200a、miR-190表达间无显著差异(P>0.05), 治疗后研究组血清miR-200a、miR-190表达高于对照组(P<0.05). 见表4.
| 组别 | 例数 | miR-200a | miR-190 | ||
| 治疗前 | 治疗后 | 治疗前 | 治疗后 | ||
| 研究组 | 46 | 0.89±0.20 | 1.46±0.24 | 0.74±0.15 | 1.29±0.25 |
| 对照组 | 46 | 0.91±0.22 | 1.23±0.23 | 0.72±0.16 | 1.13±0.20 |
| t值 | 0.456 | 4.693 | 0.619 | 3.390 | |
| P值 | 0.649 | 0.000 | 0.538 | 0.001 | |
治疗前2组血清TGF-α、IGF-Ⅱ水平间无显著差异(P>0.05), 治疗后研究组血清TGF-α、IGF-Ⅱ水平低于对照组(P<0.05). 见表5.
| 组别 | 例数 | TGF-α | IGF-Ⅱ | ||
| 治疗前 | 治疗后 | 治疗前 | 治疗后 | ||
| 研究组 | 46 | 18.64±5.01 | 6.79±2.18 | 181.05±21.37 | 99.26±10.18 |
| 对照组 | 46 | 19.13±4.93 | 9.91±1.95 | 179.64±19.34 | 113.54±12.26 |
| t值 | 0.473 | 7.235 | 0.332 | 6.078 | |
| P值 | 0.638 | 0.000 | 0.741 | 0.000 | |
2组均未发生Ⅳ度毒副反应, 且研究组血红蛋白减少、胃肠道反应、呕吐恶心、骨髓抑制、中性粒细胞减少发生率与对照组相比无明显差异(P>0.05). 见表6.
| 毒副反应 | 研究组(n = 46) | 对照组(n = 46) | χ2 | P | ||||||
| Ⅰ度 | Ⅱ度 | Ⅲ度 | 总发生率 | Ⅰ度 | Ⅱ度 | Ⅲ度 | 总发生率 | |||
| 血红蛋白减少 | 7 | 3 | 7 | 18 (39.13) | 7 | 2 | 5 | 16 (34.78) | 0.187 | .666 |
| 胃肠道反应 | 6 | 7 | 6 | 19 (41.30) | 6 | 4 | 8 | 18 (39.13) | 0.045 | 0.832 |
| 呕吐恶心 | 7 | 7 | 4 | 18 (39.13) | 7 | 3 | 5 | 15 (32.61) | 0.425 | 0.514 |
| 骨髓抑制 | 6 | 7 | 3 | 16 (34.78) | 4 | 4 | 7 | 16 (34.78) | 0.000 | 1.000 |
| 中性粒细胞减少 | 6 | 6 | 5 | 17 (36.96) | 5 | 4 | 5 | 15 (32.61) | 0.192 | 0.662 |
CRC发病率高, 且可通过淋巴及血液循环等途径播散至其他器官组织, 且若患者未及时得到有效干预, 则可进展至中晚期, 出现腹水、肝脏肿大、全身无力、贫血等诸多反应[11,12]. 因此, 如何对CRC患者实施安全有效治疗仍是研究热点.
贝伐珠单抗为晚期CRC重要靶向治疗药物, 为重组人源化单克隆抗体, 可对肿瘤新生血管生成予以抑制, 影响内皮细胞增殖, 可以血管内皮生长因子为靶点, 和内源性血管内皮生长因子竞争性结合于血管内皮生长因子受体, 阻止内皮细胞有丝分裂, 促使现有肿瘤血管退化, 减少新生血管生成, 阻断肿瘤生长所需氧气、血液、其他营养供给, 限制肿瘤生长, 使存活肿瘤血管趋化正常. FOLFOX化疗在CRC中较常用, 其中奥沙利铂属新型铂类抗肿瘤药物, 可对DNA合成予以抑制, 产生抗肿瘤作用及细胞毒作用; 氟尿嘧啶静脉注入机体后通过人体代谢酶作用, 能转化为可抑制DNA合成的核苷酸, 其能有效阻止肿瘤细胞分裂增殖; 而亚叶酸钙则可进一步增强氟尿嘧啶抗肿瘤活性[13]. 但FOLFOX化疗方案在CRC中整体效果不佳, 李玉梅等[14]研究指出, 贝伐珠单抗及西妥昔单抗等靶向治疗药物联合化疗对CRC患者实施治疗, 可有效延长患者生存期限, 但靶向治疗药物较昂贵, 导致其临床应用存在一定局限性, 无法广泛普及应用. 伊立替康在恶性肿瘤中也较常用, 其属半合成可溶性喜树碱衍生物, 其可通过拓扑异构酶Ⅰ与DNA形成的复合体稳定结合, 造成DNA单链断裂, 导致DNA发生不可逆性损伤, 最终造成细胞凋亡[15]. 本研究联合FOLFOX化疗方案及伊立替康对我院CRC患者实施治疗后发现, 研究组总有效率略高于对照组, 但血清肿瘤标志物水平低于对照组, 且毒副反应发生率组间比较无显著差异, 表明FOLFOX化疗方案及伊立替康联合治疗CRC可更有效下调血清肿瘤标志物水平, 利于改善疾病治疗效果. 分析其原因主要在于: 奥沙利铂可通过水化衍生物作用于DNA, 造成链间和链内交联, 阻止DNA合成, 但大剂量应用可引发诸多毒副反应, 而联合氟尿嘧啶不仅能减少全身毒性作用, 且可提升癌细胞中药物浓度; 氟尿嘧啶为核糖核酸重要组成部分, 可抑制脱氧核糖鸟苷酸中胸苷酸合成酶转化, 抑制DNA合成[16]. 而伊立替康水溶性较好, 经机体代谢后, 其与活性代谢物7-乙基-10羟基喜树碱可结合于DNA拓扑异构酶Ⅰ形成复合物, 最终促使肿瘤细胞凋亡, 达到治疗目的[17]. 同时, 在静止及增生肿瘤细胞内拓扑异构酶Ⅰ含量增高, 因此伊立替康对迅速生长及相对缓慢的肿瘤细胞杀伤效果均较好[18].
近年来, miRNA成为肿瘤研究热点, 其可经信使RNA降解或沉默蛋白翻译, 在细胞凋亡、增殖和肿瘤发生等过程中发挥治疗作用, 且miRNA失调涉及肿瘤分化及增殖、侵袭、迁移、凋亡等[19]. miR-200a、miR-190可于脑脊液、尿液、血液内检出, 具有较高稳定性, 可作为血清肿瘤标志物, 其中miR-190可降低VEGF表达, 阻止肿瘤新生血管生成, 从而抑制肿瘤生长, 且可降低CRC细胞内DPC4基因表达, 产生负向调控, 发挥抑癌基因作用; 而miR-200a为miR-200家族重要成员, 其能对癌细胞侵袭、增殖、转移发挥重要作用[20]. 此外, IGF-Ⅱ为多肽类生长因子, 其结构与胰岛素具有一定相似性, 可特异性结合于受体, 抑制细胞中信号传导, 避免肿瘤细胞凋亡, 且能促进细胞有丝分裂, 可有效促使肿瘤细胞分化及增殖; TGF-α为表皮生长因子(EGF)家族成员, 其能发挥类似EGF的生理学活性, 即活化原癌基因与转录因子, 加快细胞膜信号传导, 并参与肿瘤细胞分化、增殖, 且TGF-α能强化肿瘤细胞活动, 活化致癌通路, 触发上皮间质转化, 促进病灶转移、浸润[21]. 本研究对上述指标水平治疗前后变化情况进行统计分析发现, 治疗后研究组血清miR-200a、miR-190表达高于对照组, 血清TGF-α、IGF-Ⅱ水平低于对照组, 进一步证实FOLFOX化疗方案联合伊立替康在CRC中具有较高应用价值, 可降低血清TGF-α、IGF-Ⅱ水平, 上调miR-200a、miR-190表达, 且其可能为该联合治疗方案能改善CRC治疗效果的重要机制之一. 另由本研究结果还可得知, 治疗后研究组生存率高于对照组, 但无显著差异, 可能与样本量较少具有关联性, 因此本研究存在一定不足, 仍需临床进一步证实.
综上所述, 联合采取FOLFOX化疗方案及伊立替康治疗CRC, 可下调血清肿瘤标志物及TGF-α、IGF-Ⅱ水平, 增高miR-200a、miR-190表达, 且不会增加毒副反应发生风险.
结直肠癌在消化道恶性肿瘤中发病率较高, 传统的化疗方案FOLFOX的治愈周期长, 复发率较高, 同时靶向药物治疗成本高, 受基因变异影响较大, 不适宜大多数患者. 化疗药物的联合治疗方案探索目前成为研究的热点, 药物之间起到互补的作用, 增强治疗的效果.
中晚期的结直肠癌患者离不开化疗药物和靶向药物的治疗. 由于靶向药物的局限性, 无法广泛普及应用, 化疗仍是主要的治疗手段. 传统的化疗手段虽然比较经典, 但是依然存在较高的复发率, 伊立替康可以促进肿瘤细胞的凋亡, 抑制其生长, 与经典的化疗手段FOLFOX相结合对清除和抑制细胞具有共进互补的作用. 为传统的化疗提供新的治疗方案.
本研究的主要目标是探讨伊立替康辅助FOLFOX化疗方案在结直肠癌中应用价值. 实现了仅依靠传统治疗方式的改善, 为延长结肠癌患者生存期以及生活质量具有进一步的意义.
本研究主要采用伊立替康辅助疗法与FOLFOX化疗方案的对比, 通过检测、观察、数据分析等研究方法, 对比说明辅助化疗相对于FOLFOX化疗方案在结直肠癌治疗中的优势.
在肿瘤控制率、毒副反应发生率和12个月生存率等指标中, 2组之间并无统计学意义上的差异. 但是治疗后, 研究组血清CEA、CA125、CA199、CA72-4、TGF-α、IGF-Ⅱ水平低于对照组, 同时miR-200a、miR-190表达高于对照组.
联合采取FOLFOX化疗方案及伊立替康治疗结直肠癌, 可下调血清肿瘤标志物及TGF-α、IGF-Ⅱ水平, 增高miR-200a、miR-190表达, 且不会增加毒副反应发生风险.
本研究中除了血清中的几个灵敏的指标有差异外, 生存率和肿瘤控制率并无显著差异, 分析原因可能与样本量较少和生存时间较短有关, 因此本研究将有待于进一步扩大样本量, 延长回访的时间, 来进行更加深入的验证.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): 0
科学编辑:刘继红 制作编辑:张砚梁
| 3. | 杜 文龙, 王 佳, 郭 渊先, 杨 小萍, 尹 兰宁. 贝伐珠单抗联合FOLFOX方案治疗进展期结直肠癌的临床疗效和安全性Meta分析. 国际外科学杂志. 2020;47:245-251, 289-290. [DOI] |
| 4. | 李 振毅, 李 龙, 马 纪周, 张 阿龙. 结直肠癌miR-100和miR-125b表达在西妥昔单抗联合FOLFOX治疗中的临床意义. 宁夏医科大学学报. 2019;41:882-887. [DOI] |
| 5. | Soveri LM, Lamminmäki A, Hänninen UA, Karhunen M, Bono P, Osterlund P. Long-term neuropathy and quality of life in colorectal cancer patients treated with oxaliplatin containing adjuvant chemotherapy. Acta Oncol. 2019;58:398-406. [PubMed] [DOI] |
| 6. | 苏 方, 张 甜甜, 吴 骁, 汪 蕊, 汪 子书. 雷替曲塞及其联合奥沙利铂或伊立替康治疗晚期结直肠癌对转氨酶的影响. 蚌埠医学院学报. 2019;44:1194-1196, 1201. [DOI] |
| 7. | Hon KW, Abu N, Ab Mutalib NS, Jamal R. miRNAs and lncRNAs as Predictive Biomarkers of Response to FOLFOX Therapy in Colorectal Cancer. Front Pharmacol. 2018;9:846. [PubMed] [DOI] |
| 11. | Cremolini C, Moretto R, Masi G, Falcone A. Safety profile of capecitabine as maintenance treatment after induction with XELOX or FOLFOX in metastatic colorectal cancer patients. Ann Oncol. 2016;27:1810. [PubMed] [DOI] |
| 13. | Ochiai T, Nishimura K, Watanabe T, Kitajima M, Nakatani A, Nagayasu K, Sakuyama N, Sato T, Kishine K, Abe Y, Nagaoka I. Impact of primary tumor location as a predictive factor in patients suffering from colorectal cancer treated with cytotoxic anticancer agents based on the collagen gel droplet-embedded drug sensitivity test. Oncol Lett. 2019;17:1842-1850. [PubMed] [DOI] |
| 14. | , ; 易 涵, 古再丽努尔·如则托合提, 姜明燕, 王佳妮. 贝伐珠单抗联合伊立替康与雷替曲塞治疗氟尿嘧啶耐药晚期结直肠癌的疗效和安全性. 药物评价研究. 2020;43:126-131. [DOI] |
| 16. | Ying K, Chong Y, Wei W, Bing D, Yanyan S, Xuefeng Y, Wei W, Ke L. Effect of FOLFOX6 chemotherapy on serum VEGF expression in advanced colorectal cancer patients. Rev Assoc Med Bras (1992). 2019;65:177-182. [PubMed] [DOI] |
| 19. | Gu X, Jin R, Mao X, Wang J, Yuan J, Zhao G. Prognostic value of miRNA-181a/b in colorectal cancer: a meta-analysis. Biomark Med. 2018;12:299-308. [PubMed] [DOI] |